蜂胶黄酮对病毒诱导PK-15细胞凋亡的影响
2016-09-21郭振环王文秀沈志强
郭振环,马 霞,王文秀,王 恬,沈志强*
(1.山东省滨州畜牧兽医研究院博士后科研工作站,山东滨州 256600;2.南京农业大学博士后科研流动站,江苏南京 210095;3.山东省滨州畜牧兽医研究院,山东滨州 256600;4.河南省康星药业股份有限公司,河南郑州 451464)
蜂胶黄酮对病毒诱导PK-15细胞凋亡的影响
郭振环1,2,3,4,马霞1,3,王文秀3,王恬2,沈志强1,3*
(1.山东省滨州畜牧兽医研究院博士后科研工作站,山东滨州 256600;2.南京农业大学博士后科研流动站,江苏南京 210095;3.山东省滨州畜牧兽医研究院,山东滨州 256600;4.河南省康星药业股份有限公司,河南郑州 451464)
为研究蜂胶黄酮对病毒诱导宿主细胞凋亡的影响,将蜂胶黄酮从最大安全浓度250 μg/mL倍比稀释5个浓度,与猪传染性胃肠炎病毒(TGEV)、猪细小病毒(PPV)分别一起加至单层PK-15细胞培养体系中,用流式细胞仪检测蜂胶黄酮对TGEV和PPV感染PK-15细胞凋亡率的影响。结果显示,与病毒对照组比较,TGEV和PPV感染PK-15细胞后,蜂胶黄酮可以显著降低PPV感染引起的PK-15细胞凋亡率,而对TGEV感染引起的PK-15细胞凋亡率则没有显著影响。说明蜂胶黄酮可以减轻无囊膜的PPV感染对PK-15细胞引起的凋亡。
蜂胶黄酮;猪传染性胃肠炎病毒;猪细小病毒;细胞凋亡
猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)和猪细小病毒(Porcine parvovirus,PPV)只能在来源于猪的细胞(如原代猪肾细胞、猪睾丸细胞及PK-15、CPK、IBRS-2、MVPK及ST等传代细胞)和人的某些传代细胞(如Hela、KB、Hep-2、Lu132等细胞)中培养增殖[1]。TGEV和PPV感染PK-15细胞可以引起细胞的凋亡和释放多种抗感染因子[2-3]。本试验在前期发现蜂胶黄酮具有抵抗TGEV和PPV感染PK-15细胞的作用及减少PK-15细胞的死亡数量的基础上[4],观察蜂胶黄酮对TGEV和PPV感染PK-15细胞引起细胞凋亡的影响,为蜂胶活性物质抗病毒作用研究基础资料。
1 材料与方法
1.1材料
1.1.1病毒毒株、细胞和药物疫苗株病原TGEV、PPV和PK-15细胞均由山东省滨州畜牧兽医研究院提供。蜂胶黄酮,由山东绿都生物科技有限公司制备,芦丁法测定黄酮含量为85%。
1.1.2主要试剂和仪器胰蛋白酶、DMEM培养基、四甲基偶氮唑蓝(MTT)染料、碘化丙啶(PI)、乙二胺四乙酸二钠(EDTA),Gibco公司产品;新生牛血清,杭州四季青生物有限公司产品;CO2培养箱(371型),Thermo公司产品;细胞培养瓶和96孔细胞培养板,德国Nunclon公司产品;倒置显微镜由重庆光学仪器厂生产。
1.2方法
1.2.1蜂胶黄酮对PK-15细胞安全浓度的测定将蜂胶黄酮用细胞维持液从2 000 μg/m连续的2倍比稀释10个浓度后,加到长成单层PK-15的96孔细胞培养板上,100 μL/孔,每个稀释度重复6孔,另设细胞对照,置37 ℃、体积分数为5% CO2培养箱中培养72 h后MTT法检测,以加蜂胶黄酮孔OD值不显著低于细胞对照孔OD值的最高浓度作为最大安全浓度。
将安全浓度下倍比稀释5个浓度的蜂胶黄酮和TGEV或PPV加到长成单层PK-15细胞,每浓度重复18孔,同时设病毒对照组和细胞对照孔。于加入后的12、24、36、48、60、72 h随机取3孔,用不含EDTA的胰蛋白酶消化PK-15细胞,PBS洗涤3次后,吸弃上清,细胞悬浮与500 μL Binging buffer中,加入5 μL PI和5 μL Annexin V-FITC,避光室温反应10 min,用流式细胞仪进行检测[5]。
2 结果
2.1蜂胶黄酮PK-15细胞的安全浓度
蜂胶黄酮在500 μg/mL~2 000 μg/mL的OD 570 nm值显著小于细胞对照组(P<0.05),表明该浓度下的蜂胶黄酮对CEF细胞具有一定的毒性。15.6 μg/mL~250 μg/mL的OD 570 nm值显著高于细胞对照组(P<0.05),3.9 μg/mL~7.8 μg/mL的OD 570 nm值与细胞对照组差异不显著(P>0.05)。故将蜂胶黄酮对PK-15的最大安全浓度定为250 μg/mL(表1)。

表1 蜂胶黄酮对CEF细胞的毒性
注:同列数据标注不含相同字母者差异显著(P<0.05)。
Note:Column data marked without the same letters differ significantly (P<0.05).
2.2蜂胶黄酮对TGEV感染后PK-15细胞凋亡的检测结果
如图1~图3所示,TGEV感染PK-15细胞后12、24、36、48、60、72 h的细胞凋亡率,在所选蜂胶黄酮剂量范围内,各蜂胶黄酮组PK-15细胞凋亡率与病毒对照组均差异不显著(P>0.05)。
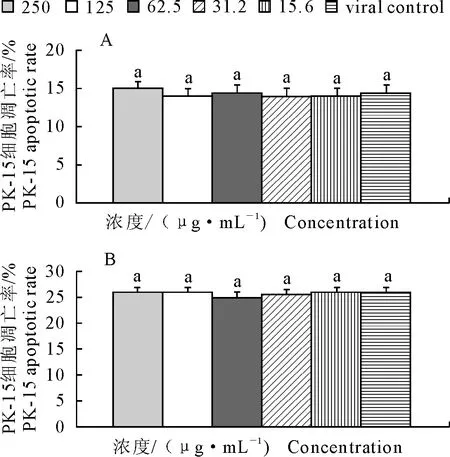
A.感染TGEV后12 h;B.感染TGEV后24 h
A.12 hours after TGEV infection;B.24 hours after TGEV infection
同组柱形图标注不含相同字母者差异显著(P<0.05)
Bars without the same letters differ significantly (P<0.05)
图1蜂胶黄酮对TGEV感染PK-15细胞12 h和24 h凋亡率的影响
Fig.1The effect of PF on PK-15 apoptotic rate 12 and 24 hours after TGEV infection
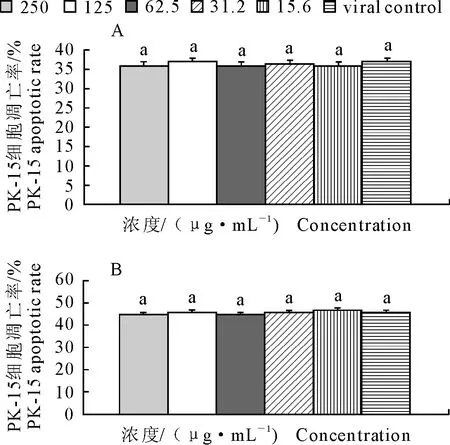
A.感染TGEV后36 h;B.感染TGEV后48 h
A.36 hours after TGEV infection;B.48 hours after TGEV infection
同组柱形图标注不含相同字母者差异显著(P<0.05)
Bars without the same letters differ significantly (P<0.05)
图2蜂胶黄酮对TGEV感染PK-15细胞36 h和48 h凋亡率的影响
Fig.2The effect of PF on PK-15 apoptotic rate 36 and 48 hours after TGEV infection

A.感染TGEV后60 h;B.感染TGEV后72 h
A.60 hours after TGEV infection;B.72 hours after TGEV infection
同组柱形图标注不含相同字母者差异显著(P<0.05)
Bars without the same letters differ significantly (P<0.05)
图3蜂胶黄酮对TGEV感染PK-15细胞60 h和72 h凋亡率的影响
Fig.3The effect of PF on PK-15 apoptotic rate 60 and 72 hours after TGEV infection
2.3蜂胶黄酮对PPV感染后PK-15细胞凋亡的检测结果
如图4~图6所示,PPV感染PK-15细胞后12、24、36、48、60、72 h的细胞凋亡率。感染12 h和24 h后,125 μg/mL和250 μg/mL浓度的蜂胶黄酮组PK-15细胞凋亡率均显著低于其他各组(P<0.05);感染36 h后,31.2、62.5、125、250 μg/mL浓度的蜂胶黄酮组PK-15细胞凋亡率均显著低于病毒对照组(P<0.05);感染48、60、72 h后,各蜂胶黄酮组PK-15细胞凋亡率显著低于病毒对照组(P<0.05)。

A.感染TGEV后12 h;B.感染TGEV后24 h
A.12 hours after TGEV infection;B.24 hours after TGEV infection
同组柱形图标注不含相同字母者差异显著(P<0.05)
Bars without the same letters differ significantly (P<0.05)
图4蜂胶黄酮对PPV感染PK-15细胞12 h和24 h凋亡率的影响
Fig.4The effect of PF on PK-15 apoptotic rate 12 and 24 hours after PPV infection

A.感染TGEV后36 h;B.感染TGEV后48 h
A.36 hours after TGEV infection;B.48 hours after TGEV infection
同组柱形图标注不含相同字母者差异显著(P<0.05)
Bars without the same letters differ significantly (P<0.05)
图5蜂胶黄酮对PPV感染PK-15细胞36 h和48 h凋亡率的影响
Fig.5The effect of PF on PK-15 apoptotic rate 36 and 48 hours after PPV infection

A.感染TGEV后60 h;B.感染TGEV后72 h
A.60 hours after TGEV infection;B.72 hours after TGEV infection
同组柱形图标注不含相同字母者差异显著(P<0.05)
Bars without the same letters differ significantly (P<0.05)
图6蜂胶黄酮对PPV感染PK-15细胞60 h和72 h凋亡率的影响
Fig.6The effect of PF on PK-15 apoptotic rate 60 and 72 hours after PPV infection
3 讨论
黄酮类化合物广泛存在于自然界,是一类具有多种药理活性的天然多酚类化合物,其具有广泛的抑制病毒活性。张玉清等[6]曾报道5种中药黄酮成分体外均有不同程度的抗病毒作用。黄酮类化合物作为蜂胶的主要有效成分之一,具有抗病毒、调节免疫、抵氧化、降血糖等作用[7]。Kai H等[8]和Nolkemper S等[9]证实蜂胶黄酮能影响流感病毒、单纯疱疹病毒等均有不同程度的抑制作用。
病毒诱导细胞凋亡是普遍现象,且病毒感染机体诱发细胞凋亡在病毒致病性上具有双重意义,因此,研究病毒诱导的细胞凋亡、宿主和病毒的凋亡及抗凋亡的规律,可为控制病毒感染和病毒病治疗提供理论依据。陈艺娟等[10]试验发现猴头菇多糖能在呼肠孤病毒感染晚期抑制细胞凋亡,认为这可能是猴头菇多糖对病毒感染产生积极影响,助于防止病毒在细胞中的扩散甚至利于病毒的清除。刘晓静等[11]也从细胞凋亡的角度证明了黄芩、连翘的中草药提取液具有抗流感病毒作用,为临床使用中药进行抗病毒治疗提供了新的分子机制和试验依据。
苏建青等[12]认为中药抗病毒感染细胞的作用途径更多的可能是通过增强细胞的抵抗力而实现的。本试验结果发现蜂胶黄酮对PPV感染细胞引起的凋亡具有明显的减轻作用,且降低作用与蜂胶黄酮有一定的量效关系。Ma X等[13]前期研究蜂胶黄酮和Bankova V等[14]在研究黄酮类化合物抗病毒作用时,也发现药物对病毒的抑制作用与药物浓度在一定范围内成正相关。蜂胶黄酮对TGEV感染细胞引起的细胞凋亡没有明显的减轻作用,可能是TGEV进入细胞的速度快于药物进入细胞的速度的原因,孙秋艳等[15]研究浒苔多糖抗TGEV时也持相同观点。
李厚伟等[2]研究猪细小病毒感染PK-15细胞的增殖规律时发现,干扰素及相关细胞因子、凋亡相关细胞因子、部分抗病毒基因表达相应的加强,对阐释细胞因子的免疫作用机制及PPV的分子作用机制提供了依据,为预防和治疗PPV相关药物的筛选及研制奠定了理论基础。戴美玲等[3]在研究猪传染性胃肠炎病毒(TGEV)诱导ST细胞凋亡时发现,TGEV感染能够诱导ST细胞凋亡,caspase-3、caspase-8及FasL介导的死亡受体通路和Bcl-2家族调控的线粒体凋亡通路,在调控TGEV感染诱导的细胞凋亡过程中可能起着非常重要的作用。本试验结果发现,蜂胶黄酮可以减轻PPV感染PK-15细胞后诱导的细胞凋亡,而对TGEV感染引起的PK-15细胞凋亡则没有明显的减轻作用,更深层次的机理如蜂胶黄酮通过调控PPV感染的PK-15细胞的哪种信号传导通路及在基因水平还是蛋白水平及病毒本身结构(有无囊膜)影响药物作用等则需要进一步的研究。
[1]刘艳华,范伟兴,王锡乐.猪细小病毒的研究概况[J].中国畜牧兽医,2004,31(12):45-48.
[2]李厚伟,魏战勇,尹海燕,等,猪细小病毒感染PK-15细胞抗病毒相关因子转录变化的分析[J].畜牧兽医学报,2011,42(1):48-55.
[3]戴美玲,赵晓民,丁利,等.猪传染性胃肠炎病毒诱导ST细胞凋亡的初步研究[J].西北农林科技大学学报:自然科学版,2013,41(11):19-25.
[4]马霞,刘永录,张志辉,等.蜂胶体外对猪细小病毒感染细胞能力的影响[J].中国畜牧兽医,2013,40(12):196-199.
[5]殷震,刘景华.动物病毒学[M].2版,北京:科学出版社,1997:1145-1155.
[6]张玉清,王帅,景娇,等.5种中药黄酮成分体外抗病毒作用观察[J].南京农业大学学报,2012,35(4):105-109.
[7]侯伟杰,高洋,高晶晖,等.三种佐剂对奶山羊乳房炎灭活疫苗免疫效果的影响[J].动物医学进展,2015,36(1)45-48.
[8]Kai H,Obuchi M,Yoshida H,et al.Invitroandinvivoanti-influenza virus activities of flavonoids and related compounds as components of Brazilian propolis(AF-08)[J].J Funct Foods,2014,8:214-223.
[9]Nolkemper S,Reichling J,Sensch K H,et al.Mechanism of herpes simplex virus type 2 suppression by propolis extracts [J].Phytomedicine,2010,17:132-138.
[10]陈艺娟,吴异健,黄一帆,等.猴头菇多糖对呼肠孤病毒感染番鸭组织病变及细胞凋亡的影响[J].中国预防兽医学报,2010,32(1):14-18.
[11]刘晓静,孙坚.中草药提取液对流感病毒诱导细胞凋亡的影响[J].南昌大学学报:医学版,2012,52(1):10-13.
[12]苏建青,褚秀玲,付本懂,等.人参皂苷体外抗鸡新城疫病毒的效果观察[J].动物医学进展,2009,30(6):17-20.
[13]Ma X,Guo Z H,Shen Z Q,et al.The anti-procine parvovirus activity of nanometer propolis flavone and propolis flavone in vitro andInvivo[J].Evidence-Based Complementary and Alternative Medicine,2015,http://dx.doi.org/10.1155/472876.10 pages.
[14]Bankova V,Galabov A S,Antonova D,et al.Chemical composition of propolis extract ACF and activity against herpes simplex virus[J].Phytomedicine,2014,21:1432-1438.
[15]孙秋艳,沈美艳.浒苔多糖体外抗猪传染性胃肠炎病毒研究[J].动物医学进展,2015,36(12):90-93.
Effect of Propolis Flavone on Apoptosis of PK-15 Cells Induced by Viruses
GUO Zhen-huan1,2,3,4,MA Xia1,3,WANG Wen-xiu3,WANG Tian2,SHEN Zhi-qiang1,3
(1.Postdoctoral Programme,Binzhou Animal Science and Veterinary Medicine Academy,Binzhou, Shandong, 256600,China;2.PostdoctoralProgramme,NanjingAgriculturalUniversity,Nanjing,Jiangsu, 210095,China;3.BinzhouAnimalScienceandVeterinaryMedicineAcademy,Binzhou,Shandong, 256600,China;4.HenanProvinceHealthStarPharmaceuticalCo.,Ltd,Zhengzhou,Henan, 451646,China)
In order to investigate the effect of propolis flavone (PF) on apoptosis of host cells induced by virus.PF was diluted to five concentrations with MM in of its safe concentration and added into PK-15 monolayers with transmissible gastroenteritis virus(TGEV) and porcine parvovirus(PPV).Then the effects of PF on apoptosis rate of host cells induced by TGEV and PPV were detected by flow cytometry.The results showed that PF could reduced the apoptosis rate of PK-15 cells induced by PPV remarkably compared with virus control.But the apoptosis rate of PK-15 cells induced by TGEV had no obvious significance.In conclusion,PF was able to alleviate the apoptosis rate of PK-15 cells induced by PPV,which had no envelope.
propolis flavone; Transmissible gastroenteritis virus; Porcine parvovirus; apoptosis
2016-01-04
山东省滨州畜牧兽医研究院博士后科研启动基金项目(bzxmsybsh201502)
郭振环(1977-),男,山东淄博人,助理研究员,博士,主要从事中药药理学研究。*通讯作者
S852.3;S853.76
A
1007-5038(2016)08-0041-04
