青藤碱增强表柔比星对黑色素瘤细胞侵袭的抑制作用
2016-09-20郭冰玉全亮亮
郭冰玉,张 宇,回 蔷,全亮亮,陶 凯
青藤碱增强表柔比星对黑色素瘤细胞侵袭的抑制作用
郭冰玉,张宇,回蔷,全亮亮,陶凯*
目的初探青藤碱如何增强表柔比星对黑色素瘤细胞侵袭的抑制作用。方法应用Transwell方法检测不同处理因素对A375细胞侵袭的影响。处理因素分为4组,分别为:生理盐水组(对照),表柔比星处理组、青藤碱处理组和两种药物联合处理组。通过Western blot及Real-time PCR检测不同因素作用下侵袭相关蛋白的变化。结果5 μg/mL表柔比星、10 μg/mL青藤碱以及两种药物联合处理组24 h后对A375细胞侵袭的抑制率分别为20.40%±4.63%、14.40%±2.67%和50.32%±3.02%。药物联用后对A375细胞侵袭的抑制作用显著高于各单药组,组间比较差异有统计学意义(P<0.05)。青藤碱可以增强表柔比星对侵袭相关蛋白MMP-2和MMP-9的抑制作用。结论低浓度青藤碱(10 μg/mL)可以显著增强低浓度表柔比星(0.1×PPC)对黑色素瘤细胞A375细胞侵袭的抑制作用,青藤碱可以作为化疗过程中的辅助用药,起到优化治疗效果的作用。
青藤碱;表柔比星;A375;黑色素瘤
0 引言
虽然黑色素瘤只占皮肤肿瘤的5%[1-2],但是仍有75%的皮肤肿瘤所致死亡患者死于黑色素瘤[3-4]。黑色素瘤的转移能力强,预后较差,生存期短[5-6]。侵袭转移是导致黑色素瘤患者死亡的主要原因[7],恶性黑色素瘤早期就可以出现淋巴结、肝、肺、脑等多处转移,患者一旦出现转移,预后很差[8]。因此,需要寻找新的治疗方案治疗黑色素瘤。
青藤碱(Sinomenine)是从青风藤中分离出的一种生物碱单体,常用于抗炎、降血压、镇咳镇痛等治疗。它对肿瘤细胞的增殖也有很强的抑制作用,但是对肿瘤侵袭转移的研究较少,目前尚无作为化疗辅助药物方向的研究[9]。表柔比星(Epirubicin)属于抗生素类抗肿瘤药,可以阻止RNA形成,进而抑制细胞周期,属于细胞周期非特异性药物,对于很多侵袭性强的肿瘤效果显著[10]。但是临床应用时,会导致很强的胃肠道反应。
本研究以黑色素瘤A375细胞作为研究对象,初探青藤碱联合表柔比星对细胞侵袭的抑制作用,以期改善化疗药物治疗黑色素瘤的使用剂量,降低患者化疗后的不良反应。
1 材料与方法
1.1材料人黑色素瘤A375细胞株(实验室冻存),DMEM培养基(invitrogen),胎牛血清(天津灏洋),青藤碱(Selleck),表柔比星注射液(健择),结晶紫(碧云天),抗体:MMP-2、MMP-9和GAPDH(Santa),SYBR Green(Promega),Matrigel(Bio rad)。
1.2方法
1.2.1细胞培养用含10%胎牛血清的DMEM培养基(含50 IU/mL青霉素,50 IU/mL链霉素)培养A375细胞株,置37 ℃、5% CO2培养箱中培养至对数生长期。
1.2.2药物处理浓度表柔比星为临床常用的化疗药物,根据lin burg公式C=20 D[C单位为μg/mL,D为临床剂量单位mg/(kg·d)]和体表面积计算公式S=1.15+(m-30)×0.1÷5(其中m>30 kg)计算所需药物浓度,表柔比星设中[1×PPC(Peak plasma concentration)]和低(0.1×PPC)两个浓度。青藤碱取10、20 μg/mL两个浓度。空白对照组为生理盐水处理组。
1.2.3Transwell实验4 ℃过夜溶解Matrigel,用预冷的培养基以1∶9稀释Matrigel,稀释后每个小室、上室加入50 μL,37 ℃、5% CO2孵箱孵育30 min,Matrigel聚合成凝胶后,取对数生长期细胞以1×105/mL浓度接种于上室中,终体积200 μL,下室加入600 μL双无培养基,细胞培养12 h后更换培养基,加入不同处理因素,各组均设3个副孔。24 h后取出小室,棉签擦去上层细胞,PBS清洗后95%乙醇固定20 min,1%结晶紫染色20 min。200倍显微镜下观察。药物对细胞的抑制率计算公式为:抑制率=1-(剂量组平均细胞数/对照组平均细胞数)×100%。
1.2.4Western blot检测蛋白表达水平将对数生长期细胞制成的1×106/L细胞悬液接种于6孔板中,贴壁培养24 h后,加入不同处理因素。药物作用24 h后收集细胞,提取蛋白后每个加样孔上样40 μg蛋白。电泳、转膜后,用5%的脱脂奶粉室温封闭2 h。TBST洗膜3次后孵育一抗4 ℃过夜。TBST洗膜3次后,室温孵育二抗1 h。洗膜3次后ECL发光仪发光。灰度值通过Image J软件测得。
1.2.5Real-time PCR检测蛋白RNA表达水平通过TRIZOL法提取细胞总RNA,通过试剂盒进行反转录成cDNA,参照SYBR Green实际和说明书进行Real-time PCR反应。所用引物为MMP-2,F(5′-3′):CGCATCTGGGGCTTTAAAC;R(5′-3′):CAGCACAAACAGGTTGCAG;MMP-9,F(5′-3′):CGACGTCTTCCAGTACCGAG;R(5′-3′):GTATCCGGCAAACTGGCT;GAPDH,F(5′-3′):CATCCCTTCTCCCCACACAC;R (5′-3′):AGTCCCAGGGCTTTGATTTG。
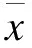
2 结果
2.1不同药物处理组对A375细胞侵袭的影响不同浓度表柔比星、青藤碱作用A375细胞24 h后,结果显示,表柔比星、青藤碱可抑制A375细胞侵袭,各组与对照组比较差异有统计学意义(P<0.01),表柔比星、青藤碱对细胞的侵袭抑制作用与剂量呈正比关系。5 μg/mL表柔比星与10 μg/mL青藤碱联合使用对A375细胞侵袭的抑制起协同作用,青藤碱能够显著提高表柔比星对细胞侵袭的抑制作用。各组与对照组比较差异有统计学意义。结果见表1~表3、图1~图6。

表1 不同剂量表柔比星对A375细胞侵袭的抑制率(n=3)
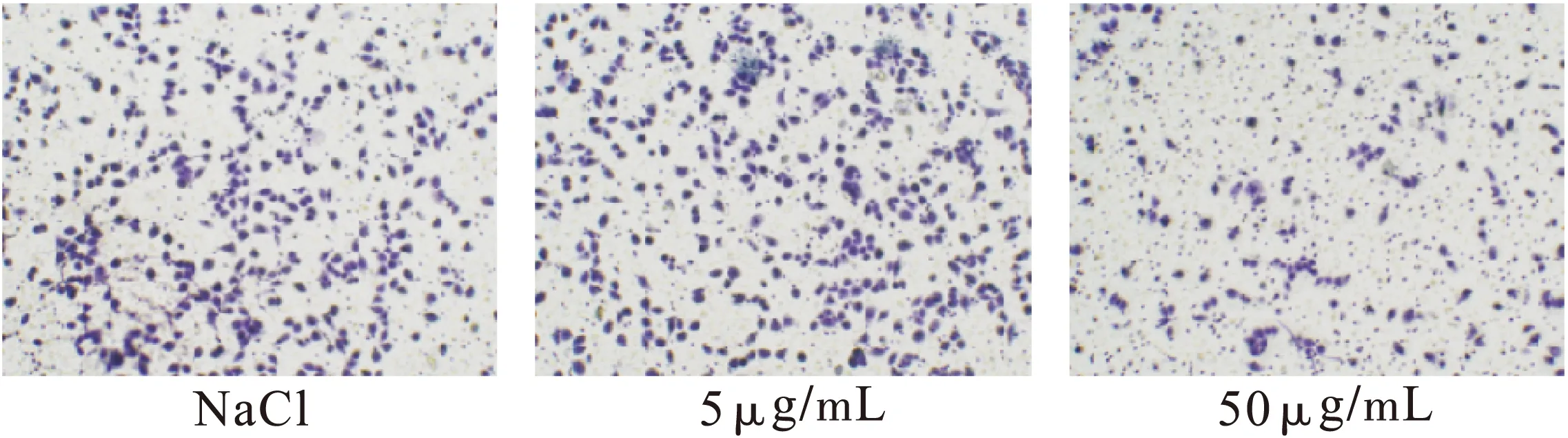
图1 不同剂量表柔比星作用下A375细胞的侵袭情况(n=3)

图2 不同剂量表柔比星对A375细胞侵袭的抑制率(n=3)

表2 不同剂量青藤碱对A375细胞侵袭的抑制率(n=3)
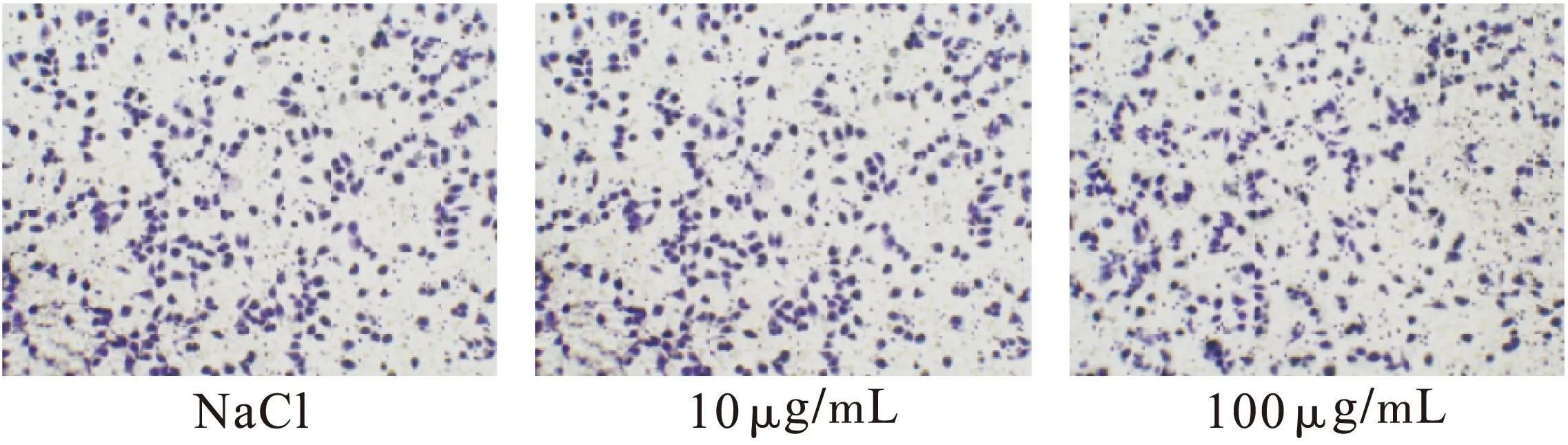
图3 不同剂量青藤碱作用下A375细胞的侵袭情况(n=3)
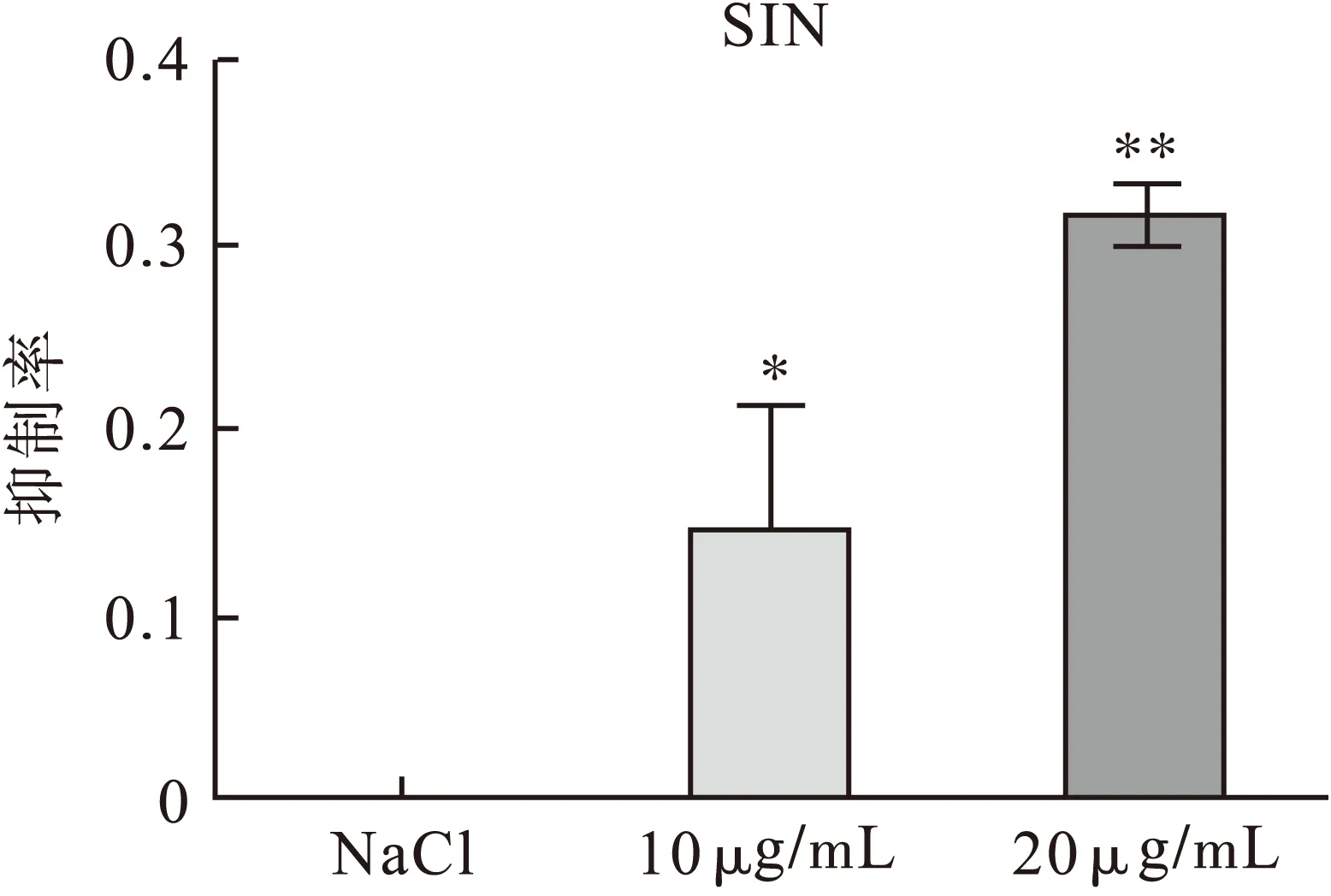
图4 不同剂量青藤碱对A375细胞侵袭的抑制率(n=3)

表3 表柔比星、青藤碱单独使用以及联合应用时细胞侵袭的抑制作用(n=3)
2.2不同处理组对A375细胞侵袭相关蛋白的影响如图7~图9所示,与对照组比较,不同药物作用下,MMP-2和MMP-9在蛋白水平及RNA水平均受到了抑制。当表柔比星与青藤碱联合应用时蛋白被抑制的程度增强。

图5 表柔比星、青藤碱单独使用以及联合应用时细胞的侵袭情况(n=3)

图6 表柔比星、青藤碱单独使用以及联合应用时对细胞侵袭的抑制作用(n=3)

图7 不同处理因素作用下A375细胞蛋白的变化

图8 不同处理因素作用下A375细胞蛋白的变化

图9 不同处理因素作用下A375细胞蛋白RNA水平的影响
3 讨论
肿瘤的转移是恶性肿瘤的典型特征,也是肿瘤致死的最主要原因。黑色素瘤早期识别治疗可以治愈[11],但其恶性程度极高,经常发生淋巴结等部位的远隔转移,占皮肤肿瘤死亡病例的极大部分。因此,寻找毒副作用小的防止黑色素瘤侵袭转移的药物很有必要[12]。目前的化疗药物大多有使用浓度高、毒副作用强的弊端[13]。所以,寻找协同作用药物是很有必要的。
青藤碱来源于防已科植物青藤的根和茎,具有镇痛镇静、镇咳局麻、降血压和抗炎等作用,实验研究表明,青藤碱对肺癌、宫颈癌、乳腺癌、肝癌等肿瘤细胞的增殖均有抑制作用[14]。报道指出,它可以促进细胞色素C的释放,启动线粒体凋亡通路促进细胞凋亡[15];在Hela细胞中抑制PI3K信号通路,抑制增殖,影响p53等蛋白调控细胞存活[16];通过抑制VEGF和COX-2的表达,抑制肿瘤血管生成抑制肿瘤生长[17];抑制ERK蛋白的磷酸化,促进肺癌细胞的凋亡,抑制其过度增殖[18]。但是其如何抑制肿瘤细胞侵袭转移以及将其作为化疗药物协同药物的研究比较少。
基质金属蛋白酶(MMPs)是基底膜及细胞外基质降解的主要蛋白水解酶,MMPs在肿瘤侵袭转移中起关键性作用,可以破坏肿瘤细胞侵袭的组织学屏障。其中,家族中的重要成员MMP-2和MMP-9已被广泛研究,可以有效降解基底膜的胶原成分和层粘连蛋白,其表达水平与肿瘤的恶性程度密切相关[19]。各种靶向药物也往往通过抑制MMPs的表达抑制肿瘤的侵袭转移[20]。
本研究结果显示,当低浓度青藤碱(10 μg/mL)与低浓度表柔比星(0.1×PPC)联合应用时,对A375细胞侵袭的抑制率高于两者单独使用的抑制率之和,起到了协同作用的效果。与此同时,药物联用时,对侵袭转移相关蛋白MMP-2和MMP-9的抑制作用显著强于单个药物作用组。由此可见,青藤碱可增强表柔比星对A375细胞侵袭的抑制效果。
目前,以青藤碱作为主要成分的药物有很多,临床已经应用的有正清风痛宁片、盐酸青藤碱注射液、毛青藤总碱片等制剂,用于治疗慢性肾炎和类风湿性关节炎等疾病。本研究表明,青藤碱除具有镇痛抗炎作用外,还对肿瘤细胞的侵袭转移具有很好的抑制作用,当与其他化疗药物联用时,可以对化疗药物起到增效的作用,加之其来源广泛,容易获取,青藤碱具有很大的深入研究价值。
综上所述,青藤碱与表柔比星联合应用可以使表柔比星在低浓度时起到更好的治疗效果,降低表柔比星的使用浓度,避免高浓度化疗药物引起的各种毒副作用,为临床解决黑色素瘤化疗难题提供了更多的药物选择。
[1]Harris K,Modi K,Kumar A,et al.Endobeochial ultrasound-guided transbronchial needle aspiration of pulmonary artery tumors:a systematic review (with video)[J].Endosc Ultrasound,2015,4(3):191-197.
[2]Pal HC,Sharma S,Strickland LR,et al.Fisetin inhibits human melanoma cell invasion through promotion of mesenchymal to epithelial transition and by targeting MAPK and NFκB signaling pathways[J].PLoS One,2014,9(1):e86338.
[3]Leiter U,Garbe C.Epidemiology of melanoma and nonmelanoma skin cancer - the role of sunlight[J].Adv Exp Med Biol,2008,624:89-103.
[4]Miller AJ,Mihm MC Jr.Melanoma[J].N Engl J Med,2006,355(1):51-65.
[5]刘桂芹,应方微.奥曲肽体外对黑色素瘤细胞株A375分泌VEGF的影响[J].国际眼科杂志,2010,10(2):231-232.
[6]赵燕,李成林,杨鹤鸣,等.皮肤恶性黑色素瘤的临床治疗进展[J].湖南中医药大学学报,2001,31(4):74-75.
[7]Cummins DL,Cummins JM,Pantle H,et al.Cutaneous malignant melanoma[J].Mayo Clin Proc,2006,81(4):500-507.
[8]Cancer statistice[J].JAMA,2013,310(9):982.
[9]孙霞,于晓佳,邱明丰,等.青风藤药理与临床研究进展[J].中国中西医结合外科杂志,2005,11(4):363-364.
[10]徐摇玲,张瑶晔,刘云鹏,等.表柔比星诱导的保护性自噬抑制了胃癌MGC823细胞的凋亡[J].现代肿瘤医学,2011,19(5):829-832.
[11]Rager EL,Bridgeford EP,Ollila D.Cutaneous melanoma:update on prevention,screening,diagnosis,and treatment[J].Am Fam Physician,2005,72(2):269-276.
[12]Murphy MJ.Diagnostic and prognostic biomarkers and therapeutic targets in melanoma[M].Springer,2012.
[13]Becker D,Mihm MC,Hewitt SM,et al.Markers and tissue resources for melanoma:meeting report[J].Cancer Res,2006,66(22):10652-10657.
[14]何晶晶.青藤碱对人肝癌细胞HepG2侵袭和转移能力的影响[D].兰州:兰州大学硕士学位论文,2012.
[15]姜廷枢,李胜岐.青藤碱对肺腺癌细胞系A549增殖和凋亡的影响[J].中国老年学杂志,2010,30(5):655-657.
[16]Zhou L,Luan H,Liu Q,et al.Activation of PI3K/AKT and ERK signaling pathways antagonized sinomeninc-induced lung cancer cell apoptosis[J].Mole Med Rep,2012,5(5):1256-1260.
[17]王晓洁,牛剑明,徐丽丹,等.青藤碱抑制肺癌细胞株Calu-1增殖凋亡影响的实验研究[J].现代肿瘤医学,2013,21(2):267-270.
[18]栾虹,周立平,郑军,等.青藤碱诱导肺癌NVI-H460细胞凋亡及其机制的实验研究[J].现代肿瘤医学,2012,20(10):2004-2006.
[19]Zhang XX,Fu Z,Zhang Z,et al.Miemeystin-LR promotes melanoma cell invasion and enhances MMP2/9 expression mediated by NF-kappaB activation[J].Environ Sci Technol,2012,46(20):11319-11326.
[20]陆茂,叶俊儒,彭科,等.PI-103对人黑色素瘤A375细胞增殖和侵袭的影响[J].四川医学,2015,36(3):309-312.
Study of sinomenine enhances the inhibitory effect of epirubicin on melanoma invasion
GUO Bing-yu,ZHANG Yu,HUI Qiang,QUAN Liang-liang,TAO Kai*
(Department of Plastic Surgery,General Hospital of Shenyang Military Command,Shenyang 110840,China)
ObjectiveTo study how sinomenine enhances the inhibition of epirubicin on invasion of melanoma cells.MethodsThe effects of different processing factors on the invasion of A375 cells were detected by Transwell.There were four groups of processing factors:NaCl group (control),epirubicin treatment group,sinomenine treatment group and epirubicin combined with sinomenine treatment group.The invasion of A375 cells treated by different concentration of drugs was tested by Tramswell.Then the protein level and RNA level of MMP-2 and MMP-9 were detected by Western blot and Real-time PCR.ResultsThe 10 μg/mL of sinomenine,5 μg/mL of epirubicin or sinomenine combined with epirubicin were used on A375 cells,the inhibition rate on cell invasion were 14.40%±2.67%,20.40%±4.33% and 50.32%±3.02%.At the same time sinomenine could significantly enhance the inhibition effect of epirubicin on MMP-2 and MMP-9.ConclusionSinomenine combined with epirubicin has a synergistic effect on the inhibition of the invasion of melanoma cells,which can help to promote the treatment effect in chemotherapy.
Sinomenine;Epirubicin;A375;Melanoma
2015-10-12
沈阳军区总医院整形外科,沈阳 110840
10.14053/j.cnki.ppcr.201608003
