活性黑5的生物脱色、复色现象及机理
2016-09-20俞承志谢学辉郑秀林徐乐铱李然柳建设
俞承志,谢学辉,郑秀林,徐乐铱,李然,柳建设
(1东华大学环境科学与工程学院,上海 201620;2国家环境保护纺织污染防治工程技术中心,上海 201620)
活性黑5的生物脱色、复色现象及机理
俞承志1,2,谢学辉1,2,郑秀林1,2,徐乐铱1,2,李然1,2,柳建设1,2
(1东华大学环境科学与工程学院,上海 201620;2国家环境保护纺织污染防治工程技术中心,上海 201620)
印染废水问题形势依然严峻,目前常用生物法来治理,筛选高效降解染料的微生物是生物法处理印染废水的关键。本文利用梯度浓度压力驯化法,从印染废水水解酸化反应器中筛选出对染料活性黑 5具有良好脱色性能的混合菌群DDMY1。利用该菌群在兼氧条件下对活性黑5进行脱色研究,首先采用拍照方式记录其反复脱色、复色的直观效果,其次运用紫外-可见光分光光度计检测其不同时间、不同状态下脱色液吸光值情况,最后运用气相色谱质谱联用仪和傅里叶变换红外光谱仪等检测方法分析脱色、复色过程中产物情况。结果表明,混合菌群DDMY1对活性黑5的脱色性能显著,24h脱色率能达到97.4%。同时,发现活性黑5的兼氧生物脱色反应可有效反复脱色、复色达17次之多,根据分析测试的结果,初步推测该现象可能是由活性黑5降解产物中的苯胺类物质或萘醌类物质造成的。
混合菌群;染料脱色;活性黑5;氧化还原反应
染料广泛应用于纺织、皮革、塑料、化妆品和食品等行业[1]。全世界每年有7×105t合成染料生产,并且有5%~10%随印染废水排放[2]。而偶氮染料是在纺织工业中应用最多的,约占70%[3]。每年有超过3000种偶氮染料用于各行业[4]。偶氮染料中有一个或多个偶氮键(—N==N—)[5]以及磺酸基团,使得染料分子具有毒性,耐高温,在酸性和碱性条件下非常稳定,很难天然降解[6-8],从而被认为是持久性有 机污染物[9]。染料进入天然水体中,不仅破坏美观,而且减少阳光透入,从而抑制水生植物光合作用[10],而其降解产物通常含有芳香胺,芳香胺对生物体具有致癌、致畸、致突变的作用[11-12],可通过食物链进入人类体内[13]。
目前,常用的处理偶氮染料的方法有絮凝法、吸附法、臭氧氧化法、光催化氧化法、膜过滤法和电化学氧化法等[14]。然而,它们各自均有局限性,比如高昂的成本、产生具有风险的副产品和大量的能耗需要[15]。而微生物处理技术以其低成本、环保、产生微量污泥等特点,成为越来越重要的印染废水处理技术[16]。偶氮染料微生物处理过程,通常先厌氧还原染料分子为芳香胺,接着用好氧工艺彻底矿化芳香胺[17]。厌氧代谢能够打开偶氮键,使染料分子还原为无色的芳香胺,降低色度,而芳香胺在厌氧状态下无法进一步降解[18],但在好氧条件这些胺可以通过非特异性的酶羟化和打开芳环[18]。厌氧还原偶氮染料的细菌已有很多报道,如沼泽红假单胞菌[19]和Enterobacter sp.EC3[20]。此外,水解酸化工艺是一种兼氧处理工艺,在偶氮染料的处理方面有越来越多的应用。水解酸化工艺是通过微生物分泌出的胞外酶来实现的,这些微生物多为兼性厌氧菌,包括水解菌、发酵细菌及产酸菌。在染料降解过程中起主要作用的酶主要有偶氮还原酶、漆酶、过氧化物酶、NADH-DCIP还原酶和其他氧化还原酶等[21-23]。
本文利用梯度浓度压力驯化法,从运行良好的印染废水水解酸化反应器中驯化筛选出对活性黑 5具有良好脱色性能的混合菌群DDMY1,并对其菌群结构采用高通量测序方法进行了分析。在本实验中,采用2mL无色离心管作为培养容器,在兼氧状态下发现,混合菌群DDMY1对活性黑5具有良好的脱色效率。同时还发现,兼氧条件下,活性黑 5经菌群DDMY1脱色后,脱色液呈浅黄色,而当打开离心管盖,脱色液接触到空气后,会立即变为深蓝色。针对此现象,进一步采用紫外可见分光光度法、气相色谱质谱联用法、傅里叶转换红外光谱法等方法对脱色与复色机理进行了探究。初步推测,偶氮染料在菌群的作用下被还原为某种浅色物质,而这种物质极易与氧气发生反应,变成深色的物质。该物质具有氧化、还原两种状态,能够在兼氧状态下被菌群DDMY1还原为浅色还原态,在氧气存在时变为深色氧化态。这种染料脱色后又复色的现象可能在实际应用过程中影响人们对生物脱色处理效果的判断。
1 材料和方法
1.1 材料和仪器设备
(1)主要实验材料 本文选用染料为活性黑 5(reactive black 5,RB5)SIGMA-ALORICH公司生产双偶氮类酸性染料,染料分子式为C26H25N5O19S6·4Na,相对分子质量为991.82,熔点为300℃。特征波长λmax=597nm,分子结构式如图1所示。
(2)培养基 无水硫酸钠 0.5g/L,氯化铵0.2g/L,磷酸二氢钾2.66g/L,酵母提取物3g/L,染料0.05~0.40g/L。培养基均在1×105Pa灭菌20min后冷却备用。

图1 活性黑5的化学结构
(3)主要仪器设备 微量紫外可见分光光度计,IMPLEN,德国 Implen GmbH;气相色谱质谱联用仪,7890A/5975C,美国Agilent Technologies;傅里叶红外光谱仪,Nicolet 6700,美国Thermo Fisher。
1.2 研究方法
(1)脱色菌群的分离筛选过程 从本实验室运行良好的印染废水水解酸化反应器取新鲜活性污泥10mL至含90mL富集培养基的250mL锥形瓶中,于35℃下恒温培养24h。以未加菌液的富集培养基为空白对照,用分光光度法测定培养液的OD600值。当用血球计数板计数大于108个/mL,且OD600在1.5左右时,对其用驯化培养基在恒温培养箱内进行梯度浓度压力的驯化培养,培养温度为35℃,待脱色率达到80%以上,则重新转至富集培养基中,24h后转入下一瓶驯化培养基中,并逐步增加驯化培养基中染料的质量浓度,其质量浓度梯度依次为50mg/L、100mg/L、150mg/L、200mg/L、250mg/L、300mg/L、400mg/L,直至其对400mg/L活性黑5脱色率能保持80%以上,则富集驯化培养结束。通过此过程获得了对活性黑5具有良好脱色性能的混合菌群DDMY1。
(2)兼氧脱色活性黑5过程 用2mL无色离心管作为培养容器,接种10%菌液,然后加入10g/L的活性黑5母液80μL,最后加入培养基1720μL,培养液总体为2mL,盖上离心管盖密封(2mL离心管实际体积略大于2mL,培养体系中有一小部分空气,并没有完全厌氧,而是兼氧环境),于 35℃恒温培养箱中培养。同时设置对照组,染料+培养基、染料+超纯水、染料+10%菌液+超纯水,每组染料浓度均为 400mg/L,每组设置 10个平行样。每隔24h,观察颜色并检测特征峰吸光度值,计算脱色率。
(3)复色、再脱色过程 每隔24h后,离心管内活性黑5被脱色为浅黄色,此时将离心管从培养箱中取出,在超净台内,打开离心管盖子,让脱色后的染料溶液暴露在空气中约3s,目的是让新鲜空气替换离心管内原有的微量气体。然后立刻盖上离心管盖子,用力摇匀离心管,摇晃的时间长短不同表示新鲜空气与溶液的混合均匀程度的不同,摇晃时间越长,混合越均匀,猛烈摇晃约3s,即可明显观察到浅黄色溶液迅速变色成深蓝色,盖上离心管盖后,重新放回培养箱中,24h后即可再次完成脱色。
(4)紫外-可见全波长扫描并计算脱色率 把装有脱色液的2mL离心管以10000r/min的转速离心 10min后,对上清液进行 200~800nm范围的紫外-可见全波长扫描,获得脱色后的特征峰值,A597。其余对照组稀释20倍后扫描全波长,并得到特征峰值;脱色液复色后,用超纯水稀释20倍后扫描全波长,得到特征峰值。其脱色率根据式(1)计算,并以此来表示菌群的脱色能力。

式中,Ad为脱色率;A0为染料溶液脱色前在597nm的吸光度值;At为染料溶液脱色后在597nm的吸光度值。
(5)GC-MS法检测复色后产物 取100mL复色液以1000r/min转速离心10min,之后用二氯甲烷以40mL、30mL、30mL液液萃取3次,将萃取液经旋转蒸发后,用 5mL二氯甲烷溶解后,通过0.22μm滤膜,转移入气相色谱样品瓶待测。GC-MS分析:以氦气(He)为载气,流速为1.0mL/min,样品进样量为 1μL,进样口温度为280℃。产物鉴定通过与 GC-MS机器软件内部的标准谱图库(NIST08)进行比对分析。GC-MS分析测定的升温程序如下:初始温度80℃,保持10min;接着以10℃/min的速率升温至280℃,保持7min。
(6)FTIR法检测复色后产物 萃取方法同实验方法中步骤(5),萃取后得到的溶液经氮气吹干成粉末,放在NICOLET 6700型(Thermo,美国)FTIR光谱仪上进行分析,扫描范围为 4000~600cm-1。测定特征谱带的吸光度变化。
(7)高通量测序 从培养 24h的富集培养基中取10mL菌液,交由上海美吉生物医药科技有限公司进行高通量测序。
2 结果与讨论
2.1 脱色菌群的筛选及脱色性能
经过100代传代驯化后,筛选得到了对活性黑5具有良好脱色性能的混合菌群 DDMY1。混合菌群对400mg/L浓度的染料于35℃恒温培养24h后,脱色效果见图2。
从图2可以明显看到,混合菌群DDMY1对活性黑5的兼氧脱色效果十分显著,活性黑5本色为深黑色,色度极大,而经过混合菌群DDMY1的兼氧脱色之后,脱色液呈现浅黄色(如图 2中 RJP1所示),色度大幅度降低,从表观达到去除色度的作用。通过紫外-可见光全波长分光光度法测定特征波长处吸光值,运用公式(1)计算求得脱色率为97.4%,明显高于已报道的对活性黑 5具有脱色能力的菌株,如范凤霞等[24]的混合菌群FF对200mg/L活性黑5的24h脱色率为94%,陈刚等[25]的菌株GY-1对50mg/L活性黑5的30h脱色率仅为85.9%。然而,打开离心管盖接触空气后,脱色液迅速变色为深蓝色,色度又明显增加,但并没有加深至原来活性黑5的色度,而且呈现的深蓝色也与活性黑5的颜色不同,此时的脱色率仍有73.7%(如图2中RJP2所示)。实验结果呈现了一种染料活性黑5脱色后又能复色的现象。此现象鲜有报道,目前仅有MOHANTY等[26]在对活性黑5的细菌脱色实验中提到过这个现象,但他们并没有作进一步深入的探究。

图2 混合菌群DDMY1兼氧脱色活性黑5效果图
通过高通量测序方法对该菌群群落结构进行解析,结果如图3所示。
结果检测到混合菌群DDMY1主要包括变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)类细菌,共7个菌属的细菌。从图3可以明显看出,混合菌群中变形菌门细菌,尤其是变形菌门中的假单胞菌目占据绝对优势地位,而假单胞菌对印染废水具有高效降解能力已被广泛报道[27-28],其中检测到的铜绿假单胞菌(Pseudomonas)已经被报道有特异性的偶氮还原酶[29],能够高效断裂偶氮键。另外,菌群中占比较少的克雷伯氏菌(Klebsiella)[30]和嗜麦芽窄食单胞菌(Stenotrophomonas)[31]等也经常在废水处理过程中被检测到。推测本实验中对活性黑5的脱色应当是以假单胞菌为主导的,各种其他菌属细菌协作的复杂过程。

图3 混合菌群在门、属分类水平的结构图
2.2 反复脱色、复色现象
2.2.1 反复脱色、复色现象的记录和描述
混合菌群DDMY1在兼氧条件下,能对活性黑5具有高效的脱色效率,24h脱色率均能稳定达到97%以上,但是,当脱色液接触到空气数秒后,即刻发生复色现象。在本实验中,当染料初次被脱色至浅黄色需要约 24h,打开离心管盖暴露于空气中3s后,盖上离心管盖摇匀,约 3s可观察到复色现象,复色之后的离心管重新放回恒温培养箱中,经过观察,约8h后,可以再次脱色至浅黄色。实验中每隔 24h,开盖使其复色。定义每次复色、脱色为一个周期,根据观察,从0时刻至最终失去脱色能力,一共经历 18个周期,即可反复脱色、复色共18次,最终失去脱色能力后离心管内溶液保持复色后的状态。在整个过程里,每24h测定复色后培养液的紫外-可见光全波长光谱,并进行产物分析。在本文中以0天,5天,10天以及最终状态时的培养液的脱色、复色效果图为代表,见图 4,其余时刻现象与此类似,未一一列出。
整个过程长达18个周期,即从初始时刻至最终无法脱色历时18天,期间17次脱色与复色,从颜色上观察基本一致。推测脱色后的某组分具有较强还原性,每次打开盖子后,可能是空气中的氧气将其氧化而变成深蓝色。复色后的溶液重新密封培养8h后,再次脱色,推测可能是由于菌群在兼氧的环境下能将其重新还原。因此,浅黄色和深蓝色应该是该组分的还原态与氧化态,并且能够相互转化。而能够反复出现17次,至第18天时脱色复色现象消失,恒定保持在复色状态。为了确定是菌群的作用而引起该脱色、复色现象,本实验曾将初次复色后的溶液高速离心,去除菌群,然后把呈复色状态的上清液重新密封,于原来的培养条件下放置 10天,10天内任何时刻均无重新脱色,故认为是菌群DDMY1的生化作用导致复色液的重新脱色。在本实验上述的18个周期内,不对反应体系补充任何营养物质,根据细菌生长曲线[32]规律,随着时间的延长,营养物质将逐渐消耗殆尽,并且受代谢产物及空间大小等因素限制,细菌将逐渐进入衰亡期,菌体数量将逐渐减少。陈刚[33]曾获得一株对活性黑5具有高效降解能力的肠杆菌,研究表明,该菌株在培养20h以后即进入衰亡期,菌体数量开始大幅减少,30h后培养液中菌体数量极低,并会按照生长曲线规律继续降低。因此推测,本实验18天时,离心管中细菌基本衰亡殆尽,不能提供足够的生化作用对复色液进行脱色,导致循环终止。
2.2.2 渐变的复色过程
复色的速度极其迅速,打开离心管盖后,气液两相界面自动开始发生复色现象,盖上盖子后,将进入离心管上部的少量空气与溶液摇匀,即发生均匀的复色,且复色后颜色的深浅与摇匀的程度有关,摇匀约 3s后,溶液复色至最终的深蓝色,如图 5所示。从图5(a)可以看出,摇晃时间从1~3s,复色呈现的色度随之加深,说明复色现象与脱色液、空气混匀程度有关系,即再次证明,空气中的某种气体与复色有关,该气体与脱色液混合越均匀,复色液的颜色就越深。从图5(b)可知,即使初始摇晃时间长短不一,但当放置 3min及更长时间后,离心管内空气会自动与溶液彻底混匀,此时与初始摇晃时间长短无关,最终复色后的 C、D、E、F,这 4只离心管内溶液色度基本一致,而每只离心管内存在的空气量是基本一致的。因此,推测复色后最终色度与溶液的量与空气的量有关。另外,从图5(c)可以看到,在溶液与离心管顶部空气两相交界面上,溶液颜色逐步加深,由亨利定律[34]可知,这是空气中某气体组分向液相内分配导致,而经过24h兼氧培养,离心管内的溶解氧被细菌消耗而大量减少。因此,推测应该是空气中的氧气向液相分配,并与脱色液中某成分发生了氧化还原反应造成此复色现象。
2.3 多种方法对脱色液、复色液进行产物分析
2.3.1 紫外-可见分光光度法
用紫外-可见全波长分光光度计分别测定纯染料溶液、培养0h的溶液、培养24h后的脱色液以及培养24h后复色液的全波长光谱,测定结果如图6所示。

图4 反复脱色、复色过程

图5 混匀程度不同时的复色渐变过程
由于各组溶液直接测定全波长时,300nm以下测定,但脱色液稀释过程也会复色,因此,只能直接测定全波长并将300nm以下部分截去。由图6可知,脱色前活性黑5在597nm处有明显的特征峰值,24h后,脱色液中该特征峰消失,复色液中该特征峰强度极弱,此外复色液在紫外区262nm处吸收峰明显增大。上述现象表明,在活性黑5的脱色过程中,显色基团—偶氮键发生断裂,生成新的物质,比如芳香胺。而峰值在262nm附近正是芳环的紫外吸收特性,与SAGARIKA等的实验结果相似[35]。

图6 活性黑5的0h及24h培养液的紫外-可见全波长光谱
在整个实验过程中,共有18个周期,17次发生脱色-复色现象。本文测定了每个周期的复色液的紫外可见光全波长光谱,见图7。对图7的分析可知,24h后,在活性黑5特征波长597nm光谱基本一致,说明复色液的色度、降解产物组成在17天内是几乎一致的,即降解产物中显色的物质已经无法被混合菌群DDMY1进一步降解,因此脱色、复色可看作是一种稳定的循环过程,而该现象还未见有关文献的报道。
2.3.2 FTIR分析
由于一旦接触空气,脱色液即发生复色现象,因此未能对脱色液进行FTIR分析,本文仅对48h时刻的复色液进行了 FTIR 检测。测试结果见图8。
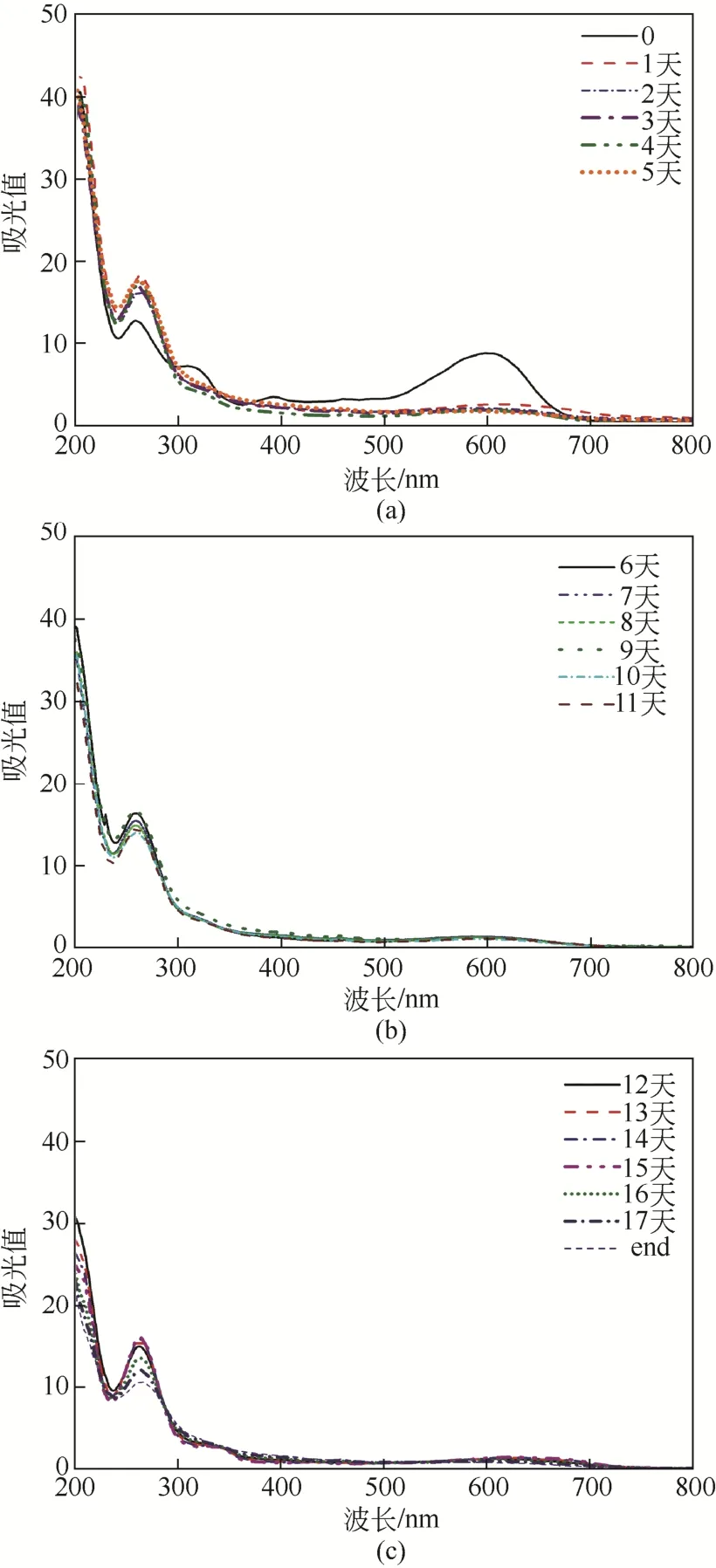
图7 不同时刻复色液紫外-可见光全波长光谱

图8 复色液FTIR图谱
图8中,1578cm-1和1515cm-1处的峰代表的是苯环上的 C==C伸缩振动,说明有苯环存在,3380cm-1处的峰是芳香仲胺的伸缩振动,说明有偶氮键发生断裂,1000~1300cm-1是C—O的伸缩振动,吸收位置变化很大,但能引起很强的红外吸收,因此这个范围内有2个强烈的吸收峰,说明—C—O—的存在。1635cm-1和1150cm-1处出现的峰代表的是羧酸中C==O和C—O的伸缩振动,说明降解过程中出现酸化。1243cm-1处的峰是芳香醚结构的伸缩振动,2857cm-1处的峰CH2对称伸缩振动,2924cm-1处的峰是—CH2不对称伸缩振动,719cm-1处的峰是—(CH2)n—(n>4)的平面摇摆振动。1150cm-1处吸收峰大幅下降,说明脱色效果显著,脱色率经计算为在 17天内,每次复色后的全波长扫描处的峰是—SO伸缩振动,629cm-1表明了含硫基团的存在。675~900cm-1低频率处中等的吸收峰表明有多环芳烃在,推测应当是萘环结构,1595cm-1处的峰指出—NH3+的存在[36]。1486cm-1处的峰是—NO键的伸缩振动,1297cm-1是芳香胺上—CN伸缩振动[37]。从FTIR光谱分析结果可以看出,至少有部分偶氮键被打开,形成了芳香胺类无色物质,这被认为是兼氧还原的主要过程,此外还有一些酰胺类物质,并且在兼氧过程中产生羧酸以及醚类和具有萘环的物质,说明兼氧过程并不能彻底将染料分子矿化[38]。
2.3.3 GC-MS分析
本文对48h时刻的复色液进行了GC-MS检测。测试结果见表1。

表1 复色液中成分GC-MS分析
本文通过GC-MS检测到多种物质,检测到的组分与FTIR测定结果基本吻合,包括了菌群生长代谢产生的产物,其中含有芳环或酰胺结构的物质可能就是活性黑 5的代谢产物,如 3-methylindole、N-(3-chlorophenyl)butanamide、4-methylphenol等。偶氮染料厌氧降解通常会有苯胺类物质产生,如在KSHAMA等[39]的厌氧-好氧序批式处理纺织工业废水的实验中,检测到芳香胺类物质,虽然本文中并未直接检测到苯胺类物质的存在,但有苯酰胺类存在,推测应当是偶氮键断裂后形成苯胺类物质,之后在细菌胞内某种代谢途径下与小分子有机酸发生酰基化。如本文中检测到的 N-(3-chlorophenyl)butanamide,其可能的代谢途径如图9。
2.4 混合菌群DDMY1对活性黑5脱色、复色机理推测
偶氮染料厌氧还原的研究已经有很多报道。通常认为,偶氮染料分子在厌氧或微氧状态下易被细菌还原[40],而还原的机理通常认为是依赖黄素酶的非特异性还原[41-42],由于偶氮分子的极性和空间位阻较大,因此无法进入细胞膜内[43],而是通过氧化还原介体完成的还原反应[44],因此,本实验中对活性黑5的兼氧还原过程也应该与此相似,通过氧化还原介体在胞外完成偶氮键的断键,实现脱色。而实验中出现的复色现象,应当是活性黑5的兼氧降解的某种产物与空气的反应。本文推测,复色现象本质上很可能是空气中的氧气参与的氧化还原反应,被氧化的物质是活性黑5的兼氧降解的某种产物。推测可能原因有两种:第一种可能,是部分染料分子的偶氮键不完全氧化断裂偶氮双键中的一根,造成假脱色现象,而其氧化还原电位可能较低,因此一遇到氧气就会复原成偶氮双键,使培养液重新呈现深蓝色[26];第二种可能,芳香胺类物质自氧化,形成醌型结构[45-46],尤其是有邻羟基的萘胺,普遍对氧敏感,具有自氧化特性[47],而醌型结构就是一种发色基团,如果环上还有取代基助色,物质就会显深色。KUDLICH等[48]对几种磺化偶氮染料厌氧降解的产物进行HPLC-MS监测氧化过程的实验中,对活性黑5的实验表明,活性黑5厌氧降解产生了 1,2,7-三氨基-8-羟基萘-3,6-二磺酸钠,即TAHNDS,它是浅黄色的,而其对氧气特别敏感,非常容易自发地脱去2个氢离子,形成一个中间过渡态物质 AP1TAHNDS,随后又进一步氧化成AP2TAHNDS,其氧化过程如图10所示。
而且他们发现,AP2TAHNDS在氧气能稳定存在,不再被进一步氧化,并且观察到它是深蓝色的,与本文观察到的现象也比较符合。无论发生复色脱色的是以上哪种物质,它都具有氧化型(深蓝色)和还原型(浅黄色)两种形态。复色只需要几秒,而脱色需要8h,说明脱色是菌群活动产生的结果。因此,推测在兼氧状态下,该物质可通过菌群再次获得氢质子和电子重新还原成浅色物质,这个过程与偶氮键还原机制[49]可能相同,如图11所示。
细菌胞内代谢推动NADH的循环再生机制,通过某种氧化还原介体将NADH、H+的电子和氢质子传递给氧化态物质,使其还原。当引入新鲜空气后,氧气与还原态物质发生氧化还原反应,夺去2个氢,将其变成氧化型。之后,反复进行氧化还原的循环,直至最终培养基内营养物质耗尽,细胞凋亡,无法提供还原力而保持氧化态。
3 结 论

图9 酰胺来源推测反应式

图10 TAHNDS暴露于空气时的氧化过程[48]
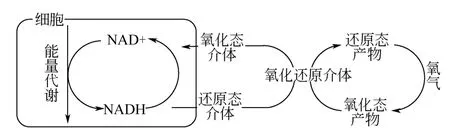
图11 脱色、复色循环机制推测
本研究筛选到一个混合菌群 DDMY1,对 400 mg/L浓度的偶氮染料活性黑5进行脱色,24h脱色率能达到97.4%。同时,研究发现脱色液具有一个反复脱色、复色的新现象。经过实验验证,复色现象是由于脱色液被空气中的氧气氧化导致的,而重新脱色是通过菌群的生化作用而被重新还原。通过UV-Vis、GC-MS和FTIR对脱色液进行了成分分析,检测到的含有芳环和酰胺结构的物质可能是活性黑5的生物降解产物。结合染料分子结构和相关文献推测,实验中可反复发生脱色、复色现象的物质可能是芳香胺类物质自氧化形成的醌型结构物质如AP2TAHNDS,并进一步推导了兼氧状态下混合菌群DDMY1对活性黑5反复脱色、复色的机理,认为这个过程与偶氮染料偶氮键还原机制可能相同,最终当菌群凋亡后,这个循环终止,脱色液保持复色状态。对于脱色、复色过程中的具体物质有待进一步检测确定。
[1]STOLZ A.Basic and applied aspects in the microbial degradation of azo dyes[J].Appl.Microbiol Biotechnol,2001,56:69-80.
[2]PADMAVATHY S,SANDHYA S,SWAMINATHAN K,et al.Aerobic decolorization of reactive azo dyes in presence of various cosubstrates[J].Chemical and Biochemical Engineering Quarterly,2003,17:147-151.
[3]WANG Xingzu,CHENG Xiang,SUN Dezhi,et al.Biodecolorization and partial mineralization of Reactive Black 5 by a strain of Rhodopseudomonas palustris[J].Journal of Environmental Sciences,2008,20:1218-1225.
[4]JADHAV S B,PATIL N S,WATHARKAR A D,et al.Batch and continuous biodegradation of Amaranth in plain distilled water by P.aeruginosa BCH and toxicological scrutiny using oxidative stress studies[J].Environ.Sci.Pollut.Res.,2013,20:2854-2866.
[5]RAFFI F,HALL J D,CERNIGLIA C E.Mutagenicity of azo dyes used in foods,drugs and cosmetics before and after reduction by Clostridium species from the human intestinal tract[J].Food Chem.Toxicol,1997,35:897-901.
[6]ZIMMERMANN T,KULLA H G,LEISINGER T.Properties of purified OrangeⅡ azoreductase,the enzyme initiating azo dye degradation by Pseudomonas KF46[J].Eur.J.Biochem.,1982,129:197-203.
[7]AHWANY El A M D.Decolorization of Fast red by metabolizing cells of Oenococcus oeni ML34[J].World Journal of Microbiology and Biotechnology,2008,24(8):1521-1527.
[8]PINHEIRO H,TOURAUD E,Thomas O.Aromatic amines from azo dye reduction:status review with emphasis on direct UV spectrophotometric detection in textile industry wastewaters[J].Dyes and Pigments,2004,61:121-139.
[9]ANLIKER R.Ecotoxicology of dyestuffs—a joint effort by industry[J].Ecotoxicol.Environ.Saf.,1979,3:59-74.
[10]AKSU Z,KILIC N K,ERTUGRUL S,et al.Inhibitory effects of chromium(Ⅵ)and Remazol Black B on chromium(Ⅵ)and dyestuff removals by Trametes versicolor[J].Enzyme and Microbial Technology,2007,40:1167-1174.
[11]CHUNG K T.The significance of azo reduction in the mutagenesis and carcinogenesis of azo dyes[J].Mutat.Res.,1983,114:269-81.
[12]HUSAIN Q.Potential applications of the oxidoreductive enzymes in the decolorization and detoxification of textile and other synthetic dyes from polluted water:a review[J].Critical Reviews in Biotechnology,2006,26(4):201-221.
[13]MOHANA S,SHRIVASTAVA S,DIVECHA J,et al.Response surface methodology for optimization of medium for decolorization of textile dye direct black 22 by a novel bacterial consortium.Bioresour[J].Technol.,2008,99:562-569.
[14]NISHANT Dafale,SATISH Wate,SUDHIR Meshram,et al.Kinetic study approach of remazol black-B use for the development of two-stage anoxic-oxic reactor for decolorization/biodegradation of azo dyes by activated bacterial consortium[J].Journal of Hazardous Materials,2008,159:319-328.
[15]ARAVINDHAN R,RAO J R,NAIR B U.Removal of basic yellow dye from aqueous solution by sorption on green alga Caulerpa scalpelliformis[J].Journal of Hazardous Materials,2007,142:68-76.
[16]JAIN K,SHAH V,CHAPLA D,et al.Decolorization and degradation of azo dye e reactive Violet 5R by an acclimatized indigenous bacterial mixed cultures-SB4 isolated from anthropogenic dye contaminated soil[J].Journal of Hazardous Materials,2012,213/214:378-386.
[17]WANG X,CHENG X,SUN D,et al.Fate and transformation of naphthylaminesulfonic azo dye reactive black 5 during wastewater treatment process[J].Environ.Sci.Pollut.Res,2014,21:5713-5723.
[18]CHAN Y,CHONG M,LIM law,et al.A review on anaerobic-aerobic treatment of industrial municipal wastewater[J].Chem.Eng.J.,2009,155:1-18.
[19]WANG X Z,CHEN X,SUN D Z,et al.Biodecolorization and partial mineralization of Reactive Black 5 by a strain of Rhodopseudomonas palustris[J].Journal of Environmental Sciences,2008,20:1218-1225.
[20]WANG Hui,XIAO Weizheng,JIAN Qiangsu,et al.Biological decolorization of the reactive dyes Reactive Black 5 by a novel isolated bacterial strain Enterobacter sp.EC3[J].Journal of Hazardous Materials,2009,171:654-659.
[21]SINGH R L,SINGH P K,SINGH R P.Enzymatic decolorization and degradation of azo dyes—a review[J].International Biodeterioration & Biodegradation,2015,104:21-31.
[22]SHAH P D,DAVE S R,RAO M S.Enzymatic degradation of textile dye Reactive Orange 13 by newly isolated bacterial strain Alcaligenes faecalis PMS-1[J].International Biodeterioration & Biodegradation,2012,69:41-50.
[23]GREKOVA Vasileva M,TOPALOVA Y.Enzyme activities and shifts in microbial populations associated with activated sludge treatment of textile effluents[J].Biotechnology & Biotechnological Equipment,2014,23(1):1136-1142.
[24]范凤霞.混合菌群FF对活性黑5的脱色降解研究[D].上海:东华大学,2013.
[25]陈刚,陈晔,黄满红,等.活性黑5脱色菌的分离鉴定及其脱色特性[J].环境污染与防治,2010,32(12):63-66.
[26]MOHANTY S,RAO N N,KAUL S N.Preliminary decolorization of H-acid based azo dye -Reactive black 5[J].Annali.Chem.,2003,93:771-775.
[27]YU J,WANG X W,YUE P L.Optimal decolorization and kinetic modeling of synthetic dyes by Pseudomonas strains[J].Water Research,2001,35(15):3579-3586.
[28]KALYANI D C,TELKE A A,DHANVE R S,et al.Ecofriendly biodegradation and detoxification of Reactive Red 2 textile dye by newly isolated Pseudomonas sp.SUK1[J].Journal of Hazardous Materials,2009,163:735-742.
[29]ALI Ryan,CHAN Ju wang,NICOLA Laurieri,et al.Reactionmechanism of azoreductases suggests convergent evolution with quinone oxidoreductases[J].Protein Cell,2010,1(8):780-790.
[30]FRANCISCON E,ZILLE A,FANTINATTI Garboggini F,et al.Microaerophilic-aerobic sequential decolourization/biodegradation of textile azo dyes by a facultative Klebsiella sp.strain VN-31[J].Process Biochem,2009,44:446-452.
[31]ARIF Al-Hamad1,MATHEW Upton1,JAMES Burnie.Molecular cloning and characterization of SmrA,a novel ABC multidrug efflux pump from Stenotrophomonas maltophilia[J].Journal of Antimicrobial Chemotherapy,2009,64:731-734.
[32]赵晓祥,张小凡.环境微生物技术[M].北京:化学工业出版社,2015.
[33]陈刚.偶氮染料废水生物脱色及典型产物好氧降解性能研究[D].上海:东华大学,2012.
[34]傅献彩,沈文霞,姚天扬,等.物理化学[M].北京:高等教育出版社,2005.
[35]SAGARIKA Mohanty,NISHANT Dafale,NAGESWARA Neti Rao.Microbial decolorization of reactive black-5 in a two-stage anaerobic-aerobic reactor using acclimatized activated textile sludge[J].Biodegradation,2006,17:403-413.
[36]KHANDARE R V,RANE N R,WAGJMODE T R,et al.Bacterial assisted phytoremediation for enhanced degradation of highly sulfonated diazo reactive dye degradation of highly sulfonated diazo reactive dye[J].Environ.Sci.Pollut.Res.,2012,19:1709-1718.
[37]KSHAMA Balapure,NIKHIL Bhatt,DATTA Madamwar.Mineralization of reactive azo dyes present in simulated textile waste water using down flow microaerophilic fixed film bioreactor[J].Bioresource Technology,2015,175:1-7.
[38]ANJALI Pandey,POONAM Singh,LEELA Iyengar.Bacterial decolorization and degradation of azo dyes[J].International Biodeterioration & Biodegradation,2007,59:73-84
[39]KSHAMA Balapure,KUNAL Jain,NIKHIL Bhatt,et al.Exploring bioremediation strategies to enhance the mineralization of textile industrial wastewater through sequential anaerobic-microaerophilic process[J].International Biodeterioration & Biodegradation,2016,106:97-105.
[40]MUSTAFA Isık,DELIA Teresa Sponza.A batch kinetic study on decolorization and inhibition of Reactive Black 5 and Direct Brown 2 in an anaerobic mixed culture[J].Chemosphere,2004,55:119-128.
[41]ANDRE B,DOS Santos,FRANCISCO J,et al.Review paper on current technologies for decolourisation of textile wastewaters.Perspectives for anaerobic biotechnology[J].Bioresource Technology,2007,98:2369-2385.
[42]SIBYLLE Bürger,ANDREAS Stolz.Characterisation of the flavin-free oxygen-tolerant azoreductase from Xenophilus azovorans KF46F in comparison to flavin-containing azoreductases[J].Appl.Microbiol.Biotechnol.,2010,87:2067-2076.
[43]FRANK P,ZEE V D,GATZE Lettinga,et al.Azo dye decolourisation by anaerobic granular sludge[J].Chemosphere,2001,44:1169-1176.
[44]CUI Daizong,LI Guofang,ZHAO Dan,et al.Effect of quinoid redox mediators on the aerobic decolorization of azo dyes by cells and cell extracts from Escherichia coli[J].Environ.Sci.Pollut.Res.,2015,22:4621-4630.
[45]ALEXANDER Plum,ASTRID Rehorek.Strategies for continuous on-line high performance liquid chromatography coupled with diode array detection and electrospray tandem mass spectrometry for process monitoring of sulphonated azo dyes and their intermediates in anaerobic-aerobic bioreactors[J].Journal of Chromatography A,2005,1084:119-133.
[46]WANG Xingzu,CHENG Xiang,SUN Dezhi,et al.Fate and transformation of naphthylaminesulfonic azo dye Reactive Black 5 during wastewater treatment process[J].Environ Sci.Pollut.Res.,2014,21:5713-5723.
[47]ANDREAS Keck,JÖRG Rau,THORSTEN Reemtsma,et al.Identification of quinoide redox mediators that are formed during the degradation of naphthalene-2-sulfonate by Sphingomonas xenophaga BN6[J].Applied and Environmental Microbiology,2002,68(9):4341-4349.
[48]KUDLICH M,HETHERIDGE M J,KNACKMUSS H J,et al.Autoxidation reactions of different aromatic o-amino hydroxy naphthalenes that are formed during the anaerobic reduction of sulfonated azo dyes[J].Environ.Sci.Technol.,1999,33:896-901.
[49]陈刚,陈亮,黄满红.偶氮染料的微生物脱色研究进展[J].微生物学通报,2009,36(7):1046-1051.
Decolorization and repigmentation of reactive black 5 biodegradation and their mechanisms
YU Chengzhi1,2,XIE Xuehui1,2,ZHENG Xiulin1,2,XU Leyi1,2,LI Ran1,2,LIU Jianshe1,2
(1College of Environmental Science and Engineering,Donghua University,Shanghai 201620,China;2State Environmental Protection Engineering Center for Pollution Treatment and Control in Textile Industry,Shanghai 201620,China)
Wastewater from printing and dyeing industrials is still a severe problem,and biological treatment is the most widely used method currently,for which screening high efficient dye biodegradation microorganisms is the key.In this paper,by using the concentration gradient pressure screening method,we selected a mixed bacterial flora DDMY1,which has good decolorization performance to reactive black 5(RB5),from the well-running hydrolytic acidification reactor for subsequent printing and dyeing wastewater treatment.The bacterial flora was used to study the RB5 decolorization under the facultative-aerobic condition.Firstly,photos were taken in the process of decolorization and repigmentation to record the repeated results visually.Secondly,ultraviolet-visible spectrophotometry was used to scan the decoloring liquid at different times and different states.At last,GC-MS(Gas Chromatography-Mass Spectrometer)and FTIR(Fourier Transform Infrared Spectroscopy)were employed to analyze the degradation products.Results indicated that,the mixed flora DDMY1 performed satisfatorily in decoloring of RB5,and with 400mg/L RB5 for 24h cultivation,thedecolorization rate could reach 97.4%.At the same time,the study found that the biological oxygen decolorization reaction could effectively repeat the decolorization-repigmentation for 17 times.According to the analysis results of the tests,it could be speculated that RB5 degradation products such as aniline,naphthoquinones might be responsible.
bacterial consortium;biological decoloring;reactive black 5;redox
X 172
A
1000-6613(2016)09-2987-10
10.16085/j.issn.1000-6613.2016.09.048
2016-03-28;修改稿日期:2016-04-28。
国家自然科学基金(21377023,51508083)、中央高校基本科研业务费专项资金(2232015D3-22)及上海市重点学科建设项目(B604)。
俞承志(1994—),男,本科生,从事水处理及环境微生物研究。联系人:谢学辉,讲师,从事环境微生物研究。E-mail xiexuehui@dhu.edu.cn。柳建设,教授,从事环境生物技术研究。E-mail liujianshe@dhu.edu.cn。
