不同番茄品种对番茄黄化曲叶病毒的抗病性分析
2016-09-19田兆丰刘伟成厚凌宇
田兆丰,刘伟成,厚凌宇,谢 华,罗 晨,柴 敏
(1北京市农林科学院植物保护环境保护研究所,北京 100097;2北京市农林科学院蔬菜研究中心,北京 100097;3北京农业生物技术研究中心,北京 100097)
不同番茄品种对番茄黄化曲叶病毒的抗病性分析
田兆丰1,刘伟成1,厚凌宇1,谢 华3,罗 晨1,柴 敏2
(1北京市农林科学院植物保护环境保护研究所,北京 100097;2北京市农林科学院蔬菜研究中心,北京 100097;3北京农业生物技术研究中心,北京 100097)
【目的】番茄黄化曲叶病毒病 (Tomato yellow leaf curl virus,TYLCV) 是一种影响全世界番茄生产的病害,培育抗病品种是最有效、经济和持久的防控手段。目前生产上应用的抗病品种繁多,但存在对 TYLVC不同抗性基因的抗性水平研究甚少、了解不够全面的问题。为了解带有不同抗性基因的番茄品种对番茄黄化曲叶病毒病的抗性,对北京市农林科学院蔬菜中心培育的番茄品种抗病性进行检测,并利用半定量RT-PCR方法分析抗病基因和抗病蛋白的表达水平。【方法】选取携带有Ty3a/Ty3a的番茄材料秋光285(Ty3a 纯合)、棚137×246 (Ty3a 杂合),携带Ty1+Ty3a纯合的秋光120、携带Ty1+Ty3a杂合的秋光81和感病对照M82为试验材料,观察番茄植株自然条件下发病情况。通过调查发病率和病情指数,考查这些番茄品种的抗病性,并利用RT-PCR方法分析抗病基因Ty1和Ty3a以及病程相关蛋白葡聚糖酶和几丁质酶基因的表达水平。【结果】携带抗性基因的杂合体、纯合体抗病性差异不明显,含有两个抗性基因和含有单一抗病基因品种的抗病性稍有差异,但差异不显著。半定量RT-PCR结果显示不同番茄品种在感染TYLCV后,体内抗性基因表达量随着发病时间的增加,Ty-3a和Ty-1的表达量逐渐增强。Ty-3a在4个番茄品种中表达水平由弱到强依次为秋光285(Ty-3a纯合)、棚137×246(Ty-3a杂合)、秋光120(Ty-1+Ty-3a纯合)和秋光81(Ty-1+Ty-3a杂合),Ty-1在秋光81中的表达显著高于在秋光120中的表达。同时,植株体内葡聚糖酶和几丁质酶基因表达量均比对照显著增加,并随着发病时间的增加逐渐增强。在发病20 d和30 d后,携带Ty-1+Ty-3a杂合的秋光81的葡聚糖酶基因表达显著强于其他几个品种。【结论】几个番茄材料对TYLCV的抗性由弱到强依次为秋光285(Ty3a 纯合)、棚137×246(Ty3a杂合)、秋光120 (Ty1+Ty3a纯合)和秋光81(Ty1+Ty3a杂合)。不同番茄抗病品种感染TYLCV后,体内抗性基因表达量随发病时间增加而增强,葡聚糖酶和几丁质酶基因表达量均比感病对照显著增加,表明番茄抗病品种在感染TYLCV后的抗病性除了与抗性基因的表达有关外,同时也与抗病相关蛋白表达增强有关。
番茄黄化曲叶病毒;抗病基因;病程相关蛋白;半定量RT-PCR
0 引言
【研究意义】番茄黄化曲叶病毒病是由番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)引起的一种毁灭性病害,并通过烟粉虱(Bemisia tabaci)传播[1]。近年来,随着全球气候变化和烟粉虱危害加重,番茄黄化曲叶病毒病在世界各地迅速扩散和蔓延。目前,这一病害已经成为影响全世界番茄生产的主要限制因素之一[2-4]。番茄黄化曲叶病毒病具有发病率高、危害大、传播效率高等特点[5],采用化学农药、物理及生物防治在一定程度上可以减轻该病的危害,但不能从根本上解决问题,而培育番茄抗病品种才是最有效、经济和持久的防控手段[6-7]。【前人研究进展】在抗病育种研究方面,国外已经有一些研究报道[8-9]。当前已经报道的番茄黄化曲叶病毒的抗性基因有Ty-1、Ty-2、Ty-3、Ty-3a、Ty-4和Ty-5等。在国内商业品种中Ty-1、Ty-2、Ty-3和Ty-3a已经被开发利用。Ty-4和Ty-5抗性基因尚未在已有商业品种中检测到[10-14]。Ty-1来自野生智利番茄材料 LA1969,该基因是第一个被定位的番茄黄化曲叶病抗病基因,位于番茄第6号染色体近着丝粒区域,Ty-3也位于番茄第6号染色体的长臂端,该基因来源于智利番茄LA2779和LA1932。Ty- 3在2个材料中的导入区段大小不同,为了便于区分,将LA1932中的抗病基因称为Ty-3a。 Ty-2是源于多毛番茄B6013的一个完全显性遗传的抗性基因。通过选育,Ty-2被转育到栽培番茄H24中,方便了对该基因的利用和研究。Ty-4来源于材料LA1932,被定为在番茄第3号染色体长臂端,Ty-5是秘鲁番茄材料TY172抗黄化曲叶病的主效基因,可以解释46.60%的表型变异,该基因位于番茄第4号染色体[15]。据报道,目前国内田间表现抗病毒的番茄品种中83.26%的番茄品种携带有Ty-1,69.04%的番茄品种携带有Ty-3a,同时携带有Ty-1和Ty-3a的番茄品种高达62.34%,因此,番茄抗TYLCV育种中利用的主要抗病基因是Ty-1和Ty-3a[15]。【本研究切入点】在TYLCV初发阶段,抗病品种多引自国外或国外种业公司直接推广自己的品种[16];后来经过国内番茄育种工作者的努力,一些TYLCV抗源已成功地转育成具有自主知识产权的、品种类型丰富的国产抗 TYLCV品种,并在生产中大面积推广应用。但是,不同抗性基因的抗性背景不同,如何将不同来源的抗病基因聚合到同一品种,能否育成对TYLCV抗性更强的品种,在生产中的表现是否更加优秀稳定等亟需进一步明确。【拟解决的关键问题】对北京市农林科学院蔬菜中心培育的含有目前生产中广泛使用的Ty-3a和Ty-1的番茄品种的抗病性进行分析,并对抗病基因和抗病蛋白的表达水平进行检测,以期为种质资源的合理利用和降低番茄黄化曲叶病毒的危害提供参考。
1 材料与方法
1.1材料
携带有Ty-3a的番茄材料秋光285(Ty-3a纯合)、棚137×246(Ty-3a杂合),携带Ty-1+Ty-3a的秋光120(Ty-1+Ty-3a纯合)、秋光81(Ty-1+Ty-3a杂合)和感病对照 M82均由北京市农林科学院蔬菜中心番茄育种课题组柴敏研究员提供。
1.2番茄试材的培育及病毒病的传播
所有番茄植株于2015年4月采取穴盘育苗的方式播种于设有防虫网隔离的温室中,自然生长,待幼苗生长至3—4叶期于5月5日移栽至北京市农林科学院植物保护环境保护研究所日光温室,每个品种移栽60 —80株。番茄移栽后按常规方法施肥和管理,定期观察温室内烟粉虱的发生情况,同时观察TYLCV在番茄上的发生情况,PCR方法定期检测TYLCV,同时定时观察和检测TYLCV在番茄上的发生情况[17]。试验在自然虫口密度的条件下进行,取样观察期间不使用任何化学农药。
1.3病情调查与分析
发病症状按严重程度划分为0、0.5、1、3、5、7、9共7个等级,分级标准、调查方法数据统计参见田兆丰等[17]。数据统计分析采用 SAS 9.0 软件,用Duncan氏新复极差法进行差异显著性分析。
1.4番茄植株抗病基因及病程相关蛋白基因表达水平的检测
从感病对照M82植株开始发病后的10、20、30 d,选取番茄幼苗生长点下第3片叶,采用半定量RT-PCR分别测定抗病基因Ty-1和Ty-3a以及病程相关蛋白葡聚糖酶和几丁质酶基因的相对表达量。总 RNA的提取采用RNeasy Mini kit(天根生化科技有限公司,北京,中国)并参照厂家的说明书进行操作。采用试剂盒avian myeloblastosis virus reverse transcriptase RNA PCRTM(TaKaRa)进行反转录,以不同处理的cDNA为模板进行PCR扩增,引物序列如表1 所示;PCR反应条件为95℃预变性4 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。取5 μL PCR产物在含有核酸荧光染料Gold View的1.0%琼脂糖凝胶电泳分离,在凝胶成像系统上观察结果。Actin为内参基因,所有结果重复3次。
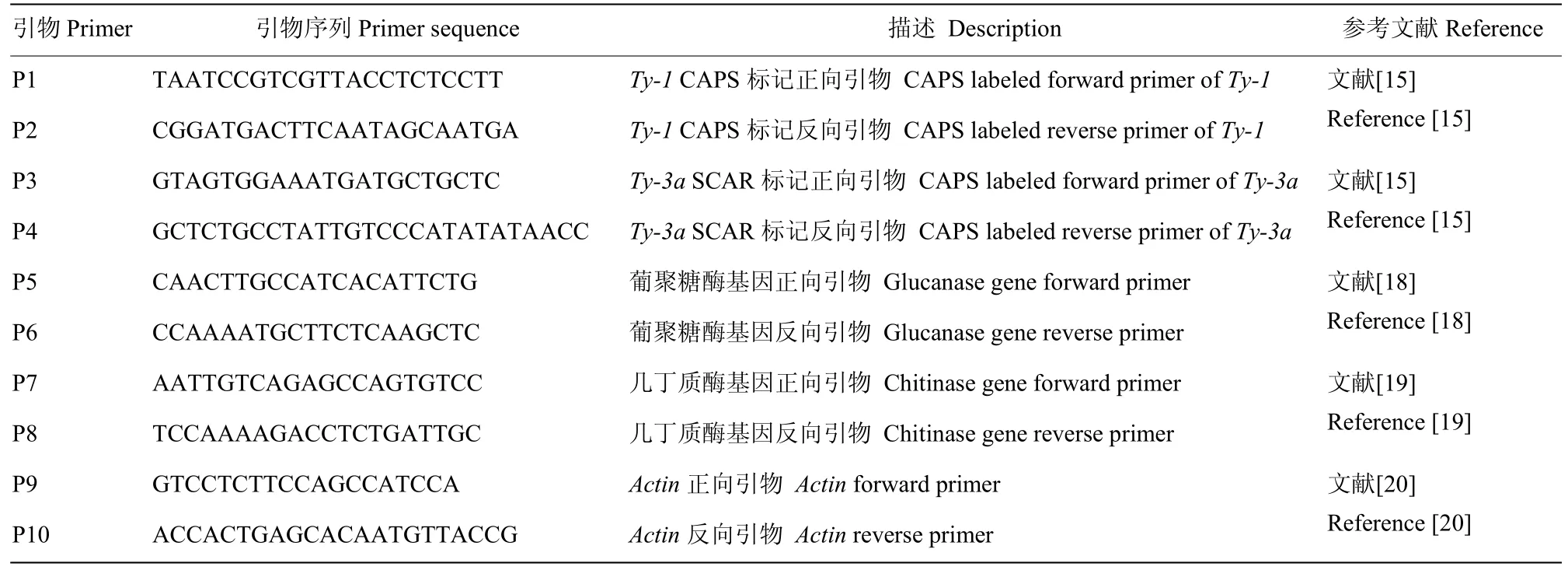
表1 PCR 扩增引物Table 1 Primer sequences for PCR
2 结果
2.1不同番茄品种病情调查情况
从感病对照M82有个别植株开始发病后第10天调查结果显示如表2,感病品种M82在第10天的发病率达到53%,病情指数为13.8,而其他几个抗病品种没有观察到明显的病状或症状;在对照发病后第20天调查中,各番茄品种都有发病症状,其中对照发病率达到 100%,而且病情指数也相应较高,而抗病材料发病率较低且病情指数也很低。在对照发病后第30天调查中,对照的病情指数进一步升高,且其他几个抗病品种的发病率也有所增加,但病情指数相对很低。综合发病率和病情指数,几个抗病品种发病程度从高到低依次为秋光285(Ty-3a纯合)、棚137×246(Ty-3a杂合)、秋光 120 (Ty-1+Ty-3a纯合)和秋光 81 (Ty-1+Ty-3a杂合)。统计分析结果表明,含有抗性基因的品种与不含抗性基因的对照品种的抗病性差异极显著。但几个抗病品种中,携带单一抗性基因的纯合体和杂合体以及携带两个抗性基因的纯合体和杂合体之间的抗病性没有差异显著性。

表2 不同时期番茄品种病情调查结果Table 2 The disease degrees of tomato varieties at different times
2.2番茄植株抗病基因的表达分析
不同番茄品种在感染TYLCV后,体内抗性基因表达量随着发病时间的增加,两个基因的表达量逐渐增强。同时,在每个调查时期,Ty-3a(约320 bp)在4个番茄品种中都有相同的表达趋势,分别为秋光285 (Ty-3a纯合)、棚 137×246(Ty-3a杂合)、秋光120(Ty-1+Ty-3a纯合)和秋光81(Ty-1+Ty-3a杂合)依次增强,且Ty-1(约400 bp)在秋光81中的表达显著高于在秋光120中的表达,表明两个抗性基因在杂合体中的表达都比纯合体高,而在同一品种中,含有两个抗性基因与单抗性基因的番茄材料比较,Ty-3a的表达没有显著差异(图1)。

图1 不同番茄品种抗性基因Ty-3a(A)和Ty-1(B)的表达Fig.1 Expression of resistance genes Ty-3a (A) and Ty-1 (B) in different tomato varieties
2.3番茄植株病程相关蛋白基因的表达分析
不同番茄品种在感染TYLCV后,体内葡聚糖酶(约800 bp)和几丁质酶(约750 bp)基因表达量均比对照显著增加。随着发病时间的增加,两个基因的表达量逐渐增强。在发病后第10天,除了对照,各品种间葡聚糖酶基因表达没有显著差异,但是在发病20 d和 30 d后,携带Ty-1+Ty-3a杂合的秋光81的葡聚糖酶基因表达显著强于其他几个品种。几丁质酶基因有轻微逐渐增加的趋势,但不显著。由此可见,携带Ty-1+Ty-3a杂合的秋光81番茄品种在整个发病过程中,抗病蛋白葡聚糖酶和几丁质酶基因的表达都高于其他几个品种,并且随着发病时间的延长表达量显著增强(图2)。
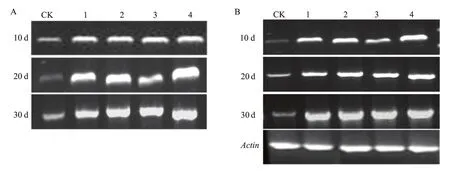
图2 不同番茄品种中葡聚糖酶(A)和几丁质酶(B)基因的表达Fig.2 Expression of glucanase (A) and chitinase (B) genes in different tomato varieties
3 讨论
虽然目前报道的番茄黄化曲叶病毒的抗性基因有Ty-1、Ty-2、Ty-3、Ty-3a、Ty-4 和 Ty-5 等,且不同抗性基因在番茄TYLCV病害防御中的作用也有少量报道,但不同抗性基因对TYLCV病原的抗性水平不同,相关抗性基因在TYLCV病原侵染下的表达水平及差异鲜有报道。北京市农林科学院蔬菜中心拥有较好的适合国内生产的优势品种,利用从国外引进的抗源材料,育成适宜于中国北方地区栽培的稳定的抗病番茄品种。本文对携带单一抗性基因Ty-3a纯合与杂合和携带多个抗性基因Ty-1/Ty-3a纯合和杂合的几个番茄抗病品种进行了TYLCV病原侵染抗病性调查和抗性基因表达水平的分析,初步从分子水平上阐述了抗性基因与抗病性的关系,该研究结果对于番茄抗TYLCV品种的选育具有重要的参考价值。
病程相关蛋白(pathogenesis-related proteins,PRPs)是指植物在受到病原物侵染或非生物因子诱导协迫条件下产生的一类与植物抗性密切相关的水溶性蛋白[21]。其中,β-1,3-葡聚糖酶和几丁质酶作为抗病蛋白在植物抗真菌病害的防卫反应中发挥重要作用,被广泛应用于植物抗病基因工程育种实践,同时测定β-1,3-葡聚糖酶和几丁质酶的表达情况也成为研究植物诱导抗病性效果的重要手段[22-24]。本研究结果表明不同番茄抗病品种在感染TYLCV后,体内葡聚糖酶和几丁质酶基因表达量均比感病对照显著增加。随着发病时间的增加,两个基因的表达量逐渐增强,且携带Ty-1+Ty-3a杂合的秋光81的葡聚糖酶基因表达量明显高于其他几个品种,表明抗病番茄品种对TYLCV抗病性与其病程相关蛋白表达存在一定的相关性。综上所述,番茄抗病品种在感染TYLCV后的抗病性除了与抗性基因的表达有关外,同时也与抗病相关蛋白表达增强有关。
4 结论
调查结果表明几个番茄材料对TYLCV的抗性由弱到强依次为秋光285(Ty-3a纯合)、棚137×246 (Ty-3a杂合)、秋光120(Ty-1+Ty-3a纯合)和秋光81(Ty-1+Ty-3a杂合),但4个抗病材料之间的抗性没有显著差异。同时半定量RT-PCR结果显示,秋光81对TYLCV抗病性较强与其抗性基因和抗病蛋白表达增强有关。
References
[1] COHEN S,HARPAZ I. Periodic,rather than continual acquisition of a new tomato virus by its vector,the tobacco whitefly (Bemisia tabaci Gennadius). Entomologia Experimentalis et Applicata,1964,7: 155-166.
[2] POLSTON J E,MCGOVERN R J,BROWN L G. Introduction of Tomato yellow leaf curl virus in Florida and implications for the spread of this and other geminiviruses of tomato. Plant Disease,1999,83(11): 984-988.
[3] 张芝利,罗晨. 我国烟粉虱的发生危害和防治对策. 植物保护,2001,27(2): 25-30. ZHANG Z L,LUO C. Occurrence and control countermeasures of Bemisia tabaci (Gennadius) in China. Plant Protection,2001,27(2): 25-30. (in Chinese)
[4] 周雪平,崔晓峰,陶小荣. 双生病毒——一类值得重视的植物病毒.植物病理学报,2003,33(6): 487-492. ZHOU X P,CUI X F,TAO X R. Geminiviruses-an emerging threat for crop production. Acta Phytopathologica Sinica,2003,33(6): 487-492. (in Chinese)
[5] 丁铭,岳宁,董家红,张仲凯. 侵染番茄的中国番茄黄化曲叶病毒致病性相关分子的遗传多样性. 云南大学学报(自然科学版),2008,30(增刊1): 63-68. DING M,YUE N,DONG J H,ZHANG Z K. Genetic diversity of tomato yellow leaf curl China virus associated satellites DNA β infecting Solanum lycopersicon. Journal of Yunnan University (Natural Sciences),2008,30(Suppl.1): 63-68. (in Chinese)
[6] LAPIDOT M,FRIEDMANN M. Breeding for resistance to whitefly-transmitted geminiviruses. Annals of Applied Biology,2002,140(2): 109-127.
[7] STANSLY P A,SÁNCHEZ P A,RODRIGUEZ J M,CAÑIZARES F,NIETO A,LOPEZ LEYVA M J,FAJARDO M,SUÁREZ V,URBANEJA A. Prospects for biological control of Bemisia tabaci (Homoptera: Aleyrodidae) in greenhouse tomatoes of southern Spain. Crop Protection,2004,23(8): 701-712.
[8] VIDAVSKY F,CZOSNEK H. Tomato breeding lines resistant and tolerant to Tomato yellow leaf curl virus issued from Lycopersicon hirsutum. Phytopathology,1988,88(9): 910-914.
[9] AKAD F,EYBISHTZ A,EDEIBAUM D,GOROVITS R,DAR-ISSA O,IRAKI N,CZOSNEK H. Making a friend from a foe: expressing a GroEL gene from the whitefly Bemisia tabaci in the phloem of tomato plants confers resistance to Tomato yellow leaf curl virus. Archives of Virology,2007,152(7): 1323-1339.
[10] ZAMIR D,EKSTEIN-MICHELSON I,ZAKAY Y,NAVOT N,ZEIDAN M,SARFATTI M,ESHED Y,HAREL E,PLEBAN T,VAN-OSS H,KEDAR N,RABINOWITCH H D,CZOSNEK H. Mapping and introgression of a tomato yellow leaf curl virus tolerance gene,Ty-1. Theoretical and Applied Genetics,1994,88(2): 141-146.
[11] JI Y,SCHUSTERD J,SCOTT J W. Ty-3,a begomovirus resistance locus near the Tomato yellow leaf curl virus resistance locus Ty-1 on chromosome 6 of tomato. Molecular Breeding,2007,20(3): 271-284.
[12] MEJÍA L,TENI R E,VIDAVSKI F,CZOSNEK H,LAPIDOT M,NAKHLA M K,MAXWELL D P. Evaluation of tomato germplasm and selection of breeding lines for resistance to begomoviruses in Guatemala. International Symposium on Tomato Diseases,2005,695: 251-256.
[13] JI Y,SCOTT J W,SCHUSTER D J,MAXWELL D P. Molecular mapping of Ty-4,a new tomato yellow leaf curl virus resistance locus on chromosome3 of tomato. Journal of the American Society for Horticultural Science,2009,134(2): 281-288.
[14] 刘榛,张延安. CAPS标记在番茄抗黄化曲叶病毒病基因 Ty-1和Ty3遗传关系分析上的应用. 西北农业学报,2013,22(4): 92-96. LIU Z,ZHANG Y A. CAPS marker use in genetic relationship analysis between Ty-1 and Ty3 resistant gene to Tomato yellow leaf curl virus. Acta Agriculturae Boreali-Occidentalis Sinica,2013,22(4): 92-96. (in Chinese)
[15] 胡恩美,余文贵,王银磊,杨玛丽,赵丽,赵统敏. 番茄抗黄化曲叶病基因研究进展. 江苏农业学报,2013,29(6): 1496-1502. HU E M,YU W G,WANG Y L,YANG M L,ZHAO L,ZHAO T M. Research progress in tomato yellow leaf curl virus resistance genes. Jiangsu Journal of Agricultural Sciences,2013,29(6): 1496-1502. (in Chinese)
[16] 叶青静,杨悦俭,王荣青,李志邈,阮美颖,周国治,姚祝平. 番茄抗黄化曲叶病育种研究进展. 中国农业科学,2009,42(4): 1230-1242. YE Q J,YANG Y J,WANG R Q,LI Z M,RUAN M Y,ZHOU Z G,YAO Z P. Progress in research on tylcd-resistant breeding of tomato. Scientia Agricultura Sinica,2009,42(4): 1230-1242. (in Chinese)
[17] 田兆丰,刘伟成,谢欢,邢若虹,柴敏,罗晨. 不同番茄品种对番茄黄化曲叶病毒的抗病性鉴定. 植物保护学报,2013,40(1): 56-60. TIAN Z F,LIU W C,XIE H,XING R H,CHAI M,LUO C. Resistance identification of tomato varieties against Tomato yellow leaf curl virus. Acta Phytophylacica Sinica,2013,40(1): 56-60. (in Chinese)
[18] VAN KAN J L,JOOSTEN M H,WAGEMAKERS C A,VAN DEN BERG-VELTHUIS G C,DE WIT P J. Differential accumulation of mRNAs encoding extracellular and intracellular PR proteins in tomato induced by virulent and avirulent races of Cladosporium fulvum. Plant Molecular Biology,1992,20(3): 513-527.
[19] DANHASH N,WAGEMAKERS C A,VAN KAN J A,DE WIT P J. Molecular characterization of four chitinase cDNAs obtained from Cladosporium fulvum-infected tomato. Plant Molecular Biology,1993,22(6): 1017-1029.
[20] 李仁,吴新新,李蔚,杨荣超,赵永钦,温常龙,赵冰,郭仰东. 番茄水通道蛋白基因SlAQP的克隆与序列分析. 中国农业科学,2012,45(2): 302-310. LI R,WU X X,LI W,YANG R C,ZHAO Y Q,WEN C L,ZHAO B,GUO Y D. Cloning and sequence analysis of the aquaporins gene SlAQP in tomato. Scientia Agricultura Sinica,2012,45(2): 302-310. (in Chinese)
[21] AIMÉ S,CORDIER C,ALABOUVETTE C,OLIVAIN C. Comparative analysis of PR gene expression in tomato inoculatedwith virulent Fusarium oxysporum f. sp. lycopersici and the biocontrol strain F. oxysporum Fo47. Physiological and Molecular Plant Pathology,2008,73(1/3): 9-15.
[22] 左豫虎,康振生,杨传平,芮海英,娄树宝,刘惕若. β-1,3-葡聚糖酶和几丁质酶活性与大豆对疫霉根腐病抗性的关系. 植物病理学报,2009,39(6): 600-607. ZUO Y H,KANG Z S,YANG C P,RUI H Y,LOU S B,LIU T R. Relationship between activities of β-1,3-glacanase and chitinase and resistance to phytophthora root rot in soybean. Acta Phytopathologica Sinica,2009,39(6): 600-607. (in Chinese)
[23] 吴艳兵,谢荔岩,谢联辉,林奇英. 毛头鬼伞多糖对烟草酶活性和同工酶谱的影响. 微生物学杂志,2007,27(5): 29-33. WU Y B,XIE L Y,XIE L H,LIN Q Y. Effects of coprinus comatus polysaccharide on the activities of enzymes and isoenzyme zymogram in tobacco leaves. Journal of Microbiology,2007,27(5): 29-33. (in Chinese)
[24] 黑银秀,朱为民,郭世荣,于力,孙锦,朱龙英. 核黄素和接种番茄黄化曲叶病毒对番茄几丁质酶和β-1,3-葡聚糖酶活性的影响. 南京农业大学学报,2012,35(4): 135-139. HEI Y X,ZHU W M,GUO S R,YU L,SUN J,ZHU LY. Effects of riboflavin and TYLCV inoculation on the activities of chitinase and β-1,3-glucanase in tomato. Journal of Nanjing Agricultural University,2012,35(4): 135-139. (in Chinese)
(责任编辑 岳梅)
Analysis of Resistance of Different Tomato Varieties to Tomato yellow leaf curl virus in Tomato
TIAN Zhao-feng1,LIU Wei-cheng1,HOU Ling-yu1,XIE Hua3, LUO Chen1,CHAI Min2
(1Institute of Plant & Environment Protection,Beijing Academy of Agriculture & Forestry Sciences,Beijing 100097;2Vegetable Research Center,Beijing Academy of Agriculture & Forestry Sciences,Beijing 100097;3Beijing Agro-Biotechnology Research Center,Beijing 100097)
【Objective】Tomato yellow leaf curl virus (TYLCV) disease is a serious threat to tomato production worldwide,breeding resistant varieties is the most economical,effective and friendly way to control this disease. Most of the tomato varietiesresistant to TYLCV used in production of China were introduced from abroad. Many new tomato varieties resistant to TYLCV have been obtained by breeding,but the resistance is unknown. In this paper,the resistance levels of the new tomato varieties resistant to TYLCV bred by Vegetable Research Center,Beijing Academy of Agriculture and Forestry Sciences were assessed and the expression of resistance genes Ty-1/Ty-3a and the pathogenesis-related proteins glucanase/chitinase were analyzed. The purpose is to provide a reference for rational utilization of germplasm resources and reduce the harm of TYLCV.【Method】Four tomato varieties Qiuguang 285,Peng 137×246,Qiuguang 120 and Qiuguang 81 were used as the experimental materials. TYLCV disease incidence was observed in the field. The disease resistance of these tomato varieties was examined by investigating the disease incidence and index. The resistance levels of the new tomato varieties resistant to TYLCV were assessed and the expression of resistance genes and the pathogenesis-related proteins were analyzed by RT-PCR. 【Result】 The resistance of the hybrid was no obvious differences with that of the pure and the resistance of the two genes was a little higher than that of single resistance genes,but yet no significant differences. Semi-quantitative RT-PCR results showed that the expression of genes Ty-3a and Ty-1 increased with the increase of the incidence of TYLCCV in different tomato varieties. The expression level of Ty-3a in four tomato varieties from weak to strong is Qiuguang 285,Peng 137×246,Qiuguang 120 and Qiuguang 81. The expression of Ty-1 in Qiuguang 81 was obviously higher than that of in Qiuguang 120. The gene expression of glucanase and chitinase in vivo was significantly higher than that in the control. The expression of the two genes increased with the increase of the time. In the 20 and 30 days after appearing of disease,the expression of glucanase gene in Qiuguang 81 with the Ty-1+Ty-3a was significantly higher than that in other varieties.【Conclusion】The resistance of four tomato varieties to TYLCV from weak to strong is Qiuguang 285,Peng 137×246,Qiuguang 120 and Qiuguang 81. After the infection of TYLCV,the expression levels of resistance genes increased with the time of disease in different tomato varieties. The expression levels of glucanase and chitinase genes in vivo were significantly higher than those in the control. The results suggested that the high resistance of variety to TYLCV is related to the high expression of resistance gene and pathogenesis-related proteins.
Tomato yellow leaf curl virus; resistance gene; pathogenesis-related proteins; semi-quantitative RT-PCR
2016-02-15;接受日期:2016-05-28
国家科技支撑计划(2012BAD19B00)、国家公益性行业(农业)科研专项(2013003019)、现代农业产业技术体系北京市叶类蔬菜创新团队(BAIC07-2016)
联系方式:田兆丰,E-mail:zhaofengtian2000@yahoo.com。通信作者罗晨,E-mail:luochen1010@126.com。通信作者柴敏,E-mail:chaimin@nercv.org
