甘蔗独脚金内酯生物合成基因ScCCD8的克隆与表达分析
2016-09-19吴转娣刘新龙刘家勇昝逢刚赵培方林秀琴陈学宽苏火生刘洪博吴才文
吴转娣,刘新龙,刘家勇,昝逢刚,赵培方,林秀琴,陈学宽,苏火生,刘洪博,吴才文
(云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南开远 661699)
甘蔗独脚金内酯生物合成基因ScCCD8的克隆与表达分析
吴转娣,刘新龙,刘家勇,昝逢刚,赵培方,林秀琴,陈学宽,苏火生,刘洪博,吴才文
(云南省农业科学院甘蔗研究所/云南省甘蔗遗传改良重点实验室,云南开远 661699)
【目的】克隆甘蔗的ScCCD8,分析其序列特征并预测其功能,研究在甘蔗不同组织部位、不同胁迫处理条件以及不同生长时间点ScCCD8的表达情况,为该基因在甘蔗基因工程育种中的应用提供理论支撑。【方法】以NCBI中检索的甘蔗CCD8同源片段EST序列为模板设计引物,扩增甘蔗CCD8的片段,采用RACE和RT-PCR技术分别从甘蔗品种新台糖22号中克隆CCD8的5′、3′目的片段和全长cDNA序列,以生物信息学方法对序列进行预测分析,利用qRT-PCR方法分析CCD8在不同组织、不同逆境胁迫条件下和不同生长时间点的表达特性。【结果】克隆获得甘蔗CCD8,命名为ScCCD8,GenBank登录号为KP742973.1。该cDNA全长2 016 bp,含有1个1 623 bp的完整开放阅读框(ORF),编码540个氨基酸,编码的蛋白质分子量为59.534 kD。生物信息学分析表明ScCCD8编码的蛋白是定位于叶绿体上的非分泌性蛋白,不是典型的跨膜蛋白,没有信号肽位点。存在着多个糖基化位点和磷酸化位点等活性位点。序列分析表明,ScCCD8与其他植物的CCD8蛋白有很高的相似性。系统进化树分析显示,甘蔗ScCCD8与高粱的CCD8蛋白亲缘关系较近。实时荧光定量PCR(qRT-PCR)分析表明,ScCCD8的表达具有组织特异性,在根中的表达量最高,是老叶中表达量的18倍。其在模拟重度干旱胁迫(20% PEG)、盐胁迫(200 mmol·L-1NaCl)、磷缺乏(1/8 mmol·L-1)和营养缺乏(纯水培养)4种胁迫处理下,茎尖中的ScCCD8均被诱导表达,且在处理24 h以后,ScCCD8的表达量增加较为明显。在不同生长时期,ScCCD8在甘蔗不同生长时期的茎尖中均有表达,且在幼苗期的表达量高于萌芽期和分蘖期。【结论】从甘蔗品种ROC22中克隆获得的甘蔗独脚金内酯生物合成关键基因ScCCD8是CCD8基因家族成员,推测ScCCD8可能与甘蔗SLs响应逆境胁迫有关。
甘蔗;ScCCD8;独脚金内酯;实时荧光定量PCR;干旱胁迫
0 引言
【研究意义】独角金内酯(strigolactones,SLs)是MAX/RMS/D途径产生的一种控制植物分枝的新激素[1-3],抑制植物分枝生长[2-4],控制中胚轴伸长[5],促进侧根形成和诱导根毛伸长等[6-8]。SLs与生长素(Auxins)相互作用进而抑制侧芽的生长,且生长素是通过调节CCD8而促进SLs生物合成,最终抑制侧芽的生长[9-11]。分蘖是决定甘蔗(Saccharum spp.)有效茎数和产量的重要农艺性状之一,甘蔗作为最重要的糖料作物,研究其分蘖具有重要的实践与理论意义。【前人研究进展】CCD8是独脚金内酯生物合成途径中的第三个酶,主要负责合成一种与SLs结构相似的可移动的前体--己内酯[12],目前,已经从拟南芥[13]、水稻[9]中分离编码CCD8的同源基因MAX4、D10等。HARRISON等[14]通过体外酶抑制试验表明,植物分蘖表型的改变很可能是通过抑制 CCD8的酶活性进而抑制SLs生物合成途径而实现的,而非D27 或CCD7,因此,CCD8被认为是SLs调节植物分蘖作用中的关键酶。甘蔗CCD8功能的研究将为甘蔗的分蘖调控研究提供重要理论基础。SLs能通过抑制腋芽的生长来抑制分枝,与生长素和细胞分裂素相互作用,共同调控植物分枝的发育[10,15],最终影响植株分枝形态的建成[16-17]。SLs能够调节植物体内的资源分配,能保持磷和氮的平衡,在不良环境条件下,能改变植物的生长方式,使植物中的资源流向特定的组织,以达到长期生存的目的。通过大量的矮化多分蘖突变体的分离鉴定、相关基因的克隆、表达调控模式分析及功能解析,植物SLs生物合成、运输、信号转导和降解途径的研究取得了许多重大的研究成果[12,18-21]。CCD8是ARITE等[22]以d10多分蘖突变体材料通过图位克隆的方法分离出来的,是MAX4/RMS1/DAD1/ D10的同源基因,编码类胡萝卜素裂解双加氧酶 CCD8。利用 RNAi干扰猕猴桃AcCCD8,导致AcCCD8表达量减少,分枝增多并延迟了叶片的衰老[23]。西红柿 SICCD8沉默后表现出分枝、节点、不定根增多,矮化,花小,果实小,且种子细少等[24]。因此,CCD8可能不仅与 SLs的生物合成有关,还参与或影响其他的生物学通路而影响植物的生殖发育[24]。多种植物的CCD8都在根中高表达[22-28]。在拟南芥中,CCD8(MAX4)在根尖、成熟花的气孔和长角果中高表达,在芽中没有表达[13,29]。这些基因差异表达的原因还未知,推测其也可能参与其他的信号通路[30]。【本研究切入点】CCD8在植物分蘖及生长发育的不同阶段起重要的调控作用,但目前关于甘蔗独脚金内酯生物合成相关基因的研究仍鲜见报道。【拟解决的关键问题】本研究利用同源克隆的方法获得了甘蔗独脚金内酯生物合成关键基因ScCCD8的cDNA全长序列,利用生物信息学分析预测ScCCD8的功能,并以qRT-PCR分析 ScCCD8在不同组织、不同胁迫处理条件下和不同生长时间点的表达模式,以期为研究 ScCCD8在甘蔗 SLs生物合成过程中的作用及其参与甘蔗分蘖调控响应逆境胁迫的作用提供理论依据。
1 材料与方法
1.1材料
选用中国蔗区的主栽品种之一 ROC22为材料,选取处于分蘖期的甘蔗茎尖作为研究材料,提取总RNA。甘蔗材料由云南省甘蔗遗传改良重点实验室提供。
1.2材料处理
大田中选取生长健壮并长势一致的 ROC22蔗茎,砍成单芽茎段,洗净并 52℃温水脱毒处理 30 min。温室中以45 d的甘蔗幼苗为材料,分别给予6种处理,(以10%(w/v)PEG6000的MS培养基处理)中度干旱、(以 20%(w/v)PEG6000的 MS培养基处理)重度干旱、(以200 mmol·L-1NaCl的MS培养基处理)中度盐胁迫、(以300 mmol·L-1NaCl 的MS培养基处理)重度盐胁迫、(1/8 mmol·L-1)磷缺乏、(纯水培养)营养缺乏,以不同时间段0 h(对照)、6、12、24、48、72和96 h取样,以茎尖作为材料,取样后,液氮速冻,并于-80℃保存备用。
2014年7月2日,在云南省甘蔗遗传改良重点实验室温室大棚中,以甘蔗渣和红壤土作为营养基质,在种植桶中栽种经温水脱毒处理的甘蔗茎段材料,栽种30 d内盖膜处理,于不同时间段取样(7、14、30、45、60、90和120 d),以茎尖作为材料,液氮冷冻,并于-80℃保存备用。
1.3甘蔗ScCCD8的EST克隆
以甘蔗茎尖分生组织为材料,提取总RNA,方法参照TaKaRa公司RNA Plant Kit试剂盒说明书操作,用NanoDrop法测定RNA的浓度,根据OD260/ OD280及 OD260/OD230评估 RNA的质量,并以琼脂糖凝胶电泳的结果检测RNA的完整性,以1%的琼脂糖凝胶电泳检测,于-70℃贮存备用。取1 μg茎尖总RNA用于cDNA的合成,方法按照TaKaRa公司的RNA PCR Kit试剂盒说明书操作,使用随机引物olig(dT)18。
以 NCBI检索的甘蔗 ScCCD8的 EST序列(CA191025.1和CA100587.1),以DNAMAN软件分析并拼接2个片段。设计1对引物ScCCD8EST-F 和ScCCD8EST-R(表1),由生工生物公司合成。
以cDNA第一链为模板,PCR条件为94℃ 3 min;94℃ 30 s,56℃ 30 s,72℃ 45 s,32个循环;72℃ 10 min。PCR产物以1.5%的琼脂糖凝胶电泳检测,并以TaKaRa公司的凝胶回收试剂盒对扩增的条带进行回收、纯化,并连接到pEASYTM-T5 Zero-Vector载体中,转入DH5α大肠杆菌中,阳性克隆经PCR鉴定后,送上海生工测序。测序结果经BLAST比对分析。
1.4ScCCD8 5′端和3′端的克隆
3′RACE和5′RACE均按SMARTTMRACE cDNA Amplification Kit试剂盒说明书进行操作。根据已得到的cDNA片段序列设计特异性引物,扩增目的基因的3′和5′末端。回收、测序、比对方法同1.3,测序结果用DNAMAN 6.0对测序结果与已知EST序列进行迸接。
以 1.2中保存的 cDNA为模板,设计引物ScCCD8F和ScCCD8R(表1),扩增ScCCD8的编码区序列,扩增条件为94℃ 3 min;94℃ 30 s,57℃30 s,72℃ 45 s,32个循环;72℃ 10 min。回收、测序、比对方法同1.3。
1.5ScCCD8的生物信息学分析
采用NCBI平台对甘蔗ScCCD8进行BLAST同源比对分析,使用ORF Finer在线工具寻找编码框,将目的片段序列与其他物种的 CCD8核苷酸序列在DNAMAN进行比对,通过开放阅读框(ORF)分析并进行氨基酸BLAST比对,利用Clustal W软件进行多序列对齐和排序,用MEGA5.0构建NJ系统进化树。利用ProtParam(http://web.expasy.ory/ProtParam/)软件对蛋白序列进行分析,预测蛋白的分子量和等电点;利用ProtScale进行蛋白质疏水性分析;Motif Scan分析蛋白质生物活性位点分析;TMHMM Sever2.0(http:// www. cbs. dtu. dk/services/TMHMM/)分析蛋白的跨膜结构域;SignalP4.1(http://www. cbs. dtu. dk/services/ SignalP/)分析蛋白的信号肽;wolf PSORT(http://wolfpsort.seq. cbrc. jp/)预测亚细胞定位;使用SOPMA软件预测蛋白的二级结构;使用NCBI平台对进行BLAST同源比对分析,用MEGA5.0构建系统进化树;分别运用NetPhos 2.0Serve、DictyOGlyc 1.1 Server 在线软件预测ScCCD8翻译后磷酸化、O-糖基化修饰情况。
1.6ScCCD8在甘蔗不同组织部位的表达分析
根据ScCCD8序列设计荧光定量PCR引物,以GAPDH作为内参基因[31]。选用 TaKaRa公司的PrimeScript® RT reagent Kit with gDNA Eraser和SYBR® Premix Ex TaqTMⅡ试剂盒,按试剂盒说明书进行操作,定量PCR体系为20 μL,包括DNA模板(50 mg·μL-1)2 μL、SYBR®Premix Ex TaqII(Tli RNaseH Plus)(2×)10.0 μL、上下游引物(10 μmol·L-1)0.8 μL、ROX Reference Dye II(50×)0.4 μL和H2O 6 μL,3次重复。采用两步法PCR扩增:95℃ 30 s;95 ℃ 5 s,60℃ 34 s,40个循环;95℃ 15 s;60℃ 1 min;95℃ 15 s。每个样品设3个重复,在ABI Vii7 Real time PCR System(Applied Biosystems,USA)上进行试验。利用2-ΔΔCT法计算ScCCD8的相对表达量。
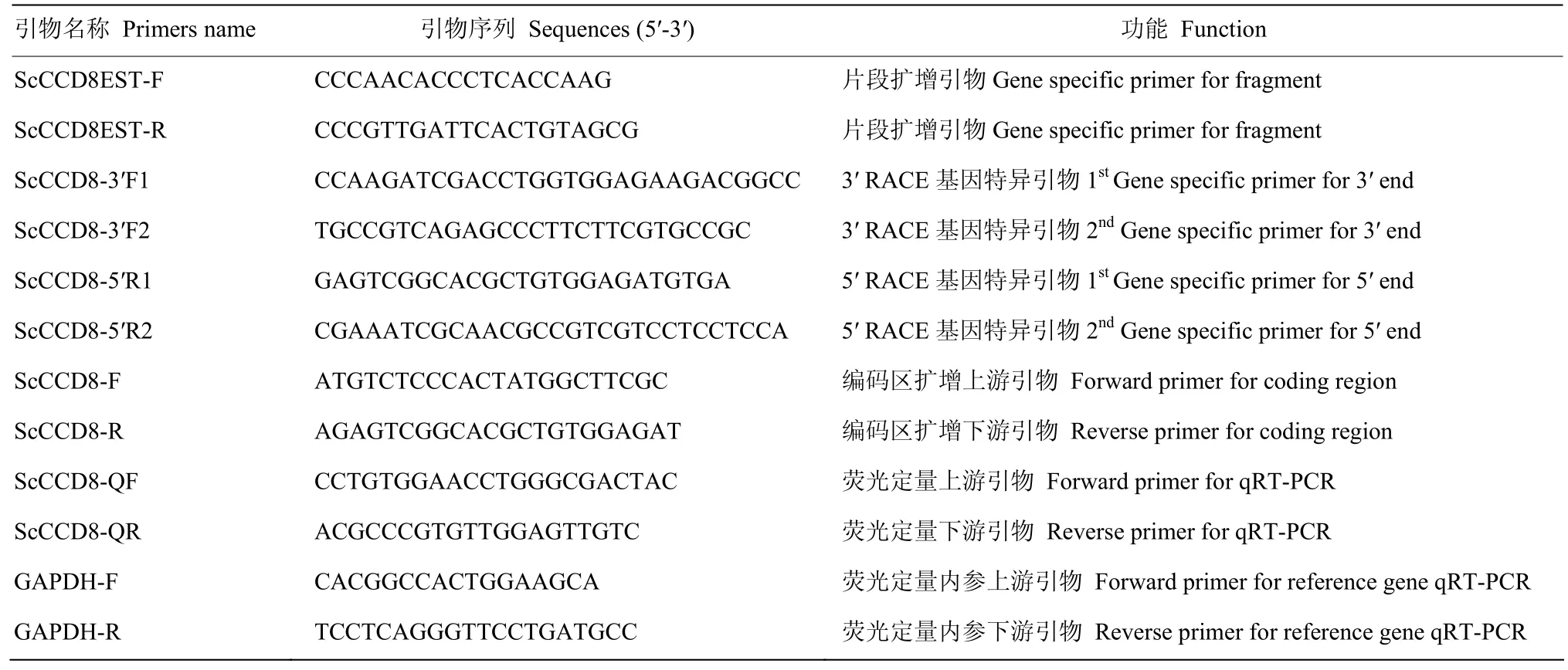
表1 CCD8的PCR引物序列Table 1 Primers used for the CCD8 gene amplification
2 结果
2.1甘蔗ScCCD8的cDNA全长序列
如图1所示,经PCR扩增得到长度为481 bp的甘蔗ScCCD8的EST片段;3′RACE获得的产物为567 bp;5′RACE获得一条长度为1 667 bp的5′端序列。通过将中间片段、3′RNAC序列和5′端序列拼接,得到全长为2 016 bp的甘蔗CCD8全长cDNA序列,预测其ORF框(图2),并设计上下游引物进行PCR扩增,获得的编码区序列长度为1 623 bp。甘蔗CCD8全长2 016 bp,包含一个35 bp的5′非翻译区和一个358 bp的3′非翻译区,以及一个1 623 bp的编码540个氨基酸的开放阅读框,命名为 ScCCD8,GenBank登录号为KP742973.1。

图1 甘蔗ScCCD8的PCR扩增电泳图Fig.1 Agarose gel electrophoresis of the PCR amplification of sugarcane ScCCD8
2.2甘蔗ScCCD8的系统发育分析
通过分析ORF框并进行氨基酸BLAST比对,甘蔗ScCCD8与其他物种的CCD8的氨基酸序列同源性与核苷酸序列相似,特别是与禾本科植物的同源性均高达80%以上(图3),与高粱(XM_002458432.1)和玉米(NM_001197000.1)的氨基酸序列相似性达到 97%,与谷子(XM_012846216.1)、水稻(NM_ 001050764.2)和二穗短柄草(XM_003569750.3)的相似性分别高达96%、96%和89%。与其他双子叶植物如小果野芭蕉(XM_009391093.1)、海枣(XM_008806408.1)、油棕(XM_010919038.1)、梅(XM_008221883.1)、碧桃(XM_007222324.1)分别为88%、88%、78%、79%和79%。结果表明,不同植物的 CCD8蛋白结构与功能高度保守,甘蔗ScCCD8与其他单子叶或双子叶植物可能具有较相似的功能。

图2 ScCCD8的编码区序列及推导出的氨基酸序列Fig.2 Nucleotide and predicted amino acid sequences of ScCCD8
在NCBI上筛选出与甘蔗ScCCD8氨基酸序列相似性较高的17个物种的CCD8蛋白,并进行多序列比对。结果显示,甘蔗ScCCD8的氨基酸序列与其他氨基酸序列有高度的保守性,特别是可变结构域、糖基化位点及磷酸化位点等重要功能位点的序列保守性更高。利用 MEGA5.0构建甘蔗与其他 17个物种的NJ进化树(图4)显示具有相同种属关系的物种被聚为一类。总体上,甘蔗ScCCD8的氨基酸序列与山羊草、水稻和二穗短柄草的亲缘关系最近,与高粱、玉米和谷子的亲缘关系较近,与柚、甜橙、海枣、野菊花、苹果、烟草和秋海棠等双子叶植物的亲缘关系相对较远。
2.3甘蔗ScCCD8的生物学信息学分析
2.3.1ScCCD8蛋白质特征分析 经生物学信息学在线软件ProtParam分析甘蔗ScCCD8的蛋白质特性,结果表明,ScCCD8所编码的蛋白分子式为C2652H4093N737O781S23,分子量为59.534 kD,等电点为6.00,Ala、Gly、Val、Leu 4个氨基酸出现频率较高,分别为8.9%、9.3%、8.1%和8.2%,而另一些氨基酸如Pyl、Sec在氨基酸序列中没有发现。稳定性系数为43.44,为不稳定蛋白(不稳定系数<40 是稳定蛋白,>40是不稳定蛋白),总平均亲水性(GRAVY)为-0.277,为亲水蛋白(蛋白质亲水区域多于疏水区域)。无信号肽位点(图5),没有跨膜区,不是跨膜蛋白。wolf PSORT预测亚细胞定位于叶绿体中。
使用SOPMA软件预测ScCCD8蛋白的二级结构(图6),该蛋白α-螺旋(h)占25.93%、β-折叠(e)占22.78%、β-转角(t)占10.19%和无规则卷曲(c)41.11%。结果表明,该蛋白质二级结构的大部分由无规则卷曲和α-螺旋构成,α-螺旋在N端与中部所占比例较大,β-转角则主要在中部和前部,延伸链主要集中在中部及C端,无规则卷曲的分布则比较平均(图6)。

图3 ScCCD8与其他作物同源蛋白的序列分析结果Fig.3 Sequence alignment of amino acid residues of ScCCD8 with other related proteins
作为蛋白质折叠的主要驱动力,蛋白质的亲水、疏水氨基酸的组成能够影响蛋白质的结构和特性,经在线软件ProtScale采用Hyhob/Kyte & Doolittle的方法分析(图7)显示,第358位具有最高分值为1.922,疏水性最强;第 349位最低分值,为-3.067,亲水性最强。整条多肽链表现为亲水性,没有特别明显的疏水区或亲水区,总体上亲水区多于疏水区,故推测甘蔗ScCCD8蛋白是一种亲水蛋白。
2.3.2ScCCD8蛋白的生物活性位点分析 蛋白质的修饰方式主要包括蛋白质的磷酸化和糖基化,它可以调节蛋白质的活力和功能。运用DictyOGlyc 1.1 Server 和NetPhos 2.0 Server在线软件预测ScCCD8翻译后磷酸化、O-糖基化修饰情况,结果显示ScCCD8蛋白有可能发生磷酸化修饰的位点有 30个,其中色氨酸(Ser)、苏氨酸(Thr)、酪氨酸(Tyr)可能发生磷酸化修饰的位点分别有13、9和8个(图8);有可能发生 O-糖基化修饰的位点有 4个,均为苏氨酸(Thr),分别在肽链的第2、第23、第25、第27位(图 9)。磷酸化位点分布都较为平均,糖基化位点则主要分布在N端。

图4 不同物种CCD8氨基酸序列的聚类分析Fig.4 Clustering analysis of the deduced amino acid sequences of CCD8 with homologous among sugarcane and other plants

图5 ScCCD8蛋白的信号肽分析Fig.5 Signal peptide analysis of ScCCD8 protein

图6 SOPMA软件预测ScCCD8蛋白的二级结构Fig.6 Secondary structure analysis of ScCCD8 protein
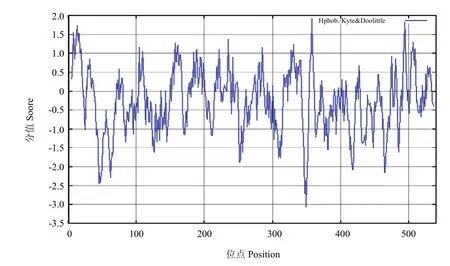
图7 ScCCD8蛋白的亲水性/疏水性预测Fig.7 Hydrophobicity/ hydrophilicity prediction of ScCCD8

图8 ScCCD8蛋白氨基酸序列翻译后磷酸化修饰位点预测Fig.8 Prediction of phosphorylation site modification in amino acid sequence of ScCCD8 protein
利用Motif Scan分析蛋白质生物活性位点,结果表明,该蛋白序列含有:1个N-糖基化位点,分别位于367—370氨基酸段;10个酪蛋白激酶Ⅱ磷酸化位点,分别为50—53、112—115、168—171、227—230、369—372、383—386、410—413、454—457、497—500 和512—515氨基酸段;10个N-肉豆蔻酰化作用位点,分别位于47—52、158—163、166—171、217—222、402—407、420—425、470—475、490—495、501—506和528—533氨基酸段;7个蛋白激酶C磷酸化位点分别位于 59—61、112—114、191—193、212—214、324—326、462—464和497—499氨基酸段;1个酪氨酸激酶磷酸化位点,位于249—257氨基酸段;1个酰胺化位点,位于461—434。
2.4ScCCD8在甘蔗不同组织部位和胁迫诱导中的表达分析
提取甘蔗不同组织来源的总 RNA,以甘蔗的GAPDH作为内参,对ScCCD8进行qRT-PCR分析(图10),结果表明,甘蔗ScCCD8在各器官中的表达量差异比较大,在甘蔗的根尖、分蘖芽、腋芽、茎尖的表达量相对较高,老根、嫩叶(距茎尖分生组织处约5 cm)、老叶(第四叶中段)、节(第五节)和叶鞘中的表达量相对较少。茎尖中的表达量是老叶中的18倍左右,因此可以说ScCCD8在甘蔗中的表达有较高的组织特异性,且主要是在甘蔗的幼嫩组织中强表达。

图9 ScCCD8蛋白氨基酸序列翻译后O-糖基化修饰位点预测Fig.9 Prediction of O-glycosylation site modification in amino acid sequence of ScCCD8 protein

图10 甘蔗不同组织ScCCD8的qRT-PCR分析Fig.10 Expression analysis of ScCCD8 gene in different sugarcane tissues by qRT-PCR
温室中以45 d的甘蔗幼苗为材料,分别给予4种处理,3个重复,(以10%(w/v)PEG6000的MS培养基处理)干旱、(以200 mmol·L-1NaCl的MS培养基处理)盐胁迫、(1/8 mmol·L-1)磷缺乏、(纯水培养)营养缺乏,以不同时间段0 h(对照)、6、12、24、48、72和96 h取样,以茎尖作为材料,提取总RNA,对ScCCD8进行qRT-PCR分析(图11),结果表明,在不同胁迫条件下,ScCCD8能够响应逆境的胁迫,在处理24 h以后ScCCD8的表达量的增加较为明显。结果表明,在甘蔗茎尖中的ScCCD8受到胁迫诱导表达。
利用qRT-PCR技术分析甘蔗茎尖ScCCD8从7 月2日栽种到至11月份进入分蘖期之间不同时间点的相对表达量,以甘蔗茎尖作为材料,均设6个重复,其中3个为温室中的桶栽试验,另外3个为大田栽种的试验。结果发现,该基因在甘蔗在不同生长时期的茎尖中均有表达,且在幼苗期的表达量高于萌芽期和分蘖期(图12),结果表明,在不同生长时期,ScCCD8的表达量存在差异。

图11 甘蔗不同胁迫条件下ScCCD8的qRT-PCR分析Fig.11 Expression analyses of ScCCD8 gene under different stressed conditions by qRT-PCR
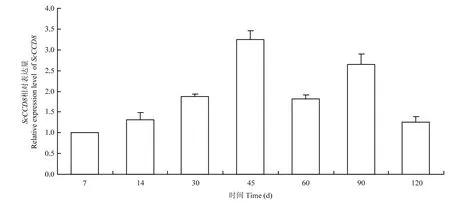
图12 甘蔗不同生长时期ScCCD8的qRT-PCR分析Fig.12 Expression analyses of ScCCD8 gene at different stages of terminal by qRT-PCR
3 讨论
CCD8参与独脚金内酯的生物合成,CCD8的转录是调节分枝抑制通路的关键步骤[22],它可能在生长素反馈调控独角金内酯及其衍生物的过程中有重要作用[32],另外,SLs也是通过与生长素的交叉应答,抑制生长素的极性运输能力来抑制侧芽生长[33]。因此,CCD8可能是在其他植物激素的共同作用下调控 SLs生物合成并最终影响植物分枝的关键基因。
本研究从甘蔗主栽品种 ROC22中克隆获得与甘蔗分蘖相关的基因 ScCCD8,该基因序列全长 2 016 bp,其开放阅读框为1 623 bp,编码540个氨基酸,ScCCD8可能定位于叶绿体中[21]。通过同源性分析和进化树分析结果表明,甘蔗ScCCD8的氨基酸序列与高粱、玉米、谷子和水稻等禾本科植物的同源性比较高,与小果野芭蕉、海枣、油棕、梅、碧桃和甜橙等双子叶植物的同源性也达到80%左右,经生物信息学预测分析 表明分离获得的ScCCD8是CCD8在甘蔗中的同系物,且氨基酸序列具有较高的保守性,推测这些基因在功能上可能高度相似。
ScCCD8是甘蔗合成独脚金内酯所必需的,其具有较高的组织特异性,主要是在幼嫩分生组织处表达,在根尖的表达量最高,其次是茎尖、分蘖芽和腋芽,而在老叶、老根和节等部位的表达量相对低。在受到非生物胁迫的情况下,该基因在甘蔗茎尖的表达受到胁迫的诱导表达,表明该基因与甘蔗非生物胁迫的响应有关。ScCCD8在不同生长时期的甘蔗茎尖中的表达量分析表明它在甘蔗生长过程中存在差异表达。
水稻CCD8是一个定位于叶绿体中的蛋白质,在甘蔗中的ScCCD8通过在线分析表明其同样定位于叶绿体[21,34],该推断还需要进一步的试验验证。
参与甘蔗独脚金内酯生物合成基因的其他基因,如D27、CCD7、MAX1以及相关的调控因子的研究还相对较少,作者已经从甘蔗中克隆获得了这些基因的cDNA全长序列,下一步将会结合 ScCCD8,进一步开展基因功能的鉴定和信号转导通路方面的研究,深入研究甘蔗独脚金内酯的生物合成基因与甘蔗逆境胁迫的关系,为进一步了解SLs调控植物分蘖的作用机制研究提供新的线索。
4 结论
获得甘蔗独脚金内酯生物合成基因ScCCD8的全长cDNA。ScCCD8蛋白具有CCD8家族的一般特性。该基因全长2 016 bp,ORF框为1 623 bp,编码540个氨基酸,ScCCD8定位于叶绿体上的非分泌性蛋白,不是典型的跨膜蛋白,还存在着糖基化位点和磷酸化位点等活性位点,ScCCD8在不同部位的表达具有组织特异性,在非生物胁迫作用下被诱导表达。在不同生长时期ScCCD8的表达存在差异,推测ScCCD8可能参与了甘蔗的非生物胁迫响应过程。
References
[1] KLEE H. Plant biology: Hormones branch out. Nature,2008,455(7210): 176-177.
[2] GOMEZ-ROLDAN V,FERMAS S,BREWER P B,PUECH-PAGES V,DUN E A,PILLOT J P,LETISSE F,MATUSOVA R,DANOUN S,PORTAIS J C,BOUWMEESTER H,BECARD G,BEVERIDGE C A,RAMEAU C,ROCHANGE S F. Strigolactone inhibition of shoot branching. Nature,2008,455(7210): 189-194.
[3] UMEHARA M,HANADA A,YOSHIDA S,AKIYAMA K,ARITE T,TAKEDA-KAMIYA N,MAGOME H,KAMIYA Y,SHIRASU K,YONEYAMA K,KYOZUKA J,YAMAGUCHI S. Inhibition of shoot branching by new terpenoid plant hormones. Nature,2008,455(7210): 195-200.
[4] LOPEZ-RAEZ J A,CHARNIKHOVA T,GOMEZ-ROLDAN V,MATUSOVA R,KOHLEN W,DE VOS R,VERSTAPPEN F,PUECH-PAGES V,BECARD G,MULDER P,BOUWMEESTER H. Tomato strigolactones are derived from carotenoids and their biosynthesis is promoted by phosphate starvation. New Phytology,2008,178(4): 863-874.
[5] HU Z,YAN H,YANG J,YAMAGUCHI S,MAEKAWA M,TAKAMURE I,TSUTSUMI N,KYOZUKA J,NAKAZONO M. Strigolactones negatively regulate mesocotyl elongation in rice during germination and growth in darkness. Plant Cell Physiology,2010,51(7): 1136-1142.
[6] KAPULNIK Y,DELAUX P M,RESNICK N,MAYZLISH-GATI E,WININGER S,BHATTACHARYA C,SEJALON-DELMAS N,COMBIER J P,BECARD G,BELAUSOV E,BEECKMAN T,DOR E,HERSHENHORN J,KOLTAI H. Strigolactones affect lateral root formation and root-hair elongation in Arabidopsis. Planta,2011,233(1): 209-216.
[7] RUYTER-SPIRA C,KOHLEN W,CHARNIKHOVA T,VAN ZEIJL A,VAN BEZOUWEN L,DE RUIJTER N,CARDOSO C,LOPEZ-RAEZ J A,MATUSOVA R,BOURS R,VERSTAPPEN F,BOUWMEESTER H. Physiological effects of the synthetic strigolactone analog GR24 on root system architecture in Arabidopsis: Another belowground role for strigolactones? Plant Physiology,2011,155(2): 721-734.
[8] BREWER P B,KOLTAI H,BEVERIDGE C A. Diverse roles of strigolactones in plant development. Molecular Plant,2013,6(1): 18-28.
[9] ARITE T,IWATA H,OHSHIMA K,MAEKAWA M,NAKAJIMA M,KOJIMA M,SAKAKIBARA H,KYOZUKA J. DWARF10,an RMS1/MAX4/DAD1 ortholog,controls lateral bud outgrowth in rice. The Plant Journal,2007,51(6): 1019-1029.
[10] HAYWARD A,STIRNBERG P,BEVERIDGE C,LEYSER O. Interactions between auxin and strigolactone in shoot branching control. Plant Physiology,2009,151(1): 400-412.
[11] BREWER P B,DUN E A,FERGUSON B J,RAMEAU C,BEVERIDGE C A. Strigolactone acts downstream of auxin to regulate bud outgrowth in pea and Arabidopsis. Plant Physiology,2009,150(1): 482-493.
[12] ALDER A,JAMIL M,MARZORATI M,BRUNO M,VERMATHEN M,BIGLER P,GHISLA S,BOUWMEESTER H,BEYER P,AL BABILI S. The path from beta-carotene to carlactone,a strigolactonelike plant hormone. Science,2012,335(6074): 1348-1351.
[13] SOREFAN K,BOOKER J,HAUROGNE K,GOUSSOT M,BAINBRIDGE K,FOO E,CHATFIELD S,WARD S,BEVERIDGE C,RAMEAU C,LEYSER O. MAX4 and RMS1 are orthologous dioxygenase-like genes that regulate shoot branching in Arabidopsis and pea. Genes & Development,2003,17(12): 1469-1474.
[14] HARRISON P J,NEWGAS S A,DESCOMBES F,SHEPHERD S A,THOMPSON A J,BUGG T D. Biochemical characterization and selective inhibition of beta-carotene cis-trans isomerase D27 and carotenoid cleavage dioxygenase CCD8 on the strigolactone biosynthetic pathway. FEBS Journal,2015,282(20): 3986-4000.
[15] STIRNBERG P,WARD S,LEYSER O. Auxin and strigolactones in shoot branching: intimately connected? Biochemical Society Transactions,2010,38(2): 717-722.
[16] MCSTEEN P,ZHAO Y. Plant hormones and signaling: common themes and new developments. Developmental Cell,2008,14(4): 467-473.
[17] CHEN Z,GAO X,ZHANG J. Alteration of osa-miR156e expression affects rice plant architecture and strigolactones (SLs) pathway. Plant Cell Reports,2015,34(5): 767-781.
[18] DRUMMOND R S,SHEEHAN H,SIMONS J L,MARTINEZSANCHEZ N M,TURNER R M,PUTTERILL J,SNOWDEN K C. The expression of petunia strigolactone pathway genes is altered as part of the endogenous developmental program. Frontiers in Plant Science,2011,2: 115.
[19] ZHANG Y,VAN DIJK A D,SCAFFIDI A,FLEMATTI G R,HOFMANN M,CHARNIKHOVA T,VERSTAPPEN F,HEPWORTH J,VAN DER KROL S,LEYSER O,SMITH S M,ZWANENBURG B,AL-BABILI S,RUYTER-SPIRA C,BOUWMEESTER H J. Rice cytochrome P450 MAX1 homologs catalyze distinct steps in strigolactone biosynthesis. Nature Chemical Biology,2014,10(12): 1028-1033.
[20] WATERS M T,BREWER P B,BUSSELL J D,SMITH S M,BEVERIDGE C A. The Arabidopsis ortholog of rice DWARF27 acts upstream of MAX1 in the control of plant development by strigolactones. Plant Physiology,2012,159(3): 1073-1085.
[21] LIN H,WANG R,QIAN Q,YAN M,MENG X,FU Z,YAN C,JIANG B,SU Z,LI J,WANG Y. DWARF27,an iron-containing protein required for the biosynthesis of strigolactones,regulates rice tiller bud outgrowth. The Plant Cell,2009,21(5): 1512-1525.
[22] ARITE T,IWATA H,OHSHIMA K,MAEKAWA M,NAKAJIMA M,KOJIMA M,SAKAKIBARA H,KYOZUKA J. DWARF10,an RMS1/MAX4/DAD1 ortholog,controls lateral bud outgrowth in rice. The Plant Journal,2007,51(6): 1019-1029.
[23] LEDGER S E,JANSSEN B J,KARUNAIRETNAM S,WANG T,SNOWDEN K C. Modified CAROTENOID CLEAVAGE DIOXYGENASE8 expression correlates with altered branching in kiwifruit (Actinidia chinensis). New Phytology,2010,188(3): 803-813.
[24] KOHLEN W,CHARNIKHOVA T,LAMMERS M,POLLINA T,TOTH P,HAIDER I,POZO M J,DE MAAGD R A,RUYTERSPIRA C,BOUWMEESTER H J,LOPEZ-RAEZ J A. The tomato CAROTENOID CLEAVAGE DIOXYGENASE8 (SlCCD8) regulates rhizosphere signaling,plant architecture and affects reproductive development through strigolactone biosynthesis. New Phytology,2012,196(2): 535-547.
[25] FOO E,BULLIER E,GOUSSOT M,FOUCHER F,RAMEAU C,BEVERIDGE C A. The branching gene RAMOSUS1 mediates interactions among two novel signals and auxin in pea. The Plant Cell,2005,17(2): 464-474.
[26] GUAN J C,KOCH K E,SUZUKI M,WU S,LATSHAW S,PETRUFF T,GOULET C,KLEE H J,MCCARTY D R. Diverse roles of strigolactone signaling in maize architecture and the uncoupling of a branching-specific subnetwork. Plant Physiology,2012,160(3): 1303-1317.
[27] LIANG J,ZHAO L,CHALLIS R,LEYSER O. Strigolactone regulation of shoot branching in chrysanthemum (Dendranthema grandiflorum). Journal of Experimental Botany,2010,61(11): 3069-3078.
[28] PASARE S A,DUCREUX L J,MORRIS W L,CAMPBELL R,SHARMA S K,ROUMELIOTIS E,KOHLEN W,VAN DER KROL S,BRAMLEY P M,ROBERTS A G,FRASER P D,TAYLOR M A. The role of the potato (Solanum tuberosum) CCD8 gene in stolon and tuber development. New Phytology,2013,198(4): 1108-1120.
[29] BAINBRIDGE K,SOREFAN K,WARD S,LEYSER O. Hormonally controlled expression of the Arabidopsis MAX4 shoot branching regulatory gene. The Plant Journal,2005,44(4): 569-580.
[30] AL-BABILI S,BOUWMEESTER H J. Strigolactones,a novel carotenoid-derived plant hormone. Annual Review of Plant Biology,2015,66: 161-186.
[31] 阙友雄,许莉萍,徐景升,张积森,张木清,陈如凯. 甘蔗基因表达定量 PCR分析中内参基因的选择. 热带作物学报,2009(3): 274-278. QUE Y X,XU L P,XU J S,ZHANG J S,ZHANG M Q,CHEN R K. Selection of control genes in Real-time qPCR analysis of gene expression in sugarcane. Chinese Journal of Tropical Crops,2009(3): 274-278. (in Chinese)
[32] ZHANG S,LI G,FANG J,CHEN W,JIANG H,ZOU J,LIU X,ZHAO X,LI X,CHU C,XIE Q,JIANG X,ZHU L. The interactions among DWARF10,auxin and cytokinin underlie lateral bud outgrowth in rice. Journal of Integrative Plant Biology,2010,52(7): 626-638.
[33] 陈小娟. 生长素及独脚金内酯介导H2O2调控番茄侧枝生长发育的机制研究[D]. 杭州: 浙江大学,2015. CHEN X J. The mechanisms of auxin and strigolactone mediated hydrogen peroxide-contrlled lateral branching outgrowth in tomato plants[D]. Hangzhou: Zhejiang University,2015. (in Chinese)
[34] 王秀梅,梁越洋,李玲,贡常委,王海鹏,黄晓西,李双成,邓其明,朱军,郑爱萍,李平,王世全. OsMAX1a,OsMAX1e通过参与独角金内酯的合成调控水稻分蘖. 中国水稻科学,2015(3): 223-231. WANG X M,LIANG Y Y,LI L,GONG C W,WANG H P,HUANG X X,LI S C,DENG Q M,ZHU J,ZHENG A P,LI P,WANG S Q. OsMAX1a and OsMAX1e,involved in the biosynthesis of Strigolactones,regulate rice tilling. Chinese Journal of Rice Science,2015(3): 223-231. (in Chinese)
(责任编辑 李莉)
Cloning and Expression Analysis of Strigolactones Biosynthesis-Related Gene ScCCD8 in Sugarcane
WU Zhuan-di,LIU Xin-long,LIU Jia-yong,ZAN Feng-gang,ZHAO Pei-fang,LIN Xiu-qin,CHEN Xue-kuan,SU Huo-sheng,LIU Hong-bo,WU Cai-wen
(Sugarcane Research Institute,Yunnan Academy of Agricultural Sciences/Yunnan Key Laboratory of Sugarcane Genetic Improvement,Kaiyuan 661699,Yunnan)
【Objective】The gene of Carotenoid Cleavage Dioxygenase8 (CCD8) from sugarcane (Saccharum officinarum L.)was cloned,then the sequence signature and functions were investigated,furthermore the gene expression in different tissues,different abiotic stresses and different growth times were analyzed. The objectives of the present study were to provide theoretical supports for the application of the ScCCD8 gene in sugarcane genetic engineering breeding.【Method】Using homologous cloning method to obtain the sequence of ScCCD8 gene from ROC22,reverse transcription-polymerase chain reaction (RT-PCR) and rapid amplification of cDNA ends PCR (RACE-PCR) were used to clone the full-length sequence of ScCCD8. The bioinformaticcharacteristics of the ScCCD8 was analyzed using online service. The expression profiles of ScCCD8 in various tissues,in response to different stress treatments and different growth times were investigated using quantitative real-time PCR (qRT-PCR). 【Result】CCD8 was isolated from sugarcane,named ScCCD8,which was submitted to GenBank with accession number KP742973.1. It has 2 016 bp in length containing a 1 623 bp open reading frame (ORF) and encoding 540 amino acid residues. The molecular weights of ScCCD8 encoding protein were 59.534 kD,it is not a transmembrane protein that did not contain the signal peptide sites,indicating that it is not the secretory protein. Subcellular localization prediction showed that ScCCD8 might localize in chloroplast,and it contains several active sites such as phosphorylation sites and glycosylation sites. Comparison of protein sequences similarity analysis showed that ScCCD8 had more similarity with CCD8 from different plants. Phylogenetic tree analysis showed that ScCCD8 had the closest genetic relationship with Sorghum bicolor. Expression quantity of ScCCD8 was the highest in root,which is 18 times more than in old leaves. Analysis of the expression patterns in response to abiotic stress revealed that ScCCD8 is up-regulated by PEG(20% PEG),NaCl(200 mmol·L-1NaCl) and phosphorus deficiency (1/8 mmol·L-1)and nutritional deficiency(cultured in pure water) in stem tip,and the obviously increase expression was found after treated 24 hours. The expression of ScCCD8 in stem tip were various in different growth times,moreover the expression was higher in germination stage then in tillering stage.【Conclusion】Sugarcane strigolactones biosynthesis-related gene ScCCD8 was cloned from ROC22,which is the member of CCD8 gene family. It is speculated that ScCCD8 might participated in plant resistance to abiotic stresses.
sugarcane; carotenoid cleavage dioxygenase 8; strigolactones; qRT-PCR; drought stress
2016-03-16;接受日期:2016-05-16
国家自然科学基金(31360359)、国家现代农业产业技术体系专项资金(CARS-20-1-1)、云南省应用基础研究计划(2016FB071)、云南省中青年学术技术带头人后备人才(2014HB038)
联系方式:吴转娣,E-mail:judith1123@126.com。刘新龙,E-mail:lxlgood868@163.com。吴转娣和刘新龙为同等贡献作者。通信作者吴才文,E-mail:gksky_wcw@163.com
