鸭坦布苏病毒病灭活疫苗(HB株)母源抗体的消长规律
2016-09-19韩春华赵际成段会娟杨志远王小蕾刘立新刘月焕
韩春华,赵际成,段会娟,林 健,杨志远,谢 佳,潘 洁,王小蕾,刘立新,刘月焕
(1北京市农林科学院畜牧兽医研究所,北京100097;2北京市通州区农业局,北京 101100)
鸭坦布苏病毒病灭活疫苗(HB株)母源抗体的消长规律
韩春华1,赵际成1,段会娟1,林 健1,杨志远1,谢 佳2,潘 洁1,王小蕾1,刘立新1,刘月焕1
(1北京市农林科学院畜牧兽医研究所,北京100097;2北京市通州区农业局,北京 101100)
【目的】评价鸭坦布苏病毒病灭活疫苗母源抗体的效力,制定疫苗的最小免疫日龄。【方法】随机采集鸭坦布苏病毒病灭活疫苗(HB株)二免后135日樱桃谷种鸭的种蛋孵化,随机取5、7、10和15日龄免疫种鸭后裔雏鸭10只和相对应日龄非免疫种鸭后裔雏鸭5只,采血,分离血清,测定母源抗体,并以0.1mL/羽(含100DID50)的剂量经腿部肌肉攻毒。观察雏鸭攻毒后的临床表现(采食量、粪便、精神和死亡情况),观察至攻毒后10d。攻毒后2d经颈静脉采血,分离血清进行病毒分离。每份血清接种5枚6日龄SPF鸡胚,0.1mL/枚,37℃孵化,24h以内死亡鸡胚视为非特异死亡,孵化至168h。只要有1枚及以上鸡胚死亡则判该鸭感染。计算母源抗体雏鸭组的攻毒保护率和无母源抗体组的发病率。攻毒后5d,分别称量雏鸭的体重,计算平均日增重。对成对样本进行T检验,分析母源抗体对雏鸭增重的影响。通过试验鸭中和抗体、增重变化和病毒分离的方法评价母源抗体的效力。【结果】(1)1日龄雏鸭的母源抗体阳性率最高,1、5、7、10和15日龄雏鸭的母源抗体阳性率分别为56.1% (37/66)、40%(4/10)、50%(5/10)、30%(3/10)和0%(0/10),5—7日龄抗体阳性率处于平台期,15日龄时母源抗体降低至全阴性;(2)攻毒后对照鸭表现精神沉郁(20/20)、仰翻和侧翻等神经症状(6/20)及死亡(2/20),有母源抗体的雏鸭临床症状明显轻于对照组。(3)5、7、10和15日龄免疫种蛋孵化雏鸭攻毒后5d平均增重115.5、142.8、177.8和162.2g。5、7、10和15日龄非免疫种蛋孵化雏鸭攻毒后5d平均增重54.5、91.0、165.0和118.8g。(4)5、7、10和15日龄免疫种蛋孵化雏鸭的攻毒保护率分别为50%(5/10)、60%(6/10)、20%(2/10)和0%(0/10);5、7、10和15日龄非免疫种蛋孵化雏鸭的发病率均为100%。(5)5和7日龄雏鸭平均增重和攻毒保护率最高,分别为50%(5/10)和60%(6/10),10和15日龄雏鸭的母源抗体尽管低(20%和0%)或阴性,仍然有明显的保护作用。【结论】(1)鸭坦布苏病毒病灭活疫苗母源抗体能够保护10日龄内雏鸭;(2)疫苗首次免疫的时间以7—10日龄为最佳。
鸭;坦布苏病毒;母源抗体
0 引言
【研究意义】近几年,中国养鸭规模快速发展,存栏量约40亿只。从2010年春季开始,中国浙江、江苏、山东、河北和北京等地区相继暴发了一种以鸭产蛋下降为主要特征的疫病[1-2],雏鸭发病后期出现精神沉郁、体重减轻、仰翻、侧翻和死亡等临床症状,若细菌继发感染,出现肝周炎、心包炎和气囊炎等,死淘率增加。2010年,根据产蛋下降和卵泡出血,将该病命名鸭出血性卵巢炎[3](duck hemorrhagic ovaritis,DHO),后经病原学研究证实该病是由黄病毒科黄病毒属中坦布苏病毒(duck Tembusu virus,DTMUV)引起[1,4-5]。2011年首届水禽疫病防控研讨会将该病统一命名为“鸭坦布苏病毒病”[6]。北京鸭、樱桃谷鸭、金定鸭、麻鸭和康贝尔鸭等均可发病[7-9],给养鸭业造成了巨大的经济损失。疫苗免疫是预防传染病有效和经济的方法之一,研究母源抗体的效力和消长规律,对合理制定首次免疫日龄具有重要意义。【前人研究进展】曹贞贞等报道引起鸭产蛋急剧下降的病原可能与黄病毒感染有关[3],随后国内外学者陆续报道该病是由于黄病毒或坦布苏病毒感染导致[4-5,7]。国内学者从鸡、鹅和麻雀中分离到病毒,且与鸭坦布苏病毒基因序列具有很高的同源性[10-11]。以色列学者DAVIDSON对70种黄病毒科的病毒进行了基因型和抗原型分类,坦布苏病毒属于基因Ⅺ,Ntaya抗原型(或病毒群)[12]。林健等用北京鸭建立了鸭出血性卵巢炎的实验感染模型[13]。除利用鸡胚、鸭胚或细胞的病毒分离技术外,万春和等建立了 RT-PCR[14-15]、套式RT-PCR[16]、荧光定量RT-PCR[17-18]技术。姬希文等进行了ELISA抗体检测试剂盒的研究[2]。韩春华等在鸭坦布苏病毒病灭活疫苗、活疫苗和活载体疫苗研制方面做了大量的研究工作,试验结果均表明疫苗有效[19-24]。尚未见鸭坦布苏病毒病灭活疫苗母源抗体消长规律和疫苗最早免疫日龄的研究报道。【本研究切入点】利用鸭坦布苏病毒病灭活疫苗免疫开产前种鸭,收集种蛋,孵化出雏,通过抗体检测和攻毒保护试验研究雏鸭母源抗体的效力与消长动态。【拟解决的关键问题】通过鸭坦布苏病毒病灭活疫苗免疫种鸭,确定对后裔雏鸭的保护效果及雏鸭的最小免疫日龄。
1 材料与方法
试验于2014年3—4月北京市农林科学院畜牧兽医研究所内完成。
1.1材料
1.1.1鸭坦布苏病毒病灭活疫苗(HB株)由北京市农林科学院畜牧兽医研究所和瑞普(保定)生物药业有限公司研制。
1.1.2樱桃谷种鸭 3 400只,285日龄樱桃谷种鸭来自广西康旺禽业发展有限责任公司,以1mL/只的剂量经胸部肌肉注射鸭坦布苏病毒病灭活疫苗(HB株),首次免疫后14 d以相同剂量进行二次免疫。同时设3 300只相同日龄未经免疫的种鸭作为非免疫对照组。
1.1.3种蛋收集 二次免疫后135 d免疫和非免疫樱桃谷鸭所产种蛋,随机取100枚免疫鸭种蛋和50枚非免疫组鸭种蛋,孵化至出雏。
1.1.4毒株 F4代鸭坦布苏病毒(HB株),由北京市农林科学院畜牧兽医研究所分离、鉴定和保存,鸭半数感染量(DID50)为107.1/0.1mL。
1.1.56日龄SPF鸡胚 购自北京梅里亚维通实验动物技术有限公司。
1.1.6SPF实验动物舍 由北京市农林科学院畜牧兽医研究所提供,实验动物许可证编号为SYXK(京)2012—0005。
1.2方法
1.2.1试验设计和攻毒 1日龄 66只免疫鸭种蛋孵化的雏鸭和34只非免疫鸭种蛋孵化雏鸭,脚环标记,并采集血样,分离血清,测定母源抗体,计算抗体阳性率。随机取出免疫种蛋孵化的5、7、10和
15日龄雏鸭10只和非免疫种蛋孵化的雏鸭5只,采血,分离血清,测定母源抗体,并以 0.1mL(含100DID50)/只的剂量经腿部肌肉注射鸭坦布苏病毒(HB株,F4代),隔离器里饲养。攻毒后观察雏鸭的临床症状,并于特定时间采集血清样品进行病毒分离和称重。
1.2.2母源抗体测定 取每只雏鸭血清,56℃水浴灭活30 min,适宜倍数稀释后备用。将F4代鸭坦布苏病毒-HB病毒稀释至200ELD50/0.1mL,与等量稀释血清37℃水浴作用1 h,同时设100ELD50病毒对照组。每份样品经卵黄囊途径接种5枚6日龄SPF鸡胚,0.1 mL/枚,孵化至168 h,弃去24 h之内死亡的鸡胚,记录鸡胚存活数。将保护率不低于80%(4/5)的血清判为抗体阳性,将保护率为20%(1/5)—60%(3/5)的血清判为抗体可疑,将保护率为 0%(0/5)的血清判为抗体阴性。计算雏鸭母源抗体的阳性率,分析母源抗体下降趋势。
1.2.3效力评价
1.2.3.1临床症状观察 观察雏鸭攻毒后的临床表现(采食量、粪便、精神和死亡情况),观察至攻毒后10 d。
1.2.3.2病毒分离 攻毒后2 d经颈静脉采血,分离血清。每份血清接种5枚6日龄SPF鸡胚,0.1 mL /枚,37℃孵化,24h以内死亡鸡胚视为非特异死亡,孵化至168 h。只要有1枚及以上鸡胚死亡则判该鸭感染。计算母源抗体雏鸭组的攻毒保护率和无母源抗体组的发病率。
1.2.3.3增重比较 攻毒后5 d,分别称量雏鸭的体重,计算平均日增重。对成对样本进行T检验,分析母源抗体对雏鸭增重的影响。
2 结果
2.1雏鸭母源抗体
1日龄雏鸭的母源抗体阳性率最高,为56.1% (37/66),达到最高检测值;5、7、10和 15日龄雏鸭的母源抗体阳性率分别为 40%(4/10)、50%(5/10)、30%(3/10)和 0%(0/10),5—7 d抗体阳性率处于平台期,随着日龄的增长,抗体阳性率呈逐渐下降趋势,10日龄时降至30%,15日龄时母源抗体降低至全阴性。鸭坦布苏病毒病灭活疫苗母源抗体效价及消长规律(表1和图1)。

图1 母源抗体效价及消长规律Fig.1 Maternal antibody titers and tendency of growth or decline
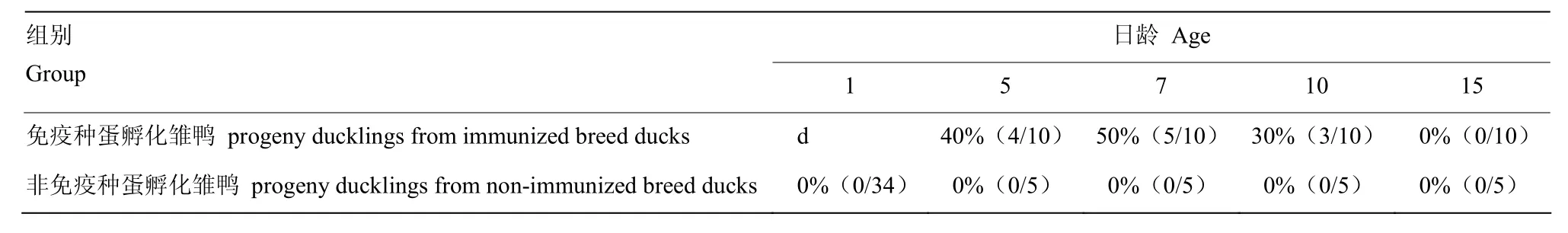
表1 雏鸭母源抗体阳性率Table 1 Positive maternal antibody titers of ducklings
2.2母源抗体的效力
2.2.1临床症状
2.2.1.1免疫种蛋孵化雏鸭 除个别鸭出现一过性精神沉郁和绿色粪便外,未见异常临床表现。
2.2.1.2非免疫种蛋孵化雏鸭 各日龄组雏鸭攻毒后3 d开始,对照组雏鸭精神沉郁,绿色粪便,增重变缓。5日龄鸭有4只出现神经症状,2只鸭分别于攻毒后7 d和9 d死亡。7日龄雏鸭有2只出现仰翻和侧翻的神经症状。
2.2.2增重变化
2.2.2.1免疫种蛋孵化雏鸭 5、7、10和15日龄雏鸭攻毒后5 d平均增重115.5、142.8、177.8和 162.2g。
2.2.2.2非免疫种蛋孵化雏鸭 5、7、10和15日龄雏鸭攻毒后5 d平均增重54.5、91.0、165.0和118.8g (表2)。

表2 攻毒后5日雏鸭平均增重Table 2 Average weight gain of ducklings 5 days post infection
2.2.2.3增重差异性分析 P值为0.027,小于0.05,结果(表3)。
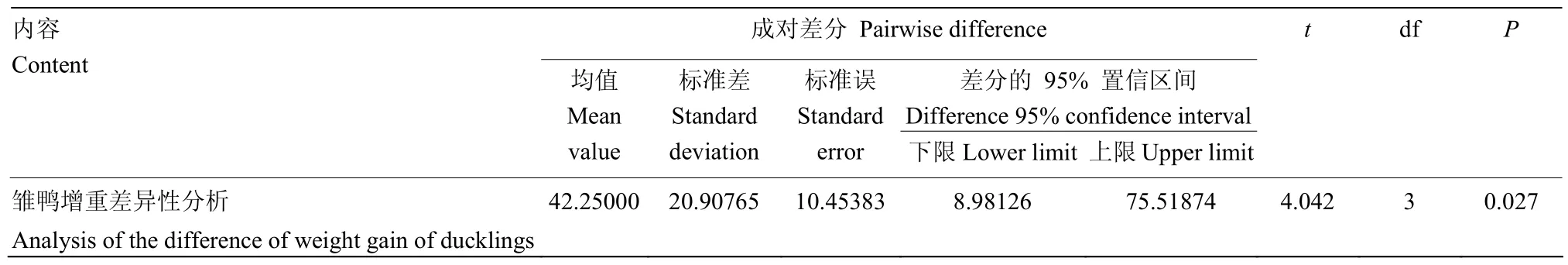
表3 增重T检验Table 3 T test of average weight gain
2.2.3攻毒保护率
2.2.3.1免疫种蛋孵化雏鸭 5、7、10和15日龄雏鸭的攻毒保护率分别为50%(5/10)、60%(6/10)、20%(2/10)和0%(0/10)。
2.2.3.2非免疫种蛋孵化雏鸭 5、7、10和15日龄雏鸭的发病率均为100%(表4)。
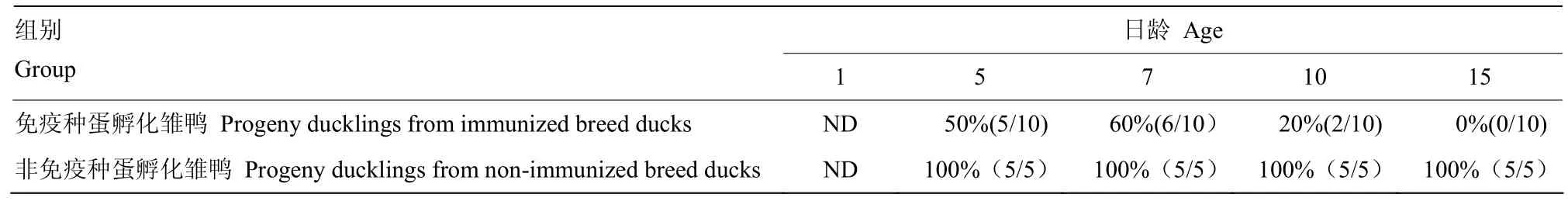
表4 雏鸭攻毒保护率Table 4 Protection rate of ducklings against virus infection
3 讨论
在禽类中,除鸽外,来自产蛋母禽的保护性抗体只能通过种蛋传递给子代雏禽,雏禽体内母源抗体水平的高低与免疫接种的日龄密切相关。雏禽的母源抗体水平与首次免疫时间和效果密切相关,因此探究母源抗体消长规律就显得非常重要[25]。目前鸭和鹅方面鸭坦布苏病毒病疫苗母源抗体变化情况尚未见报道,关于疫苗免疫家禽后,研究人员对鸡、鸭和鹅新城疫母源抗体的消长规律进行了大量研究。王泽霖研究认为,雏鸡出壳后第7天母源抗体最高,此后逐渐下降,半衰期4.5 d[26]。蔡宝祥则认为,雏鸡出壳后3 d母源抗体最高,此后呈完全下降趋势[27]。章怀云等认为雏鸡出壳后第1天母源抗体最高,此后呈完全下降趋势[28]。鸭和鹅均在3—5日龄时出现高峰[29]。因禽类的母源抗体来源卵黄,母源抗体的高低与家禽品种和卵黄吸收有关,本次试验测定樱桃谷肉鸭的母源抗体,麻鸭母源抗体的消长规律是否存在差异,尚需要进一步研究。
本次雏鸭母源抗体的测定结果表明,种鸭免疫鸭坦布苏病毒病疫苗后,1日龄雏鸭的母源抗体阳性率最高,这与章怀云等报道的一致。阳性雏鸭的比例在7日龄前变动范围较小,7日龄后阳性比例开始下降,15日龄时雏鸭母源抗体均为阴性。雏鸭母源抗体阳性率与攻毒后雏鸭的平均增重和攻毒保护率的结果相一致,呈正相关。母源抗体雏鸭的平均增重显著高于对照组鸭,其中5和7日龄雏鸭平均增重和攻毒保护率最高,10和15日龄雏鸭的母源抗体尽管低或阴性,与对照鸭相比,仍然有明显的保护作用。种鸭产生的免疫抗体除保护自身外,可以通过卵黄传递给雏鸭,起到了良好的天然被动免疫作用,能够保护雏鸭抵抗鸭坦布苏病毒的感染。因此,在实际生产中,对免疫抗体较高的种鸭群,其后代疫苗首次免疫的时间以7—10日龄为最佳。
攻毒后,对照鸭表现精神沉郁、仰翻和侧翻及死亡的发病症状,具有母源抗体的雏鸭临床症状明显轻于对照组,但从临床症状的轻和重来判定母源抗体的保护作用存在难以操作的具体困难。由于是新发传染病,如何评价母源抗体的被动保护作用,尚未有统一的方法。本研究中采用病毒分离法对雏鸭母源抗体效力评价的结果与平均增重的数据相一致,这表明,鸭坦布苏病毒感染的程度与鸭坦布苏病毒病临床症状严重程度相一致,可以采用病毒分离的方法进行母源抗体保护和疫苗效力的评价。
后裔雏鸭的母源抗体水平与种鸭的抗体水平高低直接相关,本试验中收集的是二次免疫后4个月的种鸭所产种蛋(疫苗免疫持续期末的种蛋),雏鸭母源抗体阳性率与此有关。此时是疫苗免疫后期,推测如果收集免疫后较早时期的种蛋进行孵化,则后裔雏鸭的抗体水平、阳性率和攻毒保护率应该更高。
4 结论
4.1鸭坦布苏病毒病灭活疫苗母源抗体能够保护 10日龄内雏鸭。
4.2疫苗首次免疫的时间以7—10日龄为最佳。
References
[1] YAN P X,ZHAO Y X,ZHANG X,XU D W,DAI X G,TENG Q Y,YAN L P,ZHOU J W,JI X W,ZHANG S M,LIU G Q,ZHOU Y J,YOSHIHIRO KAWAOKA,TONG G Z,LI Z J. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China. Virology,2011,417(1): 1-8.
[2] 姬希文,闫丽萍,颜丕熙,李国新,张七斤,李泽君. 鸭坦布苏病毒抗体间接 ELISA 检测方法的建立. 中国预防兽医学报,2011,33(8): 630-634. JI X W,YAN L P,YAN P X,LI G X,ZHANG Q J,LI Z J. Establishment of an indirect ELISA for detection of antibody against duck Tembusu virus. Chinese Journal of Preventive Veterinary Medicine,2011,33(8): 630-634. (in Chinese)
[3] 曹贞贞,张存,黄瑜,刁有祥,叶伟成,刘月焕,韩婧,马国明,张冬冬,许丰,王丹,姜甜甜,袁媛,谢小雨,高绪慧,唐熠,施少华,万春和,张晨,何玢,杨梦婕,陆新浩,张冰,张国中,马学军,张大丙. 鸭出血性卵巢炎的初步研究. 中国兽医杂志,2010,12(46): 3-6. CAO Z Z,ZHANG C,HUANG Y,DIAO Y X,YE W C,LIU Y H,HAN J,MA G M,ZHANG D D,XU F,WANG D,JIANG T T,YUAN Y,XIE X Y,GAO X H,TANG Y,SHI S H,WAN C H,ZHANG C,HE B,YANG M J,LU X H,ZHANG B,ZHANG G Z,MA X J,ZHANG D B. Preliminary studies on duck hemorrhagic ovaritis. Chinese Journal of Veterinary Medicine,2010,12(46): 3-6. (in Chinese)
[4] 李玉峰,马秀丽,于可响,王友令,高巍,黄兵,徐怀英,吴静,王生雨,王莉莉,秦卓明. 一种从鸭新分离的黄病毒研究初报. 畜牧兽医学报,2011,42(6): 885-891. LI Y F,MA X L,YU K X,WANG Y L,GAO W,HUANG B,XU H Y,WU J,WANG S Y,WANG L L,QIN Z M. A brief report offlaviviruses newly isolated from duck. Chinese Journal of Animal and Veterinary Sciences,2011,42(6): 885-891. (in Chinese)
[5] Palya Vilmos,Homonnay ZalÁN GÁBor,MatÓ TamÁS,Albert MihÁLy,WalkÓNÉ KovÁCs Edit,Tatár-kis Tímea. Novel Flavivirus causing neurological disease in ducks//International Congress of the World Veterinary Poultry Association. WVPA,2013: 566.
[6] 朱丽萍,颜世敢. 鸭坦布苏病毒研究进展. 中国预防兽医学报,2012,34(1):79-82. ZHU L P,YAN S G. Progress of duck Tembusu Virus. Chinese Journal of Preventive Veterinary Medicine,2012,34(1):79-82. (in Chinese)
[7] 滕巧泱,颜丕熙,张旭,闫丽萍,李泽君. 一种新的黄病毒导致蛋鸭产蛋下降及死亡. 中国动物传染病学报,2010,18(6): 1-4. TENG Q Y,YAN P X,ZHANG X,YAN L P,LI Z J. A novel flavivirus causing duck egg drops and death. Chinese Journal of Animal Infectious Diseases,2010,18(6): 1-4. (in Chinese)
[8] CAO Z Z,ZHANG C,LIU Y H,YE W C,HAN J W,MA G M,ZHANG D D,XU F,GAO X H,TANG Y,SHI S H,WAN C H,ZHANG C,HE B,YANG M J,LU X H,HUANG Y,DIAO Y X,MA X J,ZHANG D B. Tembusu virus in ducks,China. Emerging Infectious Diseases,2011,17(10): 1873-1875.
[9] SU J L,LI S,HU X D,YU X L,WANG Y Y,LIU P P,LU X S,ZHANG G Z,HU X Y,LIU D,LI X X,SU W L,LU H,NGAISHING MOK,WANG P Y,WANG M,TIAN K G,GAO G F. Duck egg-drop syndrome caused by BYD virus,a new tembusu-related flavivirus. PLoS ONE,2011,6(3): 1-10.
[10] Liu M,Chen S Y,Chen Y H,Liu C G,Chen S L,Yin X C,Li G,Zhang Y. Adapted tembusu-like virus in chickens and geese in China. Journal of Clinical Microbiology,2012,50(8): 2807-2809.
[11] TANG Y,DIAO Y,YU C,GAO X,JU X,XUE C,LIU X,GE P,QU J,ZHANG D. Characterization of a tembusu virus isolated from naturally infected house sparrows (Passer domesticus) in Northern China. Transboundary and Emerging Diseases,2012,60(2): 152-158.
[12] DAVIDSON I. A new look at avian flaviviruses//International Congress of the World Veterinary Poultry Association. WVPA,2013: 79- 84.
[13] 林健,韩春华,陈华林,蒋桃珍,梁武,何平有,杨保收,王英,韩婧雯,刘东艳,潘洁,段会娟,丁佩佩,胡胜强,刘月焕. 鸭出血性卵巢炎实验感染模型的建立. 中国农业科学,2011,44(10): 2161-2167. Lin J,Han C H,Chen H L,Jiang T Z,Liang W,He P Y,Yang B S,Wang Y,Han J W,Liu D Y,Pan J,Duan H J,Ding P P,Hu S Q,Liu Y H. Establishment of experimental infection model of duck hemorrhagic ovaritis. Scientia Agricultura Sinica,2011,44(10): 2161-2167. (in Chinese)
[14] 万春和,施少华,程龙飞,陈红梅,傅光华,彭春香,林芳,林建生,黄瑜. 鸭出血性卵巢炎病毒RT-PCR检测方法的建立. 福建农业学报,2011,26(1): 10-12. WAN C H,SHI S H,CHENG L F,CHEN H M,FU G H,PENG C X,LIN F,LIN J S,HUANG Y. Establishment of RT-PCR for detecting duck hemorrhagic ovaritis causing abrupt egg laying reduction in ducks. Fujian Journal of Agricultural Sciences,2011,26(1): 10-12. (in Chinese)
[15] 张帅,云涛,叶伟成,邓晓辉,崔言顺,华炯钢,张存,张燕. 鸭坦布苏病毒一步法RT-PCR检测方法的建立和应用. 浙江农业学报,2012,24(1): 37-40. ZHANG S,YUN T,YE W C,DENG X H,CUI Y S,HUA J G,ZHANG C,ZHANG Y. Development and application of one step RT-PCR technique for detection of duck Tembusu virus. Acta Agriculturae Zhejiangensis,2012,24(1): 37-40. (in Chinese)
[16] 颜丕熙,李国新,吴晓刚,闫丽萍,滕巧泱,李泽君. 应用套式RT-PCR快速检测鸭坦布苏病毒. 中国动物传染病学报,2011,19(3): 34-37. YAN P X,LI G X,WU X G,YAN L P,TENG Q Y,LI Z J. Rapid identification of duck Tembusu virus by the Nested RT-PCR. Chinese Journal of Animal Infectious Diseases,2011,19(3): 34-37. (in Chinese)
[17] 于春梅,刁有祥,唐熠,崔京腾,高绪慧,张颖,鞠小军,武利利.坦布苏病毒荧光定量 RT-PCR 方法的建立. 中国农业科学,2012,45(21): 4492-4500. YU C M,DIAO Y X,TANG Y,CUI J T,GAO X H,ZHANG Y,JU X J,WU L L. Fluorescence quantitative RT-PCR assay for detection of Tembusu virus. Scientia Agricultura Sinica,2012,45(21): 4492-4500. (in Chinese)
[18] 万春和,朱海侠,施少华,黄瑜,程龙飞,傅光华,陈红梅. 鸭坦布苏病毒SYBR GreenI实时荧光定量检测方法的建立. 中国兽医学报,2013,33(7): 973-978. WAN C H,ZHU H X,SHI S H,HUANG Y,CHENG L F,FU G H,CHEN H M. Establishment of a SYBR GreenI-based real-time RT-PCR for rapid detection of duck Tembusu virus. Chinese Journal of Veterinary Science,2013,33(7): 973-978. (in Chinese)
[19] HAN C H,LIN J,HE P Y,WANG X Q,YU H W,MAO Y Y,XU Q Q,ZHAO J C,YANG Z Y,PAN J,DUAN H J,XIE J,YANG B S,LIU Y H. Immunogenicity and protection efficacy of an inactivated duck hemorrhagic ovaritis virus (Tembusu Virus) vaccine//International Congress of the World Veterinary Poultry Association. WVPA,2013: 541.
[20] 李振华,李小康,郭春玲,张春杰,刘凤军,王臣. 鸭坦布苏病毒灭活油乳苗的制备及免疫效力测定. 中国预防兽医学报,2013,35(5): 388-391. LI Z H,LI X K,GUO C L,ZHANG C J,LIU F J,W C. Immune effectiveness of the oil-emulsion inactivated vaccine against duck Tembusu virus. Chinese Journal of Preventive Veterinary Medicine,2013,35(5): 388-391. (in Chinese)
[21] CHEN P,LIU J,JIANG Y,ZHAOY,LI Q,WU L,HE X,CHEN H. The vaccine efficacy of recombinant duck enteritis virus expressing secreted E with or without PrM proteins of duck tembusu virus. Vaccine,2014,32:5271-5277.
[22] LI G,GAO X,XIAO Y,LIU S,PENG S,LI X,SHI Y,ZHANG Y,YU L,WU X,YAN P,YAN L,TENG Q,TONG G, LI Z. Development of a live attenuated vaccine candidate against duck Tembusu viral disease. Virology,2014,450-451:233-242.
[23] SUN L,LI Y,ZHANG Y,HAN Z,XU Y,KONG X,LIU S. Adaptation and attenuation of duck Tembusu virus strain Du/CH/ LSD/110128 following serial passage in chicken embryos. Clinical and Vaccine Immunology,2014,21:1046-1053.
[24] ZOU Z,LIU Z,JIN M. Efficient strategy to generate a vectored duck enteritis virus delivering envelope of duck Tembusu virus. Viruses,2014,6:2428-2443.
[25] 卡尔尼克. 禽病学. 第 10版. 高福等译. 北京: 中国农业出版社,1999: 692-709. CALNEK B W. Diseases of Poultry. Edition 10. Translated by Gao Fu etc. Beijing: China Agricultural Press. 1999: 692-709. (in Chinese)
[26] 王泽霖. 鸡血凝抑制抗体的研究— 鸡母源抗体. 畜牧与兽医,1985,17( 6): 246- 248. WANG Z L. Study on the chicken hemagglutination inhibition antibody— maternal antibody of chicken. Animal Husbandry and Veterinary Medicine,1985,17(6): 246-248. (in Chinese)
[27] 蔡宝祥. 家畜传染病学. 北京: 中国农业出版社,2000: 10. CAI B X. Domestic Animal Epidemiology. Beijing: China Agricultural Press. 2000: 10. (in Chinese)
[28] 章怀云,郝俊峰,陈新春. 雏鸡新城疫母源抗体水平动态的监测.湖南农业大学学报,1997,23( 12): 570-572. ZHANG H Y,HAO J F,CHEN X C. A report on observation of dynamics of ND maternal antibody level in the chicks. Journal of Hunan Agricultural University,1997,23(12): 570-572. (in Chinese)
[29] 陈一兵,刘岳龙,解增俊,刘雷,印继华,苏建,吴扬. 几种家禽新城疫母源抗体变化规律的研究. 扬州大学学报,2004,25(4): 65-67. CHEN Y B,LIU Y L,XIE Z J,LIU L,YIN J H,SU J,WU Y. The research on the change of several sorts of poultry ND maternal anti-body. Journal of Yangzhou University,2004,25(4): 65-67.(in Chinese)
(责任编辑 林鉴非)
Dynamic Study on Maternal Antibody of Duck Tembusu Virus Disease Inactivated Vaccine (HB Strain)
HAN Chun-hua1,ZHAO Ji-cheng1,DUAN Hui-juan1,LIN Jian1,YANG Zhi-yuan1,XIE Jia2,PAN Jie1,WANG Xiao-lei1,LIU Li-xin1,LIU Yue-huan1
(1Institute of Animal Husbandry and Veterinary Medicine,Beijing Municipal Academy of Agricultural and Forestry Sciences,Beijing 100097;2Beijing Tongzhou District Agricultural Bureau,Beijing 101100)
【Objective】The objective of this study is to evaluate the efficacy of maternal antibodies induced by Duck Tembusu Virus Disease Inactivated Vaccine and to determine the age of optimal initial immunity.【Method】Fertilized eggs were collected at random from the Cherry Valley Duck farm which was 135 days post-vaccination with Duck Tembusu Virus Disease Inactivated Vaccine (HB strain),ten progeny ducklings from the immunized breed ducks and 5 progeny ducklings from non-immunized breedducks were randomly selected when they were 5 ,7 ,10,and 15 days old. Serum samples were collected from all ducks for the detection of maternal antibody,then the ducks were challenged with Duck Tembusu virus (HB strain) at 0.1ml(100DID50)/duck intramuscularly. Clinical symptoms of the challenged ducks were observed within 10 days,such as food intake,feces,abnormal clinical sighs and death. Serum samples were collected from all ducks for virus isolation via jugular vein on 2 days post inoculation (DPI). Each serum sample was inoculated into five 6-day-old SPF chicken embryos at the inoculum of 0.1 ml per embryo. Then they were hatched at 37℃ for 168h. The chicken embryos died within 24h were discarded. If more than one (including one) death chicken embryos were obsearved,then it was concluded that virus isolation was positive. The rate of protection of ducklings with maternal antibody and the morbidity of ducklings without maternal antibody were calculated. On 5 dpi,all ducklings were weighed respectively,and the average daily gain was calculated. The effect of maternal antibody on the weight gain of ducklings were analyzed by T test for paired samples. The efficacy of maternal antibodies was evaluated by neutralizing antibody titer,body weight changes and virus isolation.【Result】 (1) The number of positive maternal antibody titers peaked in 1 day old ducklings was 56.1%(37/66),then fell to 40% (4/10) in ducklings on day 5,50% (5/10) on day 7,30% (3/10) on day 10,and 0% (0/10) on day 15. (2) On viral challenge,the control group showed signs of depression (20/20),neurologic disturbances (6/20) and death (2/20). Ducklings with positive maternal antibody titers showed mild depression. (3) On 5 dpi,the average daily gain of 5-,7-,10- and 15-day old ducklings with maternal antibody were 115.5,142.8,177.8 and 162.2g,respectively,and that of the ducklings without maternal antibody were 54.5,91,165 and 118.8g,respectively. (4) The rate of protection against challenge with DTMUV of 5-,7-,10- and 15-day old ducklings with maternal antibody were 50%(5/10),60%(6/10),20%(2/10) and 0%(0/10),respectively. The morbidity of 5-,7-,10- and 15-day old ducklings without maternal antibody were all 100%. (5) The average weight gain and efficacy reached a peak in 5-day old and 7-day old ducklings,which were 50% (5/10) and 60% (6/10),respectively. Although the maternal antibodies decreased between 10 days old and 15 days old ducklings (20% and 0%),it still has protective effect compared with the control group. 【Conclusion】(1) Duck Tembusu Virus Disease killed vaccine maternal antibodies,so it play an important role in the protection of 10-day-old ducklings against virus infection; (2) Vaccination age is optimized between 7 to 10 days of age.
ducks; Tembusu virus; maternal antibody
2015-10-05;接受日期:2016-06-01
国家自然科学基金(310721597)、北京市自然科学基金(6072011)、北京市农林科学院青年基金(QNJJ201308)、北京市农林科学院科技创新能力建设专项(KJCX201204008)
联系方式:韩春华,010-51503475;E-mail:hchh1224@126.com。通信作者刘月焕,Tel:010-51503475;E-mail:liuyuehuan@sina.com
