鸭坦布苏病毒病卵巢病变标准的判定
2016-09-19杨志远何平有段会娟邹立宏杨保收赵际成王小蕾刘立新刘月焕
林 健,杨志远,何平有,段会娟,邹立宏,杨保收,赵际成,潘 洁,王小蕾,刘立新,刘月焕
(1北京市农林科学院畜牧兽医研究所,北京 100097;2瑞普(保定)生物药业有限公司,河北保定 071000)
鸭坦布苏病毒病卵巢病变标准的判定
林 健1,杨志远1,何平有2,段会娟1,邹立宏2,杨保收2,赵际成1,潘 洁1,王小蕾1,刘立新1,刘月焕1
(1北京市农林科学院畜牧兽医研究所,北京 100097;2瑞普(保定)生物药业有限公司,河北保定 071000)
【目的】了解产蛋鸭感染鸭坦布苏病毒后卵巢病变产生的进程和卵巢病变规律,为采用产蛋鸭卵巢病理变化检查法进行疫苗效力检验提供依据。【方法】70只260日龄产蛋樱桃谷鸭,以0.5mL/只(含100DID50)的剂量经胸部肌肉接种鸭坦布苏病毒(HB株)强毒。观察试验鸭的临床症状,统计每日产蛋数和采食量。攻毒后2 d,每只鸭经翅静脉采血,分离血清,经卵黄囊途径接种5枚6日龄SPF鸡胚,每胚0.1mL。接种后置37℃条件下继续孵化,24 h死亡鸡胚弃去。采用RT-PCR方法测定24—72 h死亡鸡胚的DTMUV核酸,将1/5或以上鸡胚死亡且DTMUV核酸阳性的鸭判为DTMUV感染鸭。攻毒后4—10 d,每日剖杀10只鸭,观察和分析生殖系统病变。统计病变率,检查输卵管内是否有蛋,卵泡是否变形、出血和破裂,依据病变率和病变,确定检查内容和病变卵巢的判定时间和标准。【结果】(1)攻毒后3、4、5、6 d,鸭几乎不采食,产蛋数明显下降。攻毒后7 d,鸭精神状况好转;攻毒后8 d,采食量开始回升。(2)70只鸭中,除1只鸭的病毒分离结果为阴性外,其余69只鸭的病毒分离结果均为阳性,病毒分离阳性率为98.6%(69/70)。(3)攻毒后4—10 d,共64只产蛋期鸭的生殖器官可以判定。(4)攻毒后4、5、6、7、8、9和10 d,卵巢病变率分别为66.7%(6/9)、100%(10/10)、100%(10/10)、100%(9/9)、100%(9/9)、100%(9/9)和100%(8/8)。(5)除攻毒后4 d有2只鸭输卵管中有蛋外,其余62只鸭输卵管中均无蛋,无蛋率为96.9%(62/64)。(6)攻毒后4—10 d,96.9%(62/64)鸭的卵泡变形,96.9%(62/64)鸭的卵泡出血,95.3%(61/64)鸭的卵泡变形和出血,34.4%(22/64)卵泡破裂。【结论】(1)确定卵巢病理变化检查时间为攻毒后7—8 d;(2)具有变形或出血病变之一,判病变卵泡。输卵管内无蛋且有3个及以上病变卵泡,判为病变卵巢。
鸭坦布苏病毒病;卵巢;病理变化
0 引言
【研究意义】2010年,在中国浙江等多个省市发现以产蛋鸭产蛋量急剧下降为主要特征的疾病,在病原不清楚的情况下,根据卵巢出血的大体病变,将该病暂命名为鸭出血性卵巢炎(duck hemorrhagic ovaritis,DHO)[1],随后经过病毒分离鉴定和病毒NS5片段的DNA序列同源性分析结果表明,引起上述鸭疫情的病毒为一种黄病毒、Ntaya病毒群中的Tembusu病毒[2-4]。2011年首届水禽疫病防控研讨会将该病统一命名为“鸭坦布苏病毒病”[5]。鸭坦布苏病毒病自从2010年流行以来,已经成为中国养鸭业的主要疾病之一。产蛋鸭发病后表现为持续性产蛋率低下,由于继发感染和饲养管理不当等因素可致死亡率达到 15%—20%[1,3,6]。疫苗的预防接种是控制畜禽传染病的重要手段。万春和等[7]按照常规方法制备了鸭坦布苏病毒病油乳剂灭活苗,并利用免疫鸭群平均产蛋率进行疫苗的效力评价,而李振华[8]等利用攻毒后鸭的临床表现的剖检病变来评价;林健等[9]首次使用疫苗保护效力PD50检验法对商品肉鸭进行了效力评价,攻毒试验的结果表明研制的灭活苗安全有效。LI等[10-11]分别将鸭坦布苏病毒在鸡胚成纤维细胞和鸡胚上进行连续传代,获得了致弱的疫苗候选株。ZOU等[12-13]利用反向遗传操作平台获得了以鸭瘟病毒为载体的重组二价弱毒疫苗候选株。MA等[14]用逆向蒸发法构建了嵌入重组E蛋白的脂质体疫苗,效力评价时除利用病毒血症,还采集咽拭子和肛拭子进行病毒分离。但不论是灭活疫苗、活疫苗还是基因工程疫苗,都需要建立疫苗的效力检定方法,这对疫苗质量控制至关重要。制定产蛋鸭感染鸭坦布苏病毒(duck Tembusu virus,DTMUV)后卵巢病变的适宜检查时间和病变卵巢的判定标准,在利用卵巢病变评价疫苗的效力方面有意义。【前人研究进展】曹贞贞等学者确认引起鸭产蛋急剧下降的病原为黄病毒或坦布苏病毒[1,15-16]。Tembusu病毒首次于1968年在Sarawak地区的蚊子体内分离到,曾一度认为家禽可能是病毒的自然宿主[17]。Tembusu病毒分别于1982和1992年在泰国北部日本脑炎流行地区蚊子体内分离到[18-19]。2000年,研究人员报道了一种新的名为Sitiawan的黄病毒感染鸡后能够引起鸡生长发育受阻[20],Sitiawan病毒与Tembusu病毒核酸的同源性为92%。中国从鸭体内分离到的Tembusu病毒与Bagaza病毒的核酸高度同源[21-22]。值得一提的是,温立斌等学者于1995年从10周龄以上发病的康贝尔鸭肝脾组织中分离到似乎属于黄病毒科的病毒,并将该病暂命名为“鸭病毒性脑炎”[23]。现有文献资料表明,产蛋期鸭发病后,采食量减少和产蛋量急剧下降,卵泡变形、出血、液化或破裂。尚未见系统的卵巢病理变化检查的适宜时间、检查内容和病变卵巢判定标准的报道。【本研究切入点】本文通过对70只人工感染产蛋鸭的卵巢病变产生时间、病变检查内容和判定标准进行系统研究。【拟解决的关键问题】解决鸭坦布苏病毒感染产蛋鸭后,病变卵巢判定时间和判定标准的问题。为了解产蛋鸭感染鸭坦布苏病毒后卵巢产生病变的进程,制定卵巢病变检查的适宜时间和病变卵巢标准,为确定疫苗效力检验,何时检查卵巢病理变化和如何判定病变卵巢提供依据。笔者开展了“卵巢病理变化检查时间和病变卵巢判定标准”的研究。
1 材料与方法
1.1试验地点和时间
试验于2015年3月瑞普(保定)生物药业有限公司负压动物舍,实验动物使用许可证号为 SYXK(Ji)2010-0045。
1.2材料
1.2.1毒株 鸭坦布苏病毒HB株(DTMUV-HB),鸭胚 F4代,由北京市农林科学院畜牧兽医研究所繁殖,鸭半数感染量(DID50)为107.7/0.5mL。
1.2.2樱桃谷鸭 70只260日龄DTMUV抗体阴性产蛋樱桃谷鸭,饲料和垫料,购自河北省保定市安新县某养鸭场。
1.2.3试剂 灭菌 0.5%水解乳蛋白 Hank’s液(pH 7.2)。
1.3方法
1.3.1攻毒 70只鸭腿部标记,分别经胸部肌肉接种DTMUV-HB株强毒,每只0.5mL(含100DID50)。观察试验鸭的临床症状,统计每日产蛋数和采食量。攻毒后2 d,采血分离病毒。攻毒后4—10 d,每日随机取10只鸭(包括死亡鸭),剖杀,观察卵巢病变。
1.3.2病毒分离 攻毒后2 d,每只鸭经翅静脉采血分离血清。每只鸭的血清经卵黄囊途径接种5枚6日龄SPF鸡胚,每胚0.1mL。接种后置37℃条件下继续孵化,24 h死亡鸡胚弃去。采用RT-PCR方法测定24 —72 h死亡鸡胚的DTMUV核酸,将1/5或以上鸡胚死亡且DTMUV核酸阳性的鸭判为DTMUV感染鸭。
1.3.3生殖器官检查 攻毒后4—10 d,每日随机取10只鸭(包括死亡鸭),剖杀,观察生殖器官病变(卵泡形状和输卵管内是否有蛋)。
1.3.3.1生殖器官检查要求 仅检查产蛋期鸭生殖器官,产蛋停止期和静止期鸭不检查(弃去)。
1.3.3.2检查内容 检查输卵管内是否有蛋,卵泡是否变形、出血和破裂(通过观察腹腔中是否有黄色、红褐色、米黄色或土黄色等液体判定)。
1.3.3.3数据统计和分析 统计病变率,分析攻毒后4—10 d生殖器官明显的病变特征。依据病变率和病变,确定检查内容和病变卵巢的判定时间和标准。
2 结果
2.1临床症状
攻毒后3、4、5和6 d,鸭几乎不采食,产蛋数明显下降。攻毒后7 d,鸭精神状况好转;攻毒后8 d,采食量开始回升。采食量和产蛋数结果见表1。
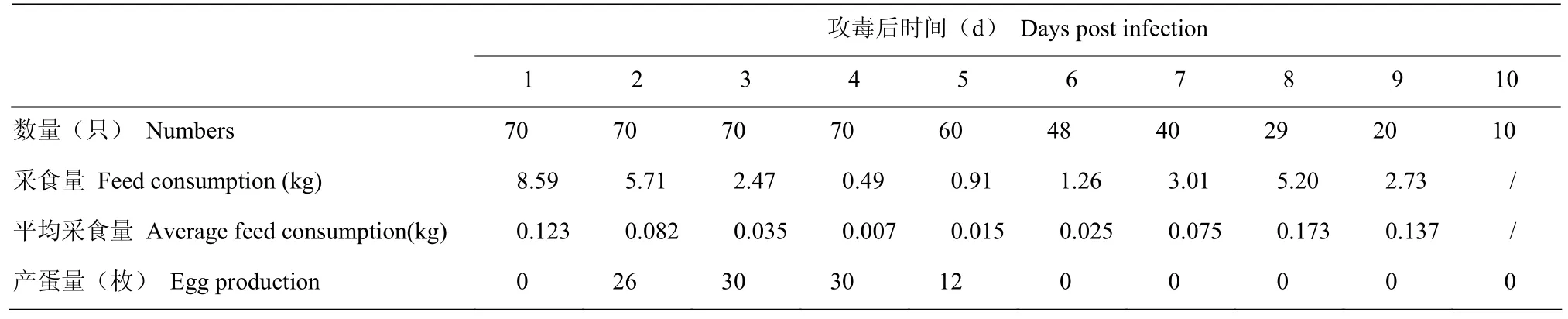
表1 攻毒后鸭采食量和产蛋量变化Table 1 Changes of feed intake and egg production of duck infected
2.2病毒分离
70只鸭中,除1只鸭(81号)的病毒分离结果为阴性外(鸡胚于接种后72 h开始死亡),其余69只鸭的病毒分离结果均为阳性,病毒分离阳性率为98.6%(69/70)。
2.3生殖器官检查
2.3.1产蛋停止和静止期鸭 3只为产蛋停止期鸭,分别为33号(攻毒后7 d剖检,图1-A)、38号(攻毒后9 d剖检)和41号(攻毒后10 d剖检);3只为产蛋静止期鸭,分别为83号(攻毒后4 d剖检,图1-B)、29号(攻毒后8 d剖检)和44号(攻毒后10 d剖检)。共6只鸭生殖器官不能判定,弃去。
2.3.2产蛋期鸭 共64只产蛋期鸭的生殖器官可作后期试验有效材料。
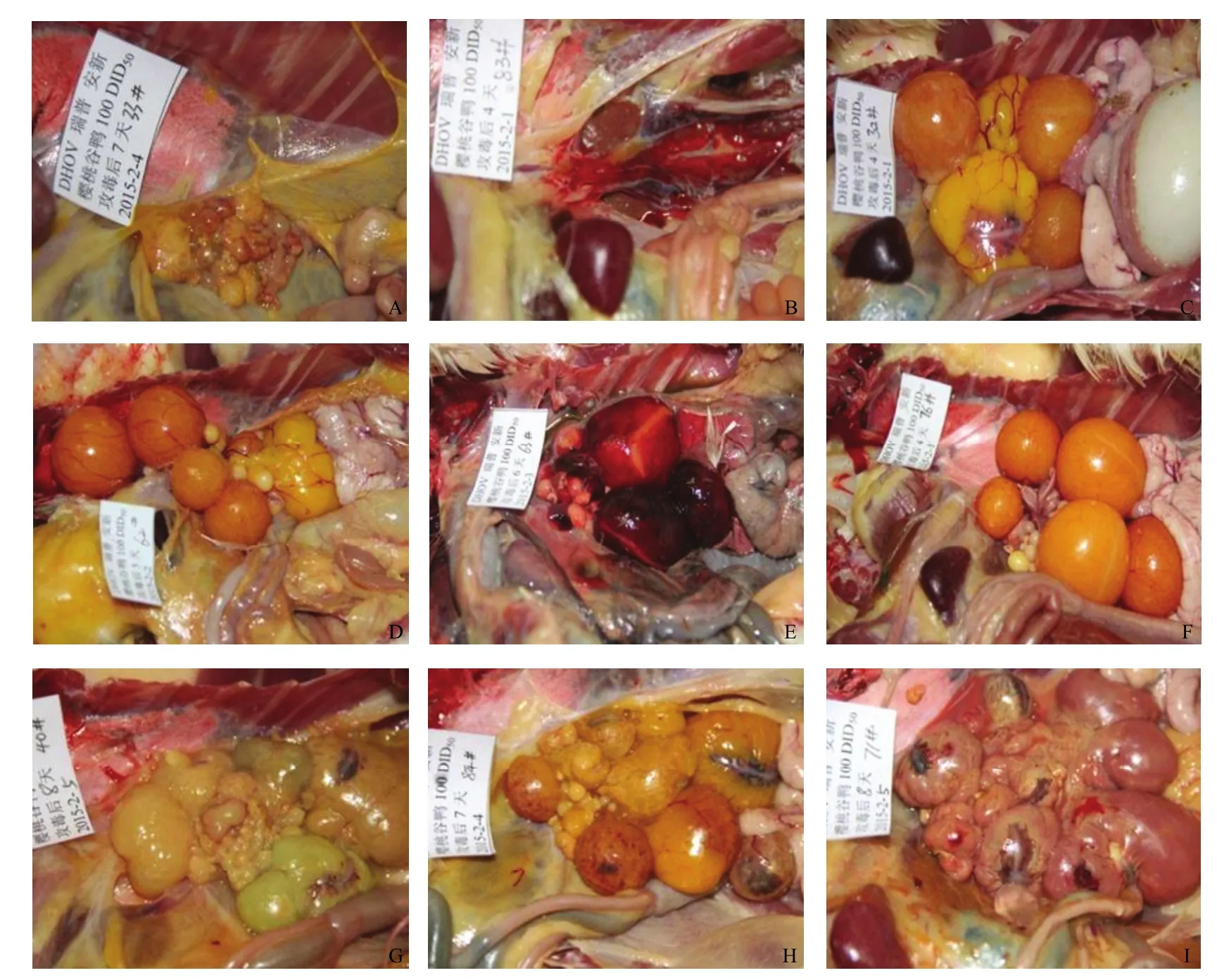
图1 攻毒鸭后生殖器官病变Fig.1 Pathological changes of ducks infected
2.3.2.1输卵管内是否有蛋 攻毒后4—10 d,除攻毒后4 d剖检的2只鸭(24和32号)输卵管子宫部有蛋(图1-C)外,其余62只鸭输卵管子宫部均无蛋,无蛋率为96.9%(62/64)。
2.3.2.2病变卵巢攻毒后4—10 d,96.9%(62/64)鸭的卵泡变形,96.9%(62/64)鸭的卵泡出血,除62号鸭卵巢仅变形(图1-D)、63号鸭卵泡仅出血(图1-E)和76号鸭(攻毒后4 d剖检)卵泡正常(无变形和出血卵泡,图1-F)外,其余61只鸭的卵巢均可观察到卵泡变形和出血(图1-G、图1-H),34.4% (22/64)的卵泡破裂(图1-I)。详细结果见表2。
2.3.3发病率 攻毒后4、5、6、7、8、9和10 d,卵巢病变率分别为 66.7%(6/9)、100%(10/10)、100%(10/10)、100%(9/9)、100%(9/9)、100% (9/9)和100%(8/8)。详细结果见表3。
3 讨论
3.1卵巢病变检查时间
试验鸭攻毒后3 d采食量和对外界刺激反应能力等明显下降,笔者前期的研究结果表明[24],攻毒后 1 —3 d病毒分离率最高,在病毒血症的早期并没有明显临床症状,而是当病毒在靶细胞持续和大量增殖时才出现,这与本次试验结果相一致。攻毒后7 d试验鸭开始恢复,8、9和10 d采食量和精神状况有明显增加或好转,这与解瑞钦等[25]的研究结果一致。卵巢病变率和病变的结果表明,攻毒后5—10 d,卵巢病变率均为 100%,但是随着时间的推移,大型病变卵泡逐渐减少。攻毒后9 d,部分鸭腹腔内有臭味,有卵黄液或者卵黄痕迹,1只鸭卵巢萎缩,1只鸭卵巢有明显萎缩倾向。攻毒后10 d,2只鸭的卵巢萎缩,其余8只鸭仅可见中小型卵泡明显变形、出血。这表明,攻毒后9—10 d,不是检查卵巢病变的适宜时间,将病变卵巢检查时间确定为攻毒后7—8 d。

表2 攻毒鸭生殖器官检查Table 2 Reproductive organs inspection on duck infected

表3 攻毒鸭病毒分离和卵巢病变Table 3 Virus isolation and ovarian pathological changes of duck infected
3.2卵巢病变检查标准
由于激素等生理或病理性因素,产蛋母鸭经历产蛋期、产蛋停止和静止期3个阶段。产蛋期鸭卵巢的直径可达5—6 cm,常可见到3—4个体积依次递增的大卵泡,其中最大的充满卵黄的卵泡直径约达 4—5 cm。本次试验利用70只260日龄父母代樱桃谷鸭,系统观察和分析了攻毒后4—10 d产蛋鸭的生殖器官,结果表明,此次试验共有8.6%(6/70)的鸭为非产蛋期鸭(产蛋停止和静止期鸭)。由于非产蛋期鸭卵巢处于未发育或未成熟状态,很难对卵泡病变进行判定,因此在利用产蛋鸭(卵巢病理变化检查法)进行疫苗的效力检验时,应将非产蛋期鸭排除在外。此次试验攻毒后5—10 d,攻毒鸭未见产蛋,剖检鸭输卵管内未见鸭蛋,将攻毒后7—8 d,只要输卵管内有蛋,就判为正常。由于输卵管里是否有蛋,与卵巢在特定时间段正常与否密切相关,而且判定时一目了然,易于判定,同时也能够反映出产蛋鸭坦布苏病毒病的临床表现,因此,将输卵管内是否有蛋列为检查内容之一。笔者前期建立的人工感染模型中[26],主要表现为急性出血性卵巢炎,此外,罗玲等[27]的研究也发现该病的临床剖检主要病变为卵巢严重充血、出血,此次试验中感染鸭卵泡变形或出血的病变率均为 96.9%,而且既出血又变形的卵泡病变率为95.3%(61/64),明显高于 34.4%的卵泡破裂病变率。因此,将卵泡变形和卵泡出血列为卵巢检查内容之一,且将具有变形或出血病变之一,判为病变卵泡。结合应激对产蛋鸭产蛋性能影响的试验结果(内部资料),综合分析上述结果,制定病变卵巢判定标准:将输卵管内无蛋,有 3个及以上病变卵泡。符合以上2条之一,判为病变卵巢。有时遇到卵泡数低于3个的鸭,规定如有病变卵泡,也判为病变卵巢。正常卵巢的判定标准如下:(1)输卵管内有蛋;(2)输卵管内无蛋,有2个及以下病变卵泡;(3)卵泡数低于 3个,无病变卵泡。符合上述3条之一者,判为正常卵巢。
4 结论
4.1卵巢病理变化检查时间为攻毒后7—8 d。
4.2具有变形或出血病变之一,判病变卵泡。输卵管内无蛋且有3个及以上病变卵泡,判为病变卵巢。
References
[1] 曹贞贞,张存,黄瑜,刁有祥,叶伟成,刘月焕,韩婧文,马国明,张冬冬,许丰,王丹,姜甜甜,袁媛,谢小雨,高绪慧,唐熠,施少华,万春和,张晨,何玢,杨梦婕,陆新浩,张冰,张国中,马学军,张大丙. 鸭坦布苏病毒病的初步研究. 中国兽医杂志,2010,12(46): 3-6. CAO Z Z,ZHANG C,HUANG Y,DIAO Y X,YE W C,LIU Y H,HAN J W,MA G M,ZHANG D D,XU F,WANG D,JIANG T T,YUAN Y,XIE X Y,GAO X H,TANG Y,SHI S H,WAN C H,ZHANG C,HE B,YANG M J,LU X H,ZHANG B,ZHANG G Z,MA X J,ZHANG D B. Preliminary studies on duck hemorrhagic ovaritis. Chinese Journal of Veterinary Medicine,2010,12(46): 3-6. (in Chinese)
[2] CAO Z,ZHANG C,LIU Y,LIU Y,YE W,HAN J,MA G,ZHANG D,XU F,GAO X,TANG Y,SHI S,WAN C,ZHANG C,HE B,YANG M,LU X,HUANG Y,DIAO Y,MA X,ZHANG D. Tembusu virus in ducks,China. Emerging Infectious Diseases,2011,17(10):1873-1875.
[3] SU J,LI S,HU X,YU X,WANG Y,LIU P,LU X,ZHANG G,HU X,LIU D,LI X,SU W,LU H,MOK N S,WANG P,WANG M,TIAN K,GAO G F. Duck egg-drop syndrome caused by BYD virus,a new Tembusu-related flavivirus. PLoS One,2011,6(3):e18106.
[4] YAN P,ZHAO Y,ZHANG X,XU D,DAI X,TENG Q,YAN L,ZHOU J,JI X,ZHANG S,LIU G,ZHOU Y,KAWAOKA Y,TONG G,LI Z. An infectious disease of ducks caused by a newly emerged Tembusu virus strain in mainland China. Virology,2011,417(1):1-8.
[5] SUN X Y,DIAO Y X,WANG J,LIU X,LU A L,ZHANG L,GE P P,HAO D M. Tembusu virus infection in Cherry Valley ducks: the effect of age at infection. Veterinary Microbiology,2014,168(1):16-24.
[6] 朱丽萍,颜世敢. 鸭坦布苏病毒研究进展. 中国预防兽医学报,2012,34(01):79-82. ZHU L P,YAN S G. Progress of Duck Tembusu Virus. Chinese Journal of Preventive Veterinary Medicine,2012,34(01):79-82. (in Chinese)
[7] 万春和,施少华,傅光华,梁昭平,王斌,程龙飞,李敏,陈红梅,林芳,林建生,王鑫,许芬芬,黄瑜.鸭黄病毒油乳剂灭活疫苗研制及免疫效果测定. 养禽与禽病防治,2011(10): 20-22. WAN C H,SHI S H,FU G H,LIANG S P,WANG B,CHENG L F,LI M,CHEN H M,LIN F,LIN J S,WANG X,XU F F,HUANG Y. Immune effectiveness of the oil-emulsion inactivated vaccine against duck Tembusu virus. Poultry Husbandry and Disease Control,2011(10): 20-22. (in Chinese)
[8] 李振华,李小康,郭香玲,张春杰,刘凤军,王臣. 鸭坦布苏病毒灭活油乳苗的制备及免疫效力测定. 中国预防兽医学报,2013,35(05):388-391. LI Z H,LI X K,GUO X L,ZHANG C J,LIU F J,WANG C. Immune effectiveness of the oil-emulsion inactivated vaccine against duck Tembusu virus. Chinese Journal of Preventive Veterinary Medicine,2013,35(05):388-391. (in Chinese)
[9] LIN J,LIU Y,WANG X,YANG B,HE P,YANG Z,DUAN H,XIE J,ZOU L,ZHAO J,PAN J. Efficacy Evaluation of an Inactivated Duck Tembusu Virus Vaccine. Avian Diseases,2015,59(2):244-248.
[10] Li G,Gao X,Xiao Y,Liu S,Peng S,Li X,Shi Y,Zhang Y,Yu L,Wu X,Yan P,Yan L,Teng Q,Tong G,Li Z. Development of a live attenuated vaccine candidate against duck Tembusu viral disease. Virology,2014,450-451:233-242.
[11] SUN L,LI Y,ZHANG Y,HAN Z,XU Y,KONG X,LIU S. Adaptation and attenuation of duck Tembusu virus strain Du/CH/LSD/ 110128 following serial passage in chicken embryos. Clinical and Vaccine Immunology,2014,21:1046-1053.
[12] ZOU Z,LIU Z,JIN M. Efficient strategy to generate a vectored duck enteritis virus delivering envelope of duck Tembusu virus. Viruses,2014,6:2428-2443.
[13] CHEN P,LIU J,JIANG Y,ZHAO Y,LI Q,WU L,HE X,CHEN H. The vaccine efficacy of recombinant duck enteritis virus expressing secreted E with or without PrM proteins of duck tembusu virus. Vaccine,2014,32:5271-5277.
[14] MA T,LIU Y,CHENG J,LIU Y,FAN W,CHENG Z,NIU X,LIU J. Liposomes containing recombinant E protein vaccine against duck Tembusu virus in ducks. Vaccine,2016,34(19):2157-2163.
[15] 滕巧泱,颜丕熙,张旭,闫丽萍,李泽君. 一种新的黄病毒导致蛋鸭产蛋下降及死亡. 中国动物传染病学报,2010,18(6):1-4. TENG Q Y,YAN P X,ZHANG X,YAN L P,LI Z J. A novel flavivirus causing duck egg drops and death. Chinese Journal of AnimalInfectious Diseases,2010,18(6): 1-4. (in Chinese)
[16] 李玉峰,马秀丽,于可响,王友令,高巍,黄兵,徐怀英,吴静,王生雨,王莉莉,秦卓明. 一种从鸭新分离的黄病毒研究初报. 畜牧兽医学报,2011,42(06):885-891. LI Y F,MA X L,YU K X,WANG Y L,GAO W,HUANG B,XU H Y,WU J,WANG S Y,WANG L L,QIN Z M. A brief report of flaviviruses newly isolated from duck. Chinese Journal of Animal andVeterinary Sciences,2011,42(6): 885-891. (in Chinese)
[17] PLATT G S,WAY H J,BOWEN E T,SIMPSON D I,HILL M N,KAMATH S,BENDELL P J,HEATHCOTE O H. Arbovirus infections in Sarawak,October 1968--February 1970 Tembusu and Sindbisvirus isolations from mosquitoes. Annals of Tropical Medicine and Parasitology,1975,69(1):65-71.
[18] LEAKE C J,USSERY M A,NISALAK A,HOKE C H,ANDRE R G,BURKE D S. Virus isolations from mosquitoes collected during the 1982 Japanese encephalitis epidemic in northern Thailand. Transactions of the Royal Society of Tropical Medicine & Hygiene,1986,80(5): 831-837.
[19] PANDEY B D,KARABATSOS N,CROPP B,TAGAKI M,TSUDA Y,ICHINOSE A,IGARASHI A. Identification of a flavivirus isolated from mosquitos in Chiang Mai Thailand. Southeast Asian Journal of Tropical Medicine and Public Health,1999,30(1):161-165.
[20] KONO Y,TSUKAMOTO K,ABD H M,DARUS A,LIAN T C,SAM L S,YOK C N,DI KB,LIM K T,YAMAGUCHI S,NARITA M. Encephalitis and retarded growth of chicks caused by Sitiawan virus,a new isolate belonging to the genus Flavivirus. American Journal of Tropical Medicine And Hygiene,2000,63(1-2):94-101.
[21] YUN T,ZHANG D,MA X,CAO Z,CHEN L,NI Z,YE W,YU B,HUA J,ZHANG Y,ZHANG C. Complete genome sequence of a novel flavivirus,duck tembusu virus,isolated from ducks and geese in china. Journal of Virology,2012,86(6):3406-3407.
[22] TANG Y,DIAO Y,YU C,GAO X,JU X,XUE C,LIU X,GE P,QU J,ZHANG D. Characterization of a Tembusu virus isolated from naturally infected house sparrows (Passer domesticus) in Northern China. Transboundary and Emerging Diseases,2013,60(2):152-158.
[23] 温立斌,张福军,王玉然,杨桂芝,马志华,解建平,杨浩. 鸭病毒性脑炎(暂定)病原分离与鉴定的初步研究. 中国兽医杂志,2001,37(2): 3-4. WEN L B,ZHANG F J,WANG Y R,YANG G Z ,MA Z H,XIE J P,YANG H. Prelim inary studies on isolation and identif ication of a new virus causing encephalitis in ducks. Chinese Journal of Veterinary Medicine,2001,37(2): 3-4. (in Chinese)
[24] 谢佳,韩春华,林健,段会娟,杨志远,赵际成,潘洁,刘月焕. 鸭出血性卵巢炎病毒血症研究. 中国农业科学,2014,47(23): 4763-4768. XIE J,HAN C H,LIN J,DUAN H J,YANG Z Y,ZHAO J C,PAN J,LIU Y H. Study on Viremia of the Ducks Infected with DHOV-HB Strain. Scientia Agricultura Sinica,2014,47(23):4763-4768. (in Chinese)
[25] 解瑞钦,李宁,刘思当,张清林. 鸭坦布苏病毒对 7周龄鸭的致病性研究. 山东畜牧兽医,2015,36(07):1-3. XIE R Q,LI N,LIU S D,ZHANG Q L. Study on pathogenicity of duck Tembusu virus in 7 week old duck. Shandong Journal of Animal Science and Veterinary Medicine,2015,36(07):1-3. (in Chinese)
[26] 林健,韩春华,陈华林,蒋桃珍,梁武,何平有,杨保收,王英,韩婧雯,刘东艳,潘洁,段会娟,丁佩佩,胡胜强,刘月焕. 鸭出血性卵巢炎实验感染模型的建立. 中国农业科学,2011,44(10): 2161-2167. LIN J,HAN C H,CHEN H L,JIANG T Z,LIANG W,HE P Y,YANG B S,WANG Y,HAN J W,LIU D Y,PAN J,DUAN H J,DING P P,HU S Q,LIU Y H. Establishment of experimental infection model of duck hemorrhagic ovaritis. Scientia Agricultura Sinica,2011,44(10): 2161-2167. (in Chinese)
[27] 罗玲,温国元,杨峻,罗青平,王红琳,艾地云,张蓉蓉,苟妙,邵华斌. 鸭黄病毒感染病例的病理组织学观察. 动物医学进展,2012,33(02):129-132. LUO L,WEN G Y,YANG J,LUO Q P,WANG H L,AI D Y,ZHANG R R,GOU M,SHAO H B. Histopathological observation of ducks infected naturally with duck flavivirus. Progress in Veterinary Medicine,2012,33(02):129-132. (in Chinese)
(责任编辑 林鉴非)
Criterion of Ovarian Lesions of Duck Tembusu Virus Disease
LIN Jian1,YANG Zhi-yuan1,HE Ping-you2,DUAN Hui-juan1,ZOU Li-hong2,YANG Bao-shou2,ZHAO Ji-cheng1,PAN Jie1,WANG Xiao-lei1,LIU Li-xin1,LIU Yue-huan1
(1Institute of Animal and Husbandry Medicine,Beijing Academy of Agriculture and Forestry Sciences,Beijing100097;2Ringpu(Baoding) Biological Pharmaceutical Co.,LTD,Baoding 071000,Hebei)
【Objective】The objective of this study is to understand the process and regularities of ovarian lesions on ducks infected with Duck Tembusu virus,and to provide data for the efficiency evaluation of vaccine using laying ducks ovary pathological inspection. 【Method】 Seventy 260-day-old laying cherry ducks were inoculated intramuscularly with Duck Tembusu virus (HB strain)at dosage of 0.5mL(100 DID50)/duck. Clinical symptoms were observed,and the egg production and feed intake were recorded daily. Serum samples were collected from all ducks for virus isolation via wing vein on 2 days post inoculation (dpi). Each serum sample was inoculated into five 6-day-old SPF chicken embryos via yolk-sac route at the inoculum of 0.1 mL per embryo. Then they werehatched at 37℃ further. The chicken embryos died in 24h were abandoned. The viral nucleic acid was detected by RT-PCR in the death chicken embryos during 24-72 h. If there were more than one (including one) death chicken embryos,and the nucleic acid testing was positive,then it was concluded that virus isolation was positive. On 4-10 dpi,10 ducks were necropsied and the gross lesions of the reproductive system were observed every day. The pathologic rate was calculated,and the gross lesions of the reproductive system were conducted including whether there were eggs in the fallopian tube,whether the follicle was deformed,hemorrhaged or ruptured or not. According to the statistical pathologic rate,the time,the content of the examination and the criterions for determining lesion ovary were confirmed. 【Result】 (1) Feed intake and egg production decreased significantly on 3-6 dpi. The mental state of the duck on 7 dpi improved,and feed intake began to rise on 8 dpi. (2) Virus isolation of 70 ducks were all positive except one duck. The virus positive isolation rate was 98.6% (69/70) on 2 dpi. (3) On 4-10 dpi,a total of 64 laying duck reproductive organs can be determined. (4) On 4-10 dpi,the ovarian lesions rate were 66.7% (6/9),100% (10/10),100% (10/10),100% (9/9),100% (9/9),100% (9/9) and 100% (8/8) respectively. (5) Eggs were found in fallopian tube of 2 ducks among 10 ducks that were necropsied on 4 dpi,and there was no egg found in fallopian tube of the remaining 62 ducks. The egg negative rate was 96.9(62/64). (6) On 4-10 dpi,the proportion of deformed follicular duck and hemorrhaged follicular duck were both 96.9% (62/64),and the proportion of deformed and hemorrhaged follicular duck was 95.3%(61/64),while the proportion of ruptured follicular duck was 34.4% (22/64).【Conclusion】 (1) The time for the examination of the pathological changes of ovary was determined as 7 to 8 dpi. (2) The criterion of abnormal follicle is that one of the lesions of deformation and hemorrhage or both were found. The criterion of lesion ovary is that three abnormal follicles or more appeared and no egg in the fallopian tube.
duck tembusu virus disease; ovary; pathological change
2015-12-21;接受日期:2016-05-17
国家自然科学基金(310721597)、北京市自然科学基金(6072011)、北京市农林科学院创新能力建设专项(KJCX201104001)、北京市农林科学院青年基金(QNJJ201516)
联系方式:林健,Tel:010-51503475;E-mail:dblinjian@sina.com。通信作者刘月焕,Tel:010-51503475;E-mail:liuyuehuan@sina.com
