不同培养体系对鼠-猪异种嵌合胚胎发育和嵌合能力的比较
2016-09-19王颖任吉龙宋玉然海棠周琪刘忠华
王颖,任吉龙,宋玉然,海棠,周琪,刘忠华
不同培养体系对鼠-猪异种嵌合胚胎发育和嵌合能力的比较
王颖1,2,任吉龙2,宋玉然2,海棠2,周琪2,刘忠华1
1 东北农业大学 生命科学学院,黑龙江 哈尔滨 150030 2 中国科学院动物研究所 干细胞与生殖生物学国家重点实验室,北京 100101
近年来,随着干细胞分化与再生医学研究的不断深入,异种嵌合已成为当前干细胞和再生医学领域的热点问题,并有望为未来解决器官移植供体来源严重短缺等再生医学难题开辟新的方向。异种嵌合以及异种器官再造过程中面临众多科学问题和技术难题,而异种嵌合过程中嵌合胚胎时期的选择,后续培养液的选择以及这些环节所造成的供体细胞与受体胚胎之间的发育平衡成为建立异种器官再造的第一个科学问题。猪由于具有与人类器官大小相似、繁殖快等特点,成为异种嵌合最适合的潜在研究对象。为了提高鼠-猪异种嵌合胚胎中小鼠供体细胞——诱导多潜能干细胞 (Induced pluripotent stem cells, iPSCs) 的存活率和增殖率,我们尝试以iPSCs培养液 (N2B27) 以及N2B27→PZM-3梯度更换的培养液 (N2B27(3.5 h)) 作为研究异种嵌合胚胎体外发育培养的对象,并与猪胚胎培养液 (PZM-3,Porcine zygotic medium)体系下发育进行比较,从而评价了这3种培养液在8-细胞和囊胚期注射后,对嵌合胚胎后续发育的影响及嵌合情况。结果显示,8-细胞期注射后,PZM-3不仅对嵌合胚胎的后续发育较为有利,更有利于小鼠iPS嵌合到猪胚胎中;囊胚期注射后3种培养体系下GFP阳性嵌合率差异不显著,但其嵌合率显著低于8-细胞期嵌合率。结果表明,PZM-3培养体系更有利于鼠-猪异种嵌合胚胎的体外发育,对8-细胞期胚胎进行嵌合操作有益于提高鼠-猪异种嵌合后胚胎的嵌合率。
异种嵌合,诱导性多潜能干细胞,嵌合注射,体外发育,猪
嵌合体 (Chimera) 是由不同遗传组成的细胞或者组织构成的嵌合生物个体。随着对发育生物学和干细胞领域研究的不断深入,嵌合个体的制备已成为研究干细胞体内分化能力的有效方法之一[1]。通过四倍体嵌合补偿技术获得诱导性多潜能干细胞 (Induced pluripotent stem cells, iPSCs) 来源的小鼠[2-3],使得四倍体嵌合成为干细胞多能性检测的“金标准”。目前除小鼠外,大鼠[4]、兔[5]、羊[6]和牛[7]、猪[8]等哺乳动物已获得嵌合个体,这对胚胎细胞发育分化的研究和特殊物种基因保存、动物育种、生产转基因动物研究等众多领域都具有广泛的应用价值。此外,由嵌合体本质属性——组织嵌合所衍生而来,通过物种间嵌合体的制备,研究其组织、器官在生理、生化、代谢水平甚至疾病病理、发病模式的遗传相关性的问题,近年来已逐渐成为广大研究学者关注的新热点。目前,已得到成活的异种嵌合体有山羊-绵羊嵌合体[9]、小鼠-大鼠嵌合体[10]、黄牛-水牛及马-斑马属间嵌合体,以及小鼠-人[11],小鼠-猴子嵌合胎儿[12];除此之外,已有报道表明,利用大鼠ES/iPS的全能性对胰腺器官缺陷小鼠模型进行胚胎嵌合补偿,获得了大鼠胰腺对缺陷小鼠补偿的成活小鼠个体[13],并通过卵裂球嵌合方法,使胰腺缺陷猪胚胎获得了由不同遗传背景正常猪胚胎发育而来的猪胰腺,出生后能够正常存活的猪只个体[14],这些胰腺器官伴随着胚胎个体发育而分化、成熟,并在异源缺陷个体体内发挥正常的生理作用。由此可见,异种嵌合动物的研究可以为未来探索临床医学疾病的发病机理带来新方向和新方法,尤其为解决目前器官移植面临的诸多问题提供了新的治疗方案[15]。
小鼠作为一种常用的啮齿类模式动物,成为众多学者和研究人员热衷的研究对象,针对其细胞多能性的研究也较为透彻。猪,作为一种重要的偶蹄类实验动物模型,因其在解剖学、生理学以及器官发育和疾病作用机制方面与人类有诸多相似性,近年来成为人类疾病在临床前研究以及未来器官替代来源等方面较为理想的动物模型。因此,以猪、鼠这两种亲缘较远的模式动物作为研究异种嵌合体的对象,对研究异种嵌合体特异性生理生化和疾病机理,未来灵长类动物-猪异种嵌合动物的生产,甚至是在猪体内得到人源化器官奠定基础。模拟人类自体免疫系统对异源 (种) 组织、细胞的免疫攻击作用,以及新药物开发、毒性检测等,具有重要的临床前研究价值。
制备嵌合体的常用方法主要有聚合法和显微注射法。聚合法是将目的干细胞或发育阶段的胚胎 (8-细胞期) 与去除透明带的早期胚胎 (4-,8-细胞期或桑椹期的胚胎) 置于培养微环境,利用细胞/胚胎-胚胎表面分子相互作用并伴随胚胎发育进程发育至嵌合个体的方法[16-18]。由于胚胎聚合法耗时较长,且对培养条件要求较高,因此,目前实验制备过程多选用显微注射法[19]。显微注射法是指通过显微操作将目的干细胞注入早期胚胎 (8-细胞、桑椹、囊胚期) 从而得到嵌合体的方法,其中,因桑椹胚期是由8-细胞向囊胚发育的中间胚胎状态,在生成过程中卵裂球高度致密化,而在操作过程中可能会对胚胎造成损伤,造成因实验操作而导致胚胎死亡率升高。因此,在实际操作中主要以8-细胞、囊胚期注射制备嵌合体较为常用。
本研究以小鼠iPSCs为嵌合供体细胞,对猪8-细胞、囊胚期胚胎进行显微注射后,分别于猪胚胎培养液 (PZM-3),小鼠iPSCs培养液 (N2B27) 以及在N2B27培养3.5 h后转移至PZM-3 (N2B27(3.5 h)) 3种培养体系培养,并分析、比较了8-细胞、囊胚期注射方法在3种体外发育体系下对鼠-猪异种嵌合胚胎体外发育及嵌合率的影响,并用胚胎体外贴壁方法对鼠-猪异种嵌合胚胎中小鼠多能性维持进行了初步探索,以期对后续异种嵌合发育过程中细胞功能提供初步证据。
1 材料与方法
1.1 材料
本研究所用猪卵巢来自北京市第五肉联集团有限公司。小鼠iPSCs来源于本研究组。
1.2 方法
1.2.1 小鼠iPSCs的培养及传代
实验所用iPSCs系为1011,是由B6D2F1小鼠成纤维细胞诱导得到的Oct4-GFP表达的多潜能干细胞系。其培养方法为复苏1011细胞于丝裂霉素C预先处理得到的小鼠胎儿成纤维细胞来源的饲养层上,所用培养液为N2B27(成分详见Gu等[20]实验方法),每日换液;培养至第3天,用Tryple消化并吹打,按1∶3比例重新接种于新鲜铺被饲养层上,完成传代培养。
1.2.2 卵母细胞成熟培养及孤雌激活
从屠宰场获得猪卵巢置于装有提前预热至30−35 ℃的生理盐水 (含青霉素和硫酸链霉素) 的保温桶里2 h内运回实验室。抽取卵巢表面直径为3−6 mm卵泡,收集内容物 (含COCs、卵泡液、颗粒细胞等) 用HEPES-缓冲液 (PVA-TL-HEPEs)洗涤沉淀5 min;重复2遍后,在倒置显微镜下挑取包裹带有完整卵丘细胞层的卵母细胞,用口吸管捡出放于38.5 ℃、5% CO2进行成熟培养。成熟培养液为改进的TCM199加10%卵泡液。成熟培养42−44 h后,于1 mg/mL透明质酸酶中吹打至卵丘细胞完全脱离,挑取卵周隙明显、胞质均匀、第一极体形态良好卵母细胞备用。将挑选得到的成熟卵母细胞依次放于预先浸于融合液的电极间,用直流电击 (1.2 kV/cm,30 μs,2次脉冲) 对卵母细胞进行孤雌激活,激活后的胚胎放于PZM-3中38.5 ℃、5% CO2培养,所用融合液为含1.0 mmol/L Ca2+和0.1 mmol/L Mg2+的3%甘露醇溶液;融合仪为德国Eppendorf公司的22331系统。
1.2.3 显微注射1011细胞系
选取生长良好的1011细胞集落,Tryple消化作用2−3 min,,吹打至单个细胞,放置于预先1%明胶铺被的皿中,37 ℃、5% CO2处理20 min去除饲养层细胞,制备iPSCs细胞悬液作为嵌合供体细胞备用。挑取孤雌激活后3 d的8-细胞期胚胎,及6 d囊胚期胚胎用于嵌合胚胎受体,将iPSCs和胚胎受体放于操作液中,固定针吸取胚胎,注射针吸取8−10个细胞,注射入8-细胞期胚胎透明带下的卵裂球间隙或囊胚腔中。所用固定针内径为30 μm,注射针直径为20 μm,操作液为含5 mg/mL BSA的TCM199,显微操作系统为Eppendorf的NKⅡ。
1.2.4 嵌合胚胎的体外培养
操作后胚胎分别放于PZM-3、N2B27,以及N2B27培养3.5 h后转入PZM-3这3种培养体系,38.5 ℃、5% CO2继续培养。孤雌激活当天为d0,培养至d7统计各个培养体系下囊胚数目,显微镜下观察绿色荧光的嵌合表达情况。
1.2.5 荧光分析统计嵌合率
将不同培养体系下收集得到的囊胚于4% PFA (多聚甲醛) 过夜固定,0.05% Triton透膜后,用10 mg/L Hoechst33342染色,压片后于激光共聚焦显微镜 (德国蔡司公司) 下观察。
1.2.6 单囊胚DNA提取及PCR检测
1011细胞系,猪野生型组织分别按DNA提取试剂盒 (天根试剂盒) 提取DNA,挑取各个实验组囊胚以及注射后未培养的d6囊胚进行单囊胚DNA提取,具体方法可参考Wang等[21]实验步骤;以小鼠基因序列特异引物 (表1) 进行PCR测定,实验所得数据采用GraphPad Prism5软件中通用程序中2WAY ANOVA进行统计分析。
表1基因特异引物序列
Table 1 Primer sequences ofgene

1.2.7 嵌合囊胚体外贴壁及观察
将PZM-3培养体系下,d7嵌合囊胚去透明带后接种于预先铺被的饲养层上,培养5 d后显微镜下观察其贴壁情况、每天换液,并注意观察其荧光表达情况。所用显微镜为倒置显微镜DMI 3000B (德国LEICA公司),荧光激发器EL6000。
2 结果与分析
2.1 鼠-猪8-细胞期嵌合胚胎在3种培养体系下发育率的比较
以猪孤雌8-细胞期胚胎为胚胎受体,小鼠iPSCs (1011细胞系) 为嵌合供体细胞 (图1A) 显微操作后分别培养于N2B27、PZM-3、N2B27 (3.5 h) 这3种培养体系培养,以未注射的猪孤雌8-细胞期胚胎为对照,每组120枚胚胎,各重复3次,到d7统计发育数据。结果如图1B所示,N2B27培养体系下,大部分胚胎发育停滞,未能发育至囊胚;PZM-3培养体系下嵌合胚胎的囊胚率显著 (<0.05) 高于N2B27 (3.5 h)体系 (22%±2.6% vs 3.3%±1.5%),证明其对嵌合胚胎的后续发育较为有利。
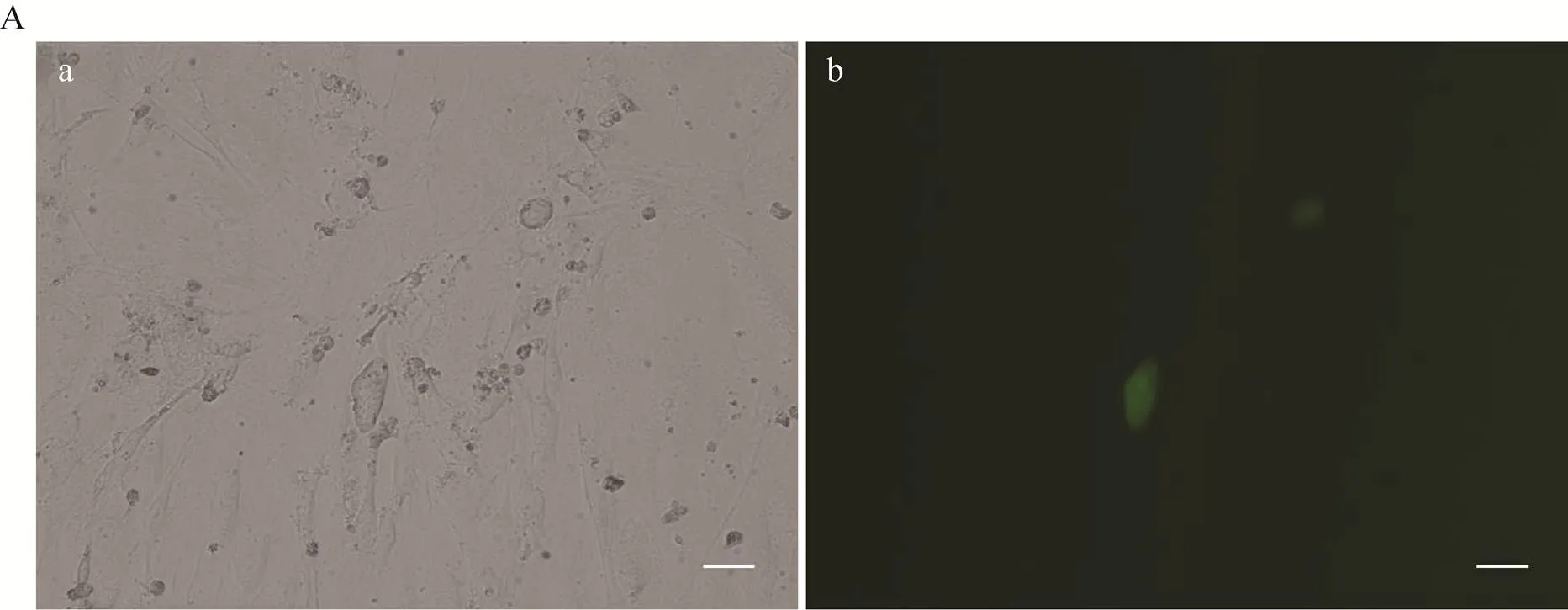
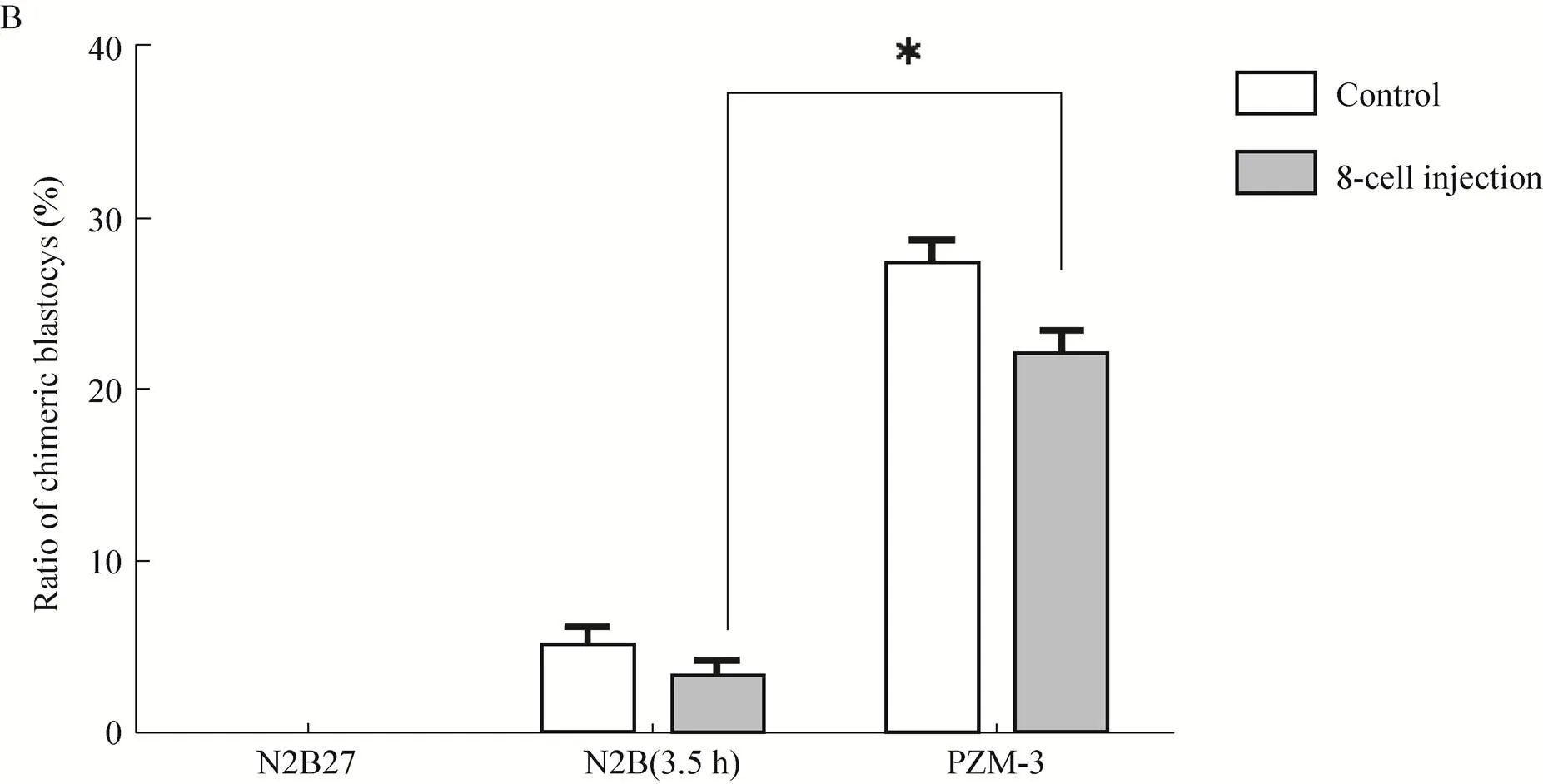
图1 嵌合供体细胞及不同体系下8-细胞注射发育情况
2.2 8-细胞期、d6囊胚期注射在不同培养体系下小鼠细胞增殖情况及嵌合率比较
8-细胞期、d6囊胚期胚胎分别注射8−10个miPSCs后进行培养至d7,于荧光显微镜下进行形态学观察 (图2)。为精确确定GFP阳性细胞比例,收集不同培养体系下2种嵌合注射时期发育得到的囊胚,通过4% PFA固定,Hoechst细胞核染色,封片,观察后统计、比较不同培养体系培养下的小鼠GFP阳性细胞在异种嵌合囊胚的占比 (嵌合率)。结果如表2所示,8-细胞注射后,GFP阳性细胞均有不同比例增殖,PZM-3嵌合率显著高于N2B27 (3.5 h) 体系培养体系 (<0.001),且如图3所示,内细胞团 (Inner cell mass, ICM) 中有GFP荧光表达细胞分布,值得注意的是,N2B27体系下所检测均为囊胚类似物,其GFP荧光表达较强,而猪胚胎细胞很少;囊胚期注射后,GFP阳性细胞增殖能力较差,且在3种培养体系下嵌合率差异不显著。
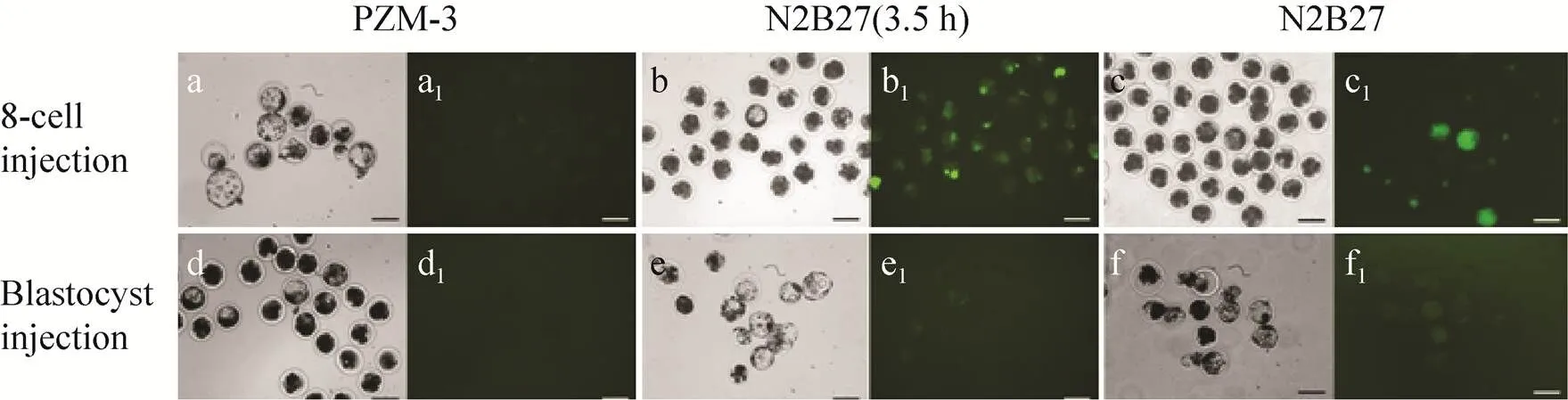
图2 8-细胞、囊胚期嵌合注射后在3种培养体系下体外发育及GFP蛋白表达结果 (100 μm)
表2 不同胚胎嵌合时期和培养体系对嵌合胚胎内小鼠iPSCs细胞增殖及嵌合比率的影响(±)
Table 2 Numbers of mouse iPSCs and chimeric rates in chimeric embryos at different chimeric stages & in different culture systems (±)
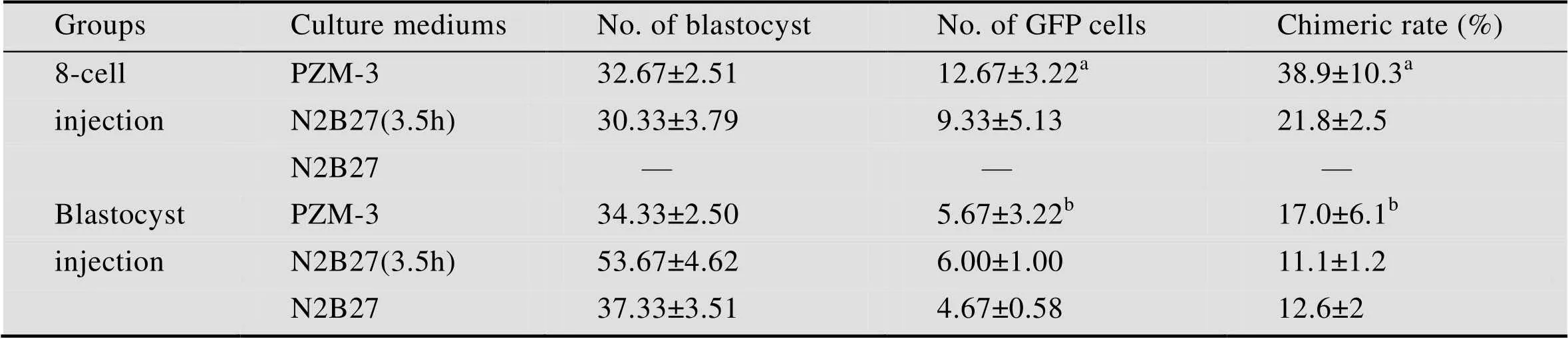
Different superscripts in the same column show significant differences; a, b indicate<0.001.
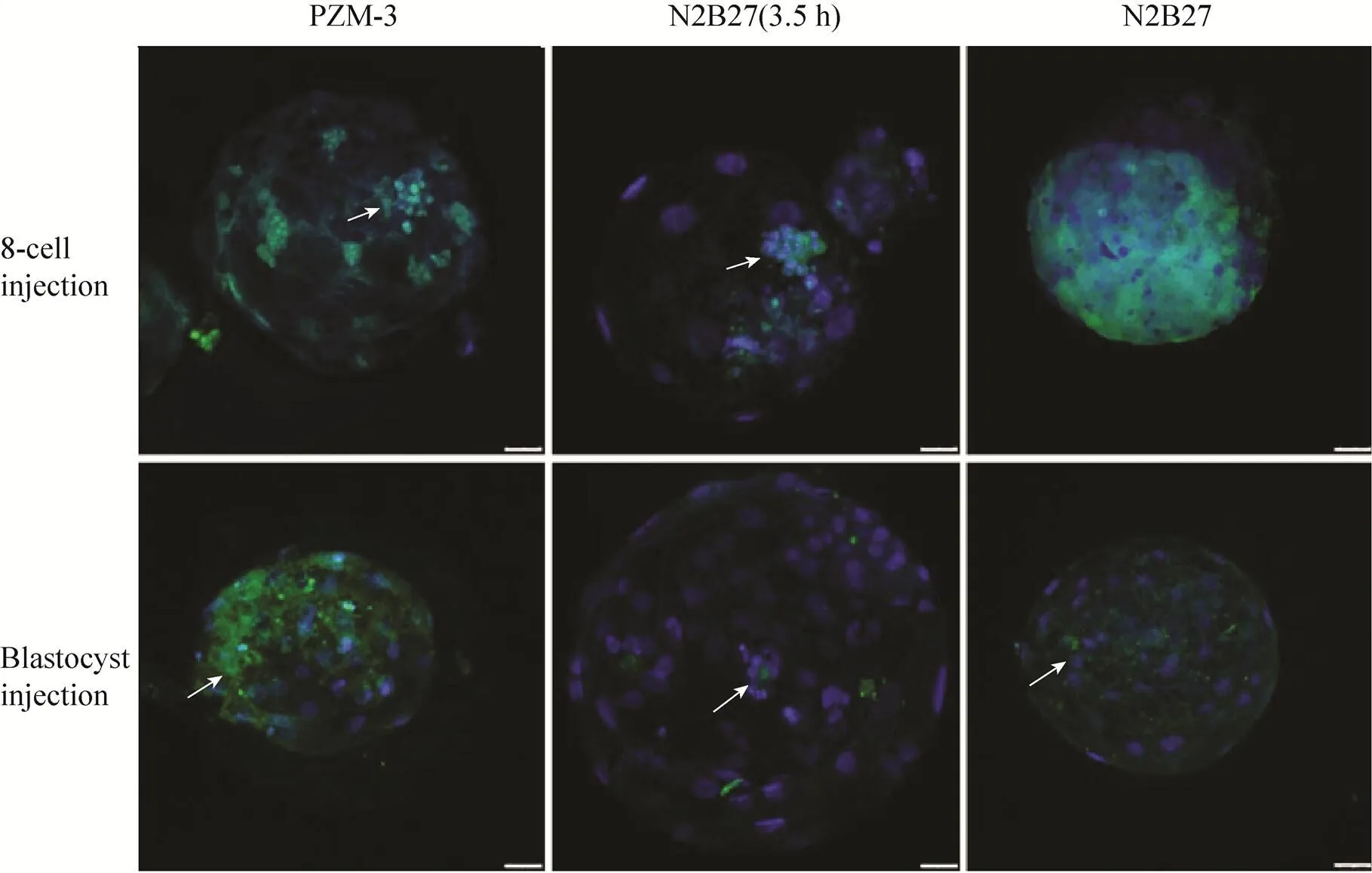
图3 体外不同发育体系下囊胚嵌合情况
2.3 鼠-猪嵌合胚胎的DNA鉴定
分别收集3种培养体系下8-细胞期注射得到的d7囊胚,囊胚期嵌合操作培养前、后的胚胎为实验组,进行单囊胚DNA提取,以小鼠基因设计特异性引物,进行嵌合胚胎的PCR检测,同时以嵌合供体细胞系1011、猪野生型DNA为对照。结果见图4所示,实验组均不同程度的检测到小鼠特异性序列的存在,同1011阳性对照组检测结果一致。
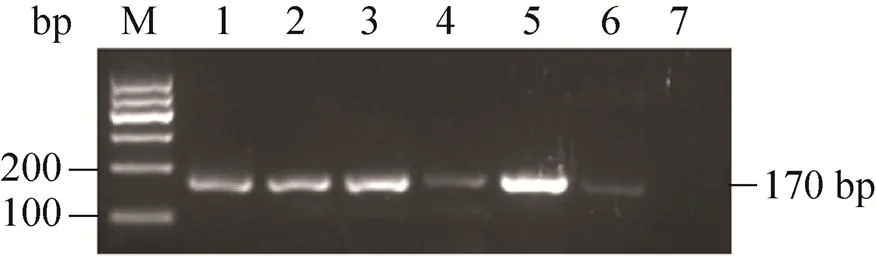
图4 嵌合单囊胚DNA检测结果
2.4 鼠-猪嵌合胚胎的建系
为研究鼠-猪异种嵌合胚胎培养体系对小鼠来源iPSCs潜能性的影响,将8-细胞期胚胎注射后得到的d7囊胚,消化去除透明带,接种于饲养层上进行胚胎贴壁培养,于N2B27培养5 d,结果如图5所示,可见嵌合胚胎贴壁后形成的细胞集落,从形态学角度来讲,该形态既不同于小鼠iPSCs克隆形态,也不同于猪ICM贴壁后形成的细胞集落,因此,可能是猪与小鼠2种细胞所形成的混合状态,且小鼠来源Oct4-GFP荧光表达细胞增殖较快且分布集中,表明体外异种嵌合胚胎培养体系可以支持小鼠iPS潜能性的维持。
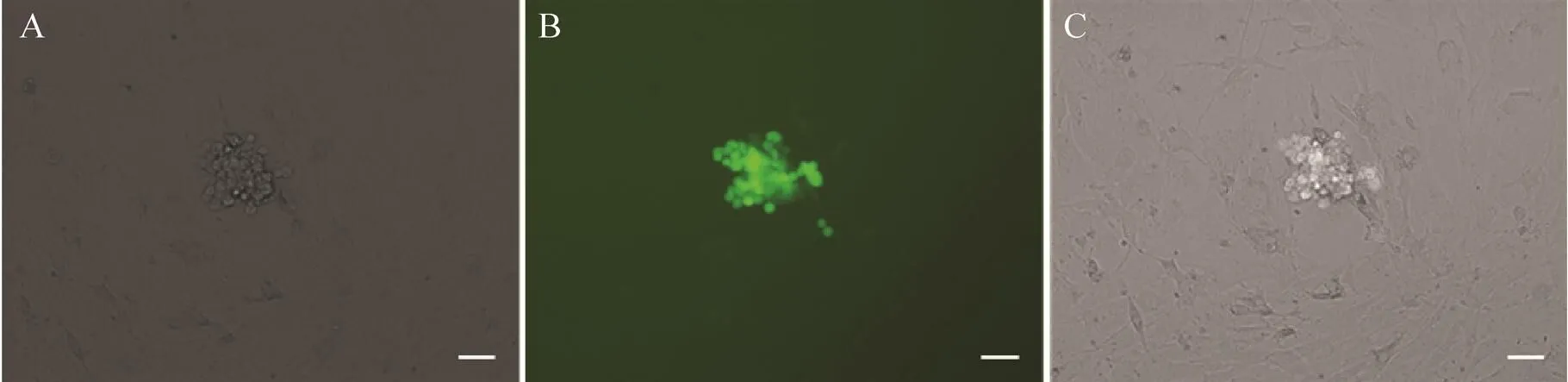
图5 嵌合囊胚贴壁7 d观察 (50 μm)
3 讨论
嵌合体,是由不同遗传组成有机整合形成的统一个体。应用嵌合体的这一属性,对嵌合体的研究,甚至是人-动物异种嵌合模式,可以为研究临床疾病的发病机理带来新的研究方向和方法,为未来器官移植提供新的治疗方案[22]。然而,由于目前得到的人源多潜能性干细胞潜能还存在一定的局限性,且人-动物异种嵌合动物势必会涉及伦理学问题[23],以及异种嵌合可能会涉及到制备方法的选择、胚胎发育时程差异、异源组织、器官之间可能发生的免疫排斥反应[24]等问题,解决这些相关问题还需要进一步摸索和研究。因此,选择实验动物之间进行异种嵌合研究较为适宜。其中,猪作为重要的农畜类动物之一,由于其与人类具有极为相似的解剖学、生理学和遗传学特征[25],已作为探究人类生命科学以及疾病机理不可或缺的模式生物;而小鼠作为最普遍、常用的模式动物,在干细胞多能性维持及分化等方面的研究较为深入。因此,以猪、鼠两种模式动物作为异种嵌合研究具有重要的生物学意义。本研究以小鼠iPSCs作为嵌合供体细胞,猪孤雌激活后胚胎为嵌合受体胚胎,探索8-细胞、囊胚期两个时期注射后形成的嵌合胚胎在体外3种培养体系中的发育、嵌合情况及小鼠iPSCs在嵌合胚胎内多能性维持等问题。
已有研究发现,嵌合体体内嵌合效率的高低与供、受体种系[26]及嵌合胚胎受体时期 (8-细胞[18]、桑椹胚[17]以及囊胚阶段的胚胎[16]) 有关,哺乳动物传统发育生物学研究发现,8-细胞时期胚胎由于来源于4-细胞胚胎期的均等分裂,其各个卵裂球仍具有全能性;当进入桑椹期,胚胎内各细胞因位置及连接因子的变化已开始发生早期分化,且细胞连接致密化;随着细胞的进一步分裂,并按照膜表面分子特异表达进行重排,继而出腔形成具有胚胎发育潜能的内细胞团 (Inner cell mass, ICM) 和与母源组织进行接触的胚外组织——上滋外胚层 (Trophectoderm, TE)。因此,目前普遍认为8-细胞及囊胚期胚胎作为小鼠嵌合体的供体胚胎是较为适宜的。一些研究组通过比较这两种时期胚胎对嵌合体生成的影响,发现以8-细胞胚胎进行嵌合注射得到的嵌合小鼠会获得较高的嵌合体,与囊胚期嵌合相比甚至可以获得更高的嵌合率 (80% vs 20%),尤其在生殖系内[27]。然而,由于猪胚胎干细胞面临着建系难度大、多能性差[28]等诸多问题,无法有效开展猪嵌合体的研究。近年来随着iPSCs研究的兴起,为猪多能性干细胞的建立另辟蹊径,2010年,首次获得iPSCs嵌合猪个体,但未能嵌合进入生殖嵴[29];2013年,虽然通过调整重编程因子以转换猪iPSCs的多能性状态,但只得到嵌合胎儿[30]。因此,猪嵌合体研究目前仍然因为无法得到与小鼠ES多能性相媲美的多能干细胞而停滞不前。本实验基于传统发育生物学理论研究,并借鉴对小鼠嵌合体制备方法的认识,通过对8-细胞、囊胚期猪孤雌胚胎与小鼠iPSCs的异种嵌合操作,研究这两种注射于不同胚胎时期的嵌合胚胎,在不同体外培养体系的体外发育情况。结果发现,8-细胞期注射后,维持小鼠iPSCs潜能及增殖能力的培养体系——N2B27,不能维持嵌合胚胎的后续发育,表现为发育阻滞,而iPSCs在胚胎透明带下无限增殖进而形成类囊胚结构;为促进嵌合供体iPSCs的早期增殖,体外N2B27处理3.5 h后再进入PZM-3培养后,发现iPSCs增殖不显著,而对8-细胞期胚胎的后续发育有一定负面影响 (嵌合囊胚率3.3%±1.5% vs 对照组囊胚率5.0%±2.0%);PZM-3培养体系下,嵌合囊胚能够正常发育,且伴随荧光的适量表达,由于显微操作会对胚胎造成一定损伤的原因,嵌合囊胚率略低于对照组 (22%±2.6% vs 27.3%±2.5%) (图1B),但显著高于以上两组平行实验发育率。由此可以看出,对8-细胞期猪胚胎进行异种嵌合注射,PZM-3培养是维持嵌合胚胎体外发育的重要培养条件。
继而发现,影响异种嵌合胚胎的嵌合程度的高低主要取决于受体胚胎发育是否与供体细胞增殖相平衡。在研究对两种胚胎时期嵌合注射后,异种嵌合胚胎在3种培养体系下嵌合率的比较后发现,3种培养体系下发育得到的囊胚均有不同程度嵌合,尤其在ICM内有iPSCs嵌合表达,其中,囊胚期注射得到的嵌合胚胎在3种培养体系下GFP阳性嵌合比率差异不显著; 8-细胞期嵌合胚胎在PZM-3的嵌合率 (38.9%±10.3%)显著高于其他两种培养体系 (N2B27(3.5 h),21.8%±2.5%;N2B27,0),这可能与8-细胞期胚胎相对于早期囊胚期而言,胚胎发育的必需营养因子对维持其后续发育进程至关重要,且在8-细胞期进行嵌合注射为iPSCs延长了增殖时间,这可能是8-细胞期注射优于囊胚期注射的原因之一;其次,在最适于猪胚胎发育的PZM-3体系下,8-细胞期注射组的嵌合率明显优于囊胚期注射组,这可能说明:异种嵌合胚胎体外发育过程中,选择处于发育早期的8-细胞期作为嵌合受体胚胎可能为小鼠iPSCs提供更为适宜的生长、增殖内环境,利于iPSCs伴随胚胎后续发育与胚胎进行有机嵌合;而对早期囊胚注射后,iPSCs的增殖及嵌合程度不显著,这可能与嵌合胚胎的内环境改变有关。
进一步地,通过对体外鼠-猪异种嵌合囊胚的重新建系,研究异种嵌合胚胎体外发育体系对小鼠iPSCs潜能性的影响,结果发现,从形态学角度上,得到的鼠-猪ESCs簇不同于小鼠iPSCs克隆形态,这可能与猪胚胎ICM与小鼠iPSCs在胚胎发育进程中进行细胞重排,及异源细胞表面分子相互作用存在差异有关,并且,小鼠iPSCs来源的荧光细胞在重建的集落中分布较为集中,表明小鼠来源iPSCs潜能性在异种嵌合胚胎体外发育体系得以维持,并伴随猪胚胎发育进程而生长、增殖。这一发现,为PZM-3有利于鼠-猪异种嵌合胚胎中鼠源细胞的潜能性维持提供佐证,为鼠-猪异种嵌合体的进一步研究提供了重要理论基础。
异种嵌合研究,无疑成为当前干细胞在再生医学研究的新课题,对解决修复受损器官及可供移植器官短缺等重大临床医学问题具有重要意义。本研究通过大量实验数据表明,8-细胞期嵌合注射并在PZM-3培养条件下更有利于嵌合细胞的增殖及鼠-猪嵌合胚胎发育。本研究将为异种嵌合的后续研究提供良好的数据基础,为下一步实现异种嵌合体的生成甚至异种嵌合体在临床医学的研究奠定了基础。
REFERENCES
[1] Bai ZD, Shen H. Generation of mouse chimeras from embryonic stem cell and influencing elements involved. J Reprod Med, 2007, 16(6): 444–447 (in Chinese). 白照岱, 沈和. 胚胎干细胞嵌合体小鼠的制备及其影响因素. 生殖医学杂志, 2007, 16(6): 444–447.
[2] Zhao XY, Li W, Lü Z, et al. iPS cells produce viable mice through tetraploid complementation. Nature, 2009, 461(7260): 86–90.
[3] Kang L, Wang JL, Zhang Y, et al. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell, 2009, 5(2): 135–138.
[4] Mayer JF, Jr., Fritz HI. The culture of preimplantation rat embryos and the production of allophenic rats. J Reprod Fertil, 1974, 39(1): 1–9.
[5] Gardner RL, Munro AJ. Successful construction of chimaeric rabbit. Nature, 1974, 250(5462): 146–147.
[6] Tucker EM, Moor RM, Rowson LE. Tetraparental sheep chimaeras induced by blastomere transplantation. Changes in blood type with age. Immunology, 1974, 26(3): 613–621.
[7] Brem G, Tenhumberg H, Kräußlich H. Chimerism in cattle through microsurgical aggregation of morulae. Theriogenology, 1984, 22(5): 609–613.
[8] West FD, Uhl EW, Liu YB, et al. Brief report: chimeric pigs produced from induced pluripotent stem cells demonstrate germline transmission and no evidence of tumor formation in young pigs. Stem Cells, 2011, 29(10): 1640–1643.
[9] Fehilly CB, Willadsen SM, Tucker EM. Interspecific chimaerism between sheep and goat. Nature, 1984, 307(5952): 634–636.
[10] Stern MS. Letter: chimaeras obtained by aggregation of mouse eggs with rat eggs. Nature, 1973, 243(5408): 472–473.
[11] James D, Noggle SA, Swigut T, et al. Contribution of human embryonic stem cells to mouse blastocysts. Dev Biol, 2006, 295(1): 90–102.
[12] Fang RG, Liu K, Zhao Y, et al. Generation of naive induced pluripotent stem cells from rhesus monkey fibroblasts. Cell Stem Cell, 2014, 15(4): 488–496.
[13] Kobayashi T, Yamaguchi T, Hamanaka S, et al. Generation of rat pancreas in mouse by interspecific blastocyst injection of pluripotent stem cells. Cell, 2010, 142(5): 787–799.
[14] Matsunari H, Nagashima H, Watanabe M, et al. Blastocyst complementation generates exogenic pancreasin apancreatic cloned pigs. Proc Natl Acad Sci USA, 2013, 110(12): 4557–4562.
[15] Miyamoto T, Nakauchi H. Generation of functional organs from pluripotent stem cells. Rinsho Ketsueki, 2015, 56(10): 2213–2219.
[16] Kawase Y, Iwata T, Watanabe M, et al. Application of the piezo-micromanipulator for injection of embryonic stem cells into mouse blastocysts. Contemp Top Lab Anim Sci, 2001, 40(2): 31–34.
[17] Lallemand Y, Brûlet P. Anassessment of the routes and extents of colonisation of the mouse embryo by embryonic stem cells and their descendants. Development, 1990, 110(4): 1241–1248.
[18] Tokunaga T, Tsunoda Y. Efficacious production of viable germ-line chimeras between embryonic stem (ES) cells and 8-cell stage embryos. Dev Growth Diff, 1992, 34(5): 561–566.
[19] Polejaeva I, Mitalipov S. Stem cell potency and the ability to contribute to chimeric organisms. Reproduction, 2013, 145(3): R81–R88.
[20] Gu Q, Hao J, Hai T, et al. Efficient generation of mouse ESCs-like pig induced pluripotent stem cells. Protein Cell, 2014, 5(5): 338–342.
[21] Wang XL, Zhou JW, Cao CW, et al. Efficient CRISPR/Cas9-mediated biallelic gene disruption and site-specific knockin after rapid selection of highly active sgRNAs in pigs. Sci Rep, 2015, 5: 13348.
[22] Behringer RR. Human-animal chimeras in biomedical research. Cell Stem Cell, 2007, 1(3): 259–262.
[23] Cabrera Trujillo LY, Engel-Glatter S. Human-animal chimera: a neuro driven discussion? Comparison of three leading European research countries. Sci Eng Ethics, 2015, 21(3): 595–617.
[24] Vadori M, Cozzi E. The immunological barriers to xenotransplantation. Tissue Antigens, 2015, 86(4): 239–253.
[25] Klymiuk N, Seeliger F, Bohlooly YM, et al. Tailored pig models for preclinical efficacy and safety testing of targeted therapies. Toxicol Pathol, 2015, 415(6867): 88-92.
[26] Nagy A, Gertsenstein M, Vinterste K, et al. Manipulating the Mouse Embryo: A Laboratory Manual. 3rd ed. New York: Cold Spring Harbor Laboratory Press, 2003.
[27] Poueymirou WT, Auerbach W, Frendewey D, et al. F0 generation mice fully derived from gene-targeted embryonic stem cells allowing immediate phenotypic analyses. Nat Biotechnol, 2007, 25(1): 91–99.
[28] Xue BH, Liu ZH. Porcine pluripotent stem cells: facts, challenges and hopes. Biotechnol Bull, 2015, 31(4): 82–91 (in Chinese).薛冰华, 刘忠华. 猪多能性干细胞研究进展与前瞻. 生物技术通报, 2015, 31(4): 82–91.
[29] West FD, Terlouw SL, Kwon DJ, et al. Porcine induced pluripotent stem cells produce chimeric offspring. Stem Cells Dev, 2010, 19(8): 1211–1220.
[30] Fujishiro SH, Nakano K, Mizukami Y, et al. Generation of naive-like porcine-induced pluripotent stem cells capable of contributing to embryonic and fetal development. Stem Cells Dev, 2013, 22(3): 473–482.
development and chimeric efficiency of mouse-porcine interspecies chimeric embryos in different culture systems
Ying Wang1,2, Jilong Ren2, Yuran Song2, Tang Hai2, Qi Zhou2, and Zhonghua Liu1
1,,150030,,2,,,100101,
With the advancements of stem cells and regenerative medicine, interspecies chimera has become a hot topic and will pave a new way of providing donor sources in organ transplantation. However, the interspecies chimera is confronted with a number of scientific questions and technical obstacles, including selections of appropriate embryonic stage and appropriate culture medium; those factors will deeply influence the developmental balance between donor cells and receptor embryos. Due to its relatively rapid reproductive cycle and similar organ size to human’s, porcine is a very potential donor candidate to study these questions. To compare the development and chimeric efficiency of interspecies embryos, we tested and evaluated three different culture systems, PZM-3 (Porcine zygotic medium), culture medium for iPSCs (N2B27) and 3.5 h of N2B27 before PZM-3 (N2B27(3.5 h)), and two different embryonic stages, 8-cell and blastocyst in mouse-porcine chimeric embryos using parthenogenetically activated porcine embryos and mouse induced pluripotent stem cells (miPS). The results showed that, PZM-3 was beneficial for both development of chimeric embryos and miPSCs proliferation in porcine embryos in the 8-cell injection group. After early blastocyst injection, the chimeric efficiency did not appear significantly different among the three culture systems but was lower than 8-cell injection. In summary, the results suggest that 8-cell injection and PZM-3 culture medium are more beneficial to thedevelopment and chimeric efficiency of mouse-porcine chimeric embryos.
interspecies chimera, induced pluripotent stem cells, chimeric injection, embryo development, porcine
October 15, 2015; Accepted: November 24, 2015
生物技术与方法
王颖, 任吉龙, 宋玉然, 等. 不同培养体系对鼠-猪异种嵌合胚胎发育和嵌合能力的比较. 生物工程学报, 2016, 32(7): 975–985.
Wang Y, Ren JL, Song YR, et al.development and chimeric efficiency of mouse-porcine interspecies chimeric embryos in different culture systems. Chin J Biotech, 2016, 32(7): 975–985.
Supported by: National Basic Research and Development Program of China (973 Program) (No. 2012CBA01300).
Corresponding author: Zhonghua Liu. Tel/Fax: +86-451-55191747; E-mail: liu086@126.com
国家重点基础研究发展计划 (973计划) (No. 2012CBA01300) 资助。
(本文责编 陈宏宇)
