le Chatelier原理的历史终结
2016-09-19高盘良
高盘良
(北京大学化学与分子工程学院,北京100871)
·师生笔谈·
le Chatelier原理的历史终结
高盘良*
(北京大学化学与分子工程学院,北京100871)
100多年以来,经验性的、定性的le Chatelier原理对平衡移动方向的判据经常出现错误。理论证明,le Chatelier原理有严格的条件限制,不是普遍适用的。现代既然有简便的、定量的平衡移动原理,le Chatelier原理应该退出化学教学了。
le Chatelier原理;平衡移动
1 le Chatelier原理简介
1884年,法国化学家、冶金学家le Chatelier研究鼓风炉中的反应时,仿照电磁学中的楞茨定律(感应电流的效果总是反抗引起感应电流的原因)总结出了外界条件改变对化学反应方向的影响,在“化学平衡的一般陈述”的论文中提出“任何一个稳定的化学平衡体系,当受到一种迫使它变更其温度和凝聚状态(压力、浓度)的外力时,它的整体或者是局部能够进行某种内部调节;如果这些调节是出于体系自身的话,则它所引起的将是与外力所引起的变化有着相反的符号。”后人称其为le Chatelier原理。130余年来,教科书、学术著作根据各自的理解对该原理作了各种各样的现代表述。其中比较常见的可举2种:“如果处于平衡状态的体系(一种物质或多种物质的集合体)受到扰动时这个体系将自行调整以抵消这种扰动,恢复平衡”(不列颠百科全书);“任何一个处于平衡系统,当某一确定系统平衡的因素(温度、压力、浓度等)发生改变时,系统的平衡将发生移动,平衡移动的方向是向着减弱外界因素的改变对系统的影响的方向”(中国大百科全书)。以上表述均未指出其适用的条件,而被当作普遍的法则应用,现在还盛行于教学中。然而自原理开始提出至今的100多年来,对le Chatelier原理的争议不断,其甚至被称为多余的原理。
2 le Chatelier原理的失效及其原因
100多年来,发表了许多对le Chatelier原理的批评、修正乃至反对的意见,le Chatelier本人对原理也多次修正,在此不一一列举,仅举常见的合成氨反应为例:
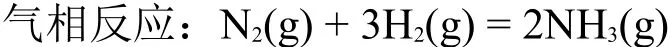
T、p一定时,Kx=8.33,其平衡组成为:n(NH3)=1.00 mol,n(H2)=1.00 mol,n(N2)=3.00 mol。保持T、p不变,当向体系中加入0.10 mol N2(g)时,按le Chatelier原理,n(N2)的增加必有利于消耗N2(g)方向反应,即平衡向右移动。事实上此时浓度商Qx=8.39>8.33=Kx,根据理论上严格的平衡移动判据的基本公式:
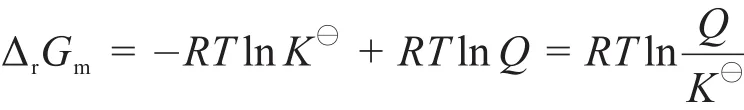
当Q>K⊖,ΔrGm>0,平衡逆向移动,即增大x(N2)及x(H2),减小x(NH3),le Chatelier原理失效了。
此外,对于复相体系或多重平衡同时存在时,le Chatelier原理也会失效,其原因在于le Chatelier原理只是一个经验性的定性叙述,含义也不十分清楚,更未指明其成立的条件,以致人们把le Chatelier原理当作判断平衡移动方向的普遍“真理”而不能自拔。
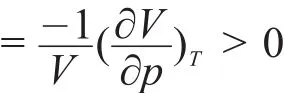
“一个稳定平衡的均相PVT封闭体系,当它与外界进行热力学相互作用时,起初只允许体系的某单一热力学量改变,体系将会离开原平衡态,此时体系中必然激发起一种热力学过程,促使体系向减弱所进行的那种热力学作用的方向转移,直到完全抵消那种作用的新平衡为止。”
这里最关键的是指出了le Chatelier原理成立的条件:没有光、电等有用功的条件下均相、封闭体系,且初始只有一个热力学量改变(如温度或压力或一个组分的浓度)。上例合成氨反应中平衡移动方向的le Chatelier原理判据失效的原因正是因开放体系,即违反了封闭体系的条件。其他如多相体系、多重平衡时应用le Chatelier原理判据讨论平衡移动方向时不能给出肯定的、正确的结论,其原因就是超越了它应用的条件.
3 若干研究成果简介
为了解决开放体系平衡移动方向问题,许多科学家进行了不懈的努力,Prigogine、katz、Heer、Geomez分别提出了自己的公式,早期的工作正如Prigogine所说:“许多科学家都想给le Chatecier原理一个全面的普遍的关系式,但这种式子即便能得到的话,它也将是十分复杂的”。本文拟就国内化学家的工作加以简单介绍。
3.1一般反应的平衡移动


3.2敞开体系浓度对反应平衡移动的影响
张索林教授等[4]自上世纪80年代以来,长期从事平衡移动的研究工作,提出了一系列研究成果,对于敞开体系引入一种或多种物质时的平衡移动可用统一的公式表示为:

式中下角II为干扰态,I为原平衡态,i为外加组分,将本文中合成氨平衡的各项数据代入可得:ln(Qx,II/Kx,I)>0,即平衡逆向移动。显然,以上研究结果建立了平衡移动的普遍公式,比le Chatelier原理前进了一大步,避免了因为不符合le Chatelier原理应用条件而误入歧途、跌入错误的陷阱。本原理尽管适用条件普遍,但过于复杂,以至在教学中(尤其在中学教学中)不实用。
4 结论
100多年来,对le Chatelier原理一直存在着争议,一种意见持完全否定的态度,另一种则企图把所有平衡移动问题全部纳入le Chatelier原理之中。我认为在肯定le Chatelier原理在判断平衡移动方向的简便性及历史功绩时,应还le Chatelier原理的本来面目,明确其应用的条件和解决问题的范围。
目前物理化学教学中已不用le Chatelier原理来讨论平衡移动方向,但在普通化学教学中仍有其影响,而在中学化学教学中则把le Chatelier原理当作法宝,在广泛地使用着,其实完全可以应用经过科学论证且非常简便的Q(广义的浓度商)与平衡常数K之比较来代替le Chatelier原理,因为新课程标准引入了平衡常数概念,为这一建议之实行建立了一个平台,多年的教学实践证明是完全可行的。在生产实践定量计算中,由于计算技术的高度发展,定性的、经验性的le Chatelier原理早就失去了其用武之地。因此,le Chatelier原理已完成了历史使命,可以放进科学史展览馆了。
[1]韩德刚,高执棣.化学热力学.北京:高等教育出版社,1997:214-217.
[2]韩德刚,高执棣,高盘良.物理化学.第2版.北京:高等教育出版社,2009:78-82.
[3]张世民.化学通报,1996,No.2,49.
[4]张索林,魏雨,童汝亭.大学化学,1986,1(3),25.
The End of le Chatelier Principle History
GAO Pan-Liang*
(College of Chemistry and Molecular Engineering,Peking University,Beijing 100871,P.R.China)
le Chatelier principle is empirical and qualitative.In fact,it often comes to incorrect results about the shift direction to restore chemical equilibrium,since introduced in 1884.It is proved theoretically that le Chatelier principle′s application conditions are very strict.The modern chemical equilibrium principle is quantitative and legible,and has been taught widely.We propose that le Chatelier principle should not be used in chemical teaching anymore.
le Chatelier principle;Shift in equilibrium
O64;G64
10.3866/PKU.DXHX201508014
,Email:gpl@pku.edu.cn
