关于热力学自发过程及其判据的讨论
2016-09-19郭子成李俊新
郭子成 李俊新 任 杰
(河北科技大学理学院,石家庄050018)
关于热力学自发过程及其判据的讨论
郭子成*李俊新任杰
(河北科技大学理学院,石家庄050018)
文章指出现有各种自发过程的判据都是在指定的约束条件下才能应用,缺乏普适性是自发过程定义多样化的引发原因。在无约束条件下将热力学第一定律代入总熵判据得出并分析讨论了总熵判据的另一种形式,结合自发过程的特点总结出了热力学变化过程中能量变化的本质,给出了自发过程的通用定义。进一步指出原总熵判据只能分辨可逆与不可逆,不能分辨自发与非自发。文章给出的总熵判据的另一种形式——封闭系统任意过程的做功能力判据具有分辨自发与非自发的能力。通过理论研讨和实际应用表明,做功能力判据与总熵判据完全等价,在相应约束条件下可还原为当前热力学中各类方向判据。填补了常见的变温过程和变压过程在以前的教科书中无自发和非自发判据的空白。以前教科书中由于自发过程定义和解释的混乱而出现的一些疑难问题,在通用定义和做功能力判据面前都能得到满意的解答。
封闭系统;任意过程;自发变化;非自发变化;做功能力;方向判据
热力学第二定律是阐释自然界热力学变化过程方向与限度的基本规律,克劳修斯不等式是热力学第二定律的具体表现形式,可适用于任何热力学变化过程方向与限度的判断。目前国内主流物理化学教科书[1-4]中给出的3个方向与限度的判据分别为:
由于3个判据中都存在“自发”这一概念,因此自发过程也成为物理化学(或热力学)课程中非常重要的概念。然而不同的教科书[1-8]中对自发过程的定义却不尽相同,甚至差别很大,这给物理化学的教学带来不便,因此一些学者对自发过程的定义及其相关判据进行讨论[13-18]。本文就这些问题发表一些看法并提出一些教学建议。
1 关于自发过程定义多样化的引发原因
1.1由顾名思义引发
“在自然条件下发生的过程就是自发过程”。这样的定义简单易懂,很容易被初学者接受,但后来人们发现它并不十分准确[15]。例如绿色植物在阳光下的光合作用,就是在自然条件下发生的,是个复杂的过程,很难从单纯的热力学角度来解释它是一个自发过程,因为过程中有光能的参与,光能被认为是非体积功的一种形式。
“自发过程的特征”是不可逆,所以“一切不可逆过程都是自发过程”。这样的概念在很多物理化学学习者的头脑中存在过。由于很多热力学教材在介绍热力学第二定律时从来都不明确提及非自发过程,因此这样的问题由来已久,已经困扰人们多年,不过近几年人们已经有了共识[16]:自发过程一定是不可逆过程,不可逆过程不一定都是自发过程,因为还有非自发过程。因此有文献[19]将不可逆过程称作“能发生过程”。能发生过程就是自然发生的或人为帮助发生的一切实际过程。
1.2由判据引发
由式(1)所示的判据告诉人们:在隔离系统中发生的一切过程都是自发的,即“一切不可逆过程都是自发过程”。严格说来,这个自发应该是大隔离系统的,而不是实际系统的,但教材中从不明确指出。
由式(2)和式(3)可知:在恒温恒容和恒温恒压条件下,无需非体积功的帮助系统能自动进行的过程为自发过程。
在学习电化学这部分内容时,人们会感觉到前述3个判据有些问题,首先是在电池和电解过程中会有非体积功存在,但是式(2)或式(3)所示的两个判据却不能用,再者是电解过程是人们公认的非自发过程,但电解过程的总熵大于零,按式(1)所示的判据判断是自发过程,又出现了矛盾。
1.3由实际过程的约束条件引发
一个热力学过程总是在一定条件下发生的,条件不同对外力帮助的理解也会不同。例如锌片与硫酸铜的置换反应:Zn(s)+Cu2+(aq)→Zn2+(aq)+Cu(s)在常温常压下是自发的,它的逆反应显然是不会自发的。电解的方法可以使该逆反应发生,但须环境对系统做非体积功,这就是非自发。环境对系统做的非体积功就是外力帮助。对于等温等容过程,由于系统的体积不变,不可能做体积功,所以外力帮助的含义也只能是环境对系统做非体积功。再如压力为2p0(p0为101325 Pa,也是环境压力)的理想气体在等温条件下膨胀为环境压力时是自发过程,而环境压力下的理想气体在等温条件下被外力直接压缩为2p0则是非自发过程,这时外界给予系统的压缩功就是外力帮助。外界还可以通过输入电功带动压缩机压缩气体,这时外界的帮助又变成了非体积功。再举一例,在常压下把一杯60°C的水放到20°C的环境中,水的降温是自发过程,而逆过程把环境温度为20°C的水升温到60°C应该是非自发过程。此非自发过程中外界给予系统的外力帮助是什么呢?这可能要看给水升温的方式。如果用电加热的方式给水升温,那么消耗的是非体积功,非体积功是外界给予系统的帮助;如果用燃料燃烧的方式给水升温,那么消耗的是热量,热量就是外界给予系统的帮助。
由上面的讨论可知,对于等温等压和等温等容过程,如果从环境做功的角度来定义自发过程,则可描述为:不需要环境供给非体积功就能发生的热力学过程。但是它不适合等温变压过程,也不适合等压变温过程,因为在这两类过程中非自发过程的发生有可能是环境对于系统做体积功引起的,也有可能是环境对于系统做非体积功引起的,还可能是环境向系统输入热量引起的。由于外力帮助的含义很复杂,所以就不适合以功的类型来定义自发过程。另外,对于等温等容过程,自发过程还可以定义为不需要环境供给功就能发生的热力学过程,因为等容过程中不做体积功,所以此种定义与用非体积功定义是一致的。然而这种以总功定义的自发过程并不适合于等温等压过程。由此可知,无论用非体积功还是用总功定义自发过程都只是适用于某些特定的条件,以功的类型不可能对各种条件下的自发过程给出统一的定义。即现有各种自发过程的判据都是在某些特殊条件下才能应用的,缺乏普适性。因此,找寻在没有任何约束条件下的自发性判据颇为必要。
笔者以为,根据自发过程的特点找出热力学过程中能量转化的本质,同时还要找到无条件限制且能分辨出自发与非自发的判据,才能得出普适准确的自发过程定义。
2 热力学自发过程的本质与定义
什么样的变化过程是热力学自发过程呢?笔者认为可从自发过程的特点出发,从中找出本质性的东西,然后给出有普遍意义的自发过程定义,最后再通过理论和判据来考查定义的合理性。
2.1热力学自发过程的特点与本质
自发过程存在某些共同的特点,可概括为:①系统的初始状态与周围环境之间存在着某些强度性质的差别,如温度差、高度差、压力差、浓度差、电势差等,这些差别构成了过程进行的推动力;②过程向着推动力减小的方向进行,其对环境有做功的能力;③过程的最终结果是达到各自的平衡态;④在同样的条件下,如果没有环境给予新能量的帮助,反方向的变化是不能发生的。这类变化揭示了人们所要关心的方向与限度问题,故人们把自然界的这类变化称之为自发过程。
系统在变化过程中能量守恒,系统的能量可区分为有做功能力的能量(可用能量)和无做功能力的能量(不可用能量)。通常是取环境状态作为衡量做功能力大小的参考状态,即认为系统与环境状态相平衡时,系统不再具有做功能力。分析自发过程的特点,变化之初就存在推动力,这个推动力有做功的能力(即二者间成正比),随着过程的进行,推动力减小,与环境达到平衡后推动力为零过程结束。或者说在自发过程中可用能量(做功能力)不断减少,不可用能量不断增多,平衡后可用能量消失,系统能量全部变成不可用能量[14]。系统能量中的可用能量的多少体现了能量的“品质”,在自发过程中系统能量的“品质”降低。
2.2总熵判据的另一种形式
因为判据中包含有自发过程的概念,下面再从理论的角度考查判据。笔者认为,为了区别真正的隔离系统和将系统与环境合在一起的大隔离系统,把前者的熵变用ΔSiso表示,后者的熵变用ΔStot表示且称为总熵变,对应的判据称为总熵判据更好些。总熵判据属于通用型判据,总熵判据体现了热力学变化过程中过程进行的方式,即可逆与不可逆,但不可逆既可能是自发的也可能是非自发的,可称其为能发生过程[19],所以总熵判据在表现形式上没有分辨自发与非自发的能力。因此,在此基础上找到一个没有约束条件且有分辨自发与非自发能力的过程判据,对自发过程的定义和理解应该具有重要意义。
如何得到这个判据呢?笔者认为只要学习亥姆霍兹和吉布斯两位前辈即可,因为亥姆霍兹和吉布斯函数两判据就是另外形式的总熵判据,但二者是加了约束条件的总熵判据,只能分辨有约束条件时的自发与非自发,而我们只需把约束条件去掉即可得无约束条件且有分辨自发与非自发能力的过程判据。
从总熵判据出发,但不可逆过程应对应“能发生过程[19]”。则:改写为:
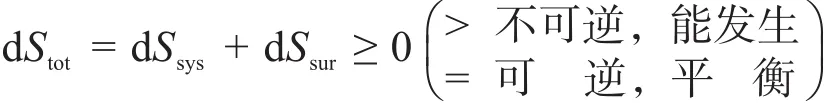
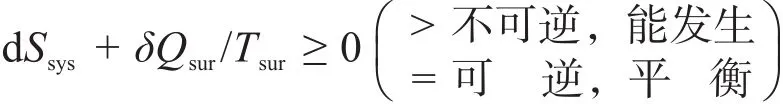

在任意的热力学变化过程中,δQsur=-δQsys,将其代入上式后发现它就是克劳修斯不等式。克劳修斯不等式是第二定律的普适公式,适用于各类系统。将克劳修斯不等式与封闭系统的热力学第一定律:δQsys=dU-δW=dU+psurdV-δWʹ联合,整理后可得:可逆过程的功代表的就是系统的做功能力而不是实际做出了这些功,即式(4)不等号的左边表达的是任意热力学过程中的做功能力,而不等号的右边表达的是系统与环境之间交换的非体积功。式(4)第一层意义就是等式代表系统能量守恒的第一定律,即系统发生变化后其总能量变化(dU)减掉因变化而产生的能量损耗(-psurdV+TsurdS)等于系统对环境的做功能力也就是可逆非体积功(δWrʹ)。在能量损耗中,-psurdV表示系统因体积变化而消耗于环境中的体积功,TsurdS表示系统因熵变化而消耗于环境中的热量。在工程热力学中,把损耗于环境中的这部分能量称为不可用能量,把有做功能力的能量称为可用能量[9-11]。而不等式则代表系统变化方向性的第二定律,指示出实际能发生过程在不同方向发生时的必然结果。因此一个过程结束后,通过比较系统的做功能力的变化与非体积功之间的大小,就可判别过程的自发性。式(4)亦可写成:

其第二层意义是在封闭系统任意的热力学变化过程中,系统对环境所能做出的最大非体积功等于系统做功能力的减少;反之,环境对系统所做的最小非体积功等于系统做功能力的增加。
式(4)即总熵判据的另一种形式,但其将系统与环境之间交换的非体积功分离出来了,因此就具备了分辨自发与非自发的能力。
对式(4)中小于号的分析:
(i)系统无非体积功,即δWʹ=0时有:dU+psurdV-TsurdS<0,若过程中系统没有得到环境的帮助,系统能发生的过程一定是自发过程。有做功能力是自发过程的特征之一,若系统还能向环境做出非体积功,即δWʹ<0时也应该包含在自发过程之中。综合两者说明,在无非体积功和系统能向环境做出非体积功时,系统能发生的过程一定都是自发过程。因此得自发过程判据为:

(ii)当过程中环境向系统提供可用能量,并满足δWʹ>dU+psurdV-TsurdS时发生非自发过程,非自发过程方向与自发过程方向相反,dU+psurdV-TsurdS>0,综合两者得非自发过程判据为:

理论上讲,环境向系统提供可用能量时,根据场合的不同既可以是功也可以是热,功的做功能力直接等于功,热的做功能力可通过卡诺热机转换为功。
式(4)中等号对应的是可逆过程,宏观上的表现即平衡。平衡判据有两种情况,即有无可逆非体积功两种情况。这其实和教科书中的亥姆霍兹函数及吉布斯函数判据面临的是同样的问题。对无可逆非体积功的第一种情况人们对其处于平衡状态是没有疑问的,有疑问的是有可逆非体积功的另一种情况,如在物理化学中的电化学部分,专业书籍[12]和文献[20]都指出在电化学池中发生电化学反应时存在:

它既是可逆电池的属性,又是电化学平衡的属性,但在国内的大部分物理化学教材中只有化学平衡及其判据而没有电化学平衡及其判据,因此很多人不理解这类平衡,认为该式只属于可逆电池。热力学第二定律要解决的是宏观变化的方向与限度问题,限度就是平衡。而可逆过程是为了解决不可测的热力学函数的理论计算而在其与可测的物理量之间建立的一种理论途径,可逆电池是实现电化学系统理论计算的一种特殊工具,可逆电功体现的是这类系统所具有的最大做功能力(这也是一种限度)和电化学平衡的性质(可表示为:dGT,p+zF(φβ-φα)dξ=dGe=0,平衡。其中dGT,p表示普通反应吉布斯函数变,dGe表示电化学反应吉布斯函数变),并不是电池实际做了多少电功。可逆过程的特点是在无限小的推动力下发生了无限接近平衡的宏观上观察不到的微小变化,故从宏观上看并没有偏离原来的平衡。所以作为更一般的情况,上述两种可逆都应是平衡的标志。即:

式(4)是总熵判据的另一种普适形式,适用于封闭系统,笔者暂称其为做功能力判据,式(5)、式(6)、式(7)是其具体形式。可逆平衡时,非体积功或可写成δWrʹ=-XdY(X代表系统的某强度性质,Y代表系统的某广度性质),成为系统平衡性质中所包含的特殊做功能力项。
2.3热力学变化过程的模型与自发过程定义
由总熵判据结合热力学第一定律,在无约束条件的情况下得出的结果和前面分析的自发过程的特点及本质是一致的。综合上述分析,我们可以总结出一个热力学变化的模型如下:①系统变化时与环境之间交换的能量从表现形式上区分为功和热,而从可利用程度上可区分为可用能量和不可用能量。当系统与环境呈平衡时,系统中可用的能量为零,系统中的能量全变成了不可用能量。或者说系统与环境平衡时就是系统可用能量的零点。②实际发生的变化过程总是朝着可用能量转化为不可用能量的方向进行。③变化过程中总能量不变。④在一定的环境下,在一些系统中变化之初就包含这种可用能量,可用能量是其发生变化的推动力,这样的变化是自发变化。⑤在一定的环境下,在一些系统中变化之初并不包含这种可用的能量,是由于外界帮助提供了这种可用的能量,系统才发生了变化,这样的变化是非自发变化。
上述模型,既包含了热力学第一定律又包含了热力学第二定律,描述了热力学变化中能量转化的本质。依据上述模型笔者给出热力学自发过程的通用定义是:系统在一定环境的条件下不需输入有做功能力的能量就有可能自动发生的过程称为热力学自发过程。热力学变化可以两种方式发生,可逆的方式和不可逆的方式,在自然界中实际发生的变化都是不可逆的方式,可逆的方式则是为了理论需要人为构造的理想方式。
从科学和辨证的角度来看,自发与非自发是个相对的概念,这里的相对指的就是相对于某环境。相对于低温环境,高温系统在低温环境中的降温是自发的;而与低温环境平衡的系统的升温,没有环境提供有用能量的帮助是不能实现的(如冬天使用供暖器材为房间供暖),有了环境提供有用能量的帮助实现了的变化是非自发的。反之,相对于高温环境,低温系统在高温环境中的升温是自发的;而与高温环境平衡的系统的降温,没有环境提供有用能量的帮助也是不能实现的(如夏天使用空调为房间降温),有了环境提供有用能量的帮助实现了的变化是非自发的。可以说自发与非自发既矛盾又统一,共存于不可逆过程之中。如果环境发生变化,二者可以互相转化。
3 做功能力判据应用
在恒U、V和Wʹ=0条件下,做功能力判据还原为隔离系统的熵判据,即dSU,V,Wʹ=0≥0。
在恒S、V和Wʹ=0条件下,做功能力判据还原为热力学能判据,即dUS,V,Wʹ=0≤0。
在恒S、p和Wʹ=0条件下,做功能力判据还原为焓判据,即dHS,p,Wʹ=0≤0。
在恒T、V和Wʹ=0条件下,做功能力判据还原为亥姆霍兹函数判据,即dAT,V,Wʹ=0≤0。
在恒T、p和Wʹ=0条件下,做功能力判据还原为吉布斯函数判据,即dGT,p,Wʹ=0≤0。
和总熵判据一样,做功能力判据既要考虑系统性质的变化又要考虑环境的性质。而上述5种判据虽然只需系统性质的变化但它们都是有约束条件的,应该说各有自己的特点。另外,做功能力判据也不能替代总熵判据,因为二者形式不同,作用也会有所不同。各方向判据之间,应该是相互依存互为补充的关系。
自然界中的任何变化,一方面与变化主体(系统)及其始末态和变化条件有关,另一方面就是与其所处的环境有关,自发过程自然也不例外。做功能力判据可以让人们从更宽泛的视野来观察和理解自发过程。研究系统一般情况下都是有限的,而与系统有联系的是环境,虽然人们只关心有联系的部分,但事实上若与有限的系统相比,环境往往是无限的。系统内的任何变化,实际上还是受控于环境的。在热力学中,环境对系统的影响主要归结于环境的温度和压力对系统的影响,环境的温度和压力也是可以发生变化的。环境可以是自然的环境,也可以是人造的环境。人造的环境与自然的环境相比虽然有些微不足道,但它仍可临时地影响系统的变化与变化方向。
下面仅对能发生的变温和变压过程做些讨论,其余的过程做功能力判据会转化成相应判据,与教科书中介绍的相同,本文不作讨论。
3.1在变温过程中的应用
在变温过程中,自发变化对应系统做功能力的减少,非自发变化由于有外界对系统的帮助,所以对应系统做功能力的增加。外界对系统的帮助可以是直接输入热量,也可以是输入非体积功,但非体积功可以自发地转化为热量,所以最终的结果还是输入热量。因此在变温过程的判据中可视作无非体积功,即:

当系统温度升高时,熵变大于零,T<Tsur(自发),T=Tsur(平衡),T>Tsur(非自发)。即当系统温度低于环境温度时,系统会自发的升温;如果想使系统温度高于环境温度,则需外界为系统提供能量(热量)的帮助才行。
当系统温度降低时,熵变小于零,T>Tsur(自发),T=Tsur(平衡),T<Tsur(非自发)。即当系统温度高于环境温度时,系统会自发的降温;如果想使系统温度低于环境温度,亦需外界为系统提供能量(冷量)的帮助才行。
结果是不管是哪种情况,自发的方向都是热量从高温部分流向低温部分,两部分温度相等后达到平衡。两部分温度相等是热平衡的标志。
3.2在变压过程中的应用
在变压过程中,类似于变温过程,外界对系统的帮助可以是直接输入体积功,也可以是输入非体积功,但非体积功最终转化为体积功,所以最终的结果还是输入了体积功。因此在变压过程的判据中也可视作无非体积功,即:
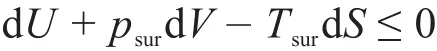
如气体在等温下的膨胀与压缩,将dU=TdS-pdV代入判据中得:
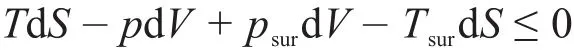
恒温时Tsur=T,得:psurdV≤pdV。
气体膨胀时,体积变化大于零,psur<p(自发),psur=p(平衡),psur>p(非自发)。即系统压力大于环境压力时,气体会自发地膨胀;反之,若想要系统压力小于环境压力时,就需要给系统减压,这需要外界的能量帮助。
气体压缩时,体积变化小于零,psur>p(自发),psur=p(平衡),psur<p(非自发)。即环境压力大于系统压力时,气体会自发地被压缩;反之,若想要系统压力大于环境压力时,就需要给系统增压,这同样需要外界的能量帮助。
总之,不管气体是膨胀还是被压缩,自发的方向总是气体从高压流向低压,双方压力相等后达到平衡。双方压力相等是力平衡的标志。
常压下石墨不能转变为金刚石。金刚石比石墨的密度大,故金刚石的摩尔体积比石墨的小,石墨转变为金刚石的摩尔体积变为负值,加压可使转变过程的可用能降低以致成为负值,所以加压可使石墨转变为金刚石,石墨和金刚石皆为固体,故ΔtrsUm≈ΔtrsHm,由ΔtrsHm+psurΔtrsVm-TsurΔtrsSm<0可求出此压力。
做功能力判据是没有约束条件的,能分辨自发与非自发的判据,所以它更是自发过程定义的试金石。从应用中看到,做功能力判据中的自发过程可以包含各类判据中的自发过程,与笔者定义的自发过程之间没有任何矛盾。
4 结语
热力学第二定律是解决变化方向与限度问题的核心理论,笔者以此为依据,从辨证与统一的角度就自发过程的定义及判据问题进行分析和讨论,指出了实际变化过程的本质。同时推荐性地提出了以做功能力为判断指标的做功能力判据,进一步的应用表明:做功能力判据可用于封闭系统的任意过程。笔者给出的自发过程定义能非常融洽地和做功能力判据配合来解释各类问题。由隔离系统熵判据、总熵能发生判据、做功能力判据及亥姆霍兹、吉布斯函数判据等构成的判据组合,把隔离系统的自发过程、封闭系统的能发生过程以及在此基础上的自发与非自发过程都辨析得较为清楚,以前自发过程定义和解释上的混乱问题希望能得到解决。
[1]傅献彩,沈文霞,姚天扬.物理化学.北京:高等教育出版社,2005.
[2]天津大学物理化学教研室.物理化学.北京:高等教育出版社,2009.
[3]胡英.物理化学.北京:高等教育出版社,1999.
[4]上海师范大学等校编.物理化学.北京:高等教育出版社,1991.
[5]朱志昂,阮文娟.近代物理化学.北京:科学出版社,2008.
[6]王光信,刘澄凡,张积树.物理化学.北京:化学工业出版社,2001.
[7]Atkins,P;de Paula,J.Physical Chemistry,9th ed.;W H Freeman and Company:New York,2010.
[8]傅鹰.化学热力学导论.北京:科学出版社,1991.
[9]童钧耕,吴孟余,王平阳.高等工程热力学.北京:科学出版社,2006.
[10]史密斯,J.M.;范内斯,H.C.;阿博特,M.M.化工热力学导论.刘洪来,陆小华,陈新志,译.北京:化学工业出版社,2007.
[11]朱自强,吴有庭.化工热力学.北京:化学工业出版社,2009.
[12]Bard,A.J.;Faulkner,L.R.Electrochemical Methods,2nd ed.;John Wiley&Sons Inc.:Hoboken NJ,2001.
[13]李大珍.大学化学,1993,8(1),43.
[14]胡兆基,母小明.洛阳大学学报,2003,18(2),104.
[15]于艳春,王明艳,李咏梅.淮海工学院学报,2004,13(3),84.
[16]高盘良.大学化学,2011,26(5),74.
[17]李俊新,唐文颖,崔敏.河北工业科技,2011,28(3),139.
[18]张德生,郭畅.绍兴文理学院学报(自然科学版),2010,30(8),1.
[19]郭子成,任聚杰,罗青枝,任杰.化学通报,2013,76(5),471.
[20]任聚杰,郭子成.化学通报,2014,77(2),188.
Discussion on Spontaneous Process of Thermodynamics and lts Criteria
GUO Zi-Cheng*LI Jun-XinREN Jie
(College of Science,Hebei University of Science and Technology,Shijiazhuang 050018,P.R.China)
Current criteria for spontaneity are used with the confined conditions.The various definitions of spontaneous change show the lack of universality.Here,the first law of thermodynamics was put in the total entropy criterion without any constraints.Then another form of entropy criterion was obtained and discussed.The nature of energy change in thermodynamics processes was summarized based on the characteristics of spontaneous process.As a result,the universal definition of spontaneous process was put forward.The original total entropy criterion can distinguish between the reversible and irreversible processes,but not the spontaneous and non-spontaneous processes.Another form of the entropy criterion,i.e.,the exergy criterion for the arbitrary process in the closed system,was proposed.This criterion can distinguish between the spontaneous and non-spontaneous processes.Through the theoretical derivation and the actual examples,we found that the exergy criterion is equivalent to the total entropy criterion.The exergy criterion can be returned to all kinds of direction criteria when using the corresponding limited conditions.In the paper,the spontaneity criteria for the processes with variable temperature or pressure were also given,which have not appeared in the current textbooks.In summary,the universal definition and the exergy criterion can solve the problems arisen from the confusing conception and explanation related to spontaneous processes.
Closed system;Arbitrary process;Spontaneous change;Non-spontaneous change;Exergy;Criteria for spontaneity
O64;G64
10.3866/PKU.DXHX201509017
,Email:gzcheng5501@sina.com
