蚜虫中携带马铃薯卷叶病毒检测方法的改进
2016-09-19韩树鑫白艳菊高艳玲范国权
韩树鑫, 白艳菊,*, 张 威,, 高艳玲,, 范国权,, 张 抒, 申 宇
( 1. 黑龙江省农业科学院, 哈尔滨 150086; 2. 东北农业大学, 哈尔滨 150030 )
蚜虫中携带马铃薯卷叶病毒检测方法的改进
韩树鑫2, 白艳菊1,2*, 张威1,2, 高艳玲1,2, 范国权1,2, 张抒1, 申宇1
( 1. 黑龙江省农业科学院, 哈尔滨 150086; 2. 东北农业大学, 哈尔滨 150030 )
马铃薯卷叶病毒(Potatoleafrollvirus,PLRV)对马铃薯生产的危害极大,是一种极为重要的马铃薯病毒病。RT-PCR是马铃薯卷叶病毒检测较为常用的方法,该方法检测准确率高、成本低、适用范围广。但在实际生产中其检测对象多为染病植株,对PLRV传播的主要介体桃蚜(Myzuspersicae)的检测,则由于蚜虫体积小、RNA提取难度大、成本高、且不能复检,因而在生产中不能被广泛使用。该研究以马铃薯感病植株和带毒蚜虫为材料,利用改进的RNA提取方法从它们中提取到PLRV的RNA,并以CP基因设计特异性引物,进行PCR检测。结果表明:该方法提取的RNA完整性好,可用于蚜虫中PLRV检测,且同样适用于对马铃薯感病植株的检测。另外,通过对田间有翅蚜和无翅蚜携带PLRV情况进行检测发现,无翅蚜PLRV检出率为100%,有翅蚜PLRV检出率也高达60%,证明该体系在生产中的实用性。该研究使用改进的RNA提取方法,提取蚜虫中RNA,并利用RT-PCR进行了PLRV检测,与以前的方法相比简单实用,可被应用于生产检测中。该研究结果为马铃薯生产中PLRV的防控提供了一种新的手段。
马铃薯卷叶病毒, 蚜虫, CP基因, 检测
在世界各地的马铃薯生产中,马铃薯卷叶病毒(Potatoleafrollvirus,PLRV)是马铃薯生产中危害最为严重的病毒之一,可以造成马铃薯的产量及品质严重下降。PLRV是单分子正义ssRNA病毒,属黄症病毒科(Luteoviridae)马铃薯卷叶病毒属(Polerovirus)的成员,基因组长约5.9 kb,具有6个读码框架。病毒粒子为等轴对称二十面体,无包膜,直径为25~30 nm(Van Regenmorte et al,2000;张鹤龄,1996;)。桃蚜(Myzuspersicae)属于半翅目(Hemipte)蚜科(Aphididae),其寄主植物在280种以上,是多种植物病毒的主要传播媒介。PLRV主要靠蚜虫中的桃蚜以持久、循环增殖型方式传播,另外还能通过嫁接传播,但不能经汁液机械接种传毒,在寄主植株体内的分布主要局限于维管束内。受其侵染的植株的症状主要为叶片边缘以主脉为中心向上卷曲,病重时呈圆筒状,叶质厚而脆,呈皮革状,植株矮小,枝叶僵化,并因韧皮部被破坏,在茎横切面可见黑点,茎基部和节部更为明显,有的品种块茎组织表现为导管区网状坏死斑纹,严重影响马铃薯的品质和产量(KOJ,1969)。
在目前的马铃薯生产中,为防止马铃薯卷叶病毒对其生产造成危害,常用的检测预防措施的检测对象为植物组织,即首先,通过植株症状初步判断是否感染了PLRV,如疑似感染则通过DAS-ELISA(Double Antibody Sandwich Enzyme Linked Immunosorbent Assay,DAS-ELISA)或RT-PCR方法进行检测,确定田间植株中是否含有PLRV(李楠楠等,2011;张华鹏等,2011),但当确定植株中含有马铃薯卷叶病毒时,事实上田间马铃薯植株已经发生,受PLRV感染的植株数量以远大于可控制的程度。而针对传毒介体蚜虫中病毒的检测方法虽已有报道,并且也还有一些研究者在继续研究。由于单头蚜虫体积极小,目前,研究者们遇到最大的问题就是蚜虫中总RNA提取,因为,只有提取出完整的、质量合格的RNA,才能进行检测,同时,合适的提取方法提取的RNA可以被保存于适当的条件下,以便日后复检或进行其它的实验研究。而目前以报道的对单头蚜虫中RNA的提取并鉴定的方法则主要是根据Singh et al (1996); Singh(1999)使用微量离型机和微量离心管,在微量离心管中利用降解液将蚜虫组织直接降解,并使用保护液保护降解液中的RNA,从而直接进行逆转录及PCR检测的方法。这类检测方法的优点是检测时,操作方便,不需专门提取RNA,但同样存在一些缺点:首先,降解液及保护液配置复杂,不能利用简单的试剂直接完成;第二,使用降解液进行RT-PCR,由于蚜虫体内的其它组织及RNA的干扰,此检测方法极易出现漏检或者错检;第三,蚜虫组织的降解液并不能长期保存,如检测出现问题,无法进行复检,也无法进行其它的相关实验。虽然,Nie & Singh (2001)通过加入Dnase I的方式改进Singh的方法,并对蚜虫中的病毒进行了多重RT-PCR检测,但这种方法依然存在以上的问题。另外,近年来还有许多针对蚜虫携带病原检测的研究,如刘永清等利用(2010)利用反转录PCR(RT-PCR)、反转录巢式PCR(RT-nested-PCR)以及实时RT-PCR(Real-time RT-PCR)对蚜虫中的柑桔衰退病毒(Citrustristezavirus,CTV)进行了定性及定量分析,但使用的提取方法,依然是利用前人对蚜虫中病毒RNA的提取方法(Metha,1997)。
随着我国马铃薯生产规模的不断扩大,对马铃薯病毒病的检测和预防逐渐上升为马铃薯生产中极为重要的一项工作,所以需要一种既简单又实用的检测方法对马铃薯病毒病的传毒介体进行检测,以便开展相关的防治工作。但目前对PLRV检测还停留在针对已受感染植株的初级阶段,而不多的针对传毒介体的检测方法则有着各种各样的缺点和不实用性,不能作为生产中经常使用的检测方法。本研究采用常规的RT-PCR方法对PLRV的传播介体-桃蚜进行检测,并针对单头蚜虫的总RNA提取困难的特点,利用相关仪器配合改进了提取方法,使其可以简便的提取出蚜虫的总RNA,并进行检测。另外,通过使用本方法,可在马铃薯植株未发现受PLRV侵染前,检测地块周围的蚜虫,进而提前进行PLRV的防控。

表 1 马铃薯卷叶病毒(PLRV)引物
1 材料与方法
1.1 材料
携带PLRV的带毒蚜虫(数只)、染病马铃薯植株及作为阴性对照的无毒蚜虫均来自于黑龙江省农业学院植物脱毒苗木研究所。待测蚜虫采集于哈尔滨市民主乡,在马铃薯卷叶病发病地块采集有翅蚜15只,马铃薯卷叶病发病植株上采集无翅蚜15只,用于验证检测方法的可靠性。
1.2 酶与试剂
试验所用的限制性内切酶、反转录酶、RNA酶抑制剂、Taq DNA聚合酶、dNTP、植物RNA提取试剂(Trizol)分别购自宝生物工程(大连)有限公司、Promega公司和Invitrogen公司。
1.3 引物设计与合成
本实验依据PLRV比较保守的CP基因序列设计、引用引物,具体详情见表1。
1.4 PLRV的检测
1.4.1 蚜虫及马铃薯的总RNA提取本文采用经过改进的Trizol法提取单个蚜虫RNA。取1只蚜虫放入2 mL的离心管中,迅速放入液氮中将蚜虫冷冻至死,打开管盖,加入2个直径2 mm的玻璃珠(玻璃珠的表面为磨砂面),盖上离心管盖,将离心管放入液氮中充分冷却, 趁离心管在液氮中冷却后温度较低,使用植物样品研磨机(MM400 Retsch)利用其高速震荡使玻璃珠在离心管中对样品进行研磨,研磨完成后将离心管重新放入液氮中,以防止样品温度升高。由于蚜虫体积较小,研磨粉碎后组织主要集中在管壁和玻璃珠上,所以利用已经预冷的冷冻台式离心机(MIKRO 220R Hettich Zentrifugen)对研磨后的样品进行12 000g,离心10 s(离心时间过长,样品易降解),离心后向离心管中立即加入1 mL Trizol后充分混匀(加入Trizol时使用移液器将Trizol沿离心管壁冲洗管壁),并将离心管水平放置滚动数次,使可能还附着在管壁上的蚜虫组织充分地与Trizol接触,水平静置于试验台10 min,以使样品充分降解。加入200 μL氯仿, 剧烈振荡混匀30 s,室温(15~25 ℃)放置15 min;然后,将样品放入冷冻台式离心机,12 000g, 4 ℃离心15 min。经离心后可见样品分为3层:底层为黄色有机相,上层为无色水相和一个中间层。小心吸取上层水相至另一离心管中加入等体积的异丙醇混匀(由于蚜虫体积小,组织含量少,这时的中间层虽然肉眼很难分辨,但还是要尽量的多吸取水相层)在室温(15~25 ℃)下放置10 min。将样品放入冷冻台式离心机中, 12 000g, 4 ℃离心10 min;由于单个蚜虫中RNA含量极少,所以移去上清液的过程需极小心,尽量不要用移液器吸头接触到管壁, 以防止RNA 丢失; 用的使用RNase free水配制75%乙醇洗涤2次, 每次500 μL, 12 000g, 室温(15~25 ℃)离心5 min; 彻底吸去上清液, 室温干燥5~10 min 使酒精完全挥发; 用25 μL RNase free水溶解RNA 样品, 分光光度法测定RNA 浓度及纯度同时使用电泳法检测RNA完整性。
植物总RNA提取,按Trizol试剂说明书按步骤进行。
1.4.2 cDNA第一链的合成以上一步中提取的RNA为模板,反转录合成cDNA第一链。反应步骤: PCR管中加入模板RNA 4 μL,Random primer 1 μL,用DEPC处理过的无菌水补齐至10 μL。70 ℃加热5 min。冰上冷却2 min后向PCR管中加入5 × Buffer 5 μL,dNTP 1.25 μL(10 mmol·L-1), RNasin 0.5 μL (40 U·μL-1), M-MLV 1 μL(200 U·μL-1),用DEPC处理过的无菌水补齐至25 μL。按下列条件进行反转录反应: 37 ℃ 1 h,70 ℃ 15 min (酶失活)后,冰上冷却,-20 ℃保存备用。
1.4.3 PLRV的RT-PCR检测及产物的序列测定以上一步合成的cDNA第一链为模板,使用RT-PCR进行扩增检测并测序。检测步骤: 在PCR管中加入制备的cDNA 2 μL,dNTP 2 μL(2.5 mmol·L-1),rTaq 0.25 μL(5 U·μL-1),10× PCR Buffer 5 μL,上下游引物 (10 mmol·L-1) 各0.5 μL,用DEPC水定容到25 μL的反应体系。PCR扩增条件: 94 ℃ 2 min预变性后进行35个循环(94 ℃变性20 s, 55.5 ℃退火30 s, 72 ℃延伸30 s), 72 ℃延伸5 min,4 ℃∞。扩增产物经琼脂糖凝胶电泳检测后,交由华大基因进行测序。
2 结果与分析
2.1 引物筛选
本研究中,选取并设计了一共3对引物,并且3对引物都成功扩增出特异性条带(图1、图2、图3)。考虑到检测的实用性和检测结果的易分辨性,我们选用引物PLRV-CP。
2.2 RNA的提取
以单头蚜虫为材料,使用改进的方法对其的总RNA进行了提取,提取完成后取5 μL进行电泳检测后发现,虽然RNA的电泳后颜色较淡,说明其浓度较低,但RNA的完整性良好,由于RT-PCR检测灵敏性高并对使用RNA要求不高,所以试验提取的RNA可用于后续试验。
2.3 蚜虫携带PLRV病毒RT-PCR检测
以单头带毒蚜虫的总RNA为模板,并使用带毒马铃薯植株为阳性对照,采用PLRV特异性引物PLRV-CP,经RT-PCR检测,带毒蚜虫和马铃薯病株扩增得到特异性条带没有差异,说明该体系适用蚜虫体内卷叶病毒的检测(图4)。

图 1 引物PLRV2627 扩增结果 M. 100 bp分子量标记; 1. 阴性对照; 2. 阳性对照; 3-6. 带毒蚜虫。下同。Fig. 1 Amplification results of PLRV2627 with PLRV M. 100 bp Marker; 1. Negative control; 2. Positive control; 3-6. Viruliferous aphid. The same below.

图 2 引物PLRVLR扩增结果Fig. 2 Amplification results of PLRVLR with PLRV
2.4 PLRV的序列测定及序列同源性比较
应用引物PLRV-CP对蚜虫携带PLRV病毒的RT-PCR扩增产物进行测序(图5)。利用BLAST工具与GenBank中已公布的PLRV分离物CP基因序列进行比较,发现核苷酸同源性均在 99%以上,证明成功扩增得到了PLRV的CP基因,同时也表明从蚜虫中提取的总 RNA可以被用于检测PLRV。
2.5 检测方法的验证
2.5.1 有翅蚜中的PLRV的检测利用商品薯地块中随机采集的有翅蚜进行检测方法的验证,15只有翅蚜经RT-PCR后利用琼脂糖凝胶电泳测检(图6)。图6结果表明,在15只有翅蚜的试验检测验证中,共有9只体内被检测出含有PLRV,检出率为60%。由于试验中使用的是有翅蚜,而有翅蚜在自然地块中是有流动性的。在本次试验中,地块中的有翅蚜为随机采集,部分蚜虫可能未能吸食到含有PLRV的马铃薯叶汁,所以本次验证中在部分蚜虫中未检测到PLRV。
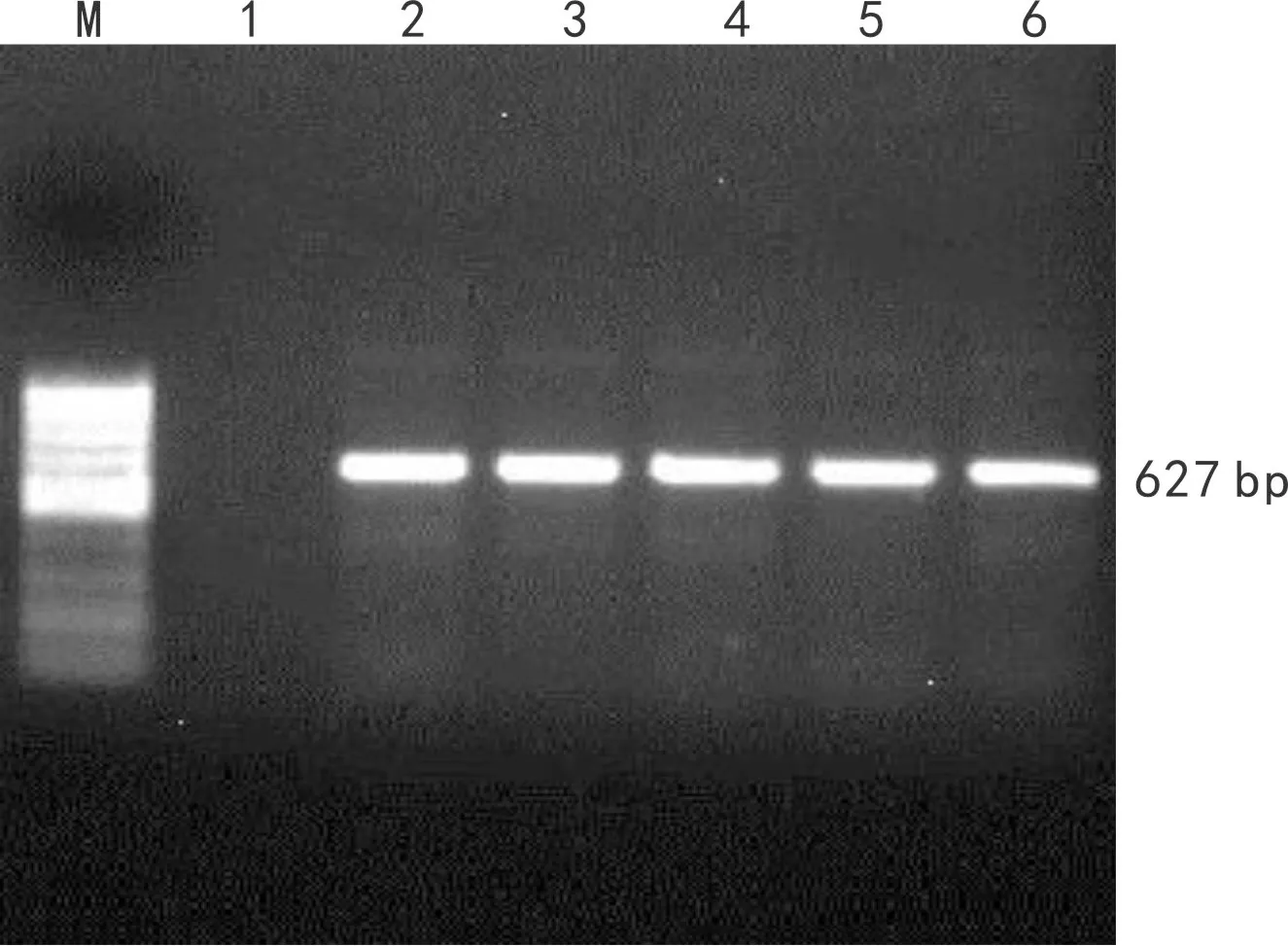
图 3 引物PLRV-CP扩增结果 Fig. 3 Amplification results of PLRV-CP with PLRV

图 4 RNA提取结果 M. 分子量标记; 1-2. 带毒蚜虫; 3-4. 带毒马铃薯植株; 5. 阳性对照; 6. 阴性对照。Fig. 4 Results of RNA extraction M. Marker; 1-2. Viruliferous aphid; 3-4. Infected plant; 5. Negative control; 6. Positive control.

图 5 使用PLRV-CP对PLRV的检测M. 100 bp 分子量标记; 1. 阴性对照; 2. 阳性对照; 3-4. 带毒蚜虫; 5. 带毒马铃薯植株。Fig. 5 Amplification and detection of PLRV with PLRV-CP M. 100 bp Marker; 1. Negative control; 2. Positive control; 3-4. Viruliferous aphid; 5. Infected plants.
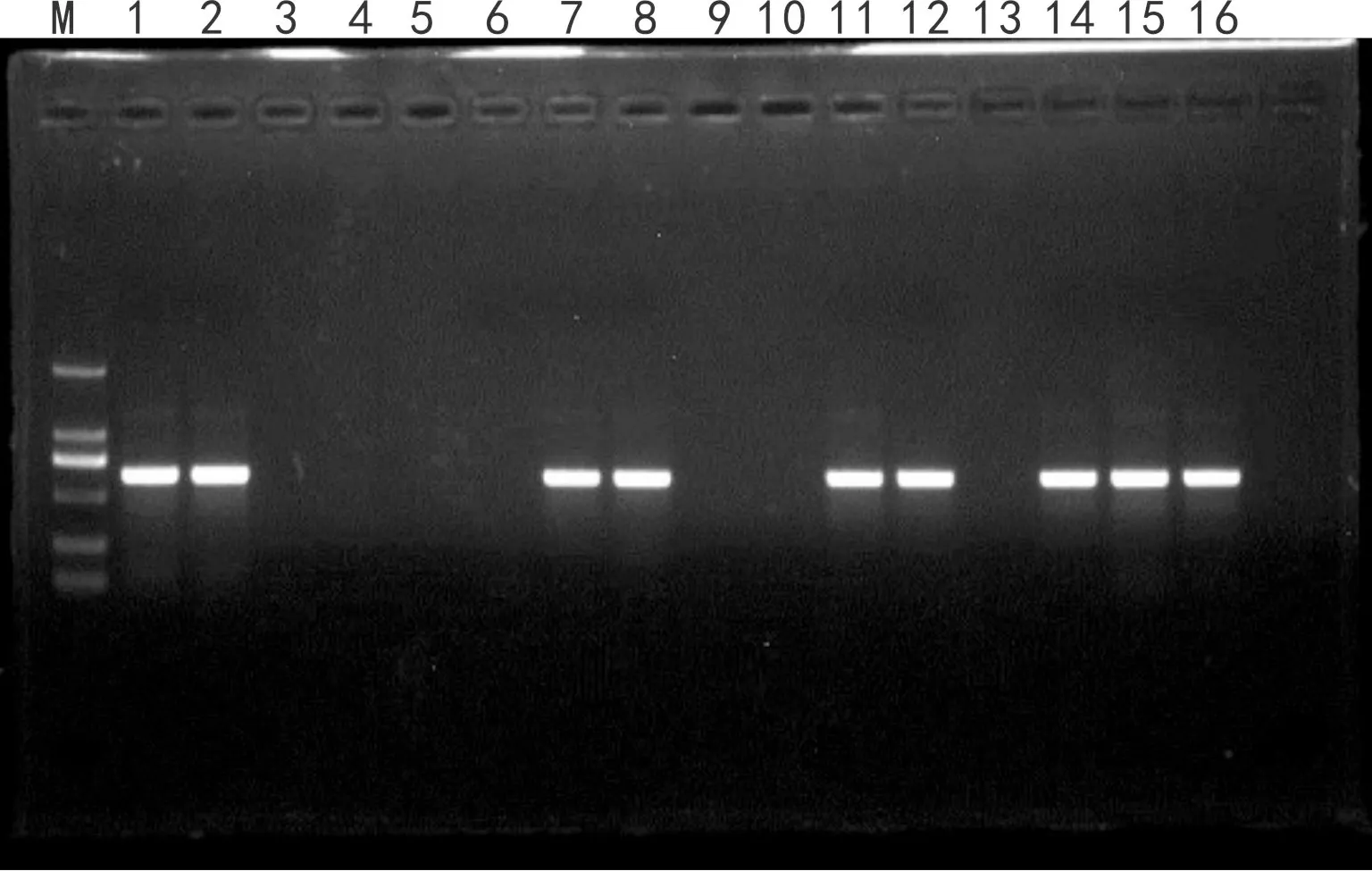
图 6 有翅蚜样品中的PLRV的检测 M. 分子量标准; 1-2. 带毒蚜虫阳性对照; 3. 蚜虫阴性对照; 4-16. 田间有翅蚜。Fig. 6 Detection of PLRV in samples of alatae M. Marker; 1-2. Negative control; 3. Positive control; 4-16. Alatae.

图 7 无翅蚜样品中的PLRV的检测 M. 分子量标准; 1、2. 带毒蚜虫阳性对照; 3. 蚜虫阴性对照; 4-13. 田间无翅蚜。Fig. 7 Detection of PLRV in samples of wingless aphid M. Marker; 1-2. Negative control; 3. Positive control; 4-13. Wingless aphid.
2.5.2 无翅蚜的PLRV检测与有翅蚜的验证方式相同,利用在商品薯地块卷叶病毒株上的无翅蚜进行检测方法的验证,试验使用无翅蚜15只,经RT-PCR后电泳检测(图7)。由图7可知,在无翅蚜的检测中,发现所有被检测的无翅蚜中,PLRV检测均呈阳性。由于无翅蚜不能飞行,所以在地块中无翅蚜的流动性与有翅蚜相比较差,试验采集的无翅蚜来源于地块中疑似含有PLRV的植株,试验结果也证明在含有PLRV的叶片上采集的无翅蚜,其体内已吸食的植物叶汁中含有PLRV病毒的比例极高,并可以被RT-PCR方法所检测。
3 讨论
近年来,马铃薯在我国农业中的地位在不断地提高。出于对马铃薯生产的保障,马铃薯病毒病的检测越来越受到重视。由于马铃薯病毒病发病区域广、面积大,且发病后造成的经济损失及生态环境损失极大,这使马铃薯病毒检测受到重视的程度不断升高。目前马铃薯生产中,大多数种子均为经过脱毒的马铃薯种薯,使用这种种子的好处在于,经过脱毒后,种子中并不携带马铃薯病毒,这样可以避免由于种子带毒而造成马铃薯病毒病的发生。目前生产中马铃薯病毒病的发生,多数是在出芽后,经由蚜虫等传毒介体传播而来,所以在蚜虫还未在地块中大规模出现的时候,对马铃薯病毒病传毒介体的检测是预防马铃薯病毒病的一种非常实用的方法。现今马铃薯病毒检测较为常用的方法为血清学检测,当血清学鉴定不能准确提供检测结果时,则使用RT-PCR进行联合检测。RT-PCR可以在样品中病毒含量极少的情况下就可以检测到是否有病毒存在,且RT-PCR方法成本较低,操作简单,易于推广。国际上,很早就开始了对马铃薯病毒的检测,随着检测技术的发展,陆续出现了许多新方法。可是这些方法仅有极少的能被应用于实际生产中,主要原因就是因为这些技术检测对象主要为马铃薯植株,仅有少部分检测方法能被应用于传毒介体,且由于这些方法需要的条件较高或检测预报的前瞻性较差导致在实际生产检测中并不实用(Du et al,2006)。Metha et al(1997)利用的多种方法提取了不同数量的蚜虫的RNA,并进行了检测。Coffin et al(1997)利用从植物样本中提取的总RNA对PLRV和马铃薯Y病毒进行了检测。Russo et al(1999)则利用相似的方法对佛罗里达州的PLRV的发生情况进行了调查。同样,我国对PLRV的研究、检测、鉴定也是如此。吴兴全等(2006)对PLRV福建分离物的CP序列进行了克隆及序列分析。周云和杨永智(2008)利用PLRV基因组保守序列片段,使用RT-PCR方法对PLRV进行了检测及研究。张威等(2014)利用了多重RT-PCR检测了马铃薯材料中的三种病毒。本研究利用改进的RNA提取方法,成功地提取了单头蚜虫中的RNA,经电泳检测RNA的完整性良好,可以被用于RT-PCR检测中。同时,从三组不同的引物中筛选出了最适合的引物对带毒蚜虫进行了检测,检测结果表明,此方法与其它的方法相比(Singh,1999;Nie & Singh,2001)具有试验普适性强,试剂配制方便,复检方便的优势。经试验验证,在有翅蚜和无翅蚜的检测中,PLRV的检出率远高于使用传统提取方法进行检测的检出率(Metha et al,1997)。
马铃薯生产中使用RT-PCR对蚜虫中的病毒进行检测,可以对蚜虫携带病毒情况的掌握,能及时对PLRV的发生流行起到预警的作用,有利于防控。通常,马铃薯植株的检测用于对病害发生的客观评价,而当植株被检测出病毒,或发病症状较重时,马铃薯已受到病毒侵害,且不可逆转。利用植物中的总RNA检测PLRV需要以新鲜植物组织进行RNA提取,而马铃薯由播种到生长为可采摘新鲜叶片的个体需要一定的时间,同时PLRV从侵染到发病也需要一定时间,这样就导致使用马铃薯叶片进行PLRV的鉴定在生产使用中存在一定时间的滞后性,进而导致PLRV对马铃薯的生产造成较大的经济损失。PLRV的传播主要是由蚜虫引起,有翅蚜一方面是其它地块迁飞而来,另一方面则是在本地块产生,对于迁飞来的蚜虫带毒情况的检测结果,可作为预警依据,指导及早防病,甚至在马铃薯田间没有出苗的时候,就可以通过检测周围杂草等指示植物、有翅蚜掌握带毒情况。无翅蚜栖息在马铃薯植株上,活动范围有限,无翅蚜携带病毒与马铃薯田间病毒的发生有密切相关性,通过田间蚜虫数量与带毒率就可以预测该地块卷叶病毒的发生、流行情况,结合蚜虫防治数据,进而可以推断出马铃薯感染卷叶病毒的状况。所以,通过蚜虫中PLRV的检测,可以为马铃薯生产中病毒病的防控提供一种新的方法。
COFFIN A, STURZ AV, SINGH RP, 1997. Evaluation of a RT-PCR method for t-he simultaneousdetection of PLRV and PVYoin field grown tubers [J]. Am J Potato Res, 74:423. CROSSLIN JM, HAMLIN LL, 2011. Standardized RT-PCR conditions for detection and identification of eleven viruses of potato and potato spindle tuber viroid [J]. Am J Potato Res, 88:333-338.
DONG DX,ZHANG SL,LUO M,et al, 2011. Development of one-step multiplex RT-PCR forsimultaneous detection of four potato viruses [J]. Microbiology, 38(1): 131-137. [董代幸,张祥林,罗明,等, 2011. 马铃薯病毒一步法多重RT-PCR检测技术的构建 [J]. 微生物学通报, 38(1): 131-137.]
DU Z, J CHEN, C HIRUKI, 2006. Optimization and application of a multiplexRT-PCR system for simultaneous detection of five potato viruses using 18S rRNA as an internal control [J]. Plant Dis, 90:185-189.
KOJ IMA M. 1969.Purification and electron microscopy of potato leafroll virus [J]. Virology, 39:162-171.
LI NN,ZUO YL,SUI JM,et al, 2011. Application of polyclonal antibody against the recombinant CP to the DAS-ELISA detection of potato leafroll virus [J]. Acta Agric Boreal Sin, 26(6):85-88. [李楠楠,左玉玲,隋炯明,等, 2011. 重组CP多克隆抗体在马铃薯卷叶病毒DAS-ELISA检测中的应用 [J]. 华北农学报, 26(6):85-88.]
LIU YQ,CAO MJ,WANG XF,et al, 2010. Rapid molecular detection technologies of citrus tristeza virus in plant tissues and single aphid [J]. Sci Agric Sin,43(7): 1 397-1 403. [刘永清,曹孟籍,王雪峰,等, 2010. 植物组织和单头蚜虫中柑橘衰退病毒的快速分子检测技术 [J]. 中国农业科学,43(7): 1 397-1 403.]
METHA P,BRLANSKY RH,GOWDA S, 1997. Reverse-transcription polymerase chain reaction detection ofCitrustristezavirusin aphids [J]. Plant Dis, 81(9):1 066-1 069.
NIE X, SINGH RP, 2001. A novel usage of random primers for multiplex RT-PCR detection of virus and viroid in aphids, leaves, and tubers [J]. J Virol Methods, 91:37-49.
RUSSO P, MILLER L, SINGH RP, et al, 1999. Comparison of PLRV and PVY detection in potato seed samples tested by Florida winter field inspection and RT-PCR [J]. Am J Potato Res, 76: 313-316.
SINGH RP, 1999. A solvent-free rapid and simple virus RNA-release method for potato leafroll virus detection in aphids and plants by reverse transcription polymerase chain reaction [J]. J Virol Meth, 83:27-33.
SINGH RP, KURZ J, BOITEAU G, et al, 1996. Detection of potato leafroll virus in single aphids by the reverse transcription polymerase chain reaction and its potential epidemiological application [J]. J Virol Meth, 55:133-143.
VAN REGENMORTE MHV, FAUQUET CM, BISHOP DHL, et al, 2000. Virus taxonomy [M]. California, USA: Seventh Report of the International Committee.
WANG ZK,XIA YX,YUAN Q,et al, 2005. Detection of mixinfected potato viruses with multiplex RT-PCR [J]. Acta Phytopathol Sin, 35(2):109-115. [王中康,夏玉先,袁青,等, 2005. 马铃薯种苗复合感染病毒多重RT-PCR同步快速检测 [J]. 植物病理学报, 35(2):109-115.]
WU XQ,TAN XR,CHEN SH,et al, 2006. Cloning and sequence analysis of CP gene of potato leaf roll virus fujian isolate [J]. J Henan Agric Univ, 40(4):391-393. [吴兴泉,谭晓荣,陈士华,等, 2006. 马铃薯卷叶病毒福建分离物的基因克隆与序列分析 [J]. 河南农业大学学报, 40(4):391-393.]
ZHANG HL, 1996. The advances in PLRV genome research [J]. Virol Sin, 11(1): 1-8. [张鹤龄, 1996. 马铃薯卷叶病毒(PLRV)基因组研究进展 [J]. 中国病毒学, 11(1): 1-8.]
ZHANG HP,ZHANG JF,LIU JY,et al, 2011. Triplex-RT-PCR detection of PVY,PVS and PLRV in potato [J]. Acta Agric Boreal-Sin, 25(6):40-45. [张华鹏,张剑锋,刘俊莹,等, 2011. 马铃薯上PVY、PVS和PLRV的三重RT.PCR检测 [J]. 华北农学报, 25(6):40-45.]
ZHANG W,BAI YJ,FAN GQ, et al, 2014. Establishment of multiplex RT-PCR system for detection of three potato viruses [J]. J NE Agric Univ,5:13-18. [张威,白艳菊,范国权,等, 2014. 三种马铃薯病毒多重RT-PCR检测体系建立 [J]. 东北农业大学学报,5:13-18.]
ZHOU Y,YANG YZ, 2008. Amplification of conserved sequence fragment in the Potato Leaf-Roll Virus genome by reverse transcription and polymera-se chain reaction(RT-PCR) [J]. J Qinghai Univ: Nat Sci Ed,26(2):16-19. [周云,杨永智, 2008. 马铃薯卷叶病毒基因组保守序列片段的RT-PCR扩增 [J]. 青海大学学报·自然科学版,26(2):16-19.]
Improved method detectionPotatoleafrollvirusin aphids
HAN Shu-Xin2, BAI Yan-Ju1,2*, ZHANG Wei1,2, GAO Yan-Ling1,2,FAN Guo-Quan1,2, ZHANG Shu1, SHEN Yu1
( 1.HeilongjiangAcademyofAgriculturalSciences, Harbin 150086, China; 2.NortheastAgriculturalUniversity, Harbin 150030, China )
In the potato production,Potatoleafrollvirus(PLRV) can be caused enormous harm,so that the PLRV is a very important disease in potato production. RT-PCR is a commonly used method for detection of the PLRV, and the detection method is high accuracy, low cost and widely used for detection of the PLRV in potato production. But in the actual production, the samples of detection often are the infected plants, and theMyzuspersicaethat is the main mediator of PLRV is not detected, because of the aphid’s small volume, RNA extraction of high difficulty, high cost, and that can not be rechecked extraction. For these reasons, the detection method of RT-PCR can not often be used in the potato production. In this paper, we used potato susceptible plants and viruliferous aphids as experimental materials, and used the improved method of RNA extraction from which they were extracted by PLRV RNA. Then, we made detection with PCR, and the specific primers were designed that refer of CP gene. The experimental results showed that the RNA extraction of potato susceptible plants and viruliferous aphids was integral that could be used to detect the PLRV in aphids, and it also can be used to detect the PLRV in potato susceptible plants. In addition, we used this method to detect the field of aphids and wingless aphids carrying PLRV. Wingless aphids PLRV positive rate was 100%, the positive rate of PLRV of aphids was as high as 60%, which proved that there was a good pragmatism of the practicability of the system in potato production. In this study, we used the improved efficacious method to extract RNA, and used RT-PCR to detect the PLRV in aphids. Compared with the detection of method, the new method is simple and practical, it can be used in potato production test, and it is a new means for the prevention and control of the PLRV in the potato production.
Potatoleafrollvirus, aphid, CP gene, detection
10.11931/guihaia.gxzw201411004韩树鑫, 白艳菊, 张威, 等. 蚜虫中携带马铃薯卷叶病毒检测方法的改进 [J]. 广西植物, 2016, 36(8):986-992
HAN SX, BAI YJ, ZHANG W, et al. Improved method detectionPotatoleafrollvirusin aphids [J]. Guihaia, 2016, 36(8):986-992
2014-11-03
2015-03-28
国家农业部现代农业产业技术体系专项 (CARS-10-P14) [Supported by Special Fund for Technology System of Modern Agricultural Industry from Ministry of Agriculture (CARS-10-P14)]。
韩树鑫(1984-),男,博士研究生,研究方向为植物分子病理学,(E-mail)pluto789@163.com。
白艳菊,硕士,研究员,研究方向为植物分子病理学,(E-mail)yanjubai@163.com。
Q945.8
A
1000-3142(2016)08-0986-07
