通过体外代谢途径构建确定乳酸合成关键酶
2016-09-19马春玲张彦飞巨晓芝刁爱坡马红武
马春玲,张彦飞,杨 雪,巨晓芝,刁爱坡,马红武*
(1.天津科技大学生物工程学院,天津300457;2.中国科学院系统微生物工程重点实验室,中国科学院天津工业生物技术研究所,天津300308)
通过体外代谢途径构建确定乳酸合成关键酶
马春玲1,2,张彦飞2,杨雪2,巨晓芝1,2,刁爱坡1,马红武2*
(1.天津科技大学生物工程学院,天津300457;2.中国科学院系统微生物工程重点实验室,中国科学院天津工业生物技术研究所,天津300308)
基于代谢控制分析理论提出了一种通过体外代谢途径构建和分析确定关键酶的方法并应用其确定乳酸高产菌株中的关键酶。首先获得高产菌株的粗酶液并测定葡萄糖到乳酸合成途径中各种蛋白的绝对浓度,进而通过向粗酶液中分别添加同等比例的各纯酶对途径进行扰动,并由扰动前后的途径通量变化计算出各酶的通量控制系数以确定关键酶。结果表明,该菌株乳酸合成途径中丙酮酸激酶和甘油醛-3-磷酸脱氢酶对途径通量影响最大,由此预测在该菌株基础上进一步过表达这两个酶对提高乳酸生成速率可能最为有效。
体外代谢途径构建;乳酸合成途径;代谢控制分析;关键酶;通量控制系数
乳酸是自然界中最小的手性分子,广泛存在于生物体中,是世界上被公认的三大有机酸之一,广泛应用于医药、印刷、印染、制革、烤烟等领域[1]。目前,世界上90%的乳酸由发酵法生产获得,少量由化学合成法生产[2-3]。近年来,因为大肠杆菌生长速度快、营养需求简单等优点,应用大肠杆菌基因改造菌株生产D-乳酸也得到了人们越来越多的关注[4-5]。构建高产D-乳酸菌株的常用方法有引入高活性外源酶、过表达关键酶及对酶基因的序列进行改造以解除抑制等,这些方法往往需要以确定关键酶为前提。为提高乳酸生成量,人们首先会考虑增加D-乳酸脱氢酶(D-lactate dehydrogenase,D-LDH)基因的表达量,但BUNCH P K等[6]的研究结果表明,在大肠杆菌中过量表达D-LDH反而会使菌体生长变慢,影响D-乳酸的生成。
该文利用体外代谢途径构建和代谢控制分析的方法对葡萄糖到乳酸合成途径中各酶对合成通量的影响进行了分析,计算通量控制系数,确定途径关键酶,为胞内改造提供指导方向。
1 材料与方法
1.1材料与试剂
Prime STAR mix、限制性内切酶、T4 DNA连接酶、蛋白标准品(Marker):New England Biolabs;葡萄糖、葡萄糖-6-磷酸、果糖-6-磷酸、果糖1,6-二磷酸、甘油醛-3-磷酸、二羟丙酮磷酸、磷酸烯醇式丙酮酸、乳酸脱氢酶、乳酸:美国Sigma公司;丙酮酸、腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)、二磷酸腺苷(adenosine diphosphate,ADP)、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinu cleotide,NAD+)、烟酰胺腺嘌呤二核苷磷酸(nicotinamide adeninedinucleotidephosphate,NADP+)、磷酸盐:北京索莱宝科技有限公司。
1.2仪器与设备
V-1600可见分光光度计:上海美普达仪器有限公司;DRP-9162电热恒温培养箱:上海森信实验仪器有限公司;Tecan infinite M 200 PRO多功能微孔板检测仪:瑞士Tecan公司;1260 Infinity LC高效液相色谱(highperformance liquid chromatography,HPLC)分析仪:美国Agilent公司。
1.3方法
本区硅质岩主量元素分析结果列于表2。SiO2的含量较高,平均为89.82%,SiO2的含量高低与镜下观察的硅质物质比例基本吻合;Al2O3、TiO2及Fe2O3平均含量分别为4.16%、0.17%和1.86%,MgO和CaO含量较低,MnO的含量小于0.01%,研究Fe/Mn的比值可以确定矿床的成因类型。本区硅质岩微量元素分析结果见表3。由表2可以看出,Sc的含量平均为4.13×10-6。U和Th的含量平均含量分别为3.16×10-6和4.34×10-6,U/Th比值的平均值为0.84。下石炭统V的含量高于上泥盆统,且在接近地质界线处为最高165×10-6。
1.3.1乳酸高产菌株粗酶液的制备
将实验室筛选得到的一株D-乳酸高产菌株培养至对数期(12~14 h),取发酵液离心获得菌体,再经过重悬、破碎、离心取上清及透析后得到不含小分子干扰物的粗酶液,用于后续研究。
1.3.2质粒构建及蛋白纯化
根据GenBank基因序列及pET-28a的多克隆位点(multiple cloning site,MCS),应用Primer premier 5.0软件设计引物F1/R1,以E.coli MG1655基因组为模板,扩增目的片段。以pET-28a(+)为载体,以E.coli BL21(DE3)为宿主,经异丙基硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)诱导12~16h后,离心获得菌体。把菌体重悬后,经破碎取上清,得到细胞液。利用咪唑对细胞液进行梯度洗脱,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)验证[16-17]后,收集目标蛋白,透析浓缩,经Bradford法定量后,分装、置于-80℃保存。
1.3.3乳酸合成途径蛋白催化速率的测定
基于NAD(P)H在波长340 nm处有吸收光,通过酶偶联的方法可测定NAD(P)H的生成或消耗,可进一步计算出反应中途径蛋白的催化速率。利用偶联酶间接测定催化速率时,要考虑反馈抑制[18]、底物及偶联酶过量等问题。由于底物甘油酸-1,3-二磷酸、甘油酸-3-磷酸、甘油酸-2-磷酸无法体外获得,故甘油酸磷酸激酶(phosphoglycerate kinase,Pgk)、甘油酸磷酸变位酶(2,3-bisphosphoglycerate-dependent phosphoglycerate mutase,GpmA)、烯醇化酶(enolase,Eno)的催化速率尚无法测定,因此未针对这三个酶进行研究。乳酸合成途径中各蛋白催化速率的测定原理及反应方程见表1。
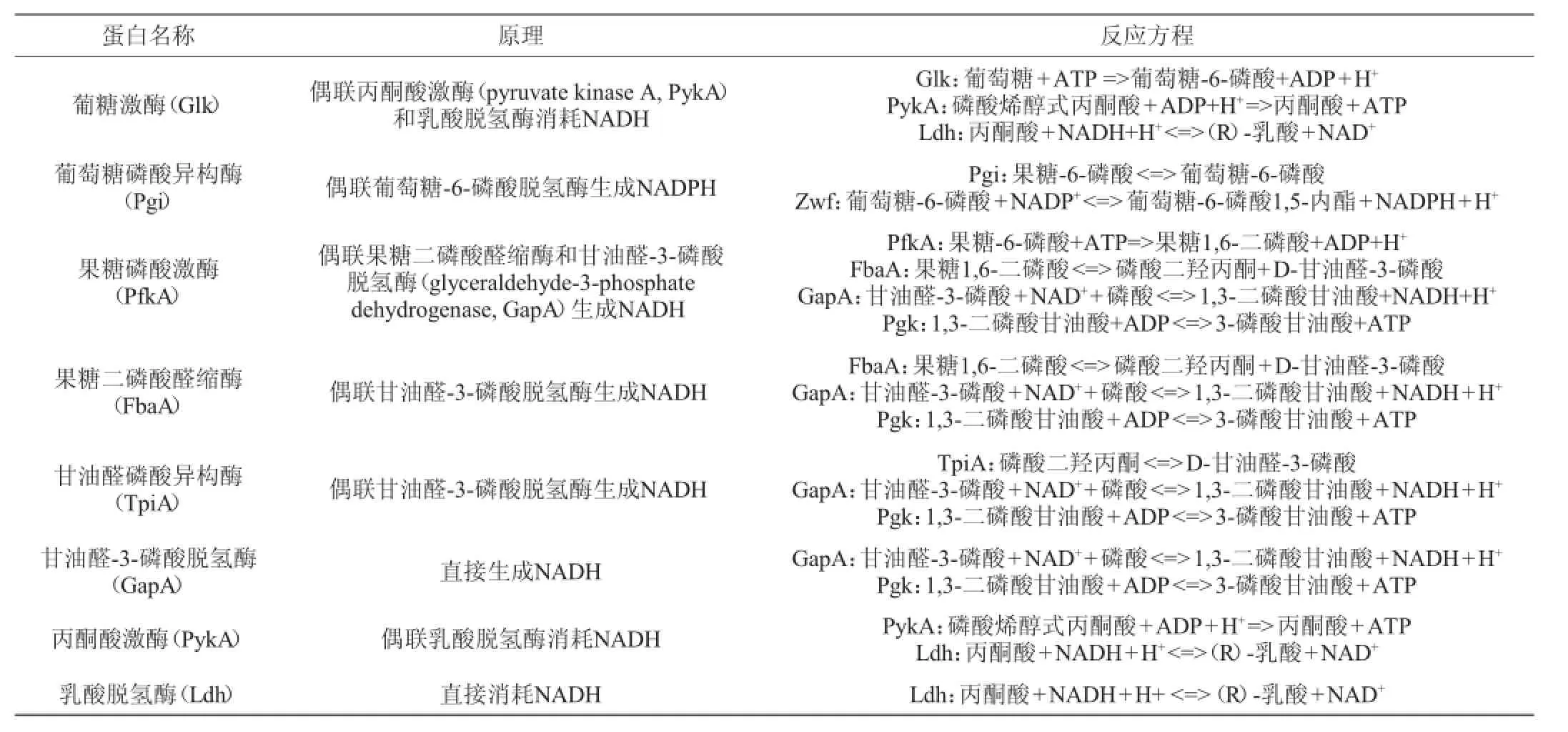
表1 乳酸合成途径中各蛋白催化速率的测定原理及反应方程Table 1 Measuremen t princip les and reaction equations of catalysis rates of the enzym es in the lac tate synthesis pathway
1.3.4代谢物浓度测定
(1)NADH浓度的检测
利用光栅型多功能微孔检测仪Tecan infinite M 200 PRO进行在线测定,紫外检测波长为340 nm,检测池温度为37℃,样品量200 μL。
(2)乳酸浓度的检测
利用高效液相色谱(HPLC)进行测定,色谱柱为BIORAD Aminex HPX-87H有机酸柱(7.8 mm×300 mm),柱温45℃,流动相为终浓度5 mmol/L的H2SO4,流速0.6 m L/min,串联连接RID、VWD检测器,紫外检测波长为190 nm,检测池温度为35℃。每个样品进样量为10 μL,分析时间为26 m in。
1.3.5计算公式
通量控制系数(FCCs)可以由下面的公式计算,FCC越大,代表酶浓度改变对途径的通量影响越大。
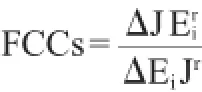
式中:Jr和表酶浓度改变后的酶量和途径通量值;ΔJ是指酶量改变后通量的变化;ΔEi是指酶浓度的变化量。
2 结果与分析
2.1乳酸合成途径中各蛋白的表达纯化
目的蛋白100℃变性10 min后,SDS-PAGE结果如图1所示。

图1 目的蛋白SDS-PAGE图谱分析Fig.1 SDS-PAGE analysis of target protein
由图1可知,目的蛋白基本没有杂带,可用于后续实验。
2.2粗酶液中乳酸合成途径各蛋白绝对浓度的测定
蛋白组学测定方法虽然可以同时测得多个蛋白的浓度变化,但结果一般是该蛋白在不同条件下的相对浓度变化而非绝对浓度,而代谢控制分析需要酶的绝对浓度。针对这一问题提出了一种通过纯酶滴定确定粗酶液中各酶绝对浓度的方法。首先对要定量的酶添加过量底物使其反应速率仅受酶浓度影响,然后在粗酶液中添加不同浓度的纯酶,通过纯酶添加浓度和反应速率的拟合曲线得到原粗酶液中相应酶的绝对浓度。以Glk为例,在200 μL粗酶反应体系中加入过量葡萄糖、ATP、磷酸烯醇式丙酮酸及偶联酶,为了使反应速率控制在合适的范围内,得到更多NADH浓度处于线性变化阶段的数据,需将粗酶稀释60倍后待用。测定只有粗酶液及添加不同浓度Glk纯酶后的反应速率,结果如图2所示。

图2 反应体系中Glk质量浓度变化对反应速率的影响曲线Fig.2 Changing curve of reaction rates w ith the Glk concentrations on reaction ra te
由图2可知,纯酶质量浓度与反应速率拟合可得到一线性关系,当纯酶质量浓度为0时的速率(Y轴截距)即粗酶液中Glk催化反应的速率,其在X轴上的截距即对应Glk在稀释后粗酶液中的绝对质量浓度,为0.63 mg/L。由稀释率可推算出原粗酶液中含有的Glk蛋白质量浓度为37.8 mg/L。
根据确定粗酶液中Glk蛋白定量的方法最终确定乳酸合成途径中各种蛋白的含量见图3。
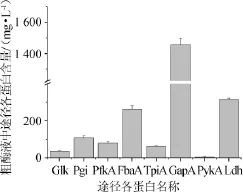
图3 粗酶液中乳酸合成途径各蛋白浓度的绝对定量Fig.3 Enzymes absolute concentrations of the lactate synthesis pathway in the crude enzyme
由图3可以看出,在此高产菌株的粗酶液中GapA蛋白浓度远高于其他蛋白,可能是由于GapA催化反应中有NADH产生,而乳酸的生成消耗NADH,GapA蛋白含量较多能够提供更多的合成还原力使该菌株能够更有效地合成乳酸。
2.3乳酸合成途径中各蛋白的通量控制系数计算
基于菌种基因工程改造过程中酶量常发生较大变化,选择将每个酶的浓度都增加到其在稀释粗酶液浓度中的两倍。代谢控制分析时要测量整个途径达到拟稳态时的通量,在葡萄糖到乳酸的合成途径中的中间代谢物都可通过前面的反应生成,因此在多酶反应体系中只需添加初始底物葡萄糖、ATP、ADP、NAD+和磷酸。参考BRENDA数据库中的亲和常数Km值及文献中胞内代谢物浓度水平[19],结合实验摸索,确定当上述代谢物终浓度分别为5 mmol/L、5 mmol/L、2 mmol/L、2 mmol/L、2 mmol/L时已足够保证底物为过量。同样,在上述稀释60倍后的粗酶液基础上,分别添加不同纯酶,纯酶添加量均为粗酶稀释液中对应该蛋白绝对浓度2倍。因合成途径的最终产物是乳酸,以乳酸合成速率代表整个途径的通量,乳酸的生成速率见图4。

图4 各纯酶添加后乳酸的生成速率Fig.4 Lactate production rate after enzym e addition
由图4可知,在粗酶液催化反应基础上添加纯酶PykA及纯酶GapA时有较大的乳酸生成速率。
经计算,途径中各种蛋白的通量控制系数(FCCs)见图5。

图5 乳酸合成途径中各蛋白的通量控制系数Fig.5 Flux control coefficients of the enzymes in the lactate synthesis pathway
由图5可知,PykA的FCC最大,其次是GapA,在蛋白浓度绝对定量的结果中,粗酶液中PykA浓度最低,其为催化生成乳酸的前体物质丙酮酸的步骤,使得添加PykA后对代谢途径通量影响最大。GapA催化反应生成NADH,而乳酸生成需要消耗NADH,所以GapA含量增加也对代谢途径通量影响较大。
3 结论
本研究利用体外代谢途径分析的方法确定了一株乳酸合成大肠杆菌中从葡萄糖到乳酸各步酶的绝对浓度,为确定该菌株的关键酶奠定了基础,进而通过向粗酶液中添加纯酶的方法对体外多酶反应体系进行扰动,基于代谢控制分析原理求得各个酶的通量控制系数从而确定对通量具有较大影响的关键酶。结果表明,该菌株中PykA和GapA为乳酸合成通量控制的关键酶,在后续代谢工程改造中可以作为过表达靶点以进一步提高乳酸合成速率。
[1]胡永红,管珺,杨文革,等.发酵法生产D-乳酸的研究进展[J].食品与发酵工业,2007,33(12):99-103.
[2]VIJAYAKUMAR J,ARAVINDAN R,VIRUTHAGIRI T.Recent trends in the production,purification and application of lactic acid[J].Chem Biochem Eng Q,2008,22(2):245-264.
[3]吴军华.生物质制备乳酸研究进展[J].中国酿造,2011,30(10):9-12.
[4]DATSENKOK A,WANNER B L.One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J].P Natl Acad Sci USA,2000,97(12):6640-6645.
[5]ZHOU S D,CAUSEY T B,HASONA A,et al.Production of optically pured-lactic acid in mineral salts medium by metabolically engineered Escherichia coli W 3110[J].App l Environ M icrobiol,2003,69(1):399-407.
[6]BUNCH P K,JAN F M,LEE N,et al.The ldhA gene encoding the fermentative lactate dehydrogenase of Escherichia coli[J].M icrobiology,1997,143(1):187-195.
[7]KIM B,KIM W J,KIM D I,et al.Application of genome-scale metabolic network model in metabolic engineering[J].J Ind M icrobiol Biot,2014,42(3):339-348.
[8]KING Z A,LLOYD C J,FEIST A M,et al.Next-generation genomescale models for metabolic engineering[J].Curr Opin Biotechnol,2015,35:23-29.
[9]MCCLOSKEY D,PALSSON B,FEIST A M.Basic and applied uses of genome-scale metabolic network reconstructions of Escherichia co li[J]. M ol Syst Biol,2013,9(1):661-666.
[10]PARK J M,PARK H M,KIM W J,et al.Flux variability scanning based on enforced objective flux for identifying gene amplification targets[J]. BM C Syst Biol,2012,6(2):106-112.
[11]王景川,庞广昌.乳酸代谢通量调控规律的研究[J].食品科学,2009,30(21):246-251.
[12]DE ATAURI P,RODRIGUEZ-PRADOS J C,MAURY J,et al.In silico strategy to rationally engineer metabolite production:a case study for threonine in Escherichia coli[J].Biotechnol Bioeng,2009(25):609-620.
[13]CHASSAGNOLE C,FELL D A,RAIS B,et al.Control of the threonine synthesis pathway in Escherichia coli:a theoretical and experimental approach[J].Biochem J,2001,356:433-444.
[14]SMALL J R,KACSER H.Responses of metabolic systems to large changes in enzyme activities and effectors[J].Eur J Biochem,1993,213:625-640.
[15]ZHANG Y F,MENG Q L,MA H W,et al.Determ ination of key enzymes for threonine synthesis through in vitro metabolic pathway analysis[J].M icrob Cell Fact,2015,86(14):1-10.
[16]ULUSU Y,S,ENTÜRK S B,KUDUGˇH.Expression,purification,and characterization of bovine chymosin enzyme using an inducible pTOL system[J].Prep Biochem Biotech,2015,18(6):245-254.
[17]ASHRAFI F,FALLAH MEHRABADI J,SIADAT S D,et al.Expression and purification of the uropathogenic Escherichia coli PapG protein and its surface absorption on Lactobacillus reuteri:implications for surface display system vaccines[J].Jund ishapur J M icrobiol,2015,8(9):25595-25603.
[18]OGAWA T,MORI H,TOM ITA M,et al.Inhibitory effect of phosphoenolpyruvate on glycolytic enzymes in Escherichia coli[J].Res M icrobiol,2007,158(2):159-63.
[19]CHRISTOPHE C,NARUEMOL N R,JOACHIM W S,et al.Dynamic modeling of the central carbon metabolism of Escherichia coli[J].W iley Periodicals,2002,79(1):53-73.
Determ ination of key enzymes for lactate synthesis through in vitro metabolic pathway construction
MA Chunling1,2,ZHANG Yanfei2,YANG Xue2,JU Xiaozhi1,2,DIAO A ipo1,MA Hongwu2*
(1.College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China;2.Key Laboratory of Systems M icrobial Biotechnology,Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China)
A method was presented for key enzyme determination through in vitro metabolic pathway analysis based on the metabolic control analysis theory and it was used to determ ine the key enzymes in lactate-producing strain.Firstly,crude enzyme extracts were obtained from the strain and the absolute protein concentrations for all enzymes in the pathway from glucose to pyruvate were measured.Then individual pure enzymes were added to the crude extract and the pathway flux changes were measured to calculate the flux control coefficients(FCCs)of the enzymes to determine the key enzymes.It was found that pyruvate kinase(PykA)and glyceraldehyde-3-phosphate dehydrogenase(GapA)had the largest effect on FCCs,and thus should be the gene overexpression targets for further improvement of lactate production.
in vitro metabolic pathway construction;lactate synthesis pathway;metabolic control analysis;key enzyme;flux control coefficient
Q815
0254-5071(2016)05-0144-05
10.11882/j.issn.0254-5071.2016.05.030
2016-02-15
国家重点基础研究计划‘973计划’(Nos.2012CB725203);国家高技术研究发展计划‘863计划’(No.2012AA 022103);天津市科技支撑计划重点项目(No.14ZCZDSY 00060)
马春玲(1990-),女,硕士研究生,研究方向为合成生物学。
马红武(1970-),男,研究员,博士,研究方向为系统微生物学。
