人大肠癌癌旁不同部位组织生长活性与组织微环境相关细胞组分差异分析
2016-09-19吴丽云刘金元广州中医药大学脾胃研究所广东广州510405
刘 红,文 彬,吴丽云,刘金元广州中医药大学脾胃研究所,广东 广州,510405
人大肠癌癌旁不同部位组织生长活性与组织微环境相关细胞组分差异分析
刘 红,文 彬,吴丽云,刘金元
广州中医药大学脾胃研究所,广东 广州,510405
背景与目的:肿瘤微环境已成为现今的肿瘤研究热点,而其对大肠癌启动也有重要意义。建立大肠癌癌旁组织体外培养实验体系,观察距大肠癌病灶不同距离肠上皮组织体外生长特性,并对这些不同部位肿瘤组织微环境中主要的细胞组分进行检测,研究不同部位组织体外生长特性与细胞组分间可能的相关性。方法:在距离大肠癌病灶近端手术切除取最远端(大于等于10 cm),癌旁(约2 cm)和二者中间位(约5 cm)分别取得组织样本,根据距病灶远近依次命名为1、2和3号位组织样本。通过重复贴壁法对组织块进行体外培养,观察组织的生长活性的差异。使用常规石蜡切片-HE染色方法和免疫组织化学检测3个部位中不同细胞组分标志物Cyclin D1(CD1)、CD133、细胞角蛋白(cytokeratin18,CK18)、波形蛋白(vimentin)和α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的表达及分布情况。结果:在最靠近肿瘤病灶的3号位组织细胞生长活性最高,其爬出细胞量与速度均高于2号位和1号位,且3号位组织的生长活性与患者的肿瘤恶性分期相关。免疫组织化学检测结果表明,在1、2、3号位中,CD1、CD133、vimentin和α-SMA表达逐渐增高,而CK18表达逐渐降低。结论:在大肠癌变过程中,其组织结构和细胞组分发生了明显的变化,提示微环境的结构和成分改变可能促进肿瘤发生、发展。
肿瘤微环境;大肠癌;免疫组织化学
肿瘤的发生、发展过程不仅与自身的突变和基因不稳定性相关,更离不开肿瘤细胞与其所处的微环境之间的动态交换及反应的作用。这些行为逐渐破坏邻近的细胞与基质之间的正常联系和组织的正常结构,组织架构和内稳态的改变是肿瘤启动的早期信号。微环境的稳定是保证细胞正常增殖、分化、代谢和功能活动的重要前提。肿瘤微环境(cancer microenvironment)是指由肿瘤细胞、内皮细胞及其前体细胞、周细胞、平滑肌细胞、肿瘤相关性成纤维细胞、免疫细胞、细胞外基质等相互作用形成的肿瘤细胞生长的特殊环境[1],它们在癌变发生过程中均发生了不同的变化。组织的结构及相关微环境的细胞类型、丰度、表型特征对组织重塑有重要作用,它们的改变与肿瘤的发生、发展密切相关[2-4]。 随着对肿瘤的深入研究,越来越多的研究者认识到肿瘤微环境对肿瘤的发生、发展至关重要[5-7]。而正常微环境下的组织结构及相关细胞的类型、丰度是组织重塑的重要内容;其改变则与肿瘤的发生、发展密切相关。本研究对肠肿瘤细胞选用Cylin D1(CD1)作为其标志物[8-10],大肠肿瘤干细胞选用CD133[11-12],上皮细胞选用细胞角蛋白(cytokeratin 18,CK18)[13-14],成纤维细胞选用波形蛋白(vimentin)和α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)[15-17]。
本研究通过对距离大肠癌癌旁组织不同距离的癌旁组织进行体外培养,探索组织结构的改变在肿瘤发生中的意义;并通过对肿瘤微环境中的不同细胞类型标志物进行检测,探讨不同距离癌旁组织的体外培养的生长活性差异与肿瘤微环境改变的相关性以及肿瘤微环境细胞成分的改变对大肠癌发生的意义。
1 材料和方法
1.1材料
1.1.1组织样本
标本取自广州中医药大学附属医院2013年11月—2014年6月手术切除的23例中分化结肠癌患者,其中男性16例,女性7例,平均年龄(56.8±10.6)岁。所有患者均为散发性大肠癌,术前未接受任何放、化疗,所有病例均经两位以上病理医师确诊。标本获取位置如图1所示,每例依次在距离大肠癌病灶近端(大于等于10 cm)、二者中间位(约5 cm)、癌旁(约2 cm)处切取,按顺序标记为1、2和3号位。
图1 标本取材部位示意图Fig.1 Position of tissues used in this research
1.1.2主要试剂
CK18(bs-1339R)、vimentin(bs-8533R)、CD1(bs-0623R)和CD133(bs-0209R) 购自北京博奥森生物技术有限公司,α-SMA (ab124964)购自英国Abcam公司,SABC大鼠IgG试剂盒(SA1025)和SABC兔IgG试剂盒(SA1022) 购自武汉博士德生物工程有限公司,培养液RPMI-1640(C11875)、Hanks 缓冲液(C14175)、青霉素和链霉素(15140)购自美国Gibco公司,CO2培养箱购自美国Thermo公司,倒置相差显微镜(DP70)购自日本Olympus公司。基础培养液:RPMI-1640(含青霉素100U/mL、链霉素100 g/ mL)、Hanks运输液(含青霉素200 U/mL、链霉素200 μg/mL)、Hanks 洗液(含青霉素100 U/mL、链霉素100 μg/mL)。
1.2主要方法
1.2.1组织培养
手术室取新鲜组织标本,置于预冷的Hanks运输液中带回实验室。无菌条件下,分别将3个部位的组织样本去除坏死组织、脂肪组织和血凝块,用Hanks洗液冲洗10次,然后将组织块置于无菌培养皿中,将组织块剪成大小为1~2 mm3小块,用培养液再清洗3次,将切好的组织块均匀地置于6孔培养板上,吸去多余的培养液,各组织小块之间相距0.5 cm。盖好培养板盖,倒置于37 ℃、CO2体积分数为5%的培养箱中,3 h后,待组织块边缘微干涸,将培养板取出,加入培养液,组织黏膜层向上,处于气-液交界面,平放入培养箱培养。每24 h换液1 次。7 d后对其组织生长形态学进行分析。
1.2.2免疫组织化学检测
标本经4%多聚甲醛固定,常规石蜡包埋,采用4 μm厚连续切片。常规脱蜡水化,PBS冲洗,3%过氧化氢灭活内源性过氧化物酶,微波修复15 min,加入一抗于4 ℃过夜;用PBS冲洗2 min重复3次,滴加相应二抗于37 ℃衡温箱温育30 min,具体步骤按试剂盒说明书操作。采用DAB显色,苏木精复染,常规乙醇脱水,二甲苯透明,中性树胶封片,置于显微镜下观察结果。每例标本均采用PBS代替一抗作为阴性对照组。应用IPP 6.0病理图像分析软件测定各组免疫阳性产物的光密度值(D值),每张切片随机测定6个视野,同时测定同一张切片上组织的D值作为背景,免疫反应产物的D值减去背景D值得到校正的D值(COD值),即为各阳性产物的实际吸光度值,然后求平均值作为该样本的COD值。用COD值进行分析和比较,以避免染色过程中的非特异性染色等导致的误差。
1.3统计学处理
采用SPSS 16.0统计软件对数据进行处理,各组实验数据以±s 表示,计量资料进行均数间比较采用t检验或方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1组织培养结果
组织培养7 d后发现,大多数样本在最靠近大肠癌病灶的3号位组织细胞生长活性最高,有较多的细胞从组织中爬出,且细胞生长速度较快,而1、2号位组织从组织块中爬出细胞量与速度较3号位低(图2)。
2.2肠组织隐窝结构分析
异常隐窝的出现是大肠癌发生的最早期事件,它也是大肠癌早期诊断的观察指标之一,正常隐窝和异常隐窝在形态学上有很大差异[18-20]。在本研究中,通过HE染色对3个不同部位组织中隐窝的形态特征进行观察。在距离大肠癌病灶最远的1号部位组织中,隐窝结构基本正常无明显改变,排列紧密且整齐,腺腔直径正常,单层排列,细胞核大小正常(图3A)。而部分样本的2号位则表现出较大的隐窝,直径大小不一,有的管腔呈锯齿状,细胞核增大拉长,排列拥挤,隐窝间质细胞和杯状细胞有所增加(图3B)。在距离癌变病灶最近的3号位中出现大量异常隐窝病灶,柱状细胞减少,杯状细胞和间质细胞明显增多,排列拥挤、紊乱,细胞组分发生明显改变。上皮层增厚,细胞核增大,隐窝异型增生明显,腺管染色加深,隐窝直径异常增大,有的隐窝结构完全消失,丧失组织正常结构(图3C)。

图2 体外培养Fig.2 Culture in vitro (×200)

图3 HE染色Fig.3 HE staining (×200)
2.3肠组织细胞组分差异分析
CD1作为肿瘤细胞的标志物,主要分布在肿瘤细胞的细胞核、细胞质和细胞膜上。免疫组织化学技术检测结果表明,1、2和3号部位组织中均有CD1表达(图4A~C),1号位上仅有极少数细胞表达,但在3号位间质中大量表达。应用IPP 6.0病理图像分析软件测定各组免疫阳性产物的光密度值:1、2和3号部位光密度值分别为0.334 004±0.039 739、0.331 365±0.042 054和0.380 984±0.022 47。3号位的表达明显高于1、2号位,差异有统计学意义(P<0.05)。
CD133作为肿瘤干细胞的标志物,主要表达在肿瘤干细胞的细胞膜上。免疫组织化学技术检测结果表明,1、2和3号部位组织中均有CD133表达(图4D~F),1号位上仅有极少数细胞表达,3号位隐窝中大量表达。应用IPP 6.0病理图像分析软件测定各组免疫阳性产物的光密度值,1、2、3号部位光密度值分别为0.320 269±0.031 419、0.379 482±0.059 796和0.409 386±0.024 943。2、3号位的表达高于1号位,差异有统计学意义(P<0.05)。
CK18作为上皮细胞的标志物,主要表达在单层上皮组织中。免疫组织化学结果表明,1、2和3号部位组织中均有CK18表达(图4G~I),1号位在上皮细胞的细胞质中有表达,3号位几乎无表达。应用IPP 6.0病理图像分析软件测定各组免疫阳性产物的光密度值,1、2和3号部位光密度值分别为0.317 105±0.022 426、0.233 354±0.025 799和0.286 773±0.003 611。1号位的表达高于2、3号位,差异有统计学意义(P<0.05)。
作为成纤维细胞的标志物,vimentin主要在成纤维细胞的细胞质中表达。α-SMA作为肌成纤维细胞的标志物,主要表达在肌成纤维细胞的细胞质中。免疫组织化学技术检测结果表明,1、2和3号部位组织中均有vimentin(图4J~L)和α-SMA(图4M~O)表达,1号位少量表达,2、3号位组织的间质中大量表达。应用IPP 6.0病理图像分析软件测定各组免疫阳性产物的光密度值,vimentin在1、2和3号部位光密度值分别为0.346 010±0.043 541、0.383 070±0.052 834 和0.405 510±0.003 268。2、3号位的表达都高于1号位,差异有统计学意义(P<0.05);α-SMA在1、2和3号部位光密度值分别为0.213 457±0.033 147、0.312 185±0.031 564和0.284 130±0.048 783。2、3号位的表达都高于1号位,差异有统计学意义(P<0.05)。
阴性对照中用PBS代替一抗,其余步骤试剂及方法不变。阴性对照中无棕黄色染色(图5)。
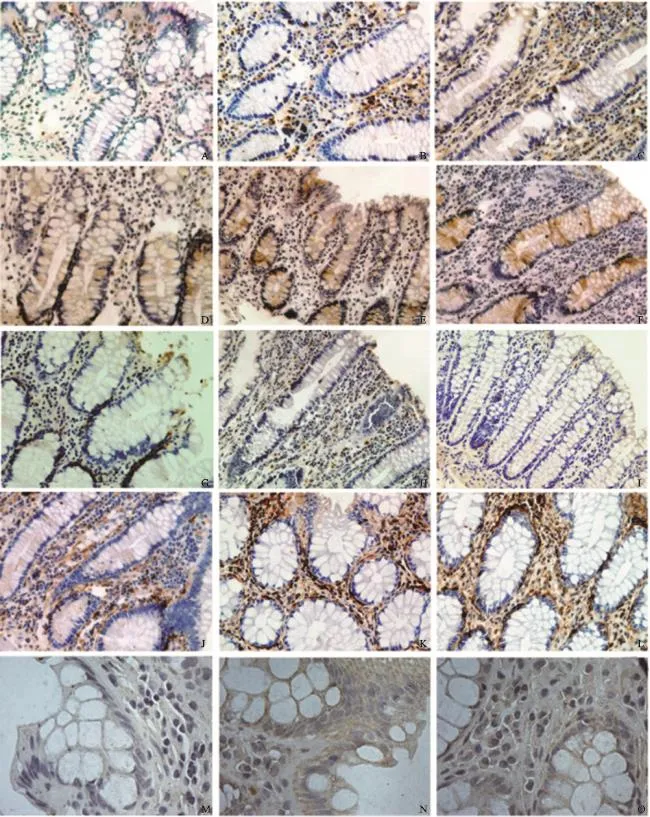
图4 免疫组织化学技术检测CD1、CD133、vimentin、CK18和α-SMA的表达Fig.4 The expressions of CD1,CD133,vimentin,CK18 and α-SMA in diferent positions detected by immunohistochemistry (×400)
图5 阴性对照Fig.5 Negative staining (×400)
3 讨 论
本研究通过免疫组织化学技术对组织的细胞成分的表达进行检测。肿瘤发生的微环境不仅包括肿瘤所在组织的结构,也包括其周围的组织细胞及其分泌的各种因子。肿瘤发生、发展是细胞增生和死亡的动态过程。一方面是肿瘤细胞大量增殖分裂,同时伴间质细胞的激活和增生,以及基质成分结构异常,导致肿瘤组织结构异常;另一方面是正常细胞和部分肿瘤细胞的凋亡和坏死,引起肿瘤组织发生炎性反应,大量炎性细胞聚集、小血管增生、成纤维细胞增多和肌成纤维细胞转化,以及细胞基质分泌增加。
目前已有很多学者认为,异常隐窝的出现是大肠癌发生的最早期事件,并把它作为大肠癌早期诊断的观察指标之一[21]。有研究发现,不同病变时期的隐窝在形态学上存在很大差异,其体积、形状、细胞核大小、表面光滑程度以及有无分支都与正常隐窝不同[22]。正常隐窝结构的改变对大肠癌癌变的诊断有重要意义。在HE染色中可以看到柱状细胞减少,杯状细胞和间质细胞明显增多,细胞核增大、排列紊乱,隐窝异型增生,这些现象提示,隐窝结构的改变可能与组织微环境内的细胞组分改变相关。
CD1是肠肿瘤细胞的特异标志物[8-10]。CD133是大肠肿瘤干细胞的标志物[11-12],这两种蛋白表达水平的上升提示大肠肿瘤细胞、大肠肿瘤干细胞在大肠癌变过程中数量增加。CD1是调控细胞周期的重要因子,能调控细胞G1/S期转换,也是最早发现的原癌基因,在很多肿瘤中都出现过表达[8-10]。过表达的CD1能使细胞周期使细胞始终处于旺盛分裂状态,造成细胞的失控性生长而引发癌变。大肠肿瘤干细胞仅占肿瘤细胞的小部分,具有自我更新的能力,并能产生异质性肿瘤细胞。而本研究检测发现,在大肠癌变过程中,大肠肿瘤干细胞的分布范围并不局限于隐窝基底,而是在整个隐窝中都有分布。
Vimentin是一种中间丝蛋白,参与维持细胞结构的稳定、细胞的生长分化状态[15-16]及细胞信号转导,还能调节蛋白间的相互作用。Vimentin主要表达于间质细胞中,是成纤维细胞的标志物[15-17],而α-SMA是肌成纤维细胞表型的标志性蛋白。在癌变发生过程中,成纤维细胞被激活转化为肌成纤维细胞。在正常组织中α-SMA不表达,说明癌细胞突破基底膜后,正常的成纤维细胞的生物学特性开始发生改变,即出现了肌成纤维细胞。肌成纤维细胞的出现,是癌细胞和间质成分相互作用的结果。肌成纤维细胞是原位肿瘤和转移癌组织的特征性间质表现,是胶原积聚和组织结构改建的重要原因,具有一定的收缩功能。肿瘤细胞激活的成纤维细胞表达α-SMA、大量胶原,以及其他基质成分的病理现象,称为“纤维成形反应”。高表达的vimentin和α-SMA增强了细胞侵袭和游走的能力。而这恰好可能解释了为什么越靠近肿瘤病灶的组织块生长活性越好。
CK18是一种直径8~l0 nm的中间丝,为上皮细胞细胞骨架的组成成分,是上皮细胞的特异性标志物[13-14]。本研究中CK18的低表达提示在癌变过程中上皮细胞逐渐减少,这可能与上皮细胞表型转变,参与上皮间质转化过程相关。细胞骨架是支撑细胞和容纳细胞内成分的主要结构。CK18和vimentin都是中间丝蛋白,在癌变过程中,CK18的下调和vimentin的上调可能导致细胞骨架的重构,促进上皮间质转化。
正常的组织结构和稳定的细胞组分对维持组织内稳态有重要意义。越靠近肿瘤病灶的组织爬出细胞量与速度越高,可以推断越靠近肿瘤病灶的组织其微环境的重构性越大。细胞组分的改变导致所处的微环境改变,促进了肿瘤的发生、发展。
[1] COUSSENS L M,WERB Z.Inflammation and cancer[J].Nature,2002,420(6917): 860.
[2] BETTINGTON M,WALKER N,CLOUSTON A,et al.The serrated pathway to colorectal carcinoma: current concepts and challenges[J].Histopathology,2013,62(3): 367-386.
[3] TARIN D.Cell and tissue interactions in carcinogenesis and metastasis and their clinical significance[J].Semin Cancer Biol,2011,21(2): 72-82.
[4] VALÁSKOVÁ Z,KINOVÁ S,DANIHEL L,et al.The complexity of interactions of the tumour growth process[J].Vnitr Lek,2009,55(12): 1145-1158.
[5] SIVEEN K S,KUTTAN G.Role of macrophages in tumour progression[J].Immunol Lett,2009,123(2): 97-102.
[6] LIOTTA L A,KOHN E C.The microenvironment of the tumour-host interface[J].Nature,2001,411(6835): 375-379.
[7] KIM B G,AN H J,KANG S,et al.Laminin-332-rich tumor microenvironment for tumor invasion in the interface zone of breast cancer[J].Am J Pathol,2011,178(1): 373-381.
[8] SERRANO M,HANNON G J,BEACH D A.A new regulatory motif in cell cycle control causing specific inhibition of cyclin D/CDK4l [J].Nature,1993,366(9): 704-707.
[9] LIN R J,LUBPAIREE T,LIU K Y.Cyclin D1 overexpression is associated with poor prognosis in oropharyngeal cancer [J].J Otolaryngol Head Neck Surg,2013,42: 23.doi: 10.1186/1916-0216-42-23.
[10] REN B,LI W,YANG Y.The impact of cyclin D1 overexpression on the prognosis of bladder cancer: a metaanalysis[J].World J Surg Oncol,2014,12(1): 55.
[11] O'BRIEN C A,POLLETT A,GALLINGER S,et al.A human colon cancer cell capable of initiating tumour growth in immunodeficient mice[J].Nature,2007,445(7123): 106-110.
[12] RICCI VITIANI L,LOMBARDI D G,PILOZZI E,et al.Identification and expansion of human colon cancer-initiating cells[J].Nature,2007,445(7123): 111-115.
[13] 许良中.实用肿瘤病理方法学[M].上海: 上海医科大学出版社,1997: 237-238.
[14] 张伟平,聂占国,代忠明,等.人结肠上皮细胞的原代培养[J].现代肿瘤学,2012,20(8): 1546-1548.
[15] LANG S H,HYDE C,REID I N,et al.Enhanced expression of vimentin in motile prostate cell lines and in poorly differentiated and metastatic prostate carcinoma[J].Prostate,2002,52(4): 253-261.
[16] SINGH S,SADACHARAN S,SU S,et al.Overexpression of vimentin: Role in the invasive phenotype in an androgen independent model of prostate cancer[J].Cancer Res,2003,63(9): 2306-2311.
[17] MUCHANETA-KUBARA E C,EI NAHAS A M.Myofibroblast phenotypes expression in experimental renal scarring[J].Nephrol Dial Transplant,1997,12(5): 904-915.
[18] TAMURA S,FURUYA Y,TADOKORO T,et al.Pit pattern and three-dimensional configuration of isolated crypts from the patients with colorectal neoplasm[J].J Gastroenterol,2002,37(10): 798-806.
[19] PRETLOW T P,PRETLOW T G.Mutant KRAS in aberrant crypt foci(ACF): initiation of colorectal cancer? [J].Biochim Biophys Acta,2005,1756(2): 83-96.
[20] CHENG L,LAI M D.Aberrant crypt foci as microscopic precursors of colorectal cancer[J].Wor1d J Gastroenterol,2003,9(12): 2642-2649.
[21] GUPTA A K,SCHOEN R E.Aberrant crypt foci: are they intermediate endpoints of colon carcinogenesis in humans?[J].Curr Opin Gastroenterol,2009,25(1): 59-65.
[22] TAMURA S,FURUYA Y,TADOKORO T,et al.Pit pattern and three-dimensional configuration of isolated crypts from the patients with colorectal neoplasm[J].J Gastroenterol,2002,37(10): 798-806.
Comparing the characteristics of tissue culture in vitro and different cell types of cancer microenvironment in tissues at diferent distances from colorectal cancer lesions
LIU Hong,WEN Bin,WU Liyun,LIU Jinyuan (Piwei Institute,Guangzhou University of Chinese Medicine,Guangzhou 510405,Guangdong Province,China)
Correspondence to: WEN BinE-mail: wenbin@gzucm.edu.cn
Background and purpose: Cancer microenvironment has become a hot topic of cancer research.It is important in the initiation of colorectal cancer.This study aimed to discuss the correlation between the characteristics of tissue culture in vitro and different cell types in cancer microenvironment.Methods: Samples were collected at different distances from the colorectal cancer lesions,which were named as positions 1,2 and 3 from distal to proximal.Tissues were cut into 1-2 mm3for in vitro culturing.HE staining was used to observe the structure of crypts.Immunohistochemistry was used to detect the expressions of Cyclin D1 (CD1),CD133,cytokeratin18 (CK18),vimentin and α-smooth muscle actin (α-SMA).Results: Position 3 grew faster than position 2 and position 1.As getting closer to the colorectal cancer lesions,expressions of CD1,CD133,vimentin and α-SMA were increased while expression of CK18 was decreased.Conclusion:The tissue structure and the expression of different cell types in cancer microenvironment changed more seriously as getting closer to the colorectal cancer lesions.This indicated that the change of cancer microenvironment may contribute to the initiation of colorectal cancer.
Cancer microenvironment; Colorectal cancer; Immunohistochemistry
10.19401/j.cnki.1007-3639.2016.07.007
R735.3+4
A
1007-3639(2016)07-0601-07
国家自然科学基金资助项目(81173257)。
文 彬 E-mail:wenbin@gzucm.edu.cn
2015-10-15
2015-12-30)
