慢病毒介导沉默食管癌细胞53BP1基因表达对裸鼠移植瘤放射敏感性的研究
2016-09-19刘志坤张魏丽祝淑钗苏景伟沈文斌河北医科大学第四医院放疗三病区河北石家庄0500河北医科大学公共卫生学院河北石家庄05007
刘志坤,张魏丽,祝淑钗,苏景伟,李 娟,沈文斌.河北医科大学第四医院放疗三病区,河北 石家庄 0500;.河北医科大学公共卫生学院,河北 石家庄 05007
慢病毒介导沉默食管癌细胞53BP1基因表达对裸鼠移植瘤放射敏感性的研究
刘志坤1,张魏丽2,祝淑钗1,苏景伟1,李 娟1,沈文斌1
1.河北医科大学第四医院放疗三病区,河北 石家庄 050011;2.河北医科大学公共卫生学院,河北 石家庄 050017
背景与目的:p53结合蛋白1(p53 binding protein,53BP1)在多种正常组织和肿瘤细胞中有表达,与放射线照射后细胞周期阻滞有关。体外实验证实抑制53BP1的蛋白表达可有效地消除肿瘤细胞照射后引起的周期阻滞,增加放射敏感性。但体内实验国内尚未见相关报道。该研究旨在探讨沉默食管癌细胞53BP1基因对裸鼠移植瘤放射敏感性的影响。方法:将48只BALB/c/nu裸鼠按随机数字表法分为对照组、单纯照射组、空载体组、空载体加照射组、沉默53BP1组以及沉默53BP1加照射组,每组8只,于裸鼠皮下接种相应食管癌细胞ECA109,制备裸鼠模型,给予15 Gy放射线单次照射,受照后1 h每组处死3只裸鼠,将肿瘤标本按蛋白[质]印迹法(Western blot)及流式细胞分析要求处理,Western blot检测移植瘤组织中CHK1、CHK2和磷酸化CHK2-T68的表达,流式细胞术分析裸鼠肿瘤组织中细胞周期分布和细胞凋亡。观察各组剩余裸鼠移植瘤照射后的生长情况,移植瘤体积变化情况。结果:所有接种裸鼠均成活并有肿瘤形成,各组之间肿瘤体积大小差异无统计学意义(F=0.67,P=0.69);单纯照射组和空载体照射组裸鼠的肿瘤生长速度慢于未照射组(P=0.02),沉默53BP1加照射组裸鼠的肿瘤生长速度最慢(P=0.03),沉默53BP1加照射组的相对生长速率较空载体加照射组和单纯照射组降低,生长抑制率增加(P=0.01)。沉默53BP1加照射组的q值为1.45;沉默53BP1加照射组裸鼠体内CHK1和CHK2的蛋白表达产物未见明显变化(P=0.71),CHK2-T68的磷酸化水平较单纯照射组和空载体照射组明显下降(P=0.03),各组裸鼠的瘤组织中细胞周期分布和凋亡率差异无统计学意义(P=0.45)。结论:体内研究显示沉默53BP1基因可以提高食管癌放射敏感性。
食管癌;53BP1;移植瘤;放射敏感性;RNA干扰
照射后细胞周期阻滞为受损细胞修复创造了条件,消除照射后G2期阻滞,促使照射后G2期未修复的细胞进入有丝分裂期,可以增加放射敏感性[1]。我们前期研究采用RNA干扰技术抑制食管癌细胞ECA109中细胞周期检测点激酶p53结合蛋白1(p53 binding protein 1,53BP1)的表达后,发现CHK2-pT68的磷酸化水平明显降低[2],很大程度上消除了对G2/M期的阻滞,克隆形成实验证实放射敏感性增加。但体内与体外实验的微环境变化很大,对实验结果的影响也不一致。本研究利用体内实验研究观察沉默食管癌细胞ECA109中53BP1基因表达后对BALB/c/nu裸鼠移植瘤体积的影响以及照射后不同组间移植瘤体积的变化,并观察各组移植瘤的蛋白表达特点及细胞周期分布,为基因治疗联合放射治疗提供实验依据。
1 材料和方法
1.1细胞培养及主要试剂
食管癌细胞系ECA109由中国医学科学院肿瘤医院杨伟志教授惠赠。空病毒载体细胞(ECA109/N)、沉默53BP1基因表达的ECA109细胞(ECA109/B)为本实验室构建[2]。细胞贴壁生长于含100 U/mL青霉素及100 μg/mL链霉素的10% FBS的H-DMEM培养液中,置CO2体积分数为5%、饱和湿度的培养箱中培养,每 2~3 d传代1次。兔抗人53BP1单克隆抗体购自美国Chemion公司;碱性磷酸酶标记的IgG羊抗兔二抗购自北京博奥森生物技术有限公司;BCIP/ NBT底物显色试剂盒购自美国Ameresco公司;鼠抗单克隆抗体CHK1、CHK2和β-actin购自美国Santa Cruz公司;兔抗磷酸化CHK2-T68抗体购自美国Cell Signaling公司。
1.2实验动物及饲养
BALB/c/nu裸鼠SPF级,4~8周龄,体质量18~20 g,雄性,共48只,由中国协和医科大学中国医学科学院动物研究所提供,其特性已鉴定。合格证书编号:SCXK(京)2005-0013。裸鼠由河北医科大学实验动物中心在新鲜空气中高度除尘除菌,在无特殊病原体SPF层流室的恒温(25~27 ℃)、恒湿(45%~50%)环境中饲养,12 h光照和12 h黑夜交替。所用的垫木、饮水、饲料及其与动物接触的物品均经高压灭菌处理,喂养符合卫生部颁布的“医学实验动物全价营养饲料标准”。
1.3实验动物分组及接种
将48只BALB/c/nu裸鼠随机分6组:① 对照组(ECA109组);② 单纯照射组(ECA109/R组);③ 空载体组(ECA109/N组);④ 空载体加照射组(ECA109/NR组);⑤ 53BP1转染组(ECA109/B组);⑥ 53BP1转染加照射组(ECA109/ BR组)。每组各8只BALB/c/nu裸鼠。爪垫用0.5%碘伏消毒,将食管癌ECA109、ECA109/N和ECA109/B细胞置于含10%胎牛血清的H-DMEM培养液中单层培养,于对数生长期时用胰酶消化液处理,锥虫蓝拒染法判断细胞活力,计算活细胞数必须大于85%,Hanks液洗涤3次后制成细胞悬液,细胞密度为2×107个/mL。在裸鼠后爪垫皮下接种ECA109、ECA109/N、ECA109/B细胞,每只接种细胞数为2× 106个/100 μL,制备裸鼠食管癌模型,成瘤后隔日观察1次,观察肿瘤的生长时间、成瘤大小和宿主的全身情况。
1.4裸鼠照射
移植瘤最大径达到0.8 cm 时,采用60Co γ射线15 Gy单次照射,照射时裸鼠未经麻醉,置于与外界空气隔绝的自行设计的放射屏蔽盒中,将裸鼠后肢固定暴露于照射野内。照射前动物接触的物品均经高压灭菌处理,使用密封一次性胶布固定。
1.5肿瘤体积测量
按照上述分组处理后,每2 d测量肿瘤最大径a值和最短径b值,根据公式v=ab2π/6计算肿瘤体积;相对生长速率:实验结束时肿瘤体积与实验开始体积的比值;生长抑制率和q值:以公式“生长抑制率=1-实验组体积/对照组体积”计算各实验组肿瘤的生长抑制率,以公式q=EA+B/(EA+EB-EA×EB)计算是否有增敏作用,其中 EA+B表示各放射增敏组对肿瘤的生长抑制率,EA、EB分别表示照射组、转染组对肿瘤的生长抑制率。q>1说明有增敏作用,q=1说明有相加作用,q<1说明有拮抗作用。
1.6蛋白[质]印迹法(Western blot)检测肿瘤组织标本中相关蛋白(CHK1、CHK2和CHK2-T68)的表达
照射后1 h处死裸鼠收集肿瘤组织标本,按每100 mg组织加1 000 μL裂解液及10 μL 的PMSF比例,在冰浴条件下加入裂解液及PMSF,置匀浆器中反复研磨,使组织充分匀浆化。冰浴30 min后,低温离心4 ℃、12 000 r/min离心15 min。小心吸取上清液即为组织蛋白。按考马斯亮蓝G250法测定蛋白浓度。按上述方法准备电泳样品,按照每样品40 μg上样,然后进行SDS-PAGE、电转印、封闭,一抗、二抗温育,BCIP/NBT显色,结果扫描后在凝胶成像仪上分析,测定灰度值,分别读取3遍取平均值。
1.8流式细胞仪检测细胞凋亡及周期分布
取肿瘤组织标本加适量的0.9%的NaCl溶液将其剪碎,用200目网过滤,离心半径12 cm,12 000 r/min离心,去上清液,将组织细胞迅速注入4 ℃、70%冷乙醇中,4 ℃冰箱保存,固定24 h,取1 mL细胞悬液,加入0.5%胃蛋白酶2 mL,37 ℃水浴中温育30 min,同时振荡悬浮2次,PBS 液10 mL终止消化;12 000 r/min离心2 min,弃上清液,加入1 mL EB 染液(50 μg/ mL),采用一步插入法进行DNA染色,0~4 ℃保存 30 min,用 500目铜网过滤后上机分析。
1.9统计学处理
2 结 果
2.153BP1基因转染对裸鼠体内ECA109细胞成瘤的影响
所有裸鼠均成活并有肿瘤形成,接种点无红肿破溃表现。接种后1周左右可见所有裸鼠的爪下均形成移植瘤,照射前对照组、空载体组、53BP1转染组、单纯照射组、空载体加照射组、53BP1转染加照射组移植瘤的体积差异无统计学意义(P=0.69,表1),提示单纯53BP1转染对ECA109细胞的生长增殖能力未见明显影响。
表1 不同组别裸鼠移植瘤体积照射前肿瘤体积Tab.1 The volume of nude mice transplantation tumors before irradiation ±s
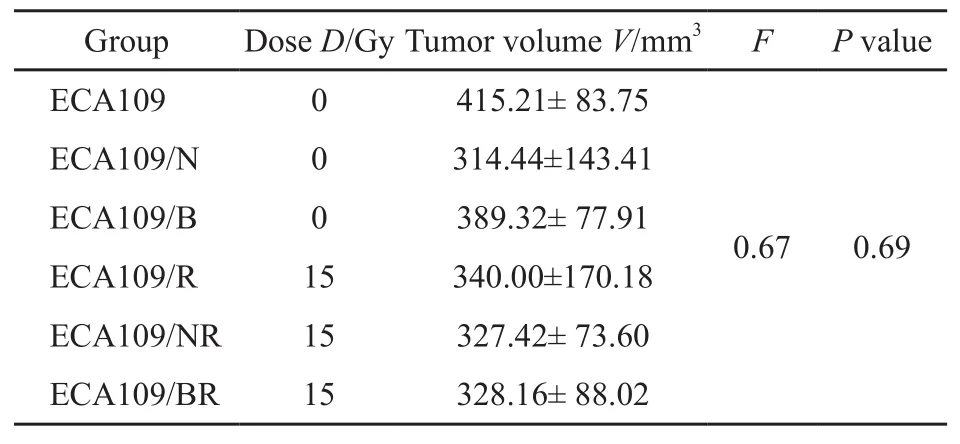
表1 不同组别裸鼠移植瘤体积照射前肿瘤体积Tab.1 The volume of nude mice transplantation tumors before irradiation ±s
GroupDose D/Gy Tumor volume V/mm3FP value ECA1090415.21± 83.75 ECA109/N0314.44±143.41 ECA109/B0389.32± 77.91 ECA109/R15340.00±170.18 ECA109/NR15327.42± 73.60 ECA109/BR15328.16± 88.02 0.670.69
2.2放射线照射后肿瘤体积的变化
按照实验分组的情况给予各组相应放射线照射。继续观察放射线照射后4周各组肿瘤体积变化情况,由表2可以看出,未接受放射线照射的裸鼠,其肿瘤生长速度较快,未接受照射的3组裸鼠移植瘤的肿瘤体积在观察期间未见明显的差异。15 Gy放射线照射后,单纯照射组和空载体加照射组裸鼠的肿瘤生长速度慢于未照射组,差异有统计学意义(P<0.05),53BP1转染加照射组裸鼠的肿瘤生长速度最慢。而且与单纯照射组和空载体加照射组比较,差异有统计学意义(P<0.05)。
2.3肿瘤相对生长速率、生长抑制率和q值
由表3可见,与对照组、53BP1转染组和单纯照射组比较,53BP1转染加照射组的相对生长速率降低,差异有统计学意义(P<0.05),而生长抑制率增加。53BP1转染加照射组的q值为1.45,表明沉默食管癌细胞中53BP1基因的蛋白表达后,确实起到了放射增敏作用。
2.4流式细胞仪检测细胞周期和凋亡的变化
各组裸鼠移植瘤在接受15 Gy的放射线照射后1 h,瘤组织内G2/M期细胞占总细胞数的比例与对照组比较差异无统计学意义(F=0.584,P=0.759),而且上述各组与未照射组之间差异也无统计学意义(F=0.584,P=0.759);同时我们也观察并检测了照射后瘤组织内凋亡细胞的比例,发现各组裸鼠的瘤组织内凋亡细胞的比例差异无统计学意义(F=0.380,P=0.901,表4)。
表2 不同组别裸鼠移植瘤15 Gy照射后不同时间肿瘤体积(mm3)Tab.2 The volume of nude mice transplantation tumors at diferent time after irradiation by 15 Gy V/mm3,±s
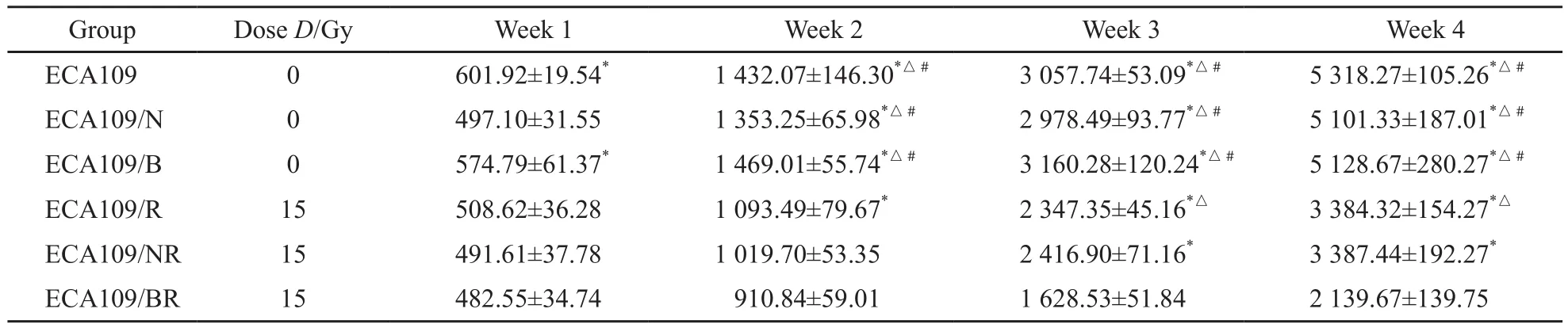
表2 不同组别裸鼠移植瘤15 Gy照射后不同时间肿瘤体积(mm3)Tab.2 The volume of nude mice transplantation tumors at diferent time after irradiation by 15 Gy V/mm3,±s
*: P<0.05,as compared with ECA109/BR;△: P<0.05,as compared with ECA109/NR;#: P<0.05,as compared with ECA109/R
GroupDose D/GyWeek 1Week 2Week 3Week 4 ECA1090601.92±19.54*1 432.07±146.30*△#3 057.74±53.09*△#5 318.27±105.26*△#ECA109/N0497.10±31.551 353.25±65.98*△#2 978.49±93.77*△#5 101.33±187.01*△#ECA109/B0574.79±61.37*1 469.01±55.74*△#3 160.28±120.24*△#5 128.67±280.27*△#ECA109/R15508.62±36.281 093.49±79.67*2 347.35±45.16*△3 384.32±154.27*△ECA109/NR15491.61±37.781 019.70±53.352 416.90±71.16*3 387.44±192.27*ECA109/BR15482.55±34.74 910.84±59.011 628.53±51.842 139.67±139.75
表3 不同组别裸鼠移植瘤照射后的相对生长速率、生长抑制率及q值Tab.3 The relative growth rate,growth inhibition rate and q value of nude mice transplantation tumors after irradiatio ±s
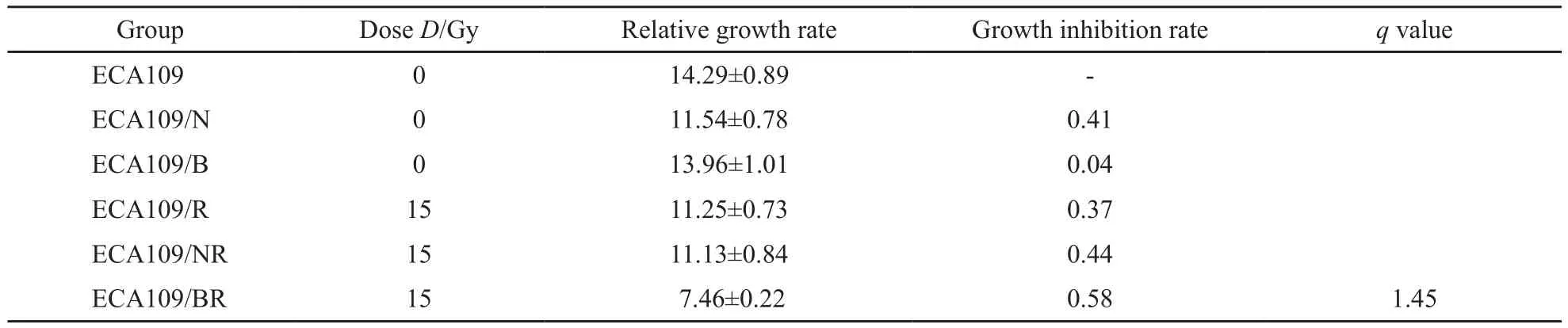
表3 不同组别裸鼠移植瘤照射后的相对生长速率、生长抑制率及q值Tab.3 The relative growth rate,growth inhibition rate and q value of nude mice transplantation tumors after irradiatio ±s
GroupDose D/GyRelative growth rateGrowth inhibition rateq value ECA109014.29±0.89-ECA109/N011.54±0.780.41 ECA109/B013.96±1.010.04 ECA109/R1511.25±0.730.37 ECA109/NR1511.13±0.840.44 ECA109/BR15 7.46±0.220.581.45
表4 15 Gy放射线照射后1 h不同组别裸鼠移植瘤的细胞周期分布及凋亡Tab.4 Distribution of cell cycle of diferent esophageal carcinoma cell types before irradiation and 1 h after irradiation by 15 Gy ±s
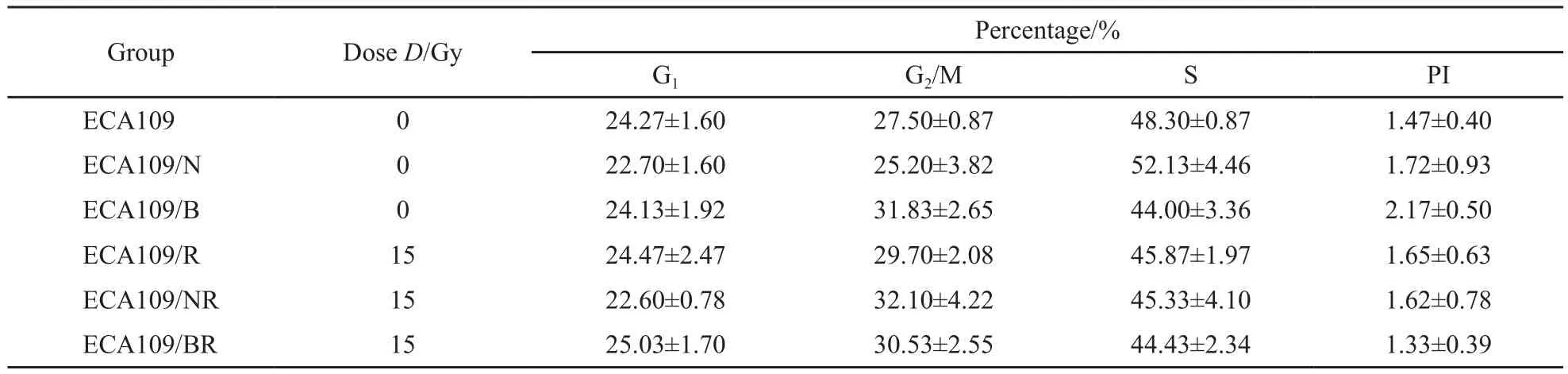
表4 15 Gy放射线照射后1 h不同组别裸鼠移植瘤的细胞周期分布及凋亡Tab.4 Distribution of cell cycle of diferent esophageal carcinoma cell types before irradiation and 1 h after irradiation by 15 Gy ±s
GroupDose D/Gy Percentage/% G1G2/MSPI ECA109024.27±1.6027.50±0.8748.30±0.871.47±0.40 ECA109/N022.70±1.6025.20±3.8252.13±4.461.72±0.93 ECA109/B024.13±1.9231.83±2.6544.00±3.362.17±0.50 ECA109/R1524.47±2.4729.70±2.0845.87±1.971.65±0.63 ECA109/NR1522.60±0.7832.10±4.2245.33±4.101.62±0.78 ECA109/BR1525.03±1.7030.53±2.5544.43±2.341.33±0.39
2.553BP1转染联合照射对瘤组织中CHK1和CHK2蛋白表达的影响
53BP1转染加照射组的裸鼠移植瘤标本中CHK1和CHK2的蛋白表达产物未见明显变化,其相对光密度比值与对照组和单纯照射组比较差异无统计学意义(P>0.05),但53BP1转染加照射组移植瘤标本中CHK2-T68的磷酸化水平较单纯照射组和空载体照射组明显降低(P<0.05)(图1、表5)。
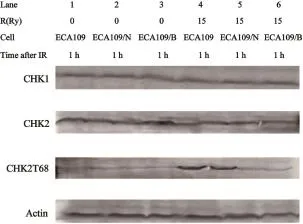
图1 不同组别裸鼠移植瘤15 Gy照射后1 h CHK1、CHK2及CHK2-T68的蛋白表达情况Fig.1 The protein expressions of CHK1,CHK2 and CHK2-T68 in diferent groups of nude mice transplantation tumors 1 h after irradiation by 15 Gy
表5 不同组别裸鼠移植瘤15 Gy照射后1 h CHK1、CHK2及CHK2-T68的蛋白表达情况Tab.5 The protein expressions of CHK1,CHK2 and CHK2-T68 in diferent groups of nude mice transplantation tumors 1 h after irradiation by 15 Gy ±s
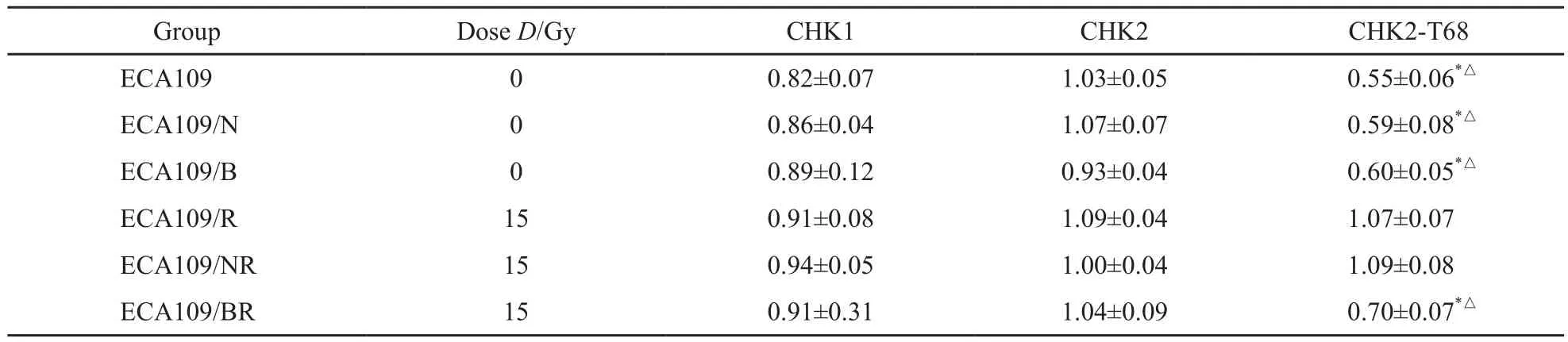
表5 不同组别裸鼠移植瘤15 Gy照射后1 h CHK1、CHK2及CHK2-T68的蛋白表达情况Tab.5 The protein expressions of CHK1,CHK2 and CHK2-T68 in diferent groups of nude mice transplantation tumors 1 h after irradiation by 15 Gy ±s
*: P<0.05,as compared with ECA109-N,with irradiation;△: P<0.05,as compared with ECA109,with irradiation
GroupDose D/GyCHK1CHK2CHK2-T68 ECA10900.82±0.071.03±0.050.55±0.06*△ECA109/N00.86±0.041.07±0.070.59±0.08*△ECA109/B00.89±0.120.93±0.040.60±0.05*△ECA109/R150.91±0.081.09±0.041.07±0.07 ECA109/NR150.94±0.051.00±0.041.09±0.08 ECA109/BR150.91±0.311.04±0.090.70±0.07*△
3 讨 论
食管癌是严重危害人类健康的消化道恶性肿瘤之一,放射治疗为该病的主要治疗手段之一。放疗后局部未控或复发率高达60%~80%。虽然放疗新技术的开展使食管癌放疗后局部控制率有了较大改善,但总体仍不近人意。出于保护正常组织的目的提高放射剂量的方法难有突破,如何在目前医疗条件下提高食管癌的放射敏感性是广大医疗工作者关注的热点,电离辐射的核心是DNA双链断裂,而细胞周期检测点激酶53BP1在检测DNA损伤过程中发挥着重要的作用。
关于食管癌RNA干扰53BP1蛋白表达与放射线照射相结合的实验,国内目前鲜有相关报道。在我们前期体外研究中,采用RNA干扰技术抑制53BP1蛋白表达,采用流式细胞术检测发现由于照射引起的细胞周期阻滞得到明显解除,Western blot检测照射后DNA损伤信号转导通路中的下游相关蛋白CHK2-T68的表达较对照组明显下降,克隆形成实验也证实沉默53BP1蛋白表达后食管癌细胞的放射敏感性增强,体外实验研究证实,细胞周期检测点激酶在调节DNA损伤修复过程中发挥重要作用[2]。但体外生长环境与肿瘤在体内环境的生长情况有所不同,致使该研究结果有一定的局限性,基因治疗的最终目的是应用于临床实践,所以本课题主要研究沉默53BP1蛋白表达对裸鼠移植瘤放射敏感性。
本研究选用BALB/c/nu裸鼠作为体内实验的动物模型,BALB/c/nu裸鼠具有易成瘤、易饲养、重复性好、易观察及相对稳定等优点,适于观察肿瘤细胞在体内生长情况,是研究食管癌病因、发病机制及肿瘤防治的首选实验动物。我们将ECA109、ECA109/N、ECA109/B肿瘤细胞制备成单细胞悬液,采用碘伏常规消毒后,于裸鼠爪垫注射等量、足量的细胞。在接种细胞7 d左右,各组裸鼠爪下均形成移植瘤,在国内首次成功构建了沉默53BP1基因的稳转细胞株荷瘤裸鼠模型,且在未接受放射线照射的情况下,各组裸鼠的肿瘤生长速度、肿瘤体积未见明显差别(P>0.05),说明慢病毒介导转染对细胞的生长增殖没有明显的影响,也可能体内环境下肿瘤的生长更依赖于损伤应答通路的完整,一旦这种完整性遭到破坏,肿瘤的生长就会受到抑制[3-4]。但是在给予放射线照射后,随着照射时间的延长,各组裸鼠移植瘤的肿瘤生长速度的差异逐渐表现出来。53BP1转染加照射组的肿瘤生长速度明显慢于其余各组。本研究结果显示,当观察点接近终点时,ECA109/BR组的肿瘤体积与其实验开始时体积的比值即相对生长速率均低于单纯照射组和53BP1转染组,差异有统计学意义(P<0.05)。通过采用评价两种处理方式联合作用的公式计算相应的增敏因子q值,发现ECA109/BR组的q值为1.45,其值大于1,说明体内实验证实采用RNA干扰技术抑制基因53BP1的蛋白表达后,确实对放射线起到了增敏作用。Ward等[5]曾采用RNA干扰技术转染、观察53BP1基因对恶性胸腺瘤生物学行为的影响,结果发现53BP1基因敲除组受照射后,与对照组相比,小鼠体内肿瘤生长速度明显减慢,且对放射线的敏感性显著增强,本研究与其结果类似。而且我们采用Western blot 技术检测各组裸鼠肿瘤组织中CHK1、CHK2及磷酸化CHK2-T68的蛋白表达水平。结果显示,ECA109/BR组的肿瘤组织中CHK1和CHK2的蛋白表达与对照组之间差异无统计学意义(P>0.05),但磷酸化CHK2-T68的表达水平却明显低于对照组(P<0.05)。采用RNA干扰技术抑制基因53BP1的蛋白表达后,对照射后CHK1和CHK2的总蛋白表达量影响并不大,但是对CHK2的磷酸化水平作用明显,该结果提示53BP1蛋白可能主要是通过CHK2的磷酸化来对下游相关效应蛋白进行调节的。在酵母菌中,DNA损伤导致蛋白激酶Rad9的磷酸化,磷酸化的Rad9可以促进Rad53聚集到Mec1复合体进行活化或直接活化Rad53[6-9];在哺乳动物细胞中,目前所知有3种蛋白的结构和功能与Rad9类似[10-11],这3种蛋白均含有BRCT结构域,分别是MDC1、BRCA1和53BP1[12-15]。研究表明,53BP1只是部分调节G2/M期检测点和CHK2的功能[16-18]。这些研究结果表明,53BP1在CHK2的磷酸化过程中发挥着非常重要的作用[16-18]。本课题研究中各组细胞周期和凋亡之间未见明显的差异,可能因为组织取材仅仅在裸鼠接受放射线照射1 h,受照射的时间太短,细胞周期和凋亡尚未发生明显变化。
本次实验采用慢病毒介导的方法沉默食管癌ECA109细胞的基因53BP1,并成功构建出沉默53BP1基因的稳转细胞株荷瘤裸鼠模型,而且该病毒载体对裸鼠肿瘤的生长未见明显影响,而对裸鼠移植瘤接受照射后肿瘤的生长、细胞周期相关蛋白表达产生明显影响,可能与DNA损伤信号转导通路中相关信号蛋白的相互作用减弱有关,总之,53BP1可能是基因治疗联合放疗具有应用前景的靶向基因之一。
[1] KIM Y M,PYO H.Different cell cycle modulation by celecoxib at different concentrations [J].Cancer Biother Radiopharm,2013,28(2): 138-145.
[2] 刘志坤,祝淑钗,杨 洁,等.RNA干扰53BP1基因表达对食管癌放射敏感性的影响[J].中国癌症杂志,2012,22(3): 189-195.
[3] HAN W,CHEN S,YU K N,et al.Nitric oxide mediated DNA double strand breaks induced in proliferating bystander cells after alpha-particle irradiation[J].Mutat Res,2010,684(1-2): 81-89.
[4] COLLIS S J,SCHWANINGER J M,NTAMBI A J,et al.Evasion of early cellular response mechanisms following low level radiation-induced DNA damage[J].J Biol Chem,2004,279(48): 49624-49632.
[5] WARD I M,MINN K,VAN DEURSEN J,et al.p53 binding protein 53BP1 is required for DNA damage responses and tumor suppression in mice[J].Mol Cell Biol,2003,23(7): 2556-2563.
[6] CUSSIOL J R,JABLONOWSKI C M,YIMIT A,et al.Dampening DNA damage checkpoint signalling via coordinated BRCT domain interactions[J].EMBO J,2015,34(12): 1704-1717.
[7] HENDRY J A,TAN G,OU J,et al.Leveraging DNA damage response signaling to identify yeast genes controlling genome stability[J].G3 (Bethesda),2015,5(5): 997-1006.
[8] LIANG J,SUHANDYNATA R T,ZHOU H.Phosphorylation of Sae2 mediates forkhead-associated (FHA) domain-specific interaction and regulates its DNA repair function[J].J Biol Chem,2015,290(17): 10751-10763.
[9] GILBERT C S,GREEN C M,LOWNDES N F.Budding yeast Rad9 is an ATP-dependent Rad53 activating machine[J].Mol Cell,2001,8(1): 129-136.
[10] EBERLEIN U,PEPER M,FERNÁNDEZ M,et al.Calibration of the γ-H2AX DNA double strand break focus assay for internal radiation exposure of blood lymphocytes[J].PLoS One,2015,10(4): e0123174.
[11] SCHRÖDER-HEURICH B,BOGDANOVA N,WIELAND B.Functional deficiency of NBN,the Nijmegen breakage syndrome protein,in a p.R215W mutant breast cancer cell line[J].BMC Cancer,2014,14: 434.doi: 10.1186/1471-2407-14-434.
[12] SCHULTZ L B,CHEHAB N H,MALIKZAY A,et al.p53 binding protein 1 (53BP1) is an early participant in the cellular response to DNA double-strand breaks[J].J Cell Biol,2000,151(7): 1381-1390.
[13] RAPPOLD I,IWABUCHI K,DATE T,et al.Tumor suppressor p53 binding protein 1 (53BP1) is involved in DNA damagesignaling pathways[J].J Cell Biol,2001,153(3): 613-620.
[14] SHANG Y L,BODERO A J,CHEN P L.NFBD1,a novel nuclear protein with signature motifs of FHA and BRCT,and an internal 41-amino acid repeat sequence,is an early participant in DNA damage response[J].J Biol Chem,2003,278(8): 6323-6329.
[15] ZHAO H,ZHU M,DOU G,et al.BCL10 regulates RNF8/ RNF168-mediated ubiquitination in the DNA damage response[J].Cell Cycle,2014,13(11): 1777-1787.
[16] WANG B,MATSUOKA S,CARPENTER P B,et al.53BP1,a mediator of the DNA damage checkpoint[J].Science,2002,298(5597): 1435-1438.
[17] FERNANDEZ-CAPETILLO O,CHEN HT,CELESTE A,et al.DNA damage-induced G2/M checkpoint activation by histone H2AX and 53BP1[J].Nat Cell Biol,2002,4(12): 993-997.
[18] DITULLIO R A Jr,MOCHAN T A,VENERE M,et al.53BP1 functions in an ATM-dependent checkpoint pathway that is constitutively activated in human cancer[J].Nat Cell Biol,2002,4(12): 998-1002.
Efect of silencing 53BP1 gene on radiosensitivity to esophageal cancer ECA109 cell xenograft in nude mice
LIU Zhikun1,ZHANG Weili2,ZHU Shuchai1,SU Jingwei1,LI Juan1,SHEN Wenbin1(1.Department of Radiation Oncology,the Fourth Afliated Hospital of Hebei Medical University,Shijiazhuang 050011,Hebei Province,China; 2.School of Public Health of Hebei Medical University,Shijiazhuang 050017,Hebei Province,China)
Correspondence to: ZHU ShuchaiE-mail: zhikunliu1978@163.com
Background and purpose: p53 binding protein (53BP1) expresses in many normal and tumor cells.In vitro experiments have confrmed that inhibition of the protein expression of 53BP1 can efectively eliminate cycle arrest of tumor cells,and increase the radiosensitivity after irradiation.However,the in vivo experiment has not been reported.This study aimed to explore the efect of silencing 53BP1 gene on the growth and radiosensitivity to esophageal cancer cell ECA109 xenograft in nude mice.Methods: Forty-eight male BALB/c/nu nude mice were randomly divided into 6 groups: ECA109,ECA109/R,ECA109/N,ECA109/NR,ECA109/B and ECA109/BR.Three kinds of prepared cells (ECA109,ECA109/N and ECA109/B) were subcutaneously injected into the paw pads of mice (2×106/100 μL per mouse).The nude mice in ECA109/R,ECA109/NR,and ECA109/BR groups were irradiated with 15 Gy.Tumor growth was monitored every other day on the 6thday after injection.Tumor volume was measured with calipers.Theexpression levels of CHK1,CHK2 and phosphorylated CHK2-T68 protein were examined in diferent groups by Western blot.Apoptotic cell and cell cycle distribution were detected by fow cytometry assay.Results: Visible tumors were detectable by day 7 after implantation,and the tumor volumes showed no signifcant diferences among all the groups (F=0.67,P=0.69).After irradiation with 15 Gy,tumor volumes in ECA109/BR group were smaller than those in other groups (P=0.03); the growth inhibition rate increased,but the relative growth rate decreased signifcantly (P=0.01).The q value which refected the radiosensitizing efect in ECA109/BR group was 1.45.The expressions of CHK1 and CHK2 at protein level in ECA109/BR group were not infuenced (P=0.71).However,the level of phosphorylated CHK2-T68 expression decreased signifcantly after irradiation with 15 Gy (P=0.03).Cell cycle distribution and apoptosis were not signifcantly diferent among all the groups (P=0.45).Conclusion: Silencing 53BP1 gene expression could inhibit the growth of esophageal cancer cell xenograft and increase the radiosensitivity to tumors in the nude mice.
Esophageal cancer; 53BP1; Xenograft; Radiosensitivity; RNA interference
10.19401/j.cnki.1007-3639.2016.07.003
R735.1
A
1007-3639(2016)07-0574-07
国家自然科学基金资助项目(30470524);国家自然科学基金资助项目(30870743);国家自然科学基金资助项目(8157111792);河北省医学科学研究重点课题计划项目(20100416)。
祝淑钗 E-mail:zhikunliu1978@163.com
2015-05-07
2015-10-20)
