Spink8基因对EC9706细胞增殖、凋亡及迁移能力的影响*
2016-09-19封青川范玉佳张玉超
孙 艳,张 华,封青川,范玉佳,李 涛,张玉超,贺 颖,郑 红#
1)郑州大学基础医学院医学遗传学与细胞生物学系 郑州 450001 2)河南省中医药大学第一附属医院生殖医学科 郑州 450003 3)郑州市妇幼保健院优生科 郑州 450012
Spink8基因对EC9706细胞增殖、凋亡及迁移能力的影响*
孙艳1,2),张华3),封青川1),范玉佳1),李涛1),张玉超1),贺颖1),郑红1)#
1)郑州大学基础医学院医学遗传学与细胞生物学系 郑州 4500012)河南省中医药大学第一附属医院生殖医学科 郑州 4500033)郑州市妇幼保健院优生科 郑州 450012
Spink8基因;食管癌细胞;增殖;凋亡;细胞迁移
目的:探讨Spink8基因对人食管癌EC9706细胞增殖、凋亡及迁移能力的影响。方法:利用DNA重组技术构建Spink8真核表达重组质粒并转染EC9706细胞,构建稳定表达Spink8的EC9706细胞。取未转染、转染空质粒和稳定表达Spink8的EC9706细胞,采用RT-PCR和Western blot 法检测Spink8 mRNA和蛋白,MTT法检测细胞增殖,Annexin V-APC/7-AAD法检测细胞凋亡,并进行Transwell细胞迁移实验。结果:与未转染和转染空质粒组细胞比较,稳定表达Spink8的EC9706细胞增殖受到抑制(P<0.05),增殖抑制率为24.5%;细胞凋亡率增加(P<0.05); Transwell小室穿膜细胞数减少(P<0.05)。结论:Spink8可能是一个新的抑癌基因。
食管癌是上消化道中最具有侵略性的恶性肿瘤之一,但其确切的发病机制仍未阐明。Li等[1]运用全基因组阵列分析技术并借助生物信息学筛选可能对食管癌具有重要致病作用的基因和通路,研究结果提示丝氨酸蛋白酶Kazal型抑制剂8(serine protease inhibitor kazal type 8,Spink8)在食管癌组织中表达下调,提示Spink8可能是一个新的抑癌基因,在食管癌的发生发展中起着重要的作用。作者对Spink8基因对人食管癌EC9706细胞的增殖、凋亡及迁移能力的影响进行了探讨。
1 材料与方法
1.1主要试剂EC9706由郑州大学基础医学院药理学教研室惠赠,胎牛血清购自杭州四季青生物工程有限公司,RPMI 1640培养基购自Gibco公司,ReverAidTM第一链cDNA 合成试剂盒购于美国Thermo公司,原核表达载体pGEX-5X-3、真核表达载体pEGFP-C1、限制性核酸内切酶(BamHⅠ和EcoRⅠ)、T4连接酶购于TaKaRa公司,Annexin V-APC/7-AAD凋亡检测试剂盒、质粒小量提取试剂盒、胶回收试剂盒购于Axygen公司。PCR扩增引物由上海生工生物工程技术有限公司合成,兔抗人Spink8多克隆抗体、内参GAPDH单克隆抗体及HRP标记的二抗购自Abcam公司。
1.2稳定表达Spink8的EC9706细胞系的建立
1.2.1原核表达载体的构建Trizol法提取健康人外周血总RNA,按第一链 cDNA 合成试剂盒所述步骤以随机引物反转录获得cDNA。根据GenBank中收录的人类Spink8基因cDNA序列设计引物,并在上下游引物中分别加入BamHⅠ和EcoRⅠ酶切位点(F1: 5’-CGCGGATCCCAATGAAGGGGATCTGCT CA-3’;F2:5’-CCGGAATTCTACGTTCAAGAGTTTTCA CATT-3’)。以获得的cDNA为模板,进行PCR扩增,将原核表达载体pGEX-5X-3及Spink8的PCR产物分别于37 ℃用BamHⅠ和EcoRⅠ双酶切,回收产物经T4连接酶4 ℃过夜连接,然后转化感受态DH5α,阳性克隆(pGEX-Spink8)经IPTG诱导,观察GST-Spink8融合蛋白的表达情况,以验证所调取的基因能否正常表达。
1.2.2真核表达载体的构建以pGEX-Spink8为模板,PCR扩增Spink8编码框。合成5’端含EcoRⅠ(上游)和BamHⅠ(下游)酶切位点的引物(P1: 5’-CCGGAATTCCACCATGAAGGGGATCTGCTCA-3’;P2:5’-CGCGGATCCCGTTCAAGAGTTTTCACATT-3’)。再将真核表达载体pEGFP-C1和Spink8的PCR产物分别于37 ℃用EcoRⅠ和BamHⅠ双酶切,回收产物经T4连接酶4 ℃过夜连接,然后转化感受态DH5α,阳性克隆(pEGFP-Spink8)经双酶切和测序验证。
1.2.3细胞培养和转染EC9706细胞在37 ℃、体积分数5%CO2条件下培养于含体积分数10%已灭活的胎牛血清、100 U/mL青霉素和100 U/mL链霉素的RPMI 1640培养液中。收获对数生长期的细胞接种于6孔板,待细胞密度达到80%~90%时,参照Sofast转染试剂盒操作指南转染重组质粒pEGFP-Spink8,经G418筛选获得稳定表达Spink8的EC9706细胞。

1.4细胞增殖抑制率检测按8 000个/孔将3组细胞分别接种于96孔板,每组设6个复孔。培养24 h后,每孔加20 μL 5 g/L的MTT,避光孵育4 h,弃掉孔内液体,加入DMSO 150 μL平摇5 min,酶标仪测量490 nm波长处各孔的吸光度(A)。细胞增殖抑制率=[(1-实验组A值)/对照组A值]×100%。以未转染细胞为对照组。
1.5细胞凋亡检测根据Annexin V-APC/7-AAD 凋亡检测试剂盒操作说明处理细胞,上流式细胞仪检测凋亡率。
1.6细胞迁移实验分别收集3组细胞并用不含血清和双抗的培养基调整细胞密度为4×104mL-1,在Transwell小室的下室加入600 μL完全培养基,上室加入200 μL细胞液,常规培养20 h后弃去下室内培养基,无水乙醇固定10 min,1 g/L结晶紫染色10 min,显微镜下计数小室上室底膜下室面的细胞数,即穿膜细胞数。
1.7统计学处理采用SPSS 17.0进行数据分析,3组各指标的比较采用单因素方差分析,两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1稳定表达Spink8细胞系的鉴定EC9706细胞内源性Spink8蛋白低表达,转染pEGFP-Spink8质粒后可以检测到Spink8 mRNA及蛋白的表达量增加,见图1、2,提示成功建立了稳定表达Spink8的EC9706细胞系。
2.23组细胞增殖抑制率的比较3组细胞增殖实验A值比较见表1。稳定表达Spink8细胞组A值较未转染细胞组明显降低(P<0.05)。转染空质粒组与稳定表达Spink8细胞组增殖抑制率分别为9.8%和24.5%。
2.33组细胞凋亡率的比较见表1。可见稳定表达Spink8细胞组凋亡率明显高于其他两组(P<0.05)。
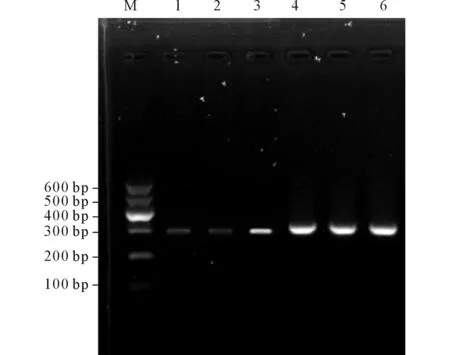
M:Marker;1、4:未转染组;2、5:转染空质粒组;3、6:稳定表达Spink8细胞组;1~3:Spink8;4~6:GAPDH。图1 3组Spink8 mRNA相对表达情况
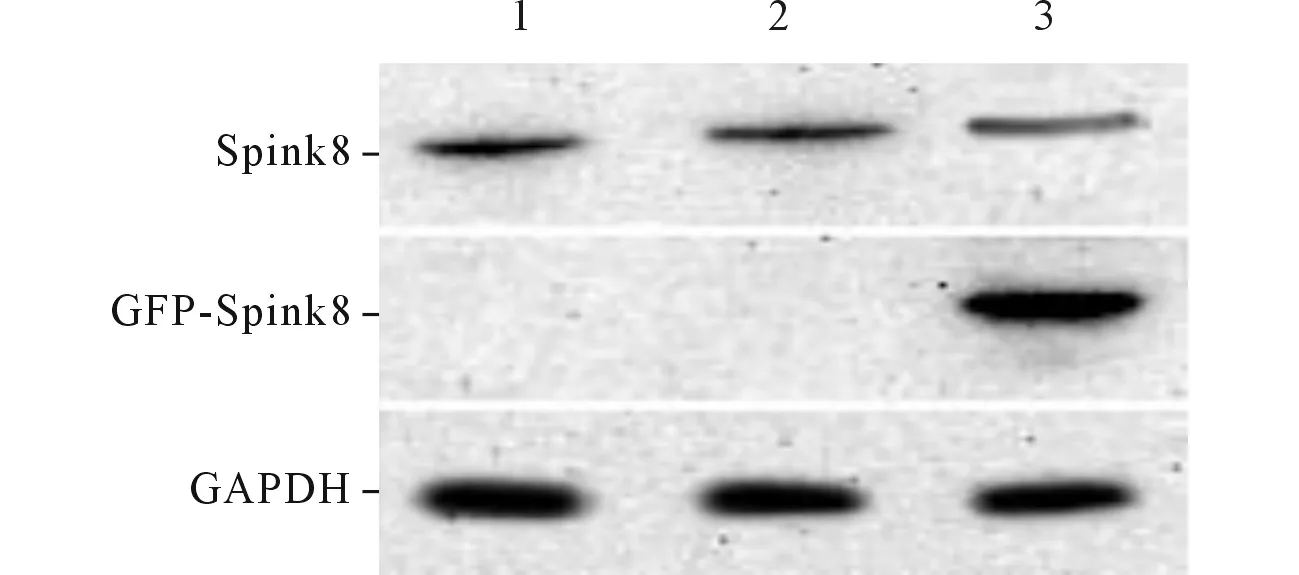
1:未转染组;2:转染空质粒组;3:稳定表达Spink8细胞组。图2 3组Western blot 结果
2.43组细胞迁移能力的比较见图3、表1。稳定表达Spink8细胞组穿膜细胞数明显低于未转染组及转染空质粒组(P<0.05),而未转染组与转染空质粒组相比,差异无统计学意义。
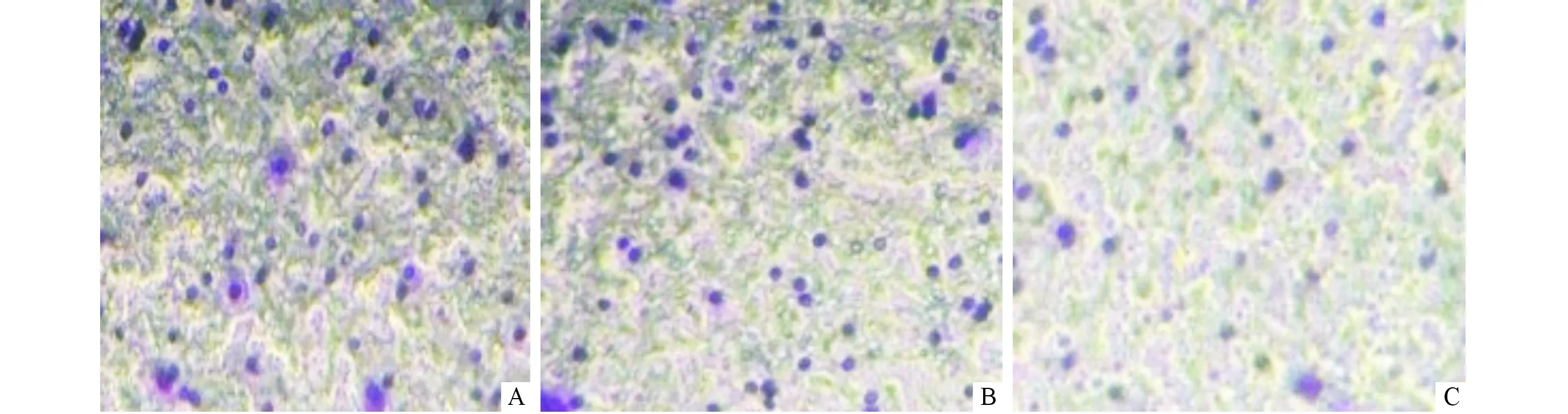
A:未转染组;B:转染空质粒组;C:稳定表达Spink8细胞组。图3 3组Transwell 细胞迁移情况(×200)

表1 3组各指标的比较
*:与未转染组比较,P<0.05;#:与转染空质粒组比较,P<0.05。
3 讨论
Spink是丝氨酸蛋白酶抑制剂家族最大的一个分支[2],包含多个亚族,该家族的特征是都含有Kazal结构域。典型的Kazal结构域包含2个α螺旋、3个反向平行β折叠和3对二硫键[3]。Spink8基因定位于3p21.3,基因全长27.958 kb,包含5个外显子,编码97个氨基酸。
该研究中,作者首先克隆Spink8基因,通过原核表达来检测所调取的基因能否正常表达。IPTG诱导表达获得的GST融合蛋白大小约37 000,已知GST标签蛋白大小为26 000,推测Spink8蛋白相对分子质量大小约11 000,这与用ExPASy软件预测Spink8蛋白大小一致,表明作者所克隆的Spink8基因可以正常表达,避免了由于基因本身的问题导致后续实验假阴性结果的产生。
原核表达验证之后构建真核表达载体pEGFP-Spink8,转染食管癌EC9706细胞, 使食管癌细胞Spink8基因过表达,构建稳定表达Spink8的EC9706细胞。结果显示,稳定表达Spink8细胞增殖抑制率较转染空质粒和未转染组细胞明显升高,细胞凋亡率增加,说明提高EC9706细胞内Spink8基因的表达量对细胞增殖具有一定抑制作用,Spink8对EC9706细胞增殖的抑制率为24.5%。目前临床上广泛使用的抗肿瘤药物有5-氟尿嘧啶、紫杉醇、顺铂及阿霉素,它们对细胞的抑制率分别为55.62%、74.44%、77.71%、94.67%[4]。与这些抗肿瘤药物相比,Spink8对细胞的增殖抑制作用较弱。
Spink家族的诸多成员在人体生理功能、机体炎症和肿瘤的发生发展中起到重要作用[5-6],其中Spink7已被确定为抑癌基因,其能够通过uPA/纤溶酶活性来抑制肿瘤细胞的迁移及侵袭[7-8]。该研究结果显示,Spink8也能够降低EC9706细胞的迁移能力。此外,Cheng等[9]还发现Spink7参与了中心体的复制以维持染色体的稳定,避免因染色体异常而导致癌症的发生,该过程依赖于P53通路。单一基因的改变往往不足以影响细胞的凋亡,常常需有多个基因的协同作用共同调节细胞凋亡。因此,对于Spink8的作用机制还应该与其他肿瘤相关基因一起研究。
总之,作者从细胞水平探究了Spink8对EC9706细胞的作用,Spink8过表达可以在一定程度上抑制食管癌EC9706细胞的增殖及迁移,并促进其凋亡,可能是一个新的抑癌基因。但是,该研究还停留在细胞水平,尚需进行蛋白表达层面及相关分子机制的研究,以为肿瘤的预防、早期诊断和预后判断提供理论基础和新的途径。
[1]LI JD,FENG QC,LI JS.Differential gene expression profiling of oesophageal squamous cell carcinoma by DNA microarray and bioinformatics analysis[J].J Int Med Res,2010,38(6):1904
[2]OU CM,TANG JB,HUANG MS,et al.The mode of reproductive-derived Spink(serine protease inhibitor Kazal-type) action in the modulation of mammalian sperm activity[J].Int J Androl,2012,35(1):52
[3]WAPENAAR MC,MONSUUR AJ,POELL J,et al.The SPINK gene family and celiac disease susceptibility[J].Immunogenetics,2007,59(5):349
[4]黄银久,宋宝安,金林红,等.MTT比色法抗肿瘤药物筛选实验条件和数据优化探索[J].激光生物学报,2009,18(3):401
[5]JØERGENSEN MT,BRUSGAARD K,NOVOVIC S,et al.Is the SPINK1 variant p.N34S overrepresented in patients with acute pancreatitis? [J].Eur J Gastroenterol Hepatol,2012,24(3):309
[6]ROCKETT JC,PATRIZIO P,SCHMID JE,et al.Gene expression patterns associated with infertility in humans and rodent models[J].Mutat Res,2004,549(1/2):225
[7]CHENG X,LU SH,CUI Y. ECRG2 regulates ECM degradation and uPAR/FPRL1 pathway contributing cell invasion/migration[J]. Cancer Lett,2010,290(1): 87
[8]TANG CH,WEI Y.The urokinase receptor and integrins in cancer progression[J].Cell Mol Life Sci,2008,65(12):1916
[9]CHENG X,SHEN Z,YANG J,et al.ECRG2 disruption leads to centrosome amplification and spindle checkpoint defects contributing chromosome instability[J].J Biol Chem,2008,283(9):5888
(2015-11-05收稿责任编辑王曼)
Effects of Spink8 gene on proliferation,apoptosis and migration of EC9706 cells
SUNYan1,2),ZHANGHua3),FENGQingchuan1),FANYujia1),LITao1),ZHANGYuchao1),HEYing1),ZHENGHong1)
1)DepartmentofMedicalGeneticsandCellBiology,CollegeofBasicMedicalSciences,ZhengzhouUniversity,Zhengzhou4500012)DepartmentofReproductiveMedicine,theFirstAffiliatedHospital,HenanUniversityofTraditionalChineseMedicine,Zhengzhou4500033)PrepotencyDivision,WomenandInfantsHospitalofZhengzhou,Zhengzhou450012
Spink8 gene;esophageal cancer cell;proliferation;apoptosis;cell migration
Aim: To investigate the effects of Spink8 gene on proliferation, apoptosis and migration of human esophageal cancer cell EC9706. Methods: Eukaryotic expression plasmid pEGFP-Spink8 was established by DNA recombination in vitro, and transfected into EC9706 cells. The expressions of Spink8 mRNA and protein were examined by RT-PCR and Western blot. MTT method was used to detect cell proliferation, Annexin V-APC/7-AAD method was used to detect cell apoptosis, and migration ability was detected by Transwell assay. Results: The plasmid of pEGFP-Spink8 was successfully established. Compared with the EC9706 cells without transfection or transfected with null plasmid, the number of surviving cells transfected with pEGFP-Spink8 decreased(P<0.05), and proliferation inhibition rate was 24.5%; the apoptosis rate was significantly increased(P<0.05); the number of cells which passed Transwell chamber decreased(P<0.05). Conclusion: Spink8 may be a new tumor suppressor gene.
10.13705/j.issn.1671-6825.2016.05.003
,女,1966年3月生,博士,教授,研究方向:遗传性疾病的致病基因的筛选与研究,E-mail:hzheng@zzu.edu.cn
*河南省医学科技攻关计划201303001
R735.1