山楂提取物对高脂损伤果蝇的保护作用
2016-09-18赵江陈纯王红王轶菲吕晓玲王浩天津科技大学食品工程与生物技术学院天津300457天津科技大学生物工程学院天津300457
赵江,陈纯,王红,2,王轶菲,2,吕晓玲,王浩,*(.天津科技大学食品工程与生物技术学院,天津300457;2.天津科技大学生物工程学院,天津300457)
山楂提取物对高脂损伤果蝇的保护作用
赵江1,陈纯1,王红1,2,王轶菲1,2,吕晓玲1,王浩1,*
(1.天津科技大学食品工程与生物技术学院,天津300457;2.天津科技大学生物工程学院,天津300457)
研究山楂提取物(Hawthorn Fruit Extract,HFE)对高脂致氧化损伤的雄性果蝇寿命的影响并探究其延缓果蝇衰老的分子机制。将2d龄雄性果蝇随机分组,在高脂培养基中饲喂不同剂量(0.5、1.5、4.5mg/mL)山楂提取物,研究山楂提取物对果蝇生存寿命及果蝇体内抗氧化酶活性(铜锌超氧化物歧化酶,Copper-zinc-containing superoxide dismutase,Cu/ Zn-SOD;锰超氧化物歧化酶Manganese-containingsuperoxide dismutase,Mn-SOD;过氧化氢酶,Catalase,CAT)、脂质过氧化产物丙二醛(Malonaldehyde,MDA)含量、蛋白质羰基(ProteinCarbonyl,PCO)含量及抗氧化相关基因表达水平的影响。HFE可以显著延长果蝇的平均寿命和最高寿命(4.5 mg/mL,P<0.05);4.5 mg/mL HFE可以显著提高果蝇体内SOD和CAT活性(P<0.05),显著降低MDA(P<0.01)和PCO含量(P<0.05);同时显著上调果蝇体内Cu/Zn-SOD及Nrf2 mRNA表达水平(P<0.05)并且极显著上调Mn-SOD和CATmRNA表达水平(P<0.01)。HFE对高脂膳食所导致的果蝇氧化损伤具有保护作用,HFE延缓果蝇衰老和抗氧化作用可能与其调控抗氧化基因的表达水平相关。
山楂提取物;果蝇;高脂;抗氧化
山楂属双子叶植物纲蔷薇科植物,具有多方面的药理活性及营养价值[1]。现代研究证明山楂果实中主要含有有机酸、黄酮类、花色苷类、三萜类等化合物[2],这些化合物是良好的抗氧化物质[3-4]。有关研究显示,山楂活性成分具有增加血液抗氧化活性的作用[5],Liu等[6]研究亦发现HFE具有明显清除羟自由基与过氧化氢的能力,其抗氧化活性显著高于VC和VE。张锐巧[7]等研究表明山楂果肉的原花青素具有很好的体外清除活性氧和保护DNA损伤的活性。40 μg/mL的山楂果肉提取物对体外DNA损伤抑制率达80.7%。一定剂量的山楂提取液可以有效的抑制大鼠肝脏CYP2E1的活性,有效降低了多种前致癌物转化为致癌物的可能性,以及减少了CYP2E1诱导产生的大量自由基,降低对肝脏的氧化损伤[8]。
衰老自由基学说认为,自由基对细胞的各种成分和结构都可产生损伤效应,这些效应的累积势必造成细胞功能的减退[9]。在高脂情况下,生物膜上的脂质成分更易受到自由基的攻击而发生脂质过氧化,使机体加速衰老[10]。抗氧化剂可以有效清除体内多余的自由基,延缓高脂导致的氧化损伤。
果蝇(Drosophila melanogaster)具有与人类十分相似的衰老基因[11-12],被广泛作为评估活性成分对寿命的影响机理的动物模型,外源抗氧化酶或活性物质如蓝莓、韩国红参,姜黄素等对果蝇寿命及抗氧化有很大的影响[13-14]。本实验以Oregon K野生型黑腹雄性果蝇为模式生物,研究山楂提取物对高脂所致果蝇脂质过氧化损伤的保护作用,并进一步研究其保护作用机制。
1 材料与方法
1.1材料
野生型Oregon K黑腹果蝇(Drosophila melanogaster,wild Oregon K strain):由天津科技大学食品添加剂与营养调控研究室提供;山楂提取物:由天津尖峰天然产物研究开发有限公司提供。
1.2果蝇饲养条件
培养基配制参照之前论文方法[15]。空白对照组果蝇饲喂基础培养基,高脂模型组果蝇饲喂高脂培养基,实验组果蝇则饲喂添加0.5、1.5、4.5 mg/mLHFE的高脂培养基。实验选用2 d龄Oregon K野生型雄性黑腹果蝇,培养于温度(25+1)℃,湿度(55+5)%、光/暗时间为12 h/12 h的恒温恒湿智能培养箱。
1.3果蝇生存实验
收集2 d龄羽化未交配的果蝇成虫进行雌雄鉴别,CO2麻醉观察其个体特征,将腹部末端颜色深且圆钝的雄性果蝇挑选出来,收集1 000只,随机分为5组:空白对照组,高脂模型组,HFE组(0.5、1.5、4.5 mg/mL),定期记录各组果蝇存活只数直至果蝇全部死亡,绘制寿命曲线,并重复实验,计算平均寿命和平均最高寿命,最高寿命为最后10%死亡果蝇的平均生存时间。
1.4果蝇抗氧化酶活性及基因表达水平的测定
果蝇培养同生存实验方法,收集40 d龄果蝇,麻醉后称重,加入生理盐水制成2%的组织匀浆,离心,收集上清液,按照试剂盒说明书上方法分别测定各管果蝇体内的总蛋白质含量(考马斯亮蓝法)、T-SOD、Cu/Zn-SOD活性(黄嘌呤氧化酶法)、CAT活性(紫外分光光度法)、MDA含量(硫代巴比妥酸法)以及PCO含量(二硝基苯肼比色法)。同上收集40 d龄果蝇,Trizol法提取总RNA,反转录合成cDNA,以RP49为内参基因,Cu/Zn-SOD、Mn-SOD、CAT、Nrf2及玛氏萨拉(Methuselah,MTH)为目的基因,Real-time PCR扩增检测抗氧化相关基因mRNA表达水平。
1.5数据的分析与处理
使用SPSS statistics17.0软件对实验数据进行统计学分析处理,采用均值±标准差的方法表示结果,组间差异进行方差检验分析,P<0.05为显著性差异,P<0.01为极显著性差异。果蝇抗氧化基因实时定量引物引物见表1。
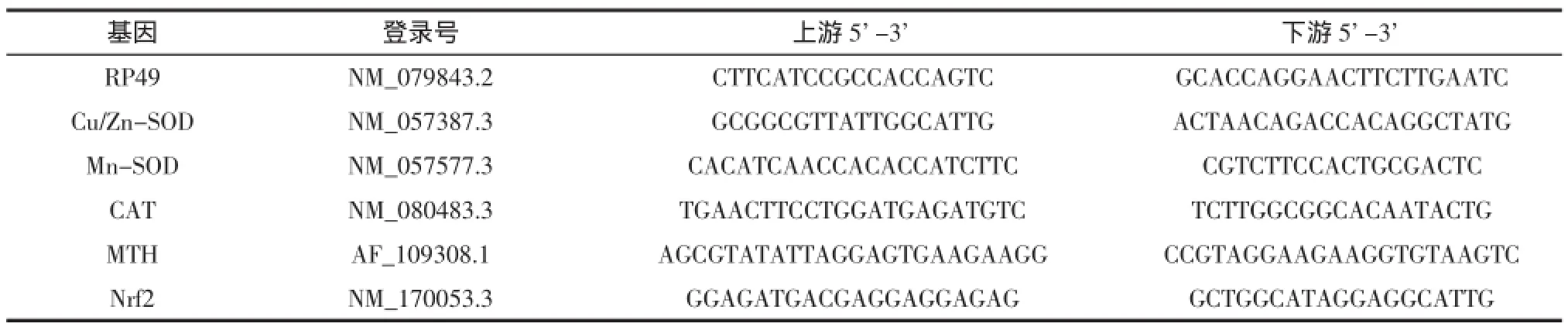
表1 果蝇抗氧化基因实时定量引物引物Table 1 RT-PCR primers for the detection of mRNA expression of antioxidant genes in Drosophila melanogaster
2 结果与分析
2.1山楂提取物的活性成分
山楂提取物的活性成分见图1。

图1 高效液相色谱法测定山楂活性成分Fig.1 HPLC chromatogram of hawthorn active ingredients
山楂提取物的主要活性成分及其所占比重分别为:原花青素B219.86%,表儿茶素15.27%,绿原酸3.10%,金丝桃苷2.91%,异槲皮素1.34%。
2.2HFE对高脂果蝇寿命的影响
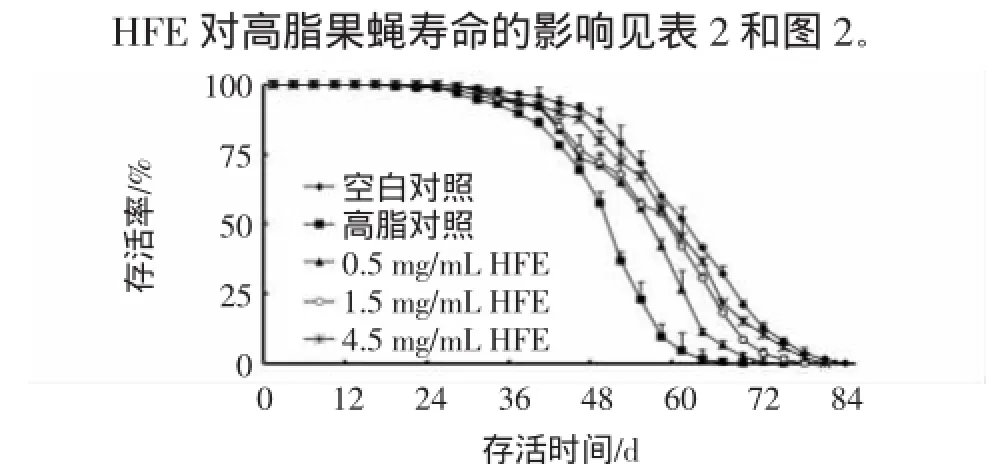
图2 高脂果蝇寿命曲线(n=200)Fig 2 Lifespan curve of fatty Drosophila melanogaster(n=200)
如表2所示,HFE对果蝇体重无明显影响,(P>0.05)。给予猪油后,果蝇平均寿命和最高寿命均显著降低(P<0.01),说明造模成功。HFE组果蝇的平均寿命及最高寿命与模型组相比均有所提高,且随着HFE浓度的增加,平均寿命和最高寿命依次延长,表明HFE对高脂损伤组果蝇有一定的保护作用。其中4.5 mg/ mL HFE组果蝇的平均寿命延长了13.57%(P<0.05),最高寿命延长了9.85%(P<0.01)。
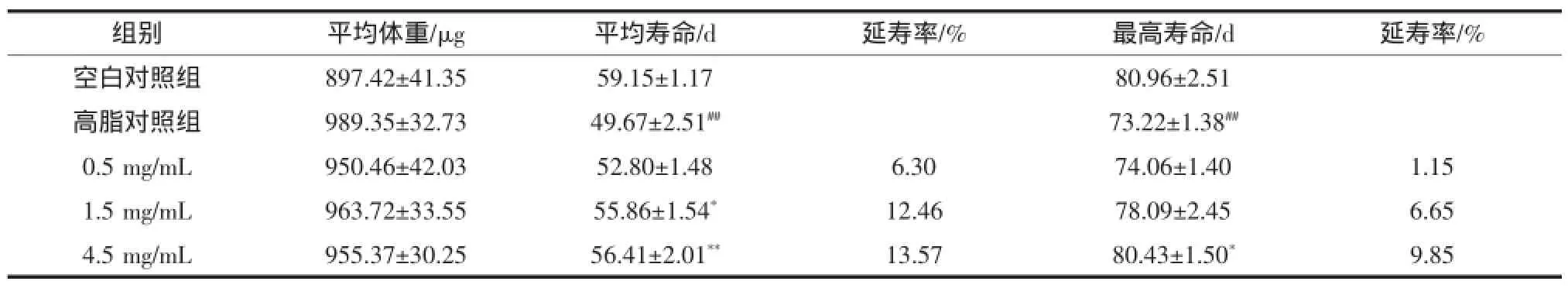
表2 山楂提取物对高脂果蝇寿命的影响(n=200)Tab 2 Effect of HFE on lifespan of fatty Drosophila melanogaster(n=200)
2.3HFE对高脂果蝇体内抗氧化酶活性的影响
HFE对高脂果蝇体内抗氧化酶活性的影响见表3。
与空白对照组相比,模型组果蝇的Cu/Zn-SOD、Mn-SOD、CAT活性明显降低,差异性显著(P<0.05),说明高脂膳食能够对果蝇造成一定程度的氧化损伤,加速衰老;与模型组相比,果蝇在饲喂HFE 40 d之后,0.5、1.5、4.5 mg/mLHFE组果蝇体内SOD及CAT活性与HFE浓度呈剂量依赖关系,其中4.5 mg/mL组果蝇的Cu/Zn-SOD和CAT酶活性显著升高(P<0.05),Mn-SOD活性极显著升高(P<0.01)。
2.4HFE对高脂果蝇丙二醛及蛋白质羰基含量的影响
HFE对高脂果蝇丙二醛及蛋白质羰基含量的影响见表4。
由表4可知,与空白对照组相比,模型组果蝇的PCO和MDA含量显著升高(P<0.01),与模型组相比,果蝇体内PCO和MDA含量随山楂提取物添加量增加呈逐渐降低的趋势,其中4.5 mg/mL组果蝇体内MDA含量极显著降低(P<0.01),蛋白质羰基值显著降低(P<0.05)。
2.5HFE对高脂果蝇抗氧化酶相关基因表达水平的影响
HFE对高脂果蝇抗氧化酶相关基因表达水平的影响见图3。
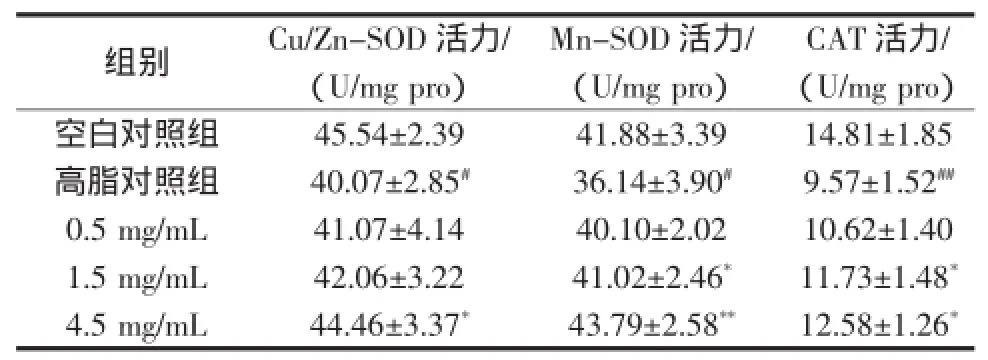
表3 高脂果蝇体内抗氧化酶活性(n=4)Tab 3 The antioxidant enzyme activity in fatty Drosophila melanogaster(n=4)

表4 丙二醛及蛋白质羰基含量Tab 4 The content of MDA and PCO in fatty Drosophila melanogaster(n=4)
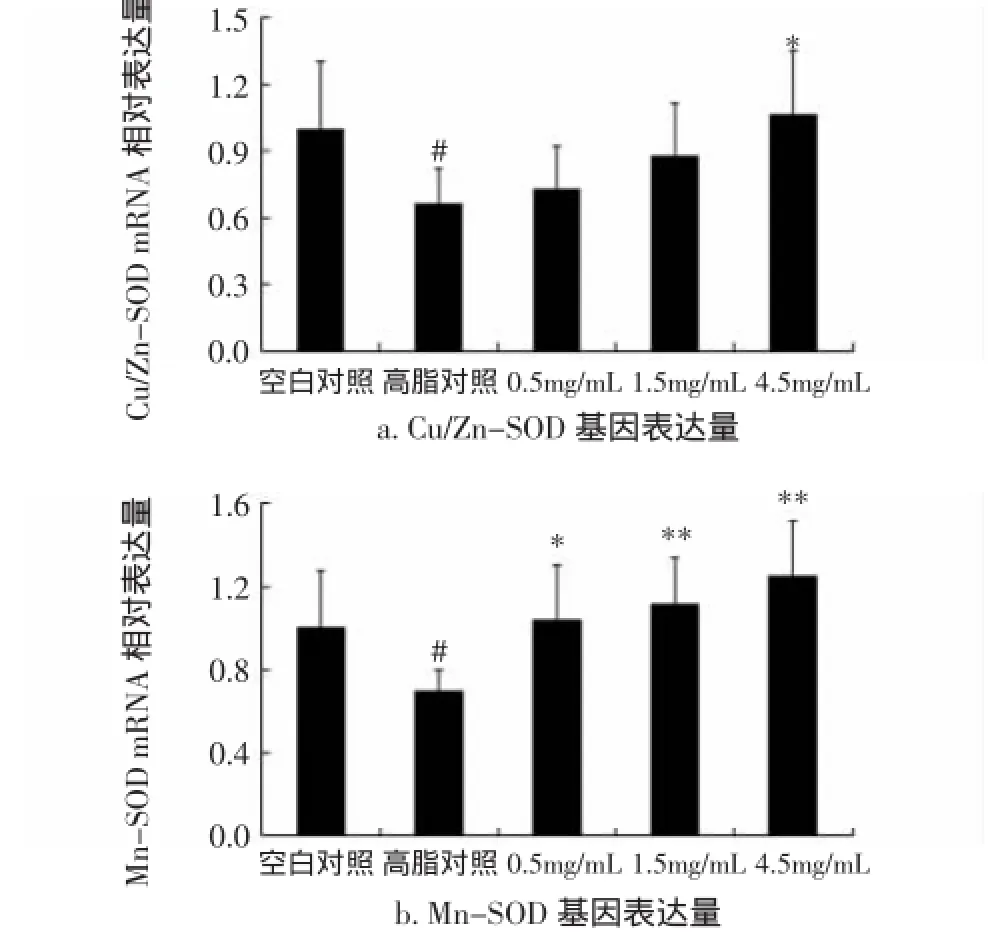
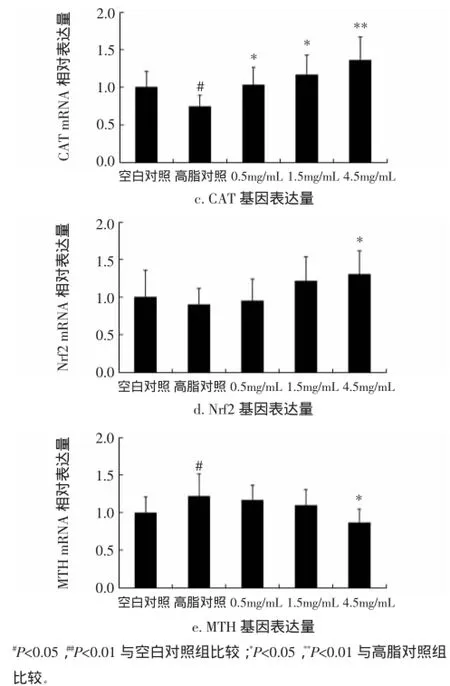
图3高脂果蝇体内抗氧化基因Cu/Zn-SOD、Mn-SOD、CAT、MTH、Nrf2 mRNA表达水平(n=4)Fig 3 mRNA expression level of Cu/Zn-SOD,Mn-SOD,CAT,MTH and Nrf2 in fatty Drosophila melanogaster(n=4)
与空白组相比,模型组果蝇的Cu/Zn-SOD、Mn-SOD、CAT mRNA表达水平显著下调(P<0.05);与模型组相比,各剂量组(0.5、1.5、4.5 mg/mL)果蝇的Cu/Zn-SOD、Mn-SOD、CAT、Nrf2 mRNA表达水平均明显上调,其中4.5 mg/mL组果蝇Mn-SOD、CAT mRNA表达水平极显著上调(P<0.01),分别比模型组提高了78.57% 与83.78%,Nrf2 mRNA显著上调以及MTH mRNA显著下调(P<0.05)。
3 讨论
山楂作为传统的药食同源植物,富含黄酮类、花青素等天然抗氧化物。有研究表明山楂提取物能有效清除超氧阴离子、羟基自由基和过氧化氢等自由基,且无论是在体内还是体外都具有较高的抗氧化活性[16-19]。果蝇进食高脂膳食后,与空白对照组相比,果蝇寿命明显缩短,说明高脂膳食能够导致果蝇体内发生一定程度的氧化应激损伤,加速果蝇衰老,高脂果蝇造模成功。亦有报道显示猪油能使小鼠体内产生大量的脂质过氧化物,加速衰老[20]。与高脂模型组相比,HFE各剂量组果蝇寿命及最高寿命均明显延长,说明HFE对高脂膳食致氧化损伤的果蝇具有一定程度的保护作用。
SOD、CAT是果蝇体内最主要的抗氧化酶,其酶活性的增加可以显著减少自由基氧化损伤,提高抗氧化活性,延缓衰老,因此SOD和CAT的活性水平间接反映机体清除氧自由基的能力[21-22]。Chen[23]等研究发现原花青素和丹酚酸有效延缓了果蝇衰老,升高了血清中SOD的水平,降低了MDA的含量。抗氧化酶活性测定结果显示,HFE组果蝇体内SOD、CAT活性较模型组明显提高,这与Wang[24]等研究的HFE能够升高加速衰老鼠血液抗氧化酶活性的结果相一致。
MDA是自由基作用于不饱和脂肪酸而产生的脂质过氧化产物,通常作为机体脂质过氧化程度的指标[25]。王文[26]等研究山楂水提取液对体外发光有抑制作用,可使大鼠体内MDA的含量降低,具有显著消除体内自由基及抗脂质过氧化作用,且与VE抗自由基及脂质过氧化具有等同作用。蛋白质羰基的产生是蛋白质分子被自由基氧化修饰一个重要标志,因此可以通过测定羰基含量判断蛋白质是否被氧化损伤。本实验测得蛋白质羰基给予果蝇4.5 mg/mLHFE显著。Stadtman与Oliver[27]等报道了蛋白质羰基含量与衰老的关系,指出蛋白质羰基含量随年龄的增长而增加。
实时定量荧光PCR测定结果显示,果蝇体内抗氧化相关基因Cu/Zn-SOD、Mn-SOD、CAT等mRNA的表达水平显著上调(P<0.05),这与果蝇体内相关抗氧化酶活性升高的趋势相一致。Peng等[28]也研究发现茶黄素可以有效延长果蝇寿命,上调Cu/Zn-SOD、Mn-SOD、CAT mRNA表达水平,同时下调MTH mRNA表达水平。Zhang等[29]亦研究发现HFE能够有效提高载体蛋白E缺陷型小鼠的抗氧化活性,并显著上调小鼠体内Cu/Zn-SOD、Mn-SOD mRNA表达水平(P<0.05)。E.A. Baldal等[30]的研究表明敲除MTH内源性配体基因或者过表达MTH受体的肽类拮抗剂均能延长果蝇的寿命。Nrf2[31]是细胞氧化应激反应中的关键因子,受Keap1的调控,通过与抗氧化反应元件相互作用,调节抗氧化蛋白和II相解毒酶的表达,给予HFE后测得果蝇体内Nrf2 mRNA表达水平上调。
实验结果表明,山楂富含多种抗氧化活性成分,一定剂量的HFE能够通过多种调控方式参与模式生物氧化能力的提升,增强机体清除体内自由基的能力,有效降低高脂膳食对果蝇的氧化损伤作用,从而延长机体的寿命。
[1] Liu P,Yang B,Kallio H.Characterization of phenolic compounds in Chinese hawthorn(Crataegus pinnatifida Bge.var.major)fruit by high performance liquid chromatography-electrospray ionization mass spectrometry[J].Food Chemistry,2010,121(4):1188-1197
[2]Gao G Y,Feng Y X,Qin X Q.Analysis of the chemical constituents of hawthorn fruits and their quality evaluation[J].ACTA PHARMACEUTICA SINICA,1995,30(2):143-143
[3]刘武.山植的营养化学成分及保健作用 [J].食品研究与开发,2002,23(5):65-66
[4]翁毅力.山植的药理作用[J].中国药业,2005,14(12):89-90
[5] Bahorun T,Aumjaud E,Ramphul H,et al.Phenolic constituents and antioxidant capacities of Crataegus monogyna(Hawthorn)callus extracts[J].Food/Nahrung,2003,47(3):191-198
[6] Liu T,Cao Y,Zhao M.Extraction optimization,purification and antioxidant activity of procyanidins from hawthorn(C.pinnatifida Bge. var.major)fruits[J].Food chemistry,2010,119(4):1656-1662
[7]张瑞巧,刘石磊,孙智达,等.山楂果肉原花青素的体外抗氧化活性和对DNA损伤的保护作用[J].天然产物研究与开发,2008,20 (1):131-133
[8]肖婷.山楂对正常大鼠肝脏CYP2E1活性的影响[J].现代医药卫生,2011,27(12):1764-1765
[9]Li Y M,Chan H Y E,Yao X Q,et al.Green tea catechins and broccoli reduce fat-induced mortality in Drosophila melanogaster[J].The Journal of nutritional biochemistry,2008,19(6):376-383
[10]武彩霞,丁华.生姜有效部位对高脂饮食所致大鼠衰老现象的影响[J].山东医学高等专科学校学报2006,28(3):183-185
[11]Harman D.The aging process[J].Proceedings of the National Academy of Sciences,1981,78(11):7124-7128
[12]Ji L L.Antioxidant enzyme response to exercise and aging[J]. Medicine and science in sports and exercise,1993,25(2):225-231
[13]Peng C,Zuo Y,Kwan K M,et al.Blueberry extract prolongs lifespan of Drosophila melanogaster[J].Experimental gerontology,2012,47(2):170-178
[14]Kim M S.Korean red ginseng tonic extends lifespan in D. melanogaster[J].Biomolecules&therapeutics,2013,21(3):241
[15]Peng C,Chan HYE,Li YM,et al.Black tea theaflavins extend the lifespan of fruit flies[J].Exp Gerontol,2009,44(12):773-783.
[16]Bahorun T,Trotin F,Pommery J,et al.Antioxidant activities of Crataegus monogyna extracts[J].Planta Medica,1994,60(4):323-328
[17]Bahorun T,Gressier B,Trotin F,et al.Oxygen species scavenging activity of phenolic extracts from hawthorn fresh plant organs and pharmaceutical preparations[J].Arzneimittel-forschung,1996,46 (11):1086-1089
[18]李刚,梁新红,葛晓红.山楂化学成分及其保健功能特性[J].调味副食品,2009,26(6):25-27
[19]Von Eiff M,Brunner H,Haegeli A,et al.Hawthorn/passion flower ex-tract and improvement in physical exercise capacity of patients with dyspnoea class II of the NYHA functional classification[J].Acta therapeutica,1994,20(1/2):47-66
[20]王建峰,乐国伟,施用晖,等.高能日粮条件下半胱胺对大鼠抗氧化功能的影响[J].中国饲料,2005(6):10-14
[21]Beal M F.Aging,energy,and oxidative stress in neurodegenerative diseases[J].Annals of neurology,1995,38(3):357-366
[22]Gupta S C,Siddique H R,Saxena D K,et al.Hazardous effect of organophosphate compound,dichlorvos in transgenic Drosophila melanogaster(hsp70-lacZ):induction of hsp70,anti-oxidant enzymes and inhibition of acetylcholinesterase[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2005,1725(1):81-92
[23]Chen G,Huang Z,Chen R,et al.The effect of proanthocyanidir and salvianolic acid on life span in drosophila,antioxidation and survival time in animal[J].Journal of Environmental&Occupational Medicine,2003,21(3):180-181,185
[24]Wang H,Zhang Z,Guo Y,et al.Hawthorn fruit increases the antioxidant capacity and reduces lipid peroxidation in senescence-accelerated mice[J].European Food Research and Technology,2011,232 (5):743-751
[25]郭善利,刘林德.遗传学实验教程[M].北京:科学出版社,2004:36-38
[26]王文.山楂提取液对大鼠血清SOD、MDA的影响[J].赣南医学院学报,2005,23(2):136-138
[27]Oliver C N,Ahn B W,Moerman E J,et al.Age-related changes in oxidized proteins[J].Journal of Biological Chemistry,1987,262(12):5488-5491
[28]Peng C,Chan H Y E,Huang Y,et al.Apple polyphenols extend the mean lifespan of Drosophila melanogaster[J].Journal of agricultural and food chemistry,2011,59(5):2097-2106
[29]Zhang Z,Ho W K K,Huang Y U,et al.Hawthorn fruit is hypolipidemic in rabbits fed a high cholesterol diet[J].The Journal of nutrition,2002,132(1):5-10
[30]Baldal E A,Baktawar W,Brakefield P M,et al.Methuselah life history in a variety of conditions,implications for the use of mutants in longevity research[J].Experimental gerontology,2006,41(11):1126-1135
[31]Kang M I,Kobayashi A,Wakabayashi N,et al.Scaffolding of Keap1 to the actin cytoskeleton controls the function of Nrf2 as key regulator of cytoprotective phase 2 genes[J].Proceedings of the National A-cademy of Sciences of the United States of America,2004,101(7):2046-2051
Protective Effect of Hawthorn Fruit Extract on the Fat-induced Damage in Drosophila melanogaster
ZHAO Jiang1,CHEN Chun1,WANG Hong1,2,WANG Yi-fei1,2,LÜ Xiao-ling1,WANG Hao1,*
(1.College of Food Engineering and Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China;2.School of Biological Engineering,Tianjin University of Science&Technology,Tianjin 300457,China)
To explore the effect of hawthorn fruit extract on lifespan in male Drosophila melanogaster damaged by high fat and the underlying mechanism of anti-aging.Male Drosophila melanogaster within 2 d-old were treated with different doses(0.5,1.5,4.5 mg/mL)of HFE.The lifespan,anti-oxidation enzymes activities andtheir encoding genes expressions were evaluated.Dietary addition of HFE could prolong the lifespan of Drosophila melanogaster significantly(especially at 4.5 mg/mL).Given HFE 4.5 mg/mL made the enzyme activity of SOD and CAT increase markedly(P<0.05)with decreasing the content of malondialdehyde(MDA)(P<0.01)and protein carbonyl(PCO)(P<0.05);moreover,a significant increase in Cu/Zn-SOD and CAT mRNA expression(P<0.05)as well as Mn-SOD and CAT mRNA expression(P<0.01)was found.HFE might play a positive and protective role on high-fat fruit flies.Simultaneously,the anti-aging and antioxidant activity of HFE was accompanied by regulation of antioxidation genes expression.
hawthorn fruit extract;Drosophila melanogaste;high fat;antioxidant
2015-09-07
赵江(1963—),男(汉),研究员,研究生,主要从事食品营养学研究。
王浩,男,副教授,主要从事食品营养学研究。
