阿苯达唑对蚯蚓若干生化指标的影响
2016-09-18丛琳武瑞李银生
丛琳,武瑞,李银生
(1.黑龙江八一农垦大学动物科技学院,大庆163319;2.上海交通大学农业与生物学院,上海200240)
阿苯达唑对蚯蚓若干生化指标的影响
丛琳1,2,武瑞1*,李银生2
(1.黑龙江八一农垦大学动物科技学院,大庆163319;2.上海交通大学农业与生物学院,上海200240)
采用人工污染土壤的方法进行阿苯达唑的蚯蚓毒性试验,设计阿苯达唑的暴露浓度为0、50、100、200、400、600 mg·kg-1,暴露实验进行3、7、14、28 d后,分别检测蚯蚓体内超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、谷胱甘肽转移酶(GST)活性和丙二醛(MDA)含量。结果表明,在供试浓度范围内,蚯蚓体内各生化指标对污染物暴露指示的敏感性存在差异,敏感性大小为:MDA>GST>SOD≈CAT>POD。400 mg·kg-1和600 mg·kg-1浓度下,阿苯达唑能够引起蚯蚓机体的氧化应激响应。这些敏感的生化指标可以用作阿苯达唑生态毒理的生物标志物。
阿苯达唑;蚯蚓;抗氧化酶;谷胱甘肽转移酶;丙二醛;生物标记物
丛琳,武瑞,李银生.阿苯达唑对蚯蚓若干生化指标的影响[J].农业环境科学学报,2016,35(7):1264-1270.
CONG Lin,WU Rui,LI Yin-sheng.Effects of albendazole on biochemical characteristics of earthworms[J].Journal of Agro-Environment Science,2016,35(7): 1264-1270.
蚯蚓是大型土壤动物,占土壤动物总量的60%,是陆生生物与土壤生物之间传递污染物的桥梁,也是土壤污染毒理诊断的指示生物[1]。目前,污染物对蚯蚓的影响及毒性效应已有报道,如通过蚯蚓急性毒性试验,可大致确定污染物对蚯蚓的毒性大小[2];通过蚯蚓慢性毒性试验,研究污染物对蚯蚓的生殖、生理、代谢、染色体以及基因的影响[3],研究的热点有谷胱甘肽转移酶(GST)、超氧化物歧化酶(SOD)、酸性磷酸酶(AP)[4]、过氧化氢酶(CAT)、乙酰胆碱脂酶(AChE)、羧酸酯酶(CES)[5]、过氧化物酶(POD)、脂质过氧化产物丙二醛(MDA)、活性氧自由基(ROS)[6]、细胞色素P450酶系[7]和彗星试验[8]等;还可以利用蚯蚓组织细胞超微结构的形态学变化来监测污染物的污染程度[9],通过研究蚯蚓以及整个土壤动物种群数量和结构的变化反映土壤的污染程度[10]。污染物对蚯蚓的影响与蚯蚓的部位有关,对蚯蚓不同部位的研究包括蚯蚓整体[11]、肠、体壁[12]、前部、中部、后部[13]和内脏[14]等。
兽药可用来维持动物的健康,然而,过度或不正确的使用,造成药物以原形或代谢物的形式随着粪便和尿液排泄到土壤环境中,从而对土壤中的生物产生危害。阿苯达唑(ABZ)是一种驱虫药,其驱虫的机理是抑制延胡索酸还原酶和葡萄糖的转运,减少三磷酸腺苷(ATP)的合成,从而干扰虫体的生长和繁殖[15],可抗旋毛虫[16]、绦虫、吸虫[17]和囊尾蚴[18]等寄生虫,广泛应用于畜牧业。ABZ在体内迅速代谢为阿苯达唑亚砜(ABZSO),进而转化为阿苯达唑砜(ABZSO2),最终转化为阿苯达唑-2-氨基砜(ABZSO2-NH2)[19]。研究发现,ABZ进入动物体内后,在肌肉、组织和乳汁中[20]均有残留,猪囊尾蚴病患者口服ABZ后,ABZ大约有11%以原药的形式随粪便排出,并且在尿液和粪便中均检测到ABZSO和ABZSO2[18]残留。
目前研究发现,ABZ影响蚯蚓精子的超显微结构[21],还显著影响AP、GST和腺三磷酶(Ca2+-ATPase)的活性[13]。而应用蚯蚓抗氧化系统对ABZ毒性评价的研究相对较少。研究还发现,蚯蚓中部可能是ABZ对蚯蚓GST活性影响较大的部位,选择蚯蚓中部作为生化指标研究的靶组织可能更有效,且有望成为毒理诊断的新方法。
本实验以蚯蚓为供试生物,以SOD、POD、CAT、GST活性及MDA含量为指标,通过人工污染土壤的方法,研究ABZ对蚯蚓体内各生化指标的影响,旨在探讨适合土壤ABZ污染诊断的生物标记物。
1 材料与方法
1.1供试材料
ABZ原粉(含量98%)由大连容海生物科技有限公司生产。
赤子爱胜蚓(Eisenia foetida)购自一蚯蚓养殖场。选取(500±20)mg、体色鲜艳红润、有明显环带的健康成年蚯蚓进行试验。
供试土壤为人工土壤,由10%的苔藓泥炭细土、20%的高岭土、69%的工业石英砂和1%的碳酸钙组成,每个处理土壤干重500 g。
1.2染毒方法
试验设1个单纯人工土壤对照组(0mg·kg-1ABZ)、5个处理组(50、100、200、400、600 mg·kg-1ABZ),染毒浓度以土壤干重计,每个处理3个重复。先将不同浓度的ABZ分别溶于20 mL丙酮中,再将ABZ溶液与500 g土壤充分混合30 min以上,待丙酮自然挥发24 h后,加入100 mL蒸馏水,转移到长方形带盖的塑料盒中(盖上有孔);选取健康成年蚯蚓,清肠12 h后,放入塑料盒中,每个塑料盒中放10条蚯蚓,同时在塑料盒表面加入30 g研细的无药物污染的湿牛粪作为蚯蚓的饵料,于人工气候箱中培养28 d。箱中为标准试验条件:温度为(23±1)℃、湿度为75%±2%、光暗比为12 h/12 h,并定期喷射少量的水以保持土壤的湿度。于试验的第3、7、14、28 d,从各处理组每个重复中取1条蚯蚓,进行SOD、CAT、POD、MDA和GST的测定。
1.3组织匀浆液的制备
以预冷的0.86%生理盐水为蚯蚓组织匀浆液,1条蚯蚓清肠12 h,除去头尾,保留中部25~33节,称重,加入适量匀浆液,快速将蚯蚓剪碎,玻璃匀浆器匀浆数次,总计加入的匀浆液应为9倍质量体积,制成10%的组织匀浆。将匀浆液装于1.5 mL离心管,10 000 r·min-1离心10 min,吸取上清,1.5 mL离心管编号供试,贮存于-80℃冰箱。
1.4酶活性的测定
SOD、CAT、SOD、GST和MDA均采用南京建成生物工程研究所生产的测试盒测定,按说明书的方法操作。其他药品均为市购分析纯。每个处理设3个重复,每个重复设3个平行,每个平行重复测定3次。
1.5数据处理
采用SPSS 19.0统计软件进行单因素方差分析(One-way ANOVA),对组间数据进行差异显著性分析,显著水平为0.05。
2 结果与分析
2.1SOD活性的变化
不同浓度的ABZ在不同时间对蚯蚓体内SOD活性的影响如图1所示。染毒后3 d,600 mg·kg-1的处理组SOD活性与对照组相比差异显著(P<0.05),为对照组的31%;其余处理组SOD活性与对照组相比没有显著差异(P>0.05)。染毒后7 d,浓度为50~200 mg·kg-1的处理组SOD活性与对照组相比没有显著差异(P>0.05);浓度为400 mg·kg-1和600 mg·kg-1的处理组SOD活性与对照组相比差异显著(P<0.05),分别为对照组的85%和83%。染毒后14 d,浓度为50 mg·kg-1和100 mg·kg-1的处理组SOD活性与对照组相比没有显著差异(P>0.05);浓度为200 mg·kg-1和400 mg·kg-1的处理组SOD活性与对照组相比差异显著(P<0.05),分别为对照组的86%和72%;浓度为600 mg·kg-1的处理组SOD活性与对照组相比差异极显著(P<0.01),为对照组的63%。染毒后28 d,浓度为50、400、600 mg·kg-1的处理组SOD活性与对照组相比差异显著(P<0.05),分别为对照组的79%、77%和75%;其余处理组SOD活性与对照组相比没有显著差异(P>0.05)。

图1 阿苯达唑对蚯蚓体内SOD活性的影响Figure 1 Effect of albendazole on SOD activity of earthworms
2.2CAT活性的变化
不同浓度的ABZ在不同时间对蚯蚓体内CAT活性的影响如图2所示。染毒后3 d,各处理组CAT活性与对照组相比没有显著差异(P>0.05),说明ABZ对其没有明显的诱导或抑制效应。染毒后7 d,浓度为50~200 mg·kg-1的处理组CAT活性与对照组相比没有显著差异(P>0.05);浓度为400 mg·kg-1和600 mg· kg-1的处理组CAT活性与对照组相比差异显著(P<0.05),分别为对照组的82%和75%。染毒后14 d,浓度为50~200 mg·kg-1的处理组CAT活性与对照组相比没有显著差异(P>0.05);浓度为400 mg·kg-1的处理组CAT活性与对照组相比差异显著(P<0.05),为对照组的83%;浓度为600 mg·kg-1的处理组CAT活性与对照组相比差异极显著(P<0.01),为对照组的73%。染毒后28 d,浓度为600 mg·kg-1的处理组CAT活性与对照组相比差异显著(P<0.05),为对照组的77%;其余处理组CAT活性与对照组相比没有显著差异(P>0.05)。
2.3POD活性的变化
不同浓度的ABZ在不同时间对蚯蚓体内POD活性的影响如图3所示。染毒后3 d,各处理组POD活性与对照组相比没有显著差异(P>0.05),说明ABZ对其没有明显的诱导或抑制效应。染毒后7 d,浓度为50~400 mg·kg-1的处理组POD活性与对照组相比没有显著差异(P>0.05);浓度为600 mg·kg-1的处理组POD活性与对照组相比差异显著(P<0.05),为对照组的84%。染毒后14 d,浓度为50~400 mg·kg-1的处理组POD活性与对照组相比没有显著差异(P>0.05);浓度为600 mg·kg-1的处理组POD活性与对照组相比差异显著(P<0.05),为对照组的86%。染毒后28 d,各处理组POD活性与对照组相比没有显著差异(P>0.05)。

图2 阿苯达唑对蚯蚓体内CAT活性的影响Figure 2 Effect of albendazole on CAT activity of earthworms

图3 阿苯达唑对蚯蚓体内POD活性的影响Figure 3 Effect of albendazole on POD activity of earthworms
2.4GST活性的变化
不同浓度的ABZ在不同时间对蚯蚓体内GST活性的影响如图4所示。染毒后3 d,各处理组GST活性与对照组相比没有显著差异(P>0.05),说明ABZ对其没有明显的诱导或抑制效应。染毒后7 d,浓度为50~200 mg·kg-1的处理组GST活性与对照组相比没有显著差异(P>0.05);浓度为400 mg·kg-1和600 mg· kg-1的处理组GST活性与对照组相比差异显著(P<0.05),分别为对照组的83%和79%。染毒后14 d,浓度为50 mg·kg-1和100 mg·kg-1的处理组GST活性与对照组相比没有显著差异(P>0.05);浓度为200 mg· kg-1的处理组GST活性与对照组相比差异显著(P<0.05),为对照组的82%;浓度为400 mg·kg-1和600 mg·kg-1的处理组GST活性与对照组相比差异极显著(P<0.01),分别为对照组的74%和68%。染毒后28 d,浓度为50~200 mg·kg-1的处理组GST活性与对照组相比没有显著差异(P>0.05);浓度为400 mg·kg-1和600 mg·kg-1的处理组GST活性与对照组相比差异显著(P<0.05),分别为对照组的84%和80%。
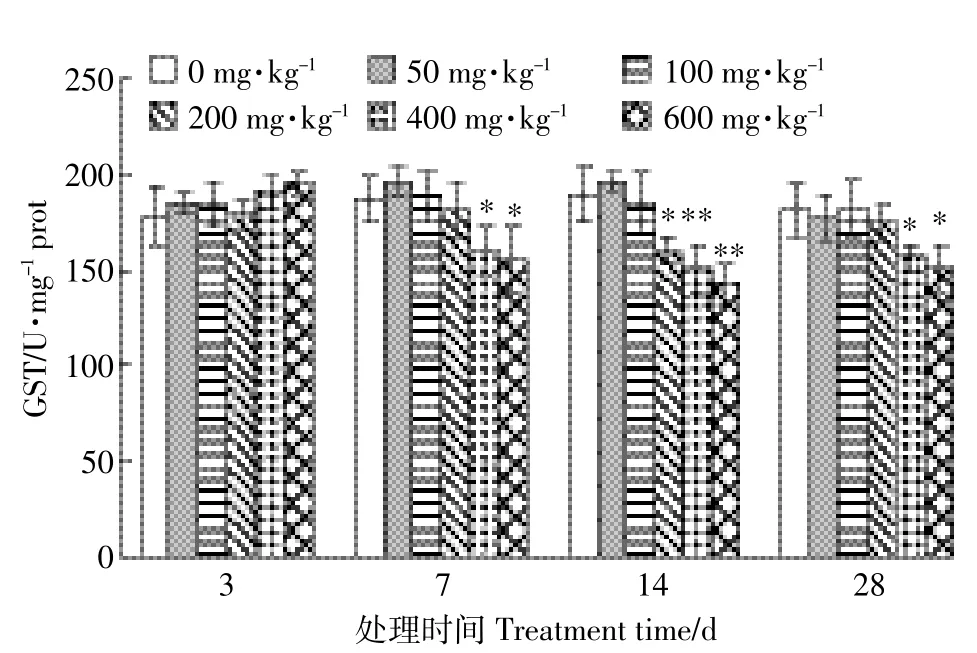
图4 阿苯达唑对蚯蚓体内GST活性的影响Figure 4 Effect of albendazole on GST activity of earthworms
2.5MDA含量的变化
不同浓度的ABZ在不同时间对蚯蚓体内MDA活性的影响如图5所示。染毒后3 d,浓度为50 mg· kg-1和100 mg·kg-1的处理组MDA活性与对照组相比没有显著差异(P>0.05);浓度为200 mg·kg-1的处理组MDA活性与对照组相比差异显著(P<0.05),比对照组高16%;浓度为400 mg·kg-1和600 mg·kg-1的处理组MDA活性与对照组相比差异极显著(P<0.01),分别比对照组高30%和38%。染毒后7 d,浓度为50 mg·kg-1和100 mg·kg-1的处理组MDA活性与对照组相比没有显著差异(P>0.05);浓度为200 mg·kg-1和400 mg·kg-1的处理组MDA活性与对照组相比差异显著(P<0.05),分别比对照组高16%和13%;浓度为600 mg·kg-1的处理组MDA活性与对照组相比差异极显著(P<0.01),比对照组高36%。染毒后14 d,浓度为50 mg·kg-1的处理组MDA活性与对照组相比没有显著差异(P>0.05);浓度为100~400 mg·kg-1的处理组MDA活性与对照组相比差异显著(P<0.05),分别比对照组高16%、13%和17%;浓度为600 mg·kg-1的处理组MDA活性与对照组相比差异极显著(P<0.01),比对照组高38%。染毒后28 d,各处理组MDA活性与对照组相比没有显著差异(P>0.05)。

图5 阿苯达唑对蚯蚓体内MDA含量的影响Figure 5 Effect of albendazole on MDA content of earthworms
3 讨论
3.1阿苯达唑对蚯蚓SOD活性的影响
SOD是一种金属酶,在动植物和微生物体内广泛存在,可催化超氧阴离子自由基生成过氧化氢(H2O2),并水解为水(H2O)和氧气(O2),SOD将对氧阴离子自由基的生成和清除处于一种动态平衡中,从而使机体免受超氧阴离子自由基的影响。SOD活性的变化常被用作标志物来指示重金属[22]和杀菌剂[23]污染。ABZ对蚯蚓SOD活性的影响表现为:中高浓度处理组,随着暴露时间的延长,其活性呈下降趋势,可能是ABZ对蚯蚓体内SOD活性有抑制作用,且随着暴露时间的延长,抑制作用越强,说明ABZ对蚯蚓体内氧化损伤作用越强。王轶等[24]在阿苯哒唑对蚯蚓的生态毒理效应中发现,染毒后21 d,浓度为0.25 mg·kg-1和0.5 mg·kg-1的处理组与对照组相比SOD活性呈上升趋势,说明低浓度的ABZ对SOD具有诱导作用。
3.2阿苯达唑对蚯蚓CAT活性的影响
CAT是一种抗氧化酶,在微生物、植物和动物体内均有存在,可清除体内的H2O2,避免其与O-2·发生反应生成有害物质OH-[25],造成机体损伤。该酶在抗氧化防御系统中是一种关键酶,广泛应用于医药、造纸、环保、食品和纺织等行业[26]。ABZ对蚯蚓CAT活性的影响表现为:低浓度处理组(50~200 mg·kg-1),在暴露时间内与对照组相比没有显著差异(P>0.05),说明ABZ对其没有明显的诱导或抑制效应。高浓度组(400 mg·kg-1和600 mg·kg-1)在染毒7 d时表现出显著的抑制效应,随着暴露时间的延长,染毒14 d时高浓度组(600 mg·kg-1)表现出极显著的抑制效应,在染毒28 d时抑制效应减弱,可能是机体内产生了大量的H2O2,超出其自动调节能力,机体内的CAT不足以清除大量的H2O2,使CAT活性下降,破坏机体的生物膜结构[27]。罗艳蕊等[11]发现,离子液体溴化1-辛基-3-甲基咪唑暴露42 d后蚯蚓体内CAT活性被显著抑制。王娟[28]发现,吡虫啉可抑制CAT活性,且浓度越大,CAT被抑制程度越高。
3.3阿苯达唑对蚯蚓POD活性的影响
POD是一种抗氧化酶,可以清除生物体内过量的H2O2,但其清除H2O2的方式与CAT不同。POD是以H2O2为电子受体,通过催化其他物质氧化分解的同时使H2O2接受电子转化为H2O。虽然POD和CAT在清除H2O2的方式上有所不同,但研究发现两者在清除体内过量H2O2上有良好的协同作用[29]。对蚯蚓POD的研究发现,蚯蚓暴露于莠去津环境时,可引起POD活力的上升[30]。ABZ对蚯蚓POD活性的影响表现为:浓度为50~400 mg·kg-1的处理组,在暴露时间内POD活力与对照组相比没有显著差异(P>0.05),说明ABZ对其没有明显的诱导或抑制效应。与之相反,浓度为600 mg·kg-1的处理组,在染毒7 d和14 d时,POD活力受到抑制,与对照组相比差异显著(P<0.05);在染毒28 d时,ABZ处理组又恢复至对照水平。造成该现象的原因可能是低剂量的ABZ产生的H2O2被体内的POD和CAT及时、有效地清除,而高剂量的ABZ产生的H2O2,超出了机体的自动调节能力,机体内的POD不足以清除大量的H2O2,使POD活性下降。本研究发现,阿苯达唑对CAT和POD均有抑制作用,与POD相比,其对CAT的抑制作用更强。
3.4阿苯达唑对蚯蚓GST活性的影响
蚯蚓体内含有很多解毒酶,例如GST、P450(细胞色素)、GSSG(氧化型谷胱甘肽)、GSH-Px(谷胱甘肽过氧化物酶)和GSH(还原型谷胱甘肽)等。GST在解毒过程中起着非常重要的作用,它可催化GSH与污染物中亲电物质结合,从而减少这些污染物与细胞内生物大分子结合,还可清除脂类过氧化物,从而减少其对机体的损伤;另外其在抗氧化过程中也起着重要作用,可对活性氧簇(ROS)进行解毒。有关GST活性的变化对污染物暴露的指示作用在水体环境中的研究较多,如朱丽娜[31]发现,五氯酚(PentachioroPhenol,PCP)暴露3 h对雄性花背蟾蜍肝脏中GST活性的影响主要为诱导效应。ABZ对蚯蚓GST活性的影响表现为:染毒7 d时高浓度组(400 mg·kg-1和600 mg· kg-1)表现出显著的抑制效应,随着暴露时间的延长,染毒14 d时高浓度组(400 mg·kg-1和600 mg·kg-1)表现出极显著的抑制效应,可能是ABZ对其产生毒性作用。Gao等[32]发现,染毒时间越长,蚯蚓体内ABZ浓度越高,其对GST活性的抑制作用越强,在染毒14 d时200~600 mg·kg-1的GST活性降到对照组的85%~73%。
3.5阿苯达唑对蚯蚓MDA含量的影响
机体通过酶系统与非酶系统产生ROS,后者可作用于生物膜中的多不饱和脂肪酸,引起脂质发生过氧化反应,生成脂质过氧化物MDA,因此测定MDA的含量可以反映机体内脂质过氧化的程度,间接反映细胞的损伤程度[33]。MDA会引起核酸、蛋白质等生物大分子的交联聚合,并且具有细胞毒性[34]。ABZ对蚯蚓MDA含量的影响表现为:在染毒3 d时,高浓度组(200~600 mg·kg-1)表现出显著的诱导效应,尤其是400 mg·kg-1和600 mg·kg-1处理组表现出极显著的诱导效应;随着暴露时间的延长,在染毒7 d和14 d时,浓度为600 mg·kg-1的处理组,持续表现出极显著的诱导效应;在染毒28 d时,ABZ处理组又恢复至对照水平。造成该现象的原因可能是高剂量的ABZ对蚯蚓造成过氧化损伤,暴露时间越长,其对蚯蚓的损伤程度越严重,而土壤的老化程度也越明显,使ABZ的生物利用度降低,所以在染毒28 d时MDA的含量恢复至对照水平。黄沛力等[16]发现,受染大鼠用药组(ABZ)血清中MDA含量升高,但与未用药组相比没有显著性差异(P>0.05)。
本研究结果显示,蚯蚓体内的生化指标对不同暴露浓度的ABZ均有响应,但不同的生化指标对ABZ响应的毒性阈值是不同的,如SOD和CAT在600 mg·kg-1剂量下暴露14 d后表现出极显著的抑制效应;而POD在600 mg·kg-1剂量下暴露14 d后表现出显著的抑制效应;GST在400 mg·kg-1和600 mg·kg-1剂量下暴露14 d后表现出极显著的抑制效应;MDA在400 mg·kg-1和600 mg·kg-1剂量下暴露3 d后表现出极显著的诱导效应。由此可看出,MDA响应最为敏感,其次为GST,POD的响应最弱。
本研究结果表明,土壤中的ABZ可能对蚯蚓产生氧化损伤。这种损伤是否影响蚯蚓的生存、生长发育甚至种群数量与结构等,需要进一步研究。鉴于蚯蚓的重要生态功能,ABZ的这种毒性对土壤环境具有一定的潜在风险。
4 结论
(1)蚯蚓暴露于阿苯达唑污染土壤时,所研究的5种生化指标均对其产生了不同程度的响应,但是不同的生化指标对毒性效应响应的阈值不同,其敏感性大小为MDA>GST>SOD≈CAT>POD。
(2)本研究结果可为阿苯达唑的土壤生态毒理诊断提供参考。
[1]Johnston A S,Hodson M E,Thorbek P,et al.An energy budget agentbased model of earthworm populations and its application to study the effects of pesticides[J].Ecol Modell,2014,280(8):5-17.
[2]胡秀卿,吴珉,苍涛,等.毒死蜱和甲氰菊酯对蚯蚓毒性与安全评价研究[J].农药科学与管理,2004,25(4):10-11. HU Xiu-qing,WU Min,CANG Tao,et al.Study on toxicity and safety evaluation of chlorpyrifos and fenpropathrin to earthworm[J].Pesticide Science and Administration,2004,25(4):10-11.
[3]邱江平.蚯蚓及其在环境保护上的应用Ⅱ.蚯蚓生态毒理学[J].上海农学院学报,1999,17(4):301-308. QIU Jiang-ping.Earthworms and their application in environment protectionⅡ.Ecotoxicology of earthworms[J].Journal of Shanghai Agricultual College,1999,17(4):301-308.
[4]王辉,谢鑫源.Cd、Cu和Pb复合污染对蚯蚓抗氧化酶活性的影响[J].环境科学,2014,35(7):2748-2754. WANG Hui,XIE Xin-yuan.Effects of combined pollution of Cd,Cu and Pb on antioxidant enzyme activities of earthworm in soils[J].Environmental Science,2014,35(7):2748-2454.
[5]Velki M,Hackenberger B K,Loncˇaric′Z,et al.Application of microcosmic system for assessment of insecticide effects on biomarker responses in ecologically different earthworm species[J].Ecotoxicol Environ Saf,2014,104:110-119.
[6]Zhang Q,Zhang B,Wang C.Ecotoxicological effects on the earthworm Eisenia fetida following exposure to soil contaminated with imidacloprid[J].Environ Sci Pollut Res Int,2014,21(21):12345-12353.
[7]Zhang W,Song Y F,Gong P,et al.Earthworm cytochrome P450 determination and application as a biomarker for diagnosing PAH exposure[J].JEnviron Monit,2006,8(9):963-967.
[8]Bustos-Obregon E,Goicochea R I.Pesticide soil contamination mainly affects earthworm malere productive parameters[J].Asian J Androl,2002,4(3):195-199.
[9]甘雅玲,郭中伟.溴氰菊脂对蚯蚓超微结构影响的研究[J].电子显微学报,2002,21(5):513-514. GAN Ya-ling,GUO Zhong-wei.Study on the effect of deltamethrin on ultrastructure of earthworm[J].Journal of Chinese Electron Microscopy Society,2002,21(5):513-514.
[10]孙铁珩,宋玉芳.土壤污染的生态毒理诊断[J].环境科学学报,2002,22(6):689-695. SUN Tie-heng,SONG Yu-fang.Eco-toxicological diagnosis of soil pollution[J].ActaScientiae Circumstantiae,2002,22(6):689-695.
[11]罗艳蕊,李效宇,运迷霞,等.[C8mim]Br对蚯蚓抗氧化系统的亚慢性毒性效应[J].农业环境科学学报,2009,28(2):343-347. LUO Yan-rui,LI Xiao-yu,YUN Mi-xia,et al.Subchronic toxicity effect of[C8mim]Br on the antioxidant system of earthworm[J].Journal of Agro-Environment Science,2009,28(2):343-347.
[12]Gao Y,Sun X,Sun Z,et al.Toxic effects of enrofloxacin on growth rate and catalase activity in Eisenia fetida[J].Environ Toxicol Pharmacol,2008,26(2):177-180.
[13]高玉红,孙振钧,孙新胜,等.阿苯哒唑对蚯蚓(Eisenia fetida)酸性磷酸酶、谷胱甘肽硫转移酶及腺三磷酶活性的影响[J].生态学报,2007,27(9):3916-3922. GAO Yu-hong,SUN Zhen-jun,SUN Xin-sheng,et al.Effect of albendazole on acid phosphatase,glutathione S-transferase and adenosine triphosphatease activities of earthworms[J].ActaEcologicaSinica,2007,27(9):3916-3922.
[14]杨晓霞,张薇,曹秀凤,等.亚致死剂量铜对蚯蚓P450酶和抗氧化酶活性的长期影响[J].环境科学学报,2012,32(3):745-750. YANG Xiao-xia,ZHANG Wei,CAO Xiu-feng,et al.Long-term effect of copper with sublethal dose on cytochrome P450 and antioxidant enzyme activities of earthworms[J].Acta Scientiae Circumstantiae,2012,32(3):745-750.
[15]GrØnvold J,Svendsen T S,Kraglund H O,et al.Effect of the antiparasitic drugs fenbendazole and ivermectin on the soil nematode Pristionchus maupasi[J].Vet Parasitol,2004,124(1/2):91-99.
[16]黄沛力,李浴峰,陈怡,等.氧自由基与阿苯达唑对旋毛虫幼虫作用关系初探[J].中国人兽共患病杂志,2002,18(2):76-78. HUANG Pei-li,LI Yu-feng,CHEN Yi,et al.Studies on relationship between oxygen free radical and albenedazle acting on the larve of T. spiralis[J].Chinese Journal of Zoonoses,2002,18(2):76-78.
[17]许正敏,李智山,温茂兴,等.中药合剂和阿苯达唑对犬钩蚴的作用效果观察[J].中国病原生物学杂志,2012,7(5):357-359. XU Zheng-min,LI Zhi-shan,WEN Mao-xing,et al.Observation of the effects of a traditional Chinese medicinal mixture and albendazole on canine hookworm larvae[J].Journal of Pathogen Biology,2012,7(5):357-359.
[18]赵冠宏,许炽标.阿苯哒唑在猪囊尾蚴病患者体内吸收和排泄的初步研究[J].中国航天医药杂志,2002,4(3):4-5. ZHAO Guan-hong,XU Chi-biao.Preliminary studies on absorption and excretion of albendazole in patients with cysticercosis cellulosae[J]. Medical Journal of Casc,2002,4(3):4-5.
[19]Mirfazaelian A,Dadashzadeh S,Rouini M R.A high performance liquid chromatography method for simultaneous determination of albendazole metabolites in human serum[J].J Pharm Biomed Anal,2002,30(4):1249-1254.
[20]李慧萍,毕文岩,郭恒,等.牛肉中阿苯达唑及其代谢产物残留的检测[J].中国奶牛,2011(8):62-64. LI Hui-ping,BI Wen-yan,GUO Heng,et al.Detection of beef albendazole and its metabolites[J].ChinaDairy Cattle,2011(8):62-64.
[21]高玉红,贾鎏辉,吴占军,等.兽药阿苯达唑对蚯蚓精子发生的显微和超显微结构的影响[J].环境科学学报,2012,32(10):2607-2611. GAO Yu-hong,JIA Liu-hui,WU Zhan-jun,et al.Effect of albendazole on microstructure and ultrastructure during spermiogenesis in earthworms[J].Acta Scientiae Circumstantiae,2012,32(10):2607-2611.
[22]Yang X,Song Y,Ackland M L,et al.Biochemical responses of earthworm Eisenia fetida exposed to cadmium-contaminated soil with long duration[J].Bull Environ Contam Toxicol,2012,89(6):1148-1153.
[23]Cao X,Yang C,Liu J,et al.DNA damage and effects on antioxidative enzymes in earthworm(Eisenia fetida)induced by flumorph[J].Appl Biochem Biotechnol,2014,172(4):2276-2285.
[24]王轶,唐云,徐凌凌,等.阿苯哒唑对蚯蚓的生态毒理效应[J].应用生态学报,2009,20(9):2298-2300. WANG Yi,TANG Yun,XU Ling-ling,et al.Ecotoxicolgical effects of albendazole on Eisenia fetida[J].Chinese Journal of Applied Ecology,2009,20(9):2298-2300.
[25]毛玉霞,郑洪,郭祥群,等.过氧化氢酶荧光分析法及其在海洋水生生物酶活力测定中的应用[J].高等学校化学学报,2002,10(23):1864-1867. MAO Yu-Xia,ZHENG Hong,GUO Xiang-Qun,et al.Fluorescence analysis of catalase and its application in the determination of enzyme activity in marine aquatic life[J].Chemical Research in Chinese Universities,2002,10(23):1864-1867.
[26]Zamocky M,Furtmüller P G,Obinger C.Evolution of catalases from bacteria to humans[J].Antioxid Redox Signal,2008,10(9):1527-1548.
[27]徐镜波,袁晓凡,郎佩珍.过氧化氢酶活性及活性抑制的紫外分光光度测定[J].环境化学,1997,16(1):73-76. XU Jing-bo,YUAN Xiao-fan,LANG Pei-zhen.Determination of catalase activity and activity inhibition by UV Spectrophotometry[J].Environmental Chemistry,1997,16(1):73-76.
[28]王娟.吡虫啉对蚯蚓抗氧化酶系的影响及DNA损伤[D].泰安:山东农业大学,2013. WANG Juan.Oxidative stress and DNA damage induced by imidacloprid exposure in earthworm[D].Taian:Shandong Agricultural University,2013.
[29]张薇,宋玉芳,孙铁珩,等.土壤低剂量荧蒽胁迫下蚯蚓的抗氧化防御反应[J].土壤学报,2007,44(6):1050-1054. ZHANG Wei,SONG Yu-fang,SUN Tie-heng,et al.The antioxidant defense reaction of earthworm soil low dose fluoranthene stress[J].Acta PedologicaSinica,2007,44(6):1050-1054.
[30]Song Y,Zhu L S,Wang J,et al.DNA damage and effects on antioxidative enzymes in earthworm(Eisenia fetida)induced by atrazine[J].Soil Biology and Biochemistry,2009,41(5):905-909.
[31]朱丽娜.五氯酚对花背蟾蜍遗传毒性及GST、LDH酶活性作用的研究[D].兰州:兰州大学,2007. ZHU Li-na.The genotoxic effects of pentachlorophenol on Bufo raddei and the activity changes of GST and LDH[D].Lanzhou:Lanzhou University,2007.
[32]Gao Y H,Sun Z J,Liu Y Q,et al.Effect of albendazole anthelmintics on the enzyme activities of different tissue regions in Eisenia fetida[J]. Euro Pean Journal of Soil Biology,2007,43:S246-S251.
[33]Duryee M J,Klassen L W,Schaffert C S,et al.Malondialdehyde-acetaldehyde adduct is the dominant epitope after MDA modification of proteins in atherosclerosis[J].Free Radical Biology and Medicine,2010,49(10):1480-1486.
[34]Mooradian A D,Reinacher D,Li J P,et al.Malondialdehyde modification of proteins in vitro is enhanced in the presence of acetaldehyde[J]. Nutrition,2001,17(7/8):619-622.
Effects of albendazole on biochemical characteristics of earthworms
CONG Lin1,2,WU Rui1*,LI Yin-sheng2
(1.College of Animal Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319,China;2.College of Agriculture and Biology,Shanghai Jiao Tong University,Shanghai 200240,China)
The toxicity of albendazole(ABZ)was investigated using earthworms and artificial soils contaminated with varying concentrations(0,50,100,200,400 and 600 mg·kg-1)of ABZ.The toxicity to the earthworms was assessed by measuring malondialdehyde(MDA)content and glutathione-S-transferase(GST),superoxide dismutase(SOD),peroxidase(POD)and catalase(CAT)activities of earthworms after exposure to ABZ for 3,7,14 and 28 days.The MDA content was positively correlated with ABZ concentrations;Such correlation was significant at ABZ concentration of 400 mg·kg-1after 3 days and 600 mg·kg-1after 3,7 and 14 days.The activities of SOD,CAT,POD and GST were negatively correlated with ABZ concentrations.The SOD and CAT activities were significantly inhibited by ABZ at 600 mg·kg-1after 14 days,while POD activity was significantly suppressed by 600 mg·kg-1after 7 days,and GST activity by 400 to 600 mg·kg-1after 14 days. These sensitive biochemical indexes may be used as ecotoxicological biomarker of albendazole.
albendazole;earthworm;antioxidant enzyme;glutathione-S-transferase;malondialdehyde;biomarker
X820.3
A
1672-2043(2016)07-1264-07
10.11654/jaes.2016.07.006
2015-12-31
国家自然科学基金项目(31172360)
丛琳(1990—),女,硕士生,从事临床兽医学与新兽药研发。E-mail:151072960@qq.com
武瑞E-mail:19393603@qq.com
