桑树杆生物炭铁锰氧化物复合吸附剂的制备及其对()的吸附机理研究
2016-09-18秦艳敏梁美娜王敦球朱义年唐沈李欢欢张涛
秦艳敏,梁美娜*,王敦球,朱义年,唐沈,李欢欢,张涛
(1.桂林理工大学环境科学与工程学院,广西桂林541006;2.广西岩溶地区水污染控制与用水安全保障协同创新中心,广西桂林541004)
秦艳敏1,2,梁美娜1,2*,王敦球1,2,朱义年1,2,唐沈1,2,李欢欢1,2,张涛1,2
(1.桂林理工大学环境科学与工程学院,广西桂林541006;2.广西岩溶地区水污染控制与用水安全保障协同创新中心,广西桂林541004)
以桑树杆为原料,通过正交试验设计,利用氧化和共沉淀法制备桑树杆生物炭/铁锰氧化物复合吸附剂(MBFMA),考察pH值、离子强度、共存离子对吸附剂除As(Ⅴ)吸附性能的影响,并对MBFMA进行了表征,探讨了吸附机理。研究结果表明,制备复合吸附剂的最佳工艺为:KMnO4浓度40 g·L-1、FeCl2浓度40 g·L-1、浸渍时间24 h,煅烧温度400℃,煅烧时间3 h。在pH范围为2.0~7.0时,吸附剂对As(Ⅴ)的吸附效果最佳;硝酸根、硫酸根、碳酸根和磷酸根溶液对除砷效果有不同程度的影响,其中磷酸盐的影响最大,离子强度对除砷效果影响不大;与Freundlich相比,Langmuir模型能够较好地描述MBFMA对As(Ⅴ)的吸附行为,25℃下最大吸附量为4.87 mg·g-1。能谱分析表明吸附As(Ⅴ)的MBFMA含有0.34%的砷,FTIR定性分析表明羟基、羧基、内酯基是MBFMA表面的主要特征官能团,XPS分析表明铁、锰和表面含碳官能团参与了吸附反应,MBFMA对As(Ⅴ)的吸附是专性吸附。
桑树杆;铁锰氧化物;制备;吸附;As(Ⅴ)
秦艳敏,梁美娜,王敦球,等.桑树杆生物炭/铁锰氧化物复合吸附剂的制备及其对As(Ⅴ)的吸附机理研究[J].农业环境科学学报,2016,35(7):1398-1406.
QIN Yan-min,LIANG Mei-na,WANG Dun-qiu,et al.Preparation and arsenic adsorption and its mechanisms by mulberry stem biochar/Fe-Mn oxides composite adsorbent[J].Journal of Agro-Environment Science,2016,35(7):1398-1406.
砷及其化合物的大范围应用会导致一系列环境问题,例如:冶炼行业[1]和含砷矿床开发过程中产生的含砷废水的排放增大了环境水体中砷的含量以及分布范围。水体中的砷主要以As(Ⅴ)和As(Ⅲ)[2-3]存在,砷的含量超过了一定的浓度限值就会对人体造成危害。有研究表明,人体摄取70~80 mg的砷对人体的危害将是致命的,长期饮用砷浓度为3 mg·L-1左右的饮用水会引起慢性中毒,含砷水对人体健康的危害主要有致癌[4]以及引起皮肤病[5-6]。水体砷污染已成为亟待解决的环境问题,引起了环保学者的普遍关注。
目前,含砷废水的处理方法主要有膜分离法[7]、氧化法[3]、沉淀法[8]、吸附法[9]、离子交换法[10]等。其中,吸附法因其原料来源广泛、操作简单、成本低以及不易造成二次污染等优点而成为研究热点。有研究表明[11],金属氧化物表面的官能团能够通过表面复杂的反应或静电吸附来去除水体中的重金属污染物,铁的氧化物对As(Ⅴ)具有较好的吸附能力[12-13],可以利用铁氧化物改性[14-15]吸附剂来增大其对As(Ⅴ)的吸附能力,锰的氧化物也具有较强的氧化性[16-17]和吸附活性,因而可以利用铁锰氧化物来处理含As(Ⅴ)废水。但是相关研究[18]显示,铁锰氧化物的絮凝性比较差,机械强度不高,空结构比较少,所以可以考虑把铁、锰氧化物和其他的吸附剂结合起来,提高复合吸附剂吸附能力。
广西桑蚕业发展迅速,2005年的桑园面积已达到9.4万hm2,桑茧产量14.85万t,到2015年,全区桑园面积超过20万hm2,蚕茧产量突破了34.5万t,蚕茧产量已连续11年全国第一。然而在带来经济效益的同时,大量积累的桑树杆的有效利用也成为要解决的问题。桑树杆生物质含有大量的纤维素与半纤维素,可以作为制备吸附剂的原料利用。本文以桑树杆为主要原料,利用氧化和共沉淀法制备桑树杆生物炭/铁锰氧化物复合吸附剂(MBFMA),通过正交实验研究确定了制备MBFMA的最佳工艺条件,并研究了最佳制备条件下获得的MBFMA对As(Ⅴ)的吸附性能,探讨其对As(Ⅴ)的吸附机理,为资源化利用农业废弃物探索新的途径。
1 材料与方法
1.1仪器和试剂
主要仪器:SA-20原子荧光形态分析仪;pH仪;S-4800型场发射扫描电镜;ESCALAB 250Xi型X射线光电子能谱仪;NICOLET 6700 FT-IR傅里叶变换红外-拉曼光谱仪;X′Pert PRO型衍射仪。
主要试剂:Na3AsO4·7H2O、KMnO4、FeCl2均为分析纯,HNO3为优级纯,实验用水为超纯水。
1.2MBFMA的制备
桑树杆去皮用破碎机破碎,过20目筛后烘干备用。取10 g备用的桑树杆放入500 mL的烧杯中,加入100 mL浓度为20~50 g·L-1的高锰酸钾溶液,机械搅拌10 min,用玻璃表面皿盖住,浸渍12~48 h后过滤;过滤后的滤渣重新放入500 mL烧杯中,在快速搅拌下加入10~40 g·L-1的氯化亚铁溶液100 mL,机械搅拌10 min,浸渍12~48 h后过滤;过滤后的滤渣重新放入500 mL烧杯中,再加入质量分数为7%的氢氧化钠溶液50 mL,充分搅拌均匀,浸渍6 h后过滤,再用超纯水充分洗涤;将得到的滤渣放在磁盘中,在60~70℃下干燥12 h,得到干燥的MBFMA;将干燥的混合物放入坩埚中,在400~550℃下煅烧1~4 h,用研钵研磨,过100目筛,得到MBFMA。按5因素4水平正交实验设计,即L16(45)设计制备实验,正交实验因素水平如表1。
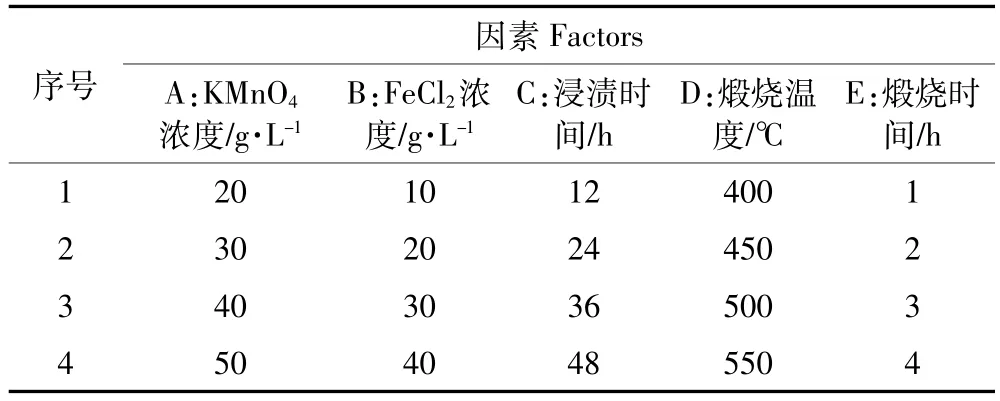
表1 正交实验因素水平Table 1 Levels of factors in orthogonal experiment
1.3对吸附As(Ⅴ)前后的MBFMA的表征
表征所用设备及其分析测试参数如下:
XRD:X′Pert3Powder型多功能X-射线衍射仪,Cu靶Kα辐射,特征X射线波长λ=1.54056Å,扫描速度0.6565°·s-1,扫描范围10~90。
电镜扫描:S-4800场发射扫描电子显微镜,加速电压为5.0kV。
XPS分析:ESCALAB250Xi X射线光电子能谱仪,单色化X射线枪工作直径500 μm,通能100 eV,步长1eV,采用能量校正方式。
FT-IR分析:NICOLET6700FT-IR傅里叶变换红外-拉曼光谱仪,样品与KBr粉末按照1:80的比例充分混合均匀,压片后测试,测试波长范围为4000~400cm-1,分辨率为0.1 cm-1,信噪比45000:1。
1.4吸附试验
称取一定量的MBFMA放于100 mL的塑料离心管中,加入50 mL一定浓度的含As(Ⅴ)溶液于塑料离心管中,用1 mol·L-1的NaOH或HCl溶液调节溶液的pH到设定值,在恒温水浴振荡器上以200 r·min-1转数振荡到设定的吸附时间,取出后置于台式离心机中以4000r·min-1离心5min,然后用0.45μm的滤膜过滤,用原子荧光法测定滤液中剩余As(Ⅴ)的浓度。
2 结果与分析
直观分析。
2.1正交试验结果
制备正交实验结果如表2、直观分析如表3所示。以砷的吸附量和MBFMA的得率为考核指标进行

表2 正交实验结果Table 2 Results of orthogonal experiment
由表3直观分析的极差结果可知:五个因素对砷吸附值影响的主次关系是D>A>C>E>B,最佳条件是A3B4C2D1E3;对复合吸附剂得率影响的主次关系是A>E>D>C>B,最佳条件是A4B2C1D1E2。两个指标最优条件的最大差异是因素B,结合所得数据知道因素B对砷吸附值的影响比较大,同时考虑本研究的目的是制备一种对As(Ⅴ)吸附量大的吸附剂,所以选择制备MBFMA的最优条件是A3B4C2D1E3,即:KMnO4浓度为40 g·L-1、FeCl2浓度为40 g·L-1、浸渍时间为24 h,煅烧温度为400℃,煅烧时间为3 h。最佳条件下制备出来的样品将其用于吸附As(Ⅴ)的性能研究。
2.2MBFMA表征结果
2.2.1红外光谱分析
MBFMA红外光谱分析结果如图1所示。主要特征吸收峰出现在3330、1580、1380、835、559 cm-1波数位置,于1380 cm-1波数处出现的吸收峰是由酚羟基的O-H的面内变形振动所致,于1580 cm-1波数处出现的吸收峰是由羧基、羟基和内酯基的C-O和C=C的伸缩振动形成的,而3330 cm-1处吸附峰是由其表面的C-H键的伸缩振动。
2.2.2X射线衍射分析
MBFMA的X射线衍射分析结果如图2所示。MBFMA没有明显的晶体结构,说明MBFMA是无定形的。利用x′pert Highscore软件对各个峰值进行分析,通过与标准图谱(PDF卡片号为01-089-2807)进行比较,在MBFMA中铁、锰、氧的摩尔比接近(为1:5:8),混合物中铁锰氧化物的分子式可表达为Mn0.43Fe2.57O4。

表3 正交试验结果直观分析Table 3 Result analysis of orthogonal experiment
2.3pH值的影响
MBFMA质量0.1 g,As(Ⅴ)初始浓度为1 mg·L-1和2 mg·L-1,溶液体积50 mL,溶液pH分别为2、3、4、5、6、7、8、9、10和11,实验温度为25℃。在此条件下进行了pH影响实验,结果见图3。
由图3可知,当pH为2~7时,pH对As(Ⅴ)吸附量的影响比较小,当pH大于7时,吸附量随着pH的增加而减小。这是因为吸附量的大小主要与溶液中砷酸根的存在形态有关。当pH在0~2范围时,以H3AsO4存在[19];当pH在3~6范围时,以H2AsO-4存在[20];当pH在7~11范围时,以HAsO2-4存在[21];当pH在12~14范围时,以AsO3-4存在[22]。经测定,MBFMA零点电位pHPZC=3.81。当被吸附溶液的pH在2~3.81范围内,溶液pH<pHPZC,吸附剂表面带正电荷,溶液中的As(Ⅴ)主要以H2AsO-4形态存在,吸附剂与吸附质处于异电吸引状态,有利于吸附;当被吸附溶液的pH在3.81~7.0范围内,溶液pH>pHPZC,复合吸附剂表面带负电荷,As(Ⅴ)主要以H2AsO-4存在,但由于H2AsO-4带的电荷量较HAsO2-4电荷量少,在pH2~7时,pH对As(Ⅴ)吸附量的影响比较小,而当pH大于7后,吸附量下降很快。这与文献[23]、[24]报道的结果相一致。
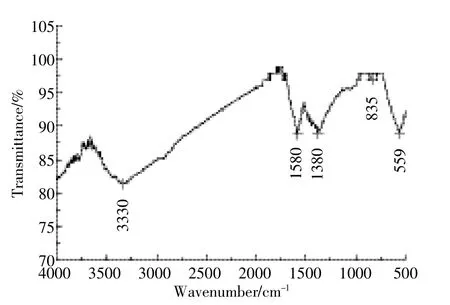
图1 复合吸附剂FTIR图谱Figure 1 FTIR spectra of MBFMA
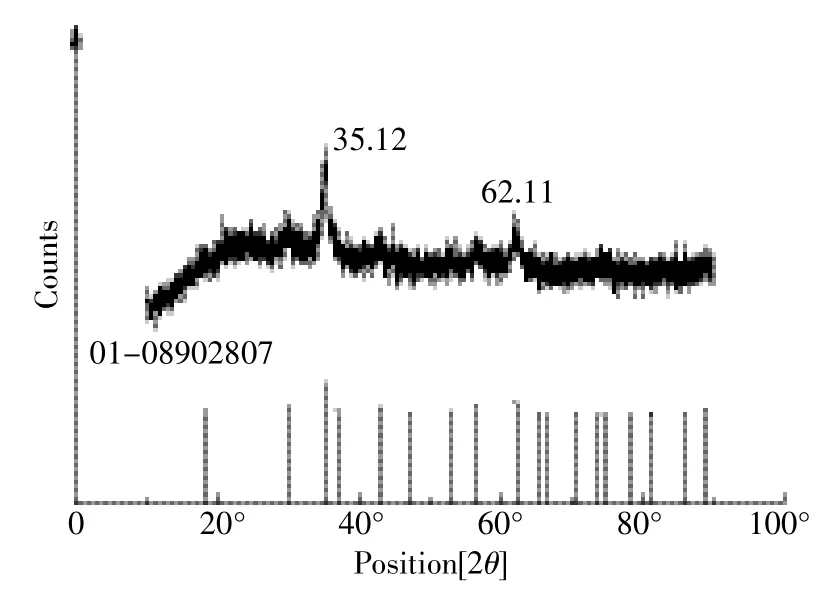
图2 复合吸附剂XRD图Figure 2 X-ray diffraction spectra of MBFMA
2.4吸附时间的影响
MBFMA质量0.1 g,初始As(Ⅴ)浓度为2 mg·L-1和10mg·L-1,溶液体积50mL,溶液pH=5,温度为25℃,取样时间分别为0.25、0.5、0.75、1、2、3、4、5、6、8、10、12、15、18、21、24、27、30、36、48 h。在此条件下进行了吸附时间的影响实验,实验结果见图4。MBFMA对As(Ⅴ)的吸附随着吸附时间的增加而逐渐增大。当As(Ⅴ)初始浓度为2 mg·L-1时,吸附量随时间的变化不明显。这是因为初始浓度较低,而在复合吸附剂上面的吸附行为较快,很快就达到了平衡。当初始As(Ⅴ)的浓度增加为10 mg·L-1时,可以看出,吸附开始的5 h内,As(Ⅴ)的去除较快,随着时间的增加,吸附速率逐渐减慢,最后趋于稳定,吸附在24 h左右达到平衡。
2.5吸附等温线
实验温度为25、35、45℃,初始As(Ⅴ)浓度分别在0.5、1、2、3、4、5、6、8、10、12、14、16、20 mg·L-1,MBFMA质量为0.1 g。对比试验加入0.1 g桑树杆生物炭,实验温度25℃。在此条件下进行吸附等温线实验。
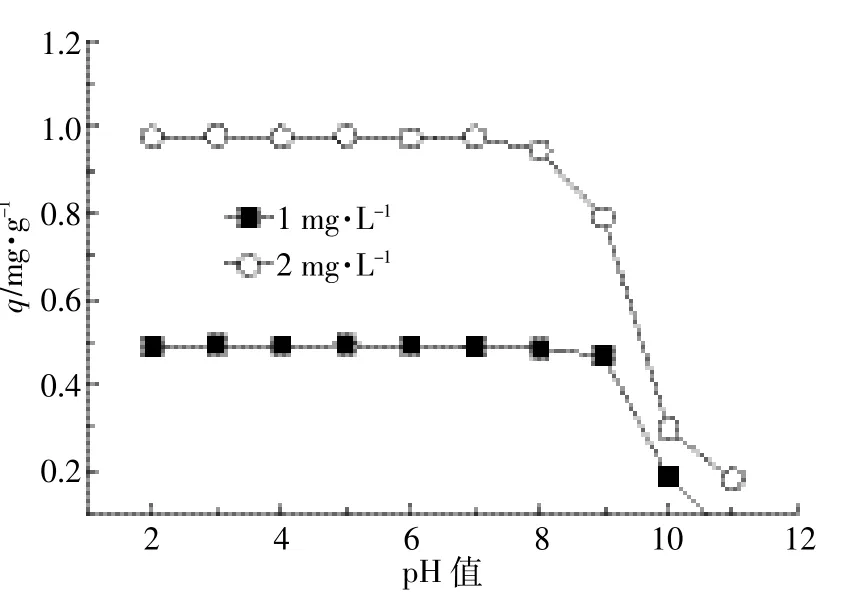
图3 pH对As(V)吸附的影响Figure 3 Effect of pH on As(V)adsorption by MBFMA

图4 吸附时间对As(V)吸附的影响Figure 4 Effect of contact time on As(V)adsorption by MBFMA
采用Langmuir模型和Freundlich模型对MBFMA吸附As(Ⅴ)的等温线实验数据拟合,拟合结果如图5和图6,拟合模型参数列于表4。从表4可知,25、35℃和45℃下,Langmuir吸附等温方程拟合的决定系数R2分别为0.954、0.958、0.953。根据Langmuir模型成立的假设条件可知,MBFMA对As(Ⅴ)的吸附更倾向于单分子层[25]的吸附,形成单层覆盖,当吸附达到平衡后在吸附剂的表面没有吸附质的转移。25℃、35℃和45℃下的最大吸附量分别为4.87、5.30、5.62 mg·g-1。25℃下,纯桑树杆生物炭最大吸附量是4.26 mg·g-1,MBFMA相对纯桑树杆生物炭对砷吸附量提高了14.3%。25、35℃和45℃下,Freundlich吸附等温方程拟合的决定系数R2分别为0.945、0.953、0.960,相对于Freundlich吸附等温方程,MBFMA对As(Ⅴ)的吸附更符合Langmuir吸附等温方程。
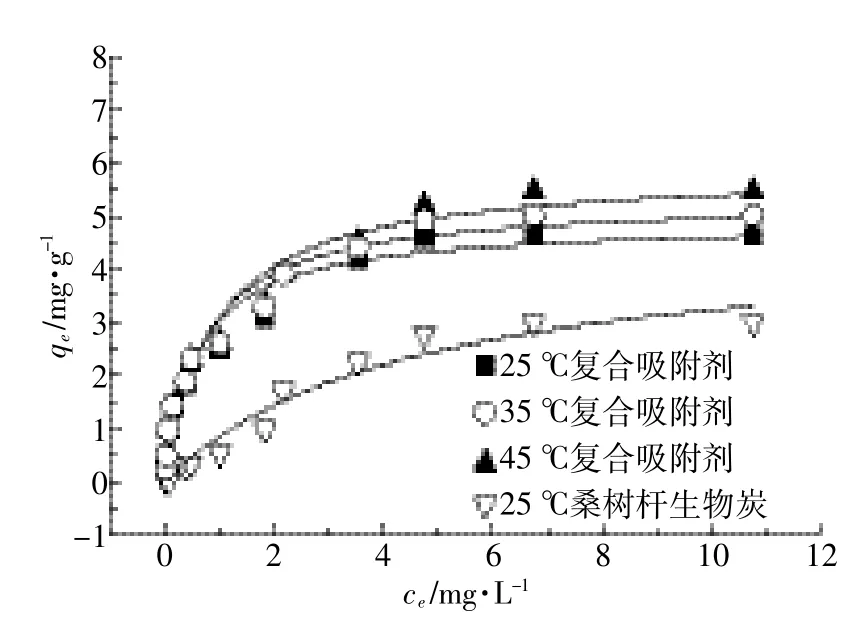
图5 Langmuir等温模型拟合曲线Figure 5 Langmuir isotherms for As(V)adsorption on MBFMA and mulberry stem biochar
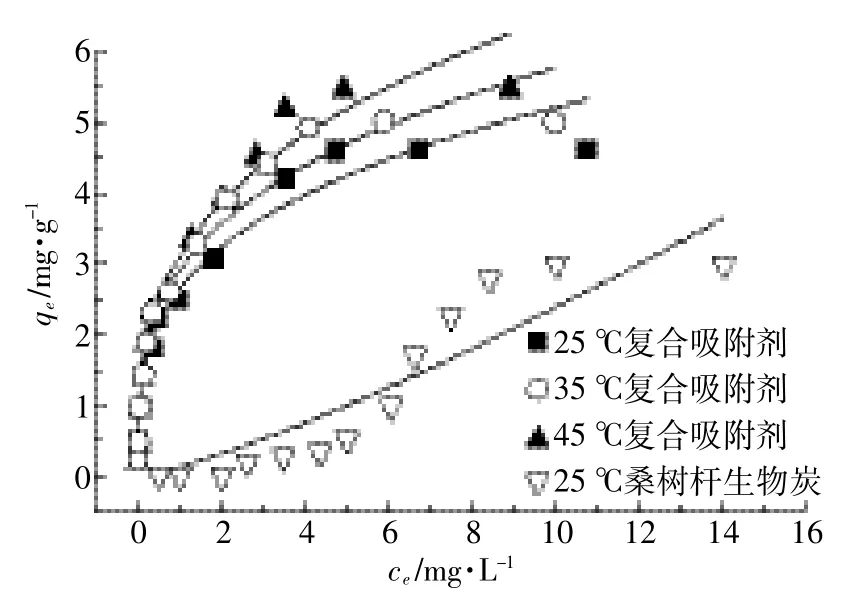
图6 Freundlich等温模型拟合曲线Figure 6 Freundlich isotherms for As(V)adsorption on MBFMA and mulberry stem biochar
由表4可见,随着吸附温度的升高,As(Ⅴ)的饱和吸附量也随之增加,说明温度的升高对As(Ⅴ)的吸附是有利的。Ruijiang Liu等[26]的研究也得到了同样的结论,他们发现当水溶液的温度由40℃升高到90℃,As(Ⅴ)的吸附量增大了60%以上。孙丽凤[27]利用活性氧化铝吸附As(Ⅴ)的研究表明,当As(Ⅴ)溶液的初始浓度为1.8 mg·L-1时,As(Ⅴ)的吸附量在0.4 mg·g-1左右;娄淑芳等[28]利用稻秆来吸附饮用水中的As(Ⅴ),当As(Ⅴ)初始浓度为300 μg·L-1时,As(Ⅴ)的吸附量是0.003 mg·g-1。龙小燕[29]利用Fe/Ti改性活性炭吸附砷,其对As(Ⅴ)的吸附量为2.541 9 mg·g-1。Ayoob S等[30]利用钙化矾土吸附水溶液中的砷,当砷的初始浓度为2 mg·L-1时,砷的吸附量为0.61 mg·g-1。由此可见,利用铁锰氧化物来改性桑树杆,可以在很大程度上提高生物质对As(Ⅴ)的吸附能力。
2.6共存离子的影响
水溶液中除了含有砷污染物外,还含有一定量的共存电解质,从而影响溶液的离子强度[28],这些电解质可以与被吸附的物质争夺吸附剂上面的可吸附位点[16],影响吸附剂的吸附效果。选取NaNO3作为电解质的代表,来验证离子强度对吸附效果的影响,共存离子影响实验条件:MBFMA 0.1 g,初始As(Ⅴ)浓度为2 mg·L-1,溶液体积50 mL,pH=5,实验温度为25℃,考察2种不同浓度(1 mg·L-1、10 mg·L-1)的硝酸根、硫酸根、碳酸根和磷酸根溶液对As(Ⅴ)吸附效果的影响。
四种不同浓度的共存离子对As(Ⅴ)吸附效果的影响如图7所示。硝酸根、硫酸根和碳酸根对MBFMA吸附As(Ⅴ)几乎没有影响,1 mg·L-1的磷酸根离子的存在对As(Ⅴ)吸附的影响很小,而当磷酸根离子浓度为10 mg·L-1时,其对As(Ⅴ)吸附的影响比较大,As(Ⅴ)的吸附量由0.93 mg·g-1降低到0.85 mg·g-1,降低了12.4%。其可能的原因是P和As同位于元素周期表中第V族元素,两者的化学性质比较相似,表面化合物具有相似的类型,荷电能力相差不大,空间结构也相似,在水溶液中具有相似的化学行为,因而磷酸根与As(Ⅴ)竞争吸附复合吸附剂的吸附位点,减小了As(Ⅴ)的吸附量。其次,磷酸根可以与复合吸附剂中铁的氧化物之间发生化学反应,生成内球配合物[31],进一步抑制对As(Ⅴ)的吸附。Gong等[32]也探讨了共存阴离子对As(Ⅴ)吸附影响,得出了相似的结论,影响主次顺序为PO3-4>SiO2-3>CO2-3>SO2-4,其中由于磷酸盐的加入,As(Ⅴ)的去除率降低了35.92%。
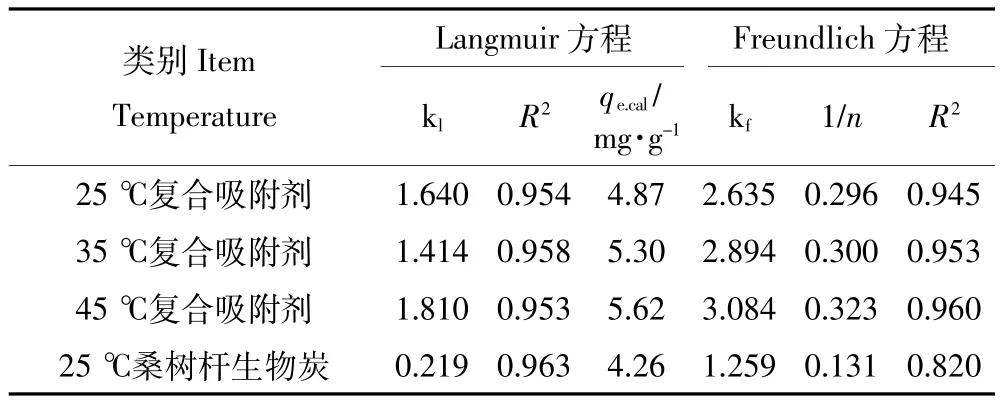
表4 不同温度下等温方程拟合参数Table 4 Parameters of Langmuir and Freundlich models at different temperatures
2.7离子强度的影响
实验条件:MBFMA 0.1 g,初始As(Ⅴ)浓度为2 mg·L-1,溶液体积50 mL,其中NaNO3的浓度分别为0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45、0.5 mol·L-1,pH=5,实验温度为25℃,离子强度对As(Ⅴ)吸附效果的影响如图8所示。
从图8可以看出,离子强度对As(Ⅴ)吸附量的影响不大,吸附量下降趋势不明显,吸附量最大减小了3.1%。此实验条件下的离子强度对As(Ⅴ)吸附的影响不敏感,As(Ⅴ)与MBFMA之间形成了内层表面络合物[33],属于内球络合吸附[34],复合吸附剂对As(Ⅴ)的吸附属于专性吸附[35]。
2.8吸附机理分析
2.8.1能谱分析
MBFMA吸附As(Ⅴ)前后的能谱分析如图9所示。从图9(a)、图9(b)可以看出,由于测定时选取点的不同以及各个元素分布的不均匀,元素的含量存在一定的差异,C、O、Mn和Fe吸附前后的质量百分比(%)分别为37.67、30.08、23.37、2.27和25.06、29.26、11.77、33.32。吸附As(Ⅴ)之后的MBFMA的能谱中含有元素As,其质量百分比(%)为0.34。
2.8.2X射线光电子能谱分析
MBFMA吸附As(Ⅴ)前后XPS分析如图10所示。吸附As(Ⅴ)之前的MBFMA XPS谱图上在结合能为44.16 eV处没有As3d轨道特征峰,而在吸附As(Ⅴ)之后的MBFMA XPS谱图上在结合能为44.16 eV处有As3d轨道特征峰,表明吸附剂表面有一定量的As元素存在。
图11是吸附前后吸附剂表面Fe2p轨道和Mn2p轨道的XPS扫描图。Fe2p轨道的结合能由吸附前的709.77 eV变为吸附后709.96 eV,Mn2p轨道的结合能由640.49 eV变为640.58 eV,说明在吸附过程中铁和锰参与了吸附反应,其吸附过程属于化学吸附。
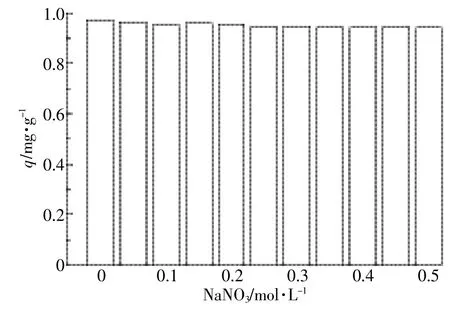
图8 离子强度对As(Ⅴ)吸附的影响Figure 8 Effect of ionic strength on As(Ⅴ)adsorption on MBFMA

图9 MBFMA吸附As(Ⅴ)前后的能谱分析图(a:吸附前;b:吸附后)Figure 9 EDAX spectrum of MBFMA before and after As(Ⅴ)adsorption(a:before adsorption;b:after adsorption)
MBFMA表面C(283.88 eV)元素的含量比较多,C1s的半峰宽为1.48 eV,吸附后的半峰宽为1.46 eV,利用XPS PEAK软件对吸附前后的C1s进行分峰拟合,拟合结果如图12所示。可以看出C1s的能谱由两个不同的峰组成,它们分别代表C-C和C-O含碳官能团,吸附前后C在C-C键和C-O键的能值都发生了改变,表明含碳官能团参与了吸附反应。
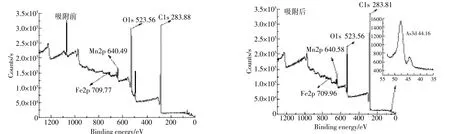
图10 MBFMA吸附As(Ⅴ)前后的XPS全谱图Figure 10 XPS of MBFMA before and after As(Ⅴ)adsorption
3 结论
(1)MBFMA的制备条件为:KMnO4浓度40 g·L-1、FeCl2浓度40 g·L-1、浸渍时间24 h,煅烧温度400℃,煅烧时间3 h。
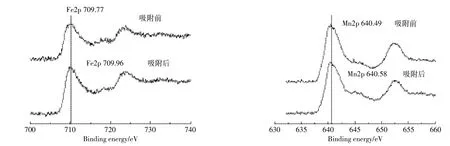
图11 吸附As(Ⅴ)前后Fe和Mn的XPS能谱Figure 11 XPS spectra of Fe and Mn before and after adsorption of As(Ⅴ)

图12 吸附As(Ⅴ)前后C1s分峰拟合图Figure 12 Sub-peak fitting spectra of C1s of before and after As(Ⅴ)adsorption
(2)由FTIR分析可知MBFMA中羟基、羧基和内酯基的存在;XRD分析表明铁和锰分别以Fe2O3和MnO2形式存在于MBFMA上;能谱分析说明吸附之后MBFMA上含有0.34%的As元素;XPS分析表明,铁、锰、C-C和C-O含碳官能团均参与了吸附反应,其对As(Ⅴ)的吸附过程属于化学专性吸附过程。
(3)MBFMA吸附As(Ⅴ)的最佳pH值范围为2~7;当磷酸盐中磷的浓度为10 mg·L-1时,As(Ⅴ)的吸附量减少了12.4%;当以NaNO3作为离子强度实验时,离子强度对As(Ⅴ)的吸附影响不大。
(4)25℃、35℃和45℃下,Langmuir吸附模型的决定系数R2分别为0.954、0.958、0.953,饱和吸附量分别为4.87、5.30、5.62 mg·g-1。
[1]王萍,王世亮,刘少卿,等.砷的发生、形态、污染源及地球化学循环[J].环境科学与技术,2010,33(7):90-97. WANG Ping,WANG Shi-liang,LIU Shao-qing,et al.Occurrence,speciation,source and geochemical cycle of arsenic[J].Environmental Science&Technology,2010,33(7):90-97.
[2]Watanabe J,Tani Y,Chang J,et al.As(Ⅲ)oxidation kinetics of biogenic manganese oxides formed by Acremonium strictum strain KR21-2[J].Chemical Geology,2013,347(6):227-232.
[3]Chang Y Y,Lee S M,Yang J K.Removal of As(Ⅲ)and As(Ⅴ)by natural and synthetic metal oxides[J].Colloids and Surfaces A:Physicochemical and EngineeringAspects,2009,346(1-3):202-207.
[4]Ren H T,Jia S Y,Wu S H,et al.Abiotic oxidation of Mn(Ⅱ)induced oxidation and mobilization of As(Ⅲ)in the presence of magnetite and hematite[J].Journal of Hazardous Materials,2013,254(6):89-97.
[5]Abtahi M,Mesdaghinia A,Saeedi R,et al.iosorption of As(Ⅲ)and As(Ⅴ)from aqueous solutions by brown macroalga Colpomeniasinuosa biomass:Kinetic and equilibrium studies[J].Desalination and Water Treatment,2013,51(16-18):3224-3232.
[6]Kanematsu M,Young T M,Fukushi K,et al.Arsenic(Ⅲ,Ⅴ)adsorption on a goethite-based adsorbent in the presence of major co-existing ions:Modeling competitive adsorption consistent with spectroscopic and molecular evidence[J].Geochimica Et Cosmochimica Acta,2013,106(4):404-428.
[7]Seidel A,Waypa J J,Elimelech M.Role of charge(Donnan)exclusion in removal of arsenic from water by a negatively charged porous nanofiltration membrane[J].Environmental Engineering Science,2001,18(2):105-113.
[8]黄自力,刘缘缘,陶青英,等.石灰沉淀法除砷的影响因素[J].环境工程学报,2012,6(3):734-738. HUANG Zi-li,LIU Yuan-yuan,TAO Qing-ying,et al.Influencing factors of arsenic removal by lime precipitation[J].Chinese Journal of Environmental Engineering,2012,6(3):734-738.
[9]刘辉利,梁美娜,朱义年,等.氢氧化铁对砷的吸附与沉淀机理[J].环境科学学报,2009,29(5):1011-1020. LIU Hui-li,LIANG Mei-na,ZHU Yi-nian,et al.The adsorption of arsenic by ferric hydroxide and its precipitation mechanism[J].Acta Scientiae Circumstantiae,2009,29(5):1011-1020.
[10]Awual M R,Hossain M A,Shenashen M A,et al.Evaluating of arsenic(Ⅴ)removal from water by weak-base anion exchange adsorbents[J]. Environmental Science and Pollution Research,2013,20(1):421-430.
[11]Wu K,Liu T,Xue W,et al.Arsenic(Ⅲ)oxidation/adsorption behaviors on a new bimetal adsorbent of Mn-oxide-doped Al oxide[J]. Chemical EngineeringJournal,2012,192:343-349.
[12]Yao S,Liu Z,Shi Z.Arsenic removal from aqueous solutions by adsorption onto iron oxide/activated carbon magnetic composite[J].Journal of Environmental Health Science and Engineering,2014,12:1-8.
[13]Lenoble V,Bouras O,Deluchat V,et al.Arsenic adsorption onto pillared clays and iron oxides[J].Journal of Colloid and Interface Science,2002,255(1):52-58.
[14]Deliyanni E,Bandosz T J.Importance of carbon surface chemistry in developmentofironcarboncompositeadsorbentsforarsenateremoval[J]. Journal of Hazardous Materials,2011,186(1):667-674.
[15]Wantala K,Khongkasem E,Khlongkarnpanich N,et al.Optimization of As(Ⅴ)adsorption on Fe-RH-MCM-41-immobilized GAC using Box Behnken design:Effects of pH,loadings,and initial concentrations[J].Applied Geochemistry,2012,27(5):1027-1034.
[16]常方方,曲久辉,刘锐平,等.铁锰复合氧化物的制备及其吸附除砷性能[J].环境科学学报,2006,26(11):1769-1774. CHANG Fang-fang,QU Jiu-hui,LIU Rui-ping,et al.Preparation of Fe-Mn bimetal oxide adsorbent and its adsorption characteristics of arsenic[J].ActaScientiae Circumstantiae,2006,26(11):1769-1774.
[17]Lǚ J,Liu H,Liu R,et al.Adsorptive removal of phosphate by a nanostructured Fe Al Mn trimetal oxide adsorbent[J].Powder Technology,2013,233:146-154.
[18]朱瑾,楼子墨,王卓行,等.铁锰氧化物/碳基复合材料的制备及其对水中砷的去除[J].化学进展,2014,26(9):1551-1561. ZHU Jin,LOU Zi-mo,WANG Zhuo-xing,et al.Preparation of iron and manganese oxides/carbon composite materials for arsenic removal from aqueous solution[J].Progress in Chemistry,2014,26(9):1551-1561.
[19]Xu Y H,Nakajima T,Ohki A.Adsorption and removal of arsenic(Ⅴ)from drinking water by aluminum-loaded Shirasu-zeolite[J].Journal of Hazardous Materials,2002,92(3):275-287.
[20]Kundu S,Gupta A K.Investigations on the adsorption efficiency of iron oxide coated cement(IOCC)towards As(Ⅴ):Kinetics,equilibrium and thermodynamic studies[J].Colloids and Surfaces A:Physicochemical and EngineeringAspects,2006,273(1-3):121-128.
[21]Pan Y F,Chiou C T,Lin T F.Adsorption of arsenic(Ⅴ)by ironoxide-coated diatomite(IOCD)[J].Environmental Science and Pollution Research,2010,17(8):1401-1410.
[22]Babaeivelni K,Khodadoust A P,Bogdan D.Adsorption and removal of arsenic(Ⅴ)using crystalline manganese(Ⅱ,Ⅲ)oxide:Kinetics,equilibrium,effect of pH and ionic strength[J].Journal of Environmental Science and Health Part A:Toxic/Hazardous Substances&Environmental Engineering,2014,49(13):1462-1473.
[23]闵伶俐,郑煜铭,钟鹭斌,等.铁氧化物/壳聚糖复合纳米纤维的制备及吸附五价砷研究[J].环境科学学报,2014,34(12):2979-2984. MIN Ling-li,ZHENG Yu-ming,ZHONG Lu-bin,et al.Preparation of a novel iron oxide/chitosan composite nanofiber and its adsorption ofarsenate from water[J].Acta Scientiae Circumstantiae,2014,34(12):2979-2984.
[24]李鸿颍,普红平,韩彩芸,等.介孔氧化铝的合成及其对As(V)的吸附特性研究[J].昆明理工大学学报(自然科学版),2013,38(4):13-16. LI Hong-ying,PU Hong-ping,HAN Cai-yun,et al.Synthesis of mesoporous alumina and Its performance of arsenic(Ⅴ)adsorption[J].Journal of Kunming University of Science and Technology(Natural Science Edition),2013,38(4):13-16.
[25]Pehlivan E,Tran T H,Ouedraogo W K I,et al.Removal of As(Ⅴ)from aqueous solutions by iron coated rice husk[J].Fuel Processing Technology,2013,106:511-517.
[26]Liu R,Lu Y,Shen X,et al.Arsenic(Ⅴ)adsorption from aqueous solution on magnetic Fe-0.2(Co20Ni80)(0.8)alloy porous microfibers[J]. Water Air and Soil Pollution,2012,223(8):5365-5373.
[27]孙丽凤.活性氧化铝对As(Ⅲ)和As(Ⅴ)的吸附性能研究[J].土木建筑与环境工程,2014,36(4):121-126. SUN Li-feng.A dsorption behavioi of As(Ⅲ)and As(Ⅴ)by activated aluminum[J].Journal of Civil,Architectural&Environmental Engineering,2014,36(4):121-126.
[28]娄淑芳,毛峰,李红玲,等.利用稻秆去除饮用水中五价砷的研究[J].安徽农业科学,2008,36(20):8801-8802,8866. LOU Shu-fang,MAO Feng,LI Hong-ling,et al.Removal of pentavalent arsenic in drinking water by rice straw adsorbent[J].Journal of Anhui Agri Sci,2008,36(20):8801-8802,8866.
[29]龙小燕.活性炭负载Fe/Ti改性及去除水体砷的效果和机理研究[D].武汉:华中农业大学,2012:44-45. LONG Xiao-yan.Effects and mechanisms for Fe/Ti modification of activated carbon and arsenic removal from water[D].Wuhan:Huazhong Agricultural University,2012:44-45.
[30]Ayoob S,Gupta A K,Bhakat P B.Analysis of breakthrough developments and modeling of fixed bed adsorption system for As(Ⅴ)removal from water by modified calcined bauxite(MCB)[J].Separation and Purification Technology,2007,52(3):430-438.
[31]廉佩佩.Fe3O4-MnO2磁性纳米盘吸附剂的制备及除砷(Ⅲ)效能研究[D].哈尔滨:哈尔滨工业大学,2013:41-42. LIAN Pei-pei.Preparation of Fe3O4-MnO2manoplates and research on its adsorption capacity for arsenite removal[D].Harbin:Harbin Institute of Technology,2013:41-42.
[32]Gong X J,Li W G,Zhang D Y,et al.Adsorption of arsenic from micropolluted water by an innovative coal-based mesoporous activated carbon in the presence of co-existing ions[J].International Biodeterioration&Biodegradation,2015,102:256-264.
[33]吴志坚,刘海宁,张慧芳.离子强度对吸附影响机理的研究进展[J].环境化学,2010,29(6):997-1003. WU Zhi-jian,LIU Hai-ning,ZHANG Hui-fang.Research progress on mechanisms about the effect of ionic strength on adsorption[J].Environmental Chemistry,2010,29(6):997-1003.
[34]Su J,Huang H G,Jin X Y,et al.Synthesis,characterization and kinetic of a surfactant-modified bentonite used to remove As(Ⅲ)and As(Ⅴ)from aqueous solution[J].Journal of Hazardous Materials,2011,185(1):63-70.
[35]吴萍萍,曾希柏,李莲芳,等.离子强度和磷酸盐对铁铝矿物及土壤吸附As(Ⅴ)的影响[J].农业环境科学学报,2012,31(3):498-503. WU Ping-ping,ZENG Xi-bai,LI Lian-fang,et al.The effect of ionic strength and phosphate on As(Ⅴ)adsorption on different iron/aluminum mineralsandsoils[J].JournalofAgro-EnvironmentScience,2012,31(3):498-503.
Preparation and arsenic adsorption and its mechanisms by mulberry stem biochar/Fe-Mn oxides composite adsorbent
QIN Yan-min1,2,LIANG Mei-na1,2*,WANG Dun-qiu1,2,ZHU Yi-nian1,2,TANG Shen1,2,LI Huan-huan1,2,ZHANG Tao1,2
(1.College of Environmental Science and Engineering,Guilin University of Technology,Guilin 541006,China;2.Guangxi Collaborative Innovation Center for Water Pollution Control and Water Safety in Karst Area,Guilin University of Technology,Guilin 541004,China)
A mulberry stem biochar/Fe-Mn oxides composite adsorbent(MBFMA)was prepared from mulberry stems by oxidation and coprecipitation methods through the orthogonal experiment.Effects of pH,ionic strength,and co-existing anions on As(Ⅴ)adsorption by MBFMA were investigated.Results show that the optimal preparation conditions were as follows:the concentrations of potassium permanganate and ferrous chloride were both 40 g·L-1,impregnation time of 24 h,calcination temperature of 400℃,and calcination time of 3 h.The range of the optimal pH values was from 2.0 to 7.0.The ions present in the natural environment,such as nitrate,sulfate,carbonate and phosphoric,had different degrees of effects on arsenic adsorption,with phosphoric having the biggest impact.The ionic strength had no obvious side effects on arsenic adsorption.The adsorption behavior of As(Ⅴ)on MBFMA was fit better with Langmuir equation than Freundlich equation. Adsorptioncapacityis4.87mg·g-1under25℃.SpectrumanalysisshowedthatMBFMAhad0.34%ofarsenicafteradsorbingAs(Ⅴ).FTIR spectra indicated that MBFMA contained hydroxy,carboxyl,and lactone functional groups.X-ray photoelectron spectroscopy analysis indicated that iron,manganese,and carbon surface functional groups involved in the adsorption reaction,and adsorption of As(Ⅴ)by MBFMA was specific process.
mulberry stem;Fe-Mn oxides;preparation;adsorption;arsenic
X171.5
A
1672-2043(2016)07-1398-09
10.11654/jaes.2016.07.024
2015-12-23
国家自然科学基金项目(21367010);“八桂学者”建设工程专项经费资助
秦艳敏(1988—),女,河南新乡人,硕士研究生,主要从事水污染控制研究。E-mail:ymqin1115@163.com
梁美娜E-mail:liangmeinaa@163.com
