不同来源葡萄糖氧化酶的分离纯化及其生物催化特性
2016-09-18王文婷章魁普郭美锦
王文婷, 赵 伟, 章魁普, 黎 亮, 郭美锦
(1.华东理工大学生物反应器工程国家重点实验室,上海 200237;2.山东福洋生物科技有限公司,山东 德州 253100)
不同来源葡萄糖氧化酶的分离纯化及其生物催化特性
王文婷1,赵伟2,章魁普1,黎亮1,郭美锦1
(1.华东理工大学生物反应器工程国家重点实验室,上海 200237;2.山东福洋生物科技有限公司,山东 德州 253100)
采用离子交换层析法对4种不同来源的葡萄糖氧化酶(Glucose oxidase,GOD,EC 1.1.3.4)进行分离纯化,纯化后酶的相对分子质量约为130 kDu,为双亚基酶。纯化后的4种酶的酶学性质相对稳定,对pH有较宽的响应范围。温度为20~50 ℃时,随着温度的升高酶活降低且稳定性较好;温度为55 ℃时稳定性较差;而在60 ℃时则失活。金属离子如Fe2+、Co2+、Mg2+和Cu2+对4种酶都有较强的抑制作用,Fe2+的抑制尤其明显,而螯合剂EDTA可以激活酶的活性。在30 ℃、pH为7.0的条件下,以不同浓度(20~100 mmol/L)的葡萄糖为底物分别测定4种酶的米氏常数(Km)和催化常数(Kcat)。通过光谱和色谱对4种葡萄糖氧化酶进行检测,虽然氨基酸组成有明显不同,但二维结构基本一致,而GOD前体goxC和修饰蛋白如过氧化氢酶、过氧化氢酶前体和Pc16g04630等可能是提高GOD催化效率和工业应用的分子基础。
葡萄糖氧化酶; 纯化; 生物催化特性; 氨基酸序列分析
葡萄糖氧化酶(glucose oxidase,GOD,EC 1.1.3.4)是一种需氧脱氢酶,能够在有氧条件下高度专一性地将β-D-葡萄糖氧化成δ-D-葡萄糖酸内酯和过氧化氢,然后δ-D-葡萄糖酸内酯以一种非酶促反应自发水解成β-D-葡萄糖酸,而过氧化氢酶将过氧化氢分解生产水和氧[1]。GOD广泛分布于动物、植物和微生物体内。目前应用于工业生产中的主要是青霉素和黑曲霉两种[2-3],其中黑曲霉的应用更为广泛。由于GOD天然无毒、无副作用,因而在食品工业、医疗诊断、生物传感器方面有着广泛的应用[4-6]。
葡萄糖酸的生产可以追溯到1870年Hlasiwetz和Habermann发现了葡萄糖酸[7]。葡萄糖酸是由葡萄糖通过一个简单的葡萄糖氧化酶催化脱氢反应产生。生产葡萄糖酸的方法有许多种,如化学、电化学、生物化学和生物电化学[8-9]。目前,发酵是一个高效且广泛使用的生产葡萄糖酸的技术,用酶法生产葡萄糖酸已经成为一种趋势。葡萄糖酸钠的工业生产多采用发酵法。将黑曲霉作为出发菌株,通过逐步扩大培养,用发酵代谢的葡萄糖氧化酶催化葡萄糖生成葡萄糖酸。然而发酵过程易受细菌、工艺变化等因素的影响。而酶法生产可直接利用GOD催化葡萄糖生成葡萄糖酸钠。但是葡萄糖氧化酶在pH 4~6以及40 ℃的条件下仅可以稳定2 h。这使得酶法生产葡萄糖酸工业化变得十分困难。本文对4种不同来源的葡萄糖氧化酶进行分离纯化并在纯化后比较其酶学性质,为其工业化应用提供指导。
1 材料与方法
1.1材料
1.1.1葡萄糖氧化酶葡萄糖氧化酶NV1和高温葡萄糖氧化酶NV2均购自诺维信公司; 葡萄糖氧化酶sGOD购自山东隆大生物技术公司,该酶为用DNA shuffling分子进化法改造而来;液体发酵葡萄糖氧化酶rGOD系自行设计合成。4种葡萄糖氧化酶均来自黑曲霉(Aspergillusniger)。
1.1.2试剂DEAE-FF填料、BCA试剂盒、三羟甲基氨基甲烷(Tris)、SDS、EDTA均为生工生物工程有限公司产品; 邻联茴香胺、辣根过氧化物酶均为上海源聚生物科技有限公司产品; 葡萄糖酸钠为梯希爱(上海)化成工业发展有限公司产品; 其余试剂均为国产分析纯。
1.1.3仪器Mini-PROTEIN垂直电泳槽(Bio-Rad科技有限公司);生物电泳图像分析系统(上海复日科技有限公司);紫外可见分光光度计(上海舜宇恒平科学仪器有限公司);电热恒温水槽(上海精宏实验设备有限公司);J-810圆二色谱仪(日本分光(JASCO)公司);ZHWY-3212回旋振荡摇瓶机(上海智诚分析仪器制造有限公司)。
1.2方法
1.2.1酶分离纯化方法将离子交换剂DEAE Sepharose FF的上清液倒去,与缓冲液按体积比为3∶1混匀后装柱,在装柱的过程中应避免产生气泡。用10个柱体积的0.05 mol/L pH 7.1的Tris-HCl缓冲溶液平衡离子交换层析柱,流速为1 mL/min。将过滤后的粗酶液以0.2 mL/min的速度泵入柱子中。用0~0.3 mol/L NaCl(用0.05 mol/L pH 7.1的Tris-HCl缓冲溶液配制)进行梯度洗脱,流速为0.7 mL/min。每管收集8 mL,层析完成后收集GOD活性管,用透析袋脱盐后冷冻备用。离子交换柱用1 mol/L的NaCl缓冲溶液重生后,用φ=20%的乙醇溶液4 ℃冷藏保存。
1.2.2酶活力的测定葡萄糖氧化酶酶活的定义:在pH=5.6,温度为30 ℃的条件下,每分钟催化1 μmol葡萄糖转化为葡萄糖酸和过氧化氢所需的葡萄糖氧化酶的量定义为一个酶活力单位(U)。
参照文献[10],在试管中分别加入2.4 mL、0.21 mol/L的邻联茴香胺,0.5 mL、1 g/L的葡萄糖溶液和0.1 mL、0.1 g/L的辣根过氧化酶,摇匀后,在35 ℃下水浴5 min。检测时加入0.1 mL样品,于波长500 nm处每30 s记录吸光度(A500 nm)。以A500 nm对时间作图,找出最大斜率ΔA(min)。根据下式计算葡萄糖氧化酶的酶活。
式中:V1为反应液总体积,mL;V2为所加样品液体积,mL;7.5为氧化型邻联茴香胺的消光系数。
1.2.3酶蛋白浓度的测定用Bradford等[11]方法测定蛋白质含量,以牛血清白蛋白(BSA)为标准品。
1.2.4酶学性质研究
(1) 最适pH。30 ℃下,分别测定纯化前后不同GOD在不同pH (3~10)缓冲液下的酶活。
(2) 最适温度。在pH=7.0的缓冲液中,分别测定纯化前后不同GOD在不同温度(4~60 ℃)下分别保温4,8,12,24 h的酶活。
(3) 金属离子活性剂对酶活的影响。在30 ℃,pH=7.0的条件下,将纯化前后不同的GOD分别与20 mmol/L的Mg2+,Fe2+,Cu2+,Co2+,Mn2+,Ca2+,Zn2+以及SDS,EDTA溶液混合,探讨各种金属离子及活性剂对酶活的影响。
(4) GOD的Km,Kcat测定。在30 ℃,pH=7.0的条件下,以不同浓度(20~100 mmol/L)的葡萄糖为底物,测定其酶活,并按双倒数法(Lineweaver-Burk法[12])作图,求出其米氏常数(Km)及最大反应速率(Vmax),并根据酶浓度计算其催化常数(Kcat)。
(5) 不同GOD的原二色谱检测。将GOD分别稀释至低于1.0 g/L,用圆二色谱检测并进行数据分析。
(6) 不同GOD的Moldi-TOF-TOF检测。将纯化后的GOD分别进行蛋白电泳,将所需的条带切下送至生工生物工程有限公司进行Moldi-TOF-TOF检测。
2 结果与分析
2.1葡萄糖氧化酶的分离纯化
4个不同来源的GOD纯化前蛋白电泳图如图1所示,可以看出GOD均有一些杂带。Marker的条带大小从上至下分别为200.0,116.0,97.2,66.4,44.3,29.0,20.1,14.3、6.5 kDu。
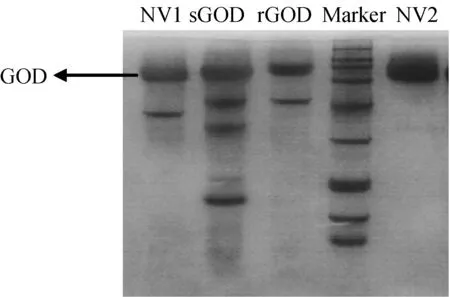
图1 层析前4种GOD的蛋白电泳图Fig.1 SDS-PAGE image of 4 kinds of glucose oxidases
GOD经DEAE-FF离子交换层析的洗脱曲线如图2所示。酶液经SDS-PAGE分析,用考马斯亮蓝R-250染色,呈现单一条带,说明该酶已经达到电泳纯,如图3所示。

图2 GOD层析的洗脱曲线Fig.2 Elution profile of glucose oxidases

图3 层析后4种GOD的蛋白电泳图Fig.3 SDS-PAGE image of 4 kinds of purified glucose oxidases
Marker的条带大小从上至下分别为200.0,116.0,97.2,66.4,44.3,29.0,20.1,14.3和6.5 kDu。纯化得到的GOD,亚基大小大约为65.8 kDu(sGOD约为63.2 kDu),全酶分子量经测定约为131 kDu(sGOD约为126 kDu),为2个相同的二聚体组成。纯化后,NV1、sGOD、rGOD、NV2的比酶活分别提高了4.5、5.6、5.2、1.2倍。
2.2酶学性质研究
2.2.1最适pH分别配制pH为3~10的缓冲液。在30 ℃下,分别测定纯化前后不同GOD在不同pH缓冲液下的酶活,得到图4。由图可见,纯化前的酶活有着各自的最适pH(集中在6~8),可能与其造粒时所加保护剂辅料有关,而纯化后的酶活对pH并不敏感,基本保持一致。
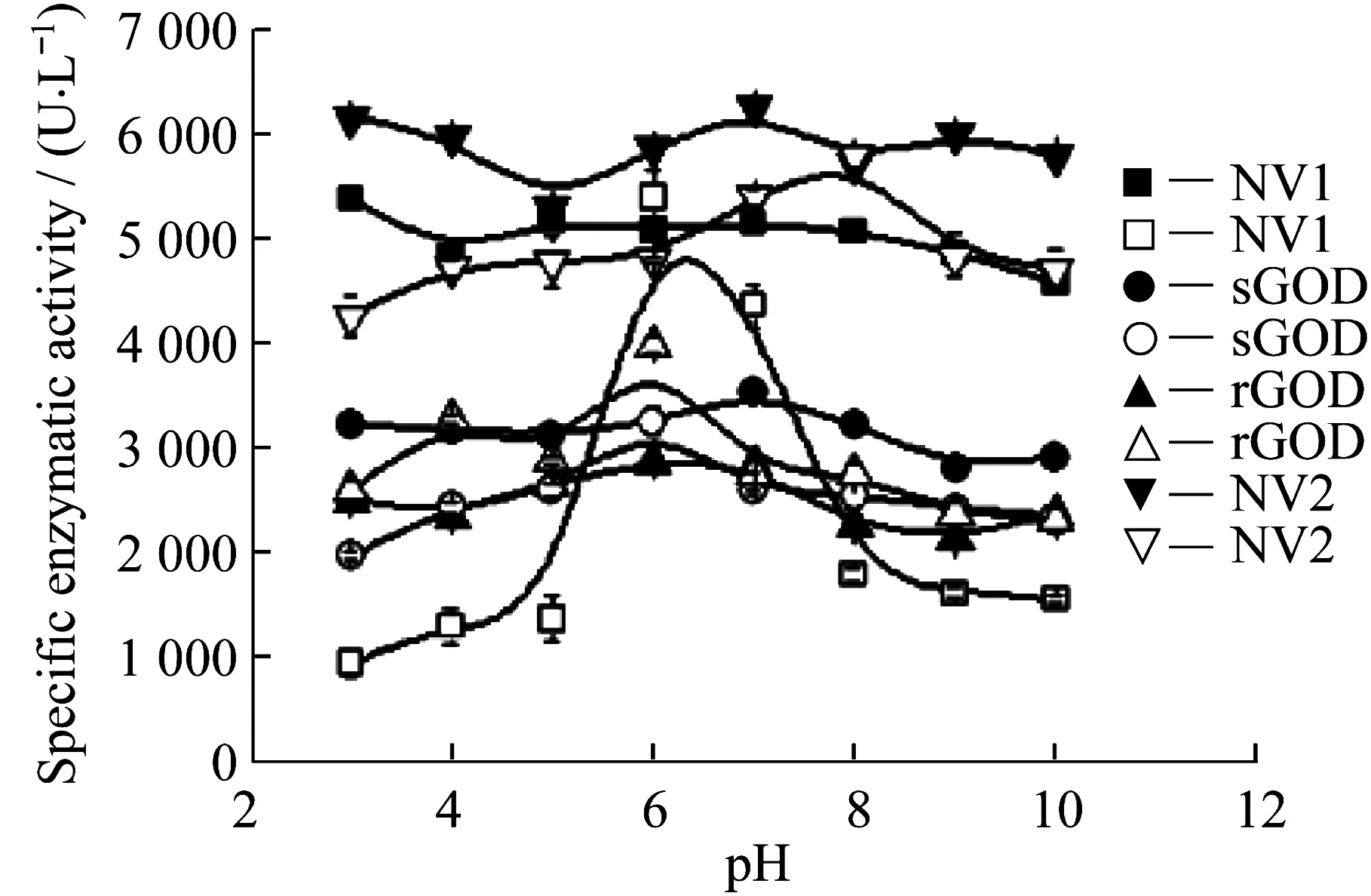
Solid is before purification;Hollow is after purification 图4 pH对纯化前后酶活的影响Fig.4 Effect of pH value on the enzymatic activity of GODs before and after purification
2.2.2最适温度将不同的GOD溶解于pH=7的缓冲液中,并分别放置在4、20、30、35、40、55、60 ℃中保温。在不同温度下保温4、8、12、24 h后测定GOD酶活。由图5可以看出,纯化后的葡萄糖氧化酶随着温度的升高而活性降低,而且随着时间的延长,酶活几乎没有损失。在55 ℃时,酶活随着时间而逐渐降低。60 ℃下,4种葡萄糖氧化酶均没有活性。
2.2.3金属离子及活性剂对酶活的影响将纯化前后不同的GOD溶解于20 mmol/L的Mg2+、Fe2+、Cu2+、Co2+、Mn2+、Ca2+、Zn2+以及SDS、EDTA溶液中,观察各种金属离子及活性剂对酶活的影响。从图6中可以看出,Fe2+对4种GOD,无论是纯化前和纯化后都为抑制作用。Co2+,Mg2+,Cu2+对GOD也有一定的抑制作用,而EDTA可以激活纯化后GOD的活性,可能是2价金属离子对GOD空间结构有影响,从而抑制酶活。经过EDTA对金属离子的络合,从而促进酶活的增加。
2.2.4葡萄糖及葡萄糖酸钠浓度对不同来源GOD催化的影响将GOD溶解于不同质量浓度的葡萄糖和葡萄糖酸钠溶液中,测定酶活。从图7和图8中可以看出,随着葡萄糖质量浓度的提高,GOD的酶活随之提高,而酶活在葡萄糖酸钠质量浓度的变化中呈现波动状(图8示出的水平线为各种酶酶活的平均值)。
2.2.5酶的动力学参数在30 ℃,pH=7.0的条件下,以不同浓度(20~100 mmol/L)的葡萄糖为底物,测定其酶活,并按双倒数法作图,如图9所示。测得GOD的Km值如下:NV1为43.93 mmol/L,sGOD为34.74 mmol/L,rGOD为43.95 mmol/L,耐高温NV2为79.13 mmol/L。说明NV2酶虽然可以耐高温,但对葡萄糖底物的亲和力却下降了约一半,因而更适合底物浓度高时的催化。此特点有可能会使底物难以完全进行催化反应。

图5 温度对GOD纯化后酶活的影响Fig.5 Effect of temperature on enzymatic activity of purified glucose oxidases
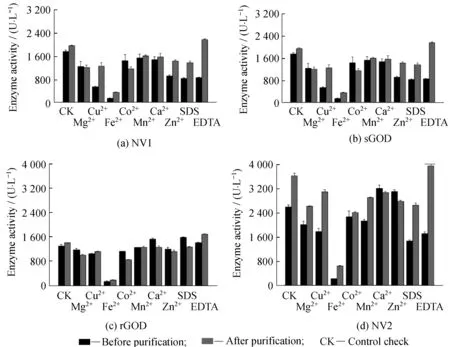
图6 金属离子及活性剂对纯化前后酶活的影响Fig.6 Effects of metal ions and active agents on the enzymatic activity before and after purification
由图9可以计算得出,催化100 mmol/L的葡萄糖时,NV1、sGOD、rGOD的Kcat值分别为45.85、20.29、37.32 s-1,耐高温葡萄糖氧化酶NV2的Kcat值为12.95 s-1。比较4种GOD的Kcat/Km值,其大小依次为:NV1>rGOD>sGOD>NV2,其中催化效率最高的NV1的Kcat/Km值达到了 1 043.706 L/(s·mol)。

图7 葡萄糖质量浓度对酶活的影响Fig.7 Effect of the concentration of glucose on the enzymatic activity of purified glucose oxidases
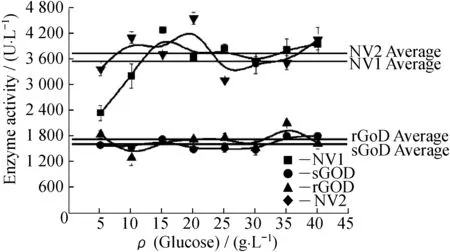
图8 葡萄糖酸钠质量浓度对酶活的影响Fig.8 Effect of the concentration of gluconate on the enzymatic activity of purified glucose oxidases
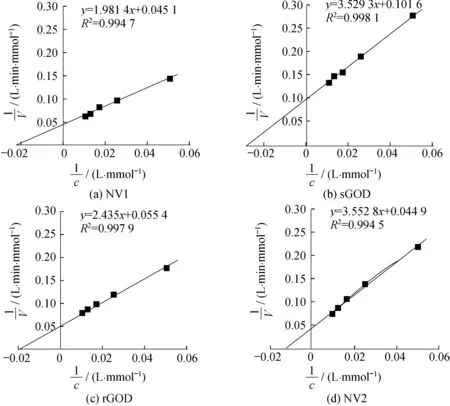
图9 不同GOD的Km值Fig.9 Km values of different kinds of glucose oxidases
2.2.6不同来源GOD的紫外吸收特性与二级结构分析4种GOD的紫外吸收峰非常接近,如图10所示,说明测试酶主要组成与结构基本相似,但有部分差异,尤其是NV1最大吸收峰在255 nm左右。进一步对其进行二级结构的圆二色分析,表明其在二级结构上基本一致,见表1、图11。
2.2.7不同来源GOD的氨基酸序列分析比较将纯化后的葡萄糖氧化酶的电泳条带进行Maldi-TOF-TOF检测,氨基酸序列结果为:NV1,rGOD和NV2的GOD序列完全一致,只是NV1中加入了GOD前体goxC、Pc16g04630和肌动蛋白;NV2中加入了GOD前体goxC、过氧化氢酶、过氧化氢酶前体、Pc16g04630和3个假定蛋白。sGOD的序列与NV1的序列比较,起始端少了24个残基,有19个残基突变。突变的残基如表2所示。

图10 不同GOD的紫外吸收峰Fig.10 UV absorption peak of different kinds of glucose oxidases 表1 不同GOD的圆二色谱检测结果 Table 1 Circular dichroism result of different kinds of glucose oxidases

w/%αhelixReverseparallelfoldingParallelfoldingβturnRandomcoil4.6041.005.3018.4034.50

图11 GOD的二级结构Fig.11 Secondary structure of glucose oxidase 表2 突变残基 Table 2 Mutated amino acid residues

Sites36386567157189226281354384427428468523526532594597599CKDSNSNVFGASNHHSTHSIEMutationEADTSILASTKDRRVNAVA
CK:Control check
3 讨 论
本实验用离子交换层析法分离纯化了4种来源不同的GOD,并对电泳处理后的纯GOD进行性质研究。GOD是一种不稳定的酶,在不适宜的温度中,极端的pH环境下甚至水溶液中都会引起变性,半衰期为30 min[1]。固定化[13-14]和基因工程[15]等技术可用于提高GOD的稳定性。由于酶的活性与活性位点上氨基酸的电离状态有关,因而pH在保持酶的适当构象上有着重要的作用。酶的反应速率与温度呈指数关系。温度每上升10 ℃,酶的反应速率将加倍。在40~70 ℃范围内,大多数酶会因变性而失去活性。米氏认为酶的初始催化速率或催化速度与底物浓度呈双曲变化。初始速率随底物浓度的增加而增加,最终达到最大速度(Vmax)。在底物浓度较低时,初始速率与底物浓度成正比,称为一级动力学。在底物浓度较高时,初始速率与底物浓度无关,称为饱和或零级动力学。不同来源的葡萄糖氧化酶有着不同的米氏常数以及最大速度。由T.flavus获得的GOD的Km值为10.9 mmol/L[16],由A.niger获得的GOD的Km值为33 mmol/L[17]。张茜纯化的尼崎青霉菌GOD的Km值为122.6 mmol/L[18]。Kcat/Km是酶与底物复合物转化为酶与产物复合物的速率常数。它可以不受非生产性结合与中间产物积累的影响,表示酶对底物的专一性。Kcat/Km值越高,则催化效率越高,说明该酶对同一底物葡萄糖的催化能力越大,应用的可能性越大。根据计算得到Kcat/Km的大小顺序为NV1>rGOD>sGOD>NV2,这与4种酶在实际应用中所表现出的催化能力完全一致,而导致同一类酶的Kcat/Km值大小差异明显的原因可能是由结构引起的。
从本研究期望找到可以影响葡萄糖氧化酶活性的结构因素。据报道,原始的GOD的最适pH为6~8,而在纯化后GOD对pH并不敏感。可能是由于在纯化后,GOD有辅料导致酶对pH有一定的保护作用。文献[19]报道,加入麦芽糊精可以大幅度提高酶的热稳定性,加入海藻糖能够很好地保持GOD的空间结构,这对工业化生产葡萄糖酸是非常有利的。在工业应用上,耐高温的GOD则具有更好的应用前景,目前催化葡萄糖生成葡萄糖酸产量最高时所需的温度为35 ℃。在本研究中GOD在40 ℃时的酶活与其在20 ℃的条件下相比,损失了约30%~50%,但是酶的活性却可以保持长期稳定,这为酶法工业化生产葡萄糖酸提供了可能性。
酶活性的改变通常与活性中心的结构有关。本文通过圆二色谱法和Maldi-TOF-TOF检测了GOD的结构,通过氨基酸序列的比较发现sGOD与其他3种GOD有部分氨基酸的缺失和突变。但是,从紫外光谱检测和圆二色谱检测的结果来看,这些酶的整体结构基本上毫无差异。在先前的研究中,一般在酶蛋白的N端和C端存在一些对于发挥特定酶活性非必需的氨基酸序列,而这些序列有可能对酶蛋白结构的稳定性或者其他功能有部分影响。同时NV1和NV2都加入了GOD前体GoxC以及修饰性蛋白,这或许可以解释这2种酶在应用时有较好效果的原因。影响GOD酶活的结构因素可能是氨基酸的突变或者缺失,也可能是酶上的修饰蛋白引起的。遗憾的是,目前还没有找到具体的影响因素。因此,可在本研究的基础上,进一步研究影响葡萄糖氧化酶酶活的因素,为酶法工业化生产葡萄糖酸提供指导。
[1]SANDIP B B,MAHESH V B,REKHA S S,etal.Glucose oxidase——An overview[J].Biotechnology Advances,2009,27:489-501.
[2]HATZINIKOLAOU D G,HANSEN O C,MACRIS B J,etal.A new glucose oxidase fromAspergillusniger:Characterization and regulation studies of enzyme and gene[J].Applied Microbiology and Biotechnology,1996,46(4):371-381.
[3]SUKHACHEVA M V,DAVYDOVA M E,NETYUSOV A I.Production ofPenicilliumfuniculosum433 glucose oxidase and its properties[J].Applied Microbiology and Biote-chnology,2004,40(1):25-29.
[4]WONG C M,WONG K H,CHEN Xiaodong.Glucose oxidase:Natural occurrence,function,properties and indus-trial applications[J].Applied Microbiology and Biotech-nology,2008,78(6):927-938.
[5]MINKSTIMIENE A K,MAZEIKO V,RAMANAVICIENE A.Evaluation of amperometric glucose biosensors based on glucose oxidase encapsulated within enzymatically synthesized polyaniline and polypyrrole[J].Sensors and Actuators B,2011,158(1):278-285.
[6]CRUZ A G,CASTRO W F,FARIA J A F.Glucose oxidase:A potential option to decrease the oxidative stress in stirred probiotic yogurt[J].Food Science and Technology,2012,47(2):512-515.
[7]ROHR M,KUBICEK C P,KOMINEK J.Gluconic Acid in Biotechnology[M].Germany,Weinheim:Verlag Chemie,1983.
[8]ISABELL H S,FRUSH H L,BATES F J.Manufacture of calcium gluconate by electrolytic oxidation of glucose[J].Industrial and Engineering Chemistry,1932,24:375-378.
[9]WILT H G J de.Oxidation of glucose to gluconic acid[J].Industrial Engineering Production Research,2002,11(4):370-373.
[10]周生民,赵伟.葡萄糖氧化酶活性变化的分析[J].中国酿造,2013,32(9):130-131.
[11]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding[J].Analytical Biochemistry,1976,72(1/2):248-254.
[12]沈同,王敬岩.生物化学(下册)[M].第2版.北京:高等教育出版社,2000.
[13]ALTIKATOGLU M,BASARN Y,ARIOZ C,etal.Glucose oxidase- dextrn conjugates with enhanced stabilities against temperature and pH[J].Applied Biochemistry and Biotech-nology,2010,160 (8):2187-2197.
[14]RAUF S,IHSAN A,AKHTAR K,etal.Glucose oxidase immobilization on a novel cellulose acetate-polymethylmeth-acrylate membrane[J].Journal of Biotechnology,2006,121:351-360.
[15]ZHU Z,WANG M,GAUTAM A,etal.Directed evolution of glucose oxidase fromAspergillusnigerfor ferroceneme-thanol-mediated electron transfer[J].Biotechnology Journal,2007,2 (2):241-248.
[16]KAY K K,DEBORAH R F,GEORGE C P.Production,purification,and properties of glucose oxidase from the biocontrol fungusTalaromycesflavus[J].Canadian Journal of Microbiology,1990,36:199-205.
[17]SWOBODA B E,MASSEY V.Purification and properties of the glucose oxidase fromAspergillusniger[J].Journal Biological Chemistry,1965,240 (5):2209-2215.
[18]张茜.尼崎青霉菌葡萄糖氧化酶的分离纯化及性质研究[D].福建厦门:厦门大学,2009.
[19]谭莹.葡萄糖氧化酶发酵条件的优化、纯化及酶制剂研究[D].江苏无锡:江南大学,2012.
Purification and Biocatalytic Properties of GlucoseOxidases from Different Sources
WANG Wen-ting1,ZHAO Wei2,ZHANG Kui-pu1,LI Liang1,GUO Mei-jin1
(1.State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai 200237,China;2.Shandong Fuyang Biology Company,Dezhou 253100,Shandong,China)
Glucose oxidases (GODs) from four different sources were purified using ion exchange chromatography.The molecular weight of double subunits of GOD is about 130 kDu.Four GODs have relatively stable enzymatic properties and wide pH range after purification.Within the temperature range of 20—50 ℃,their enzymatic activity is relatively stable but declines with the increasing of temperature.However,enzymatic activity is less stable at 55 ℃ and no activity can be detected at 60 ℃ among GODs tested here.Metal ions including Fe2+,Co2+,Mg2+and Cu2+have strong inhibitory effects on these four kinds of enzymes in which Fe2+is the strongest one.However,EDTA is able to activate GOD’s activity.Under the condition of temperature 30 ℃ and pH 7.0,these four kinds of GODs are tested forKmandKcatvalues with the different concentrations (20—100 mmol/L) of glucose as sole substrate.Based on the results of UV spectra and the circular dichroism of four kinds of glucose oxidases,it shows that their secondary structures are very similar with different amino acid residues.However,GoxC,one of precursors of GOD,and some modified proteins such as precursor of catalase and putative Pc16g04630 protein can play vital roles in catalysis efficiency and their application in industry.
glucose oxidase; purification; biocatalytic properties; amino acid residue analysis
1006-3080(2016)04-0484-08
10.14135/j.cnki.1006-3080.2016.04.008
2015-12-07
国家高技术研究发展(863)计划(2014AA021705)
王文婷(1990-),女,山西太原人,硕士生,主要从事酶学性质研究。E-mail:wwt0028@126.com
通信联系人:郭美锦,E-mail:guo_mj@ecust.edu.cn
Q814
A
