拐枣枝多糖提取工艺优化与其抗氧化性研究
2016-09-18李立天郑朋朋敖新宇
张 保,李立天,张 萌,郑朋朋,敖新宇
拐枣枝多糖提取工艺优化与其抗氧化性研究
张保,李立天,张萌,郑朋朋,敖新宇*
(西南林业大学 生命科学院,云南 昆明 650224)
为确定拐枣枝多糖的生物活性,对拐枣枝多糖提取工艺进行优化,并评价其体外抗氧化性强弱,从而为拐枣枝多糖的合理开发和应用提供理论依据。以拐枣枝为试验材料,在单因素试验基础上,采用响应面分析法优化拐枣枝多糖提取工艺;通过拐枣枝多糖对羟自由基(·OH)、ABTS自由基(ABTS+·)和DPPH自由基(DPPH·)的清除率的测定从而评价拐枣枝多糖的抗氧化性。结果表明:最佳多糖的最佳提取条件为料液比1∶30(g∶mL)、浸提温度80℃、浸提时间2.0 h,拐枣枝多糖的提取率为2.44%。抗氧化性结果表明,拐枣枝多糖对·OH、DPPH·和ABTS+·均有较强的清除作用,最大清除率分别达到76.2%、91.3%和96.8%。
拐枣枝;多糖;响应面法;抗氧化性
拐枣(Hovenia acerbaLindl)学名枳椇,为鼠李科枳椇属(Rhamnaceaehovenia)。在中国,拐枣分布广泛,已有研究表明,拐枣果梗中含有丰富的维生素、有机酸、氨基酸和糖苷以及人体必需的矿物质等[1-2]。然而目前关于拐枣有效成分的提取主要集中在三萜皂苷类[3]、黄酮类[4]、生物碱类[5]、有机酸类[6],而对提取拐枣多糖的研究却相对较少。经国内外许多的科研工作者研究发现,多糖在抗肿瘤[7]、抗氧化[8]、抗病毒[9]、免疫调节[10-11]、降血糖[12]等方面具有独特的药理活性,因此对拐枣多糖的研究具有重要意义。目前对提取拐枣多糖的研究主要集中在果梗和拐枣子,而对拐枣枝部位的研究较少。于刚等[13]采用不同pH值溶液提取拐枣子多糖,结果显示pH值为9.00的碳酸氢钠溶液提取效果最好且多糖提取率达到6.61%。郑朋朋等[14]发现拐枣枝的乙醇溶液浸提物具有一定的抗氧化性,其效果仅次于拐枣果梗,但未做进一步的研究。本试验采用水提醇沉法提取拐枣枝多糖(Hovenia acerbasticks polysaccharides,HASP),响应面法优化提取工艺,并通过对·OH、ABTS+·和DPPH·的清除率的测定从而评价拐枣枝多糖的抗氧化性,期望能为拐枣枝多糖的合理开发与利用提供理论依据。
1 材料与方法
1.1材料与试剂
1.1.1材料
拐枣枝:采购于云南省昆明市西南林业大学周边市场,60℃条件下烘箱烘干后,研磨粉粹后过80目筛,备用。
1.1.2化学试剂
水杨酸、硫酸亚铁、抗环血酸、过硫酸钾(均为分析纯):国药集团化学试剂有限公司;氯仿、正丁醇、乙醇、浓硫酸、苯酚、葡萄糖、30%双氧水(均为分析纯):汕滇药业有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate,ABTS):美国Sigma公司。
1.2仪器与设备
M20粉碎机:德国KIKAWERKE公司;HWS-12水浴锅、DHG-9240A型电热恒温鼓风干燥箱:上海一恒科学仪器有限公司;5430R离心机:德国Eppendorf公司;TU-1901紫外可见分光光度计:北京普析通用仪器有限责任公司;FD5-8冷冻干燥器:美国GOLD SIM公司;B490真空旋转蒸发仪:瑞士BUCHI公司;BS224S电子天平:德国SARTORIUS公司。
1.3方法
1.3.1拐枣枝多糖的提取
称取1.0 g拐枣枝干粉,置于50 mL的离心管中,按照设定的料液比、浸提时间和浸提温度对拐枣枝干粉进行水浴浸提;浸提完成后于6 000 r/min的条件下离心10 min,取出后转移上清液并加无水乙醇至乙醇体积分数为80%,4℃静置沉淀14 h;然后于7 000 r/min的条件下离心5 min,保留沉淀并将多糖沉淀复溶于蒸馏水中,最后转移至100 mL的容量瓶中定容待测。
1.3.2葡萄糖标准曲线绘制
精确称取105℃干燥至恒质量的葡萄糖标准品100mg,用蒸馏水溶解后定容至1 L,得到葡萄糖标准溶液。分别精确量取0、0.2mL、0.4mL、0.6mL、0.8mL、1.0mL的葡萄糖标准溶液,补水至1.0 mL,分别配制成0、20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL的葡萄糖标准待测液,加1.0 mL 5%苯酚溶液,混合后再加入3.5 mL浓硫酸,迅速混匀,放置流水中冷却5 min,然后在波长489 nm处测定吸光度值,以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制葡萄糖标准曲线。
1.3.3拐枣枝多糖的测定
量取1.0 mL多糖待测液,加1.0 mL 5%苯酚溶液,混合后加入3.5 mL的浓硫酸,迅速混匀,放置流水中冷却5 min,在波长489 nm处测定吸光度值,并利用葡萄糖标准曲线方程计算拐枣枝多糖含量,多糖提取率计算式如下:
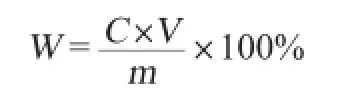
式中:W为多糖提取率,%;C为所得样品吸光值经葡萄糖标准曲线方程计算后获得的样品多糖质量浓度,μg/mL;V为样品多糖定容后体积,mL;m为拐枣枝样品质量,g。
1.3.4单因素试验
以蒸馏水为浸提溶剂,分别按料液比1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL)于浸提温度65℃、70℃、75℃、80℃、85℃、90℃条件下提取0.5h、1.0h、1.5h、2.0h、2.5h、3.0h,每组3次平行试验,以拐枣枝多糖提取率为评价指标,考察料液比、浸提温度、浸提时间对拐枣枝多糖提取的影响。
1.3.5响应面优化试验
在单因素试验基础上,采用Box-Behnken模型,以浸提温度(A)、浸提时间(B)、料液比(C)3个影响因素作为自变量,以拐枣枝多糖提取率(Y)为响应值。并以-1、0、+1分别代表因素水平。响应面因素与水平设计见表1。

表1 响应面试验因素与水平设计Table 1 Factors and levels of response surface experiments
1.3.6拐枣枝多糖样品的制备
称取100 g拐枣枝干粉,按响应面分析法优化的最佳提取工艺条件进行浸提,取出后进行抽滤,滤液经旋转蒸发仪浓缩至1.0 L,加无水乙醇至乙醇体积分数为80%,静置沉淀14 h,然后于7 000 r/min的条件下离心5 min,保留沉淀,真空干燥后得到拐枣枝粗多糖G1;将粗多糖G1复溶于水中,采用Sevag法[15]去除蛋白,在脱蛋白的多糖溶液中加入无水乙醇,沉淀真空冷冻干燥(-40℃、48 h)得到拐枣枝精多糖G2,-20℃保存待用。
1.3.7拐枣枝多糖的抗氧化性研究
清除·OH能力测定:按照参考文献[16]的方法进行,羟自由基清除效率计算式如下:
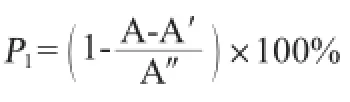
式中:P1为·OH清除率,%;A为不同样品溶液吸光度值;A′为蒸馏水替代水杨酸的样品本底吸光度值;A″为蒸馏水替代样品的对照溶液吸光度值。
清除DPPH·能力测定:按照参考文献[17]的方法进行,DPPH自由基清除率计算公式如下:
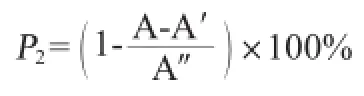
式中:P2为DPPH自由基清除率,%;A为不同样品溶液吸光度值;A′为蒸馏水替代DPPH自由基液的样品本底吸光度值;A″为蒸馏水替代样品的对照溶液吸光度值。
清除ABTS+·能力测定:按照参考文献[18]的方法进行,ABTS自由基清除率计算公式如下:
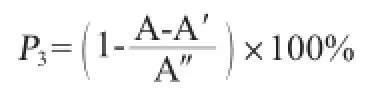
式中:P3为ABTS自由基清除率,%;A为不同样品溶液吸光度值;A′为蒸馏水替代ABTS自由基液的样品本底吸光度值;A″为蒸馏水替代样品的对照溶液吸光度值。
2 结果与分析
2.1葡萄糖标准曲线
采用Origin 8.0软件处理试验数据,得到葡萄糖标准曲线见图1。由图1可知,葡萄糖标准曲线的线性回归方程:y=0.01032x+0.07486,相关系数R2=0.997,在0~100 μg/mL的葡萄糖质量浓度范围内,质量浓度与吸光度值呈良好的线性关系。
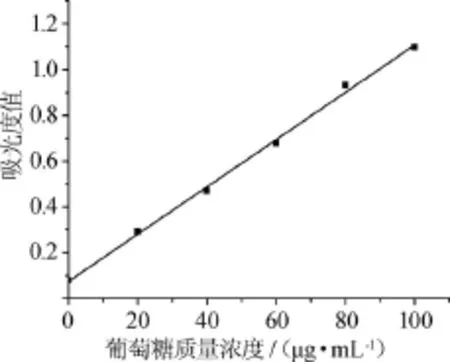
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2单因素试验结果
2.2.1料液比对拐枣枝多糖提取率的影响
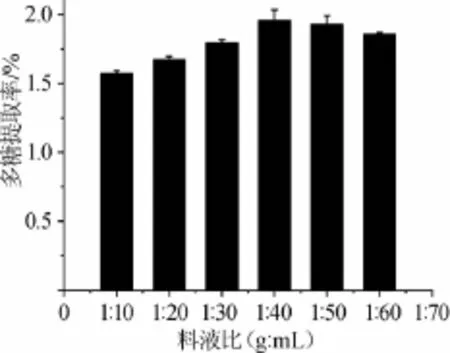
图2 料液比对多糖提取率的影响Fig.2 Effect of solid-liquid ratio on extraction rate of polysaccharides
由图2可知,料液比在1∶10~1∶40(g∶mL)时,拐枣枝多糖的提取率随着料液比的增加而逐渐增大,当液料比达到1∶40(g∶mL)时,拐枣枝多糖的提取率达到最大值1.959%;继续增加料液比,多糖提取率趋于稳定。结果表明,最佳料液比为1∶40(g∶mL)。
2.2.2浸提时间对拐枣枝多糖提取率的影响
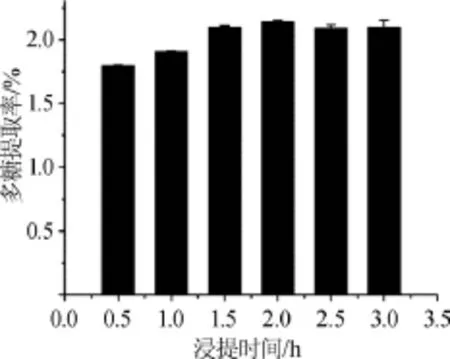
图3 浸提时间对多糖提取率的影响Fig.3 Effect of extraction time on extraction rate of polysaccharides
由图3可知,浸提时间在0.5~2.0 h时,拐枣枝多糖的提取率随着浸提时间的增加而逐渐增大,当浸提时间达到2.0 h时,拐枣枝多糖的提取率达到最大值2.141%;继续增加浸提时间,多糖提取率不再增加。结果表明,最佳浸提时间为2.0 h。
2.2.3浸提温度对拐枣枝多糖提取率的影响
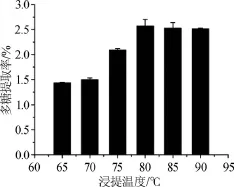
图4 浸提温度对多糖提取率的影响Fig.4 Effect of extraction temperature on extraction rate of polysaccharides
由图4可知,浸提温度在65~80℃时,拐枣枝多糖的提取率随着浸提温度的升高而逐渐增大,当浸提温度达到80℃时,拐枣枝多糖的提取率达到最大值2.570%;继续增加浸提温度,多糖提取率不再增加。结果表明,最佳浸提温度为80℃。
2.3响应面优化试验结果
2.3.1回归模型建立与方差分析
根据单因素试验结果,采用Design Expert 8.0.5软件中的Box-Behnken中心组合试验设计原理,进行3因素3水平的响应面试验。共15个试验点,其中析因点12个,零点重复3个,用以估计试验误差,结果见表2,方差分析见表3。
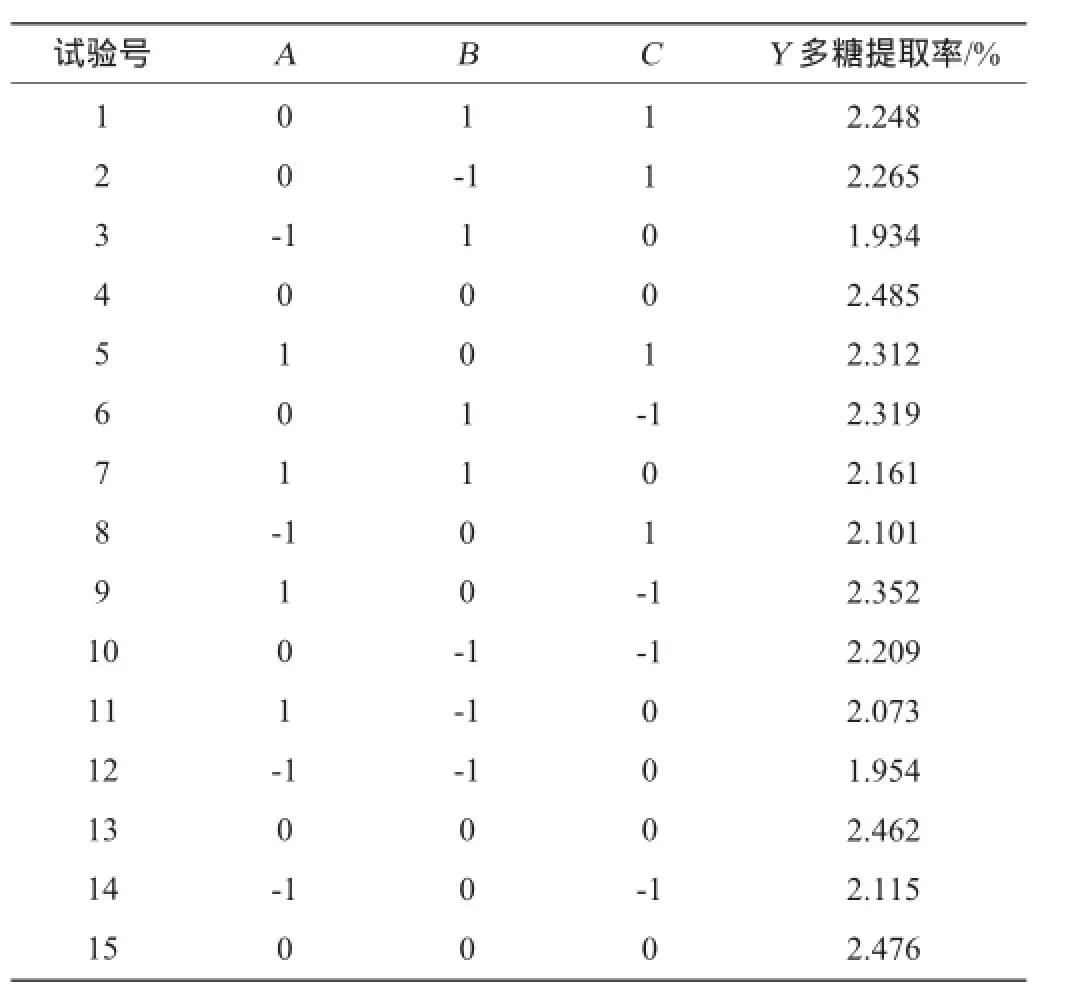
表2Box-Behnken试验设计结果Table 2 Design and results of Box-Behnken experiments
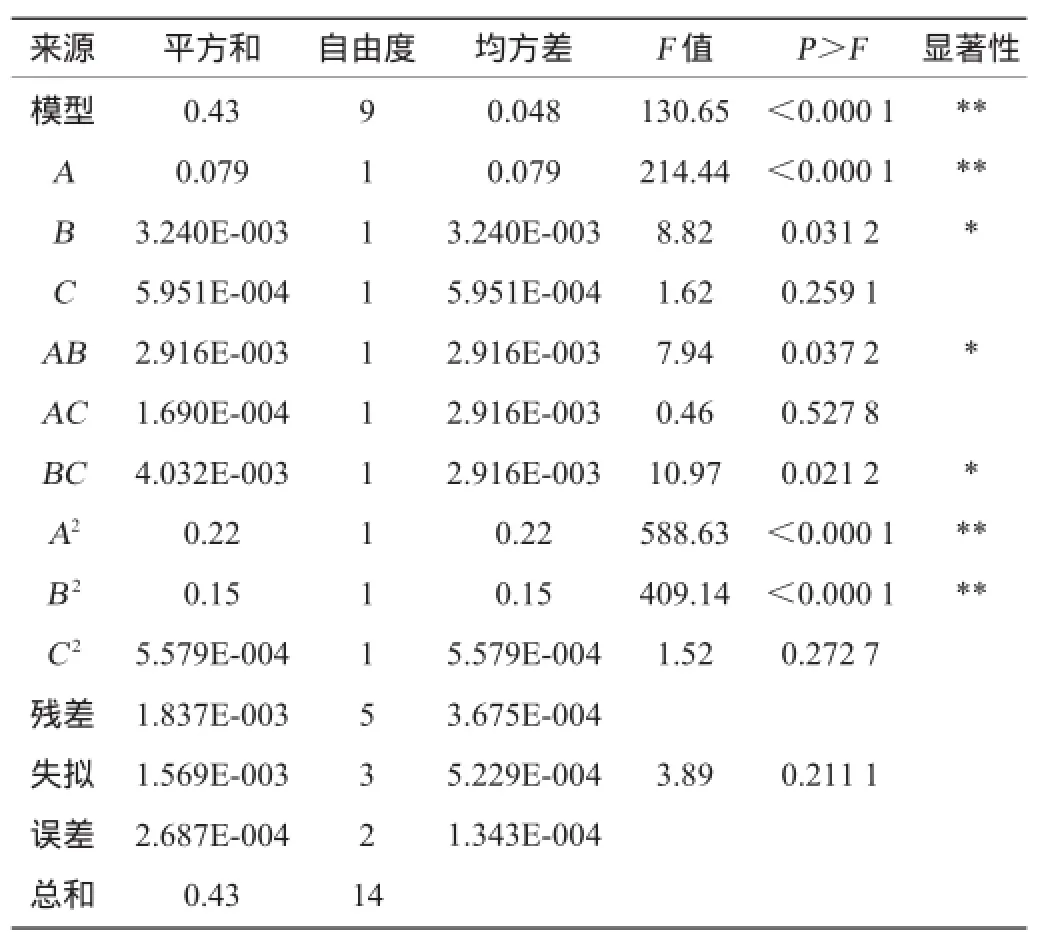
表3 回归模型方差分析Table 3 Variance analysis of regression model
根据试验结果进行回归拟合,得到二次多项式回归方程:
Y=2.47+0.099A+0.02B-8.625×10-3C+0.027AB-6.5×10-3AC-0.032BC-0.24A2-0.2B2-0.012C2。
由表3方差分析可知,调整后的决定系数R2=0.988,表明该模型拟合良好,该回归模型达到极显著水平(P<0.01)。模型中的A、A2、B2对响应值影响极显著(P<0.01),B、AB、BC对响应值影响显著(P<0.05),这表明试验因素对响应值不是简单的线性关系。失拟项P=0.211 1>0.05,差异不显著,表明建立的二次多项式回归模型可以运用于拐枣枝多糖提取优化的理论预测。
2.3.2响应面图分析
各个影响因子交互作用的响应面和等高线分析图见图5。由图5可知,在所选的各影响因素的取值范围内存在极大值,即拐枣枝多糖提取率最大。浸提温度对拐枣枝多糖提取率的影响极显著,表现为曲线较陡;浸提时间对拐枣枝多糖提取率的影响显著,表现为曲线较缓;料液比对拐枣枝多糖提取率的影响不显著,表现为曲线平缓。

图5 浸提温度、浸提时间和料液比对多糖提取率影响的响应面及等高线Fig.5 Response surface plots and contour line of effects of interactions between extraction temperature,time and solid-liquid ratio on extraction rate of polysaccharides
2.3.3最佳提取工艺条件
由Design Expert 8.0.5软件分析得出:当浸提温度(A)为80.87℃、浸提时间(B)为2.06 h、料液比(C)为1∶31.34(g∶mL)时,理论最佳拐枣枝多糖提取率为2.487%。考虑在实际操作上的方便性,将各因素修正为浸提温度80℃、浸提时间2.0h、料液比1∶30(g∶mL)。然后在修正的各因素条件下进行验证试验。通过3次平行试验得到的实际平均提取率分别为2.327%、2.486%、2.492%,平均提取率为2.435%,与理论值2.487%接近。因此,响应面法对拐枣枝多糖浸提条件的优化是可行的且具有实际应用价值。
2.4粗多糖的紫外光谱扫描结果
采用紫外可见分光光度计,对提取的拐枣枝粗多糖G1、拐枣枝精多糖G2,在800~200 nm波长范围内进行紫外光谱扫描,结果见图6。由图6可知,粗多糖G1在波长260~280 nm范围内出现紫外吸收峰,此范围内的吸收峰为蛋白质吸收峰,表明粗多糖G1是含蛋白质的多糖;而经过Sevag试剂除蛋白后的精多糖G2在波长260~280 nm范围内未出现紫外吸收峰,表明精多糖G1已经去除蛋白质,由此可见Sevag法可以有效除去拐枣枝多糖中蛋白质。
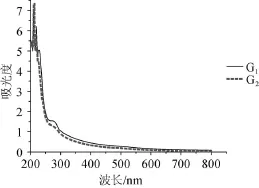
图6 拐枣枝多糖紫外吸收光谱扫描结果Fig.6 UV spectra scan results of polysaccharides
2.5拐枣枝多糖抗氧化性分析
2.5.1清除·OH能力测定结果
羟基自由基能够轻易地穿过细胞膜并与大多数生物分子(如糖类、脂类、蛋白质和DNA等)发生反应,最终导致细胞死亡,甚至组织损伤[19-20]。由图7可知,在试验质量浓度范围内,随着多糖质量浓度的增加,拐枣枝多糖对·OH清除率呈逐渐上升趋势,多糖在1~4 mg/mL时,随着质量浓度的增加,·OH清除率不断增大,4~5 mg/mL时多糖对·OH清除作用趋于稳定,最大的清除率达到76.2%。VC在质量浓度0.2~1.0 mg/mL时,随着质量浓度的增加,其对·OH清除率增加迅速,超过1.0 mg/mL后,·OH清除率基本没有变化,维持在99.1%。结果表明,拐枣枝多糖对·OH有一定的清除能力,但比VC弱。
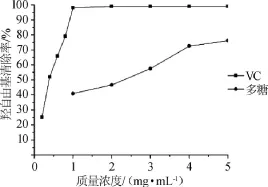
图7 拐枣枝多糖对羟自由基的清除作用Fig.7 Scavenging activity of polysaccharides on hydroxyl radicals
2.5.2清除DPPH·能力测定结果
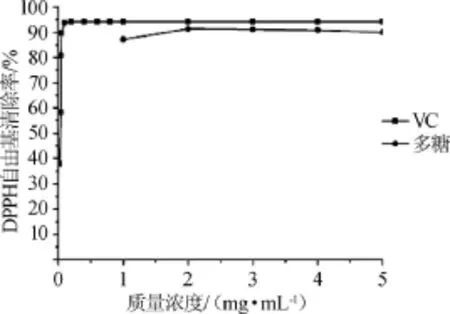
图8 拐枣枝多糖对DPPH自由基的清除作用Fig.8 Scavenging activity of polysaccharides on DPPH radicals
由于DPPH自由基操作的简单性和结果的可重现性,DPPH自由基被广泛应用于各种天然化合物的抗氧化性能力的测定[21]。由图8可知,在试验质量浓度范围内,随着多糖质量浓度的增加,拐枣枝多糖对DPPH·清除率呈逐渐上升趋势,多糖在1~2mg/mL时,随着质量浓度的增加,DPPH·清除率不断增大,2~5mg/mL时多糖对DPPH·清除作用趋于稳定,最大的清除率达到91.3%。VC在质量浓度0.02~ 0.10 mg/mL时,随着质量浓度的增加,其对DPPH·清除率增加迅速,超过0.1mg/mL后,DPPH·清除率基本没有变化,维持在94.2%。结果表明,拐枣枝多糖对DPPH·有较好的清除能力,但比VC稍弱。
2.5.3清除ABTS自由基能力测定结果
通过吸光度值的变化来检测ABTS自由基的清除率,已经成为广泛用于检测化学成分的抗氧化活性的使用方法[22-23]。由图9可知,在试验质量浓度范围内,随着质量浓度的增加,拐枣枝多糖对ABTS+·清除率维持在95%左右,最大的清除率达到96.8%。VC在质量浓度0.01~0.05 mg/mL时,随着多糖质量浓度的增加,其对ABTS自由基清除率增加迅速,多糖质量浓度超过0.05 mg/mL后,ABTS自由基清除率基本没有变化,维持在98.2%。结果表明,拐枣枝多糖有较好对ABTS自由基清除能力,但比VC略弱。
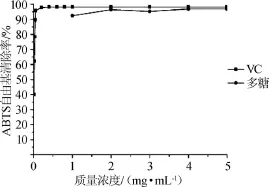
图9 拐枣枝多糖对ABTS自由基的清除作用Fig.9 Scavenging activity of polysaccharides on ABTS radicals
3 结论
本研究在单因素试验的基础上,采用响应面分析法对拐枣枝多糖的提取工艺进行优化。结果表明,最佳提取工艺为:料液比1∶30(g∶mL),浸提时间2.0 h,浸提温度80℃,多糖提取率为2.435%,与理论值2.487%接近。因此,响应面法对拐枣枝多糖的浸提条件的优化是可行的且具有实际应用价值。抗氧化性试验研究结果表明,拐枣枝多糖对·OH、DPPH·和ABTS+·具有一定的清除作用,且随着拐枣枝多糖的质量浓度增加而作用增强,最大清除率达分别到76.2%、91.3%和96.8%。试验结果表明,拐枣枝多糖具有较强的抗氧化能力,可作为天然的抗氧化剂资源进行开发和利用。
[1]王艳林.拐枣的食用价值研究I:营养成分分析[J].天然产物研究与开发,1994,6(1):89-92.
[2]向进乐,李志西,甘峰,等.枳椇果梗不同类型酚酸含量及抗氧化活性[J].食品与发酵工业,2011,37(8):106-111.
[3]YOSHIKAWA K,NAGAI Y,YOSHIDA M,et al.Antisweet naturalproductsVIII.StructuresofhodulosidesVI-XfromHoveniadulcisThunb. Var.tomentellaMakino[J].Chem Pharm Bull,1993,41(10):1722-1725.
[4]ASE K,OHSUGI M,XIONG Q,et al.Hepatoprotective effect ofHovenia dulcisThunb.on experimental liver injuries induced by carbon tetrachloride or D-galactosamine/lipopolysaccharide[J].Biol Pharm Bull,1997,20(4):381-385.
[5]TAKAI M,OGIHARA Y,SHIBATA S.New peptide alkaloids from Hovenia dulcisandH.tomentella[J].Phytochemistry,1973,12(12):2985-2986.
[6]贾春晓,熊卫东,毛多斌,等.拐枣果梗中有机酸成分的GC-MS分析[J].中国食品学报,2005,5(1):72-74.
[7]SUN L,WANG L,ZHOU Y.Immunomodulation and antitumor activities of different-molecular-weight polysaccharides fromPorphyridium cruentum[J].Carbohyd Polym,2012,87(2):1206-1210.
[8]FAN L,LI J,DENG K,et al.Effects of drying methods on the antioxidant activities of polysaccharides extracted fromGanoderma lucidum[J]. Carbohyd Polym,2012,87(2):1849-1854.
[9]SAHA S,NAVID M H,BANDYOPADHYAY S S,et al.Sulfated polysaccharidesfromLaminariaangustata:Structuralfeaturesandin vitro antiviral activities[J].Carbohyd Polym,2012,87(1):123-130.
[10]YI Y,ZHANG M W,LIAO S T,et al.Structural features and immunomodulatory activities of polysaccharides ofLongan pulp[J].Carbohyd Polym,2012,87(1):636-643.
[11]LI J J,JI L,SUN L,et al.Analysis of Herba Asari polysaccharides and their immunological activity[J].Carbohyd Polym,2012,87(1):551-556.
[12]赵博,王一峰,侯宏红.中国楤木粗多糖对糖尿病大鼠的降血糖作用[J].食品科学,2015,36(13):211-214.
[13]于刚,王立军,曹晓钢.枳椇子活性多糖的提取工艺及解酒功能研究[J].广西轻工业,2007,23(10):3-4.
[14]郑朋朋,李珊,杨正涛,等.拐枣不同提取物的体外抗氧化作用[J].中国酿造,2015,34(9):121-124.
[15]SUN Z,ZHANG L,ZHANG B,et al.Structural characterisation and antioxidant properties of polysaccharides from the fruiting bodies ofRussula virescens[J].Food Chem,2010,118(3):675-680.
[16]SHI M,ZHANG Z,YANG Y.Antioxidant and immunoregulatory activity ofGanoderma lucidumpolysaccharide(GLP)[J].Carbohyd Polym,2013,95(1):200-206.
[17]WANG J,ZHANG J,ZHAO B,et al.A comparison study on microwave-assisted extraction ofPotentilla anserinaL.polysaccharides with conventional method:Molecule weight and antioxidant activities evaluation[J].Carbohyd Polym,2010,80(1):84-93.
[18]CHENG H,FENG S,JIA X,et al.Structural characterization and antioxidant activities of polysaccharides extracted fromEpimedium acuminatum[J].Carbohyd Polym,2013,92(1):63-68.
[19]YUAN J F,ZHANG Z Q,FAN Z C,et al.Antioxidant effects and cytotoxicity of three purified polysaccharides fromLigusticum chuanxiong Hort[J].Carbohyd Polym,2008,74(4):822-827.
[20]CHENG H,FENG S,SHEN S,et al.Extraction,antioxidant and antimicrobial activities ofEpimedium acuminatumFranch.polysaccharide[J]. Carbohyd Polym,2013,96(1):101-108.
[21]LEONG L P,SHUI G.An investigation of antioxidant capacity of fruits in Singapore markets[J].Food Chem,2002,76(1):69-75.
[22]MILLER N J,RICE-EVANS C,DAVIES M J,et al.A novel method for measuring antioxidant capacity and its application to monitoring the antioxidant status in premature neonates[J].Clinical Sci,1993,84(4):407-412.
[23]LI X,HAN W,MAI W,et al.Antioxidant activity and mechanism of tetrahydroamentoflavonein vitro[J].Nat Prod Comm,2013,8(6):787-789.
Optimization of extraction technology ofHovenia acerbasticks polysaccharides and its antioxidant activity
ZHANG Bao,LI Litian,ZHANG Meng,ZHENG Pengpeng,AO Xinyu*
(College of Life Science,Southwest Forestry University,Kunming 650224,China)
To determine the biological activity ofHovenia acerbasticks polysaccharide(HASP),the extraction process condition of HASP was optimized and thein vitroantioxidant activity of HASP was evaluated.On the basis of single factor test,response surface analysis was used to optimize the extraction process of polysaccharides fromH.acerbasticks.The scavenging efficiency of HASP on hydroxyl radical,ABTS radical and DPPH radical were determined,to study the antioxidant activity.The results showed that the optimal extraction conditions were solid-liquid ratio 1∶30(g∶ml),extraction temperature 80℃and time 2.0 h,and the extraction rate of HASP was up to 2.44%.Thein vitroantioxidant activity tests revealed that HASP exhibited high hydroxyl radical,DPPH radical,and ABTS radical scavenging activities,and maximum scavenging rate were 76.2%,91.3% and 96.8%,respectively.
Hovenia acerbasticks;polysaccharide;response surface method;antioxidant activity
R284.2
0254-5071(2016)07-0155-06
10.11882/j.issn.0254-5071.2016.07.034
2016-03-10
云南省优势特色重点学科生物学一级学科建设项目(50097505);西南林业大学科技创新基金(15125)
张保(1992-),男,硕士研究生,研究方向为生物化学与分子生物学。
敖新宇(1978-),男,副教授,硕士,研究方向为生物化学与分子生物学。
