响应面法优化罗非鱼皮酶法脱脂工艺
2016-09-16陆剑锋姜绍通合肥工业大学生物与食品工程学院安徽省农产品精深加工重点实验室安徽合肥230009
蒋 丽,陆剑锋,吕 顺,姜绍通,林 琳(合肥工业大学生物与食品工程学院,安徽省农产品精深加工重点实验室,安徽合肥230009)
响应面法优化罗非鱼皮酶法脱脂工艺
蒋 丽,陆剑锋,吕 顺,姜绍通,林 琳*
(合肥工业大学生物与食品工程学院,安徽省农产品精深加工重点实验室,安徽合肥230009)
以罗非鱼鱼皮为原料,在单因素实验基础上,选取脱脂温度、脱脂时间、加酶量为自变量,罗非鱼皮脱脂率为响应值,利用Box-Benhnken中心组合设计和响应面分析法,对罗非鱼皮酶法脱脂的工艺条件进行优化。结果表明:脂肪酶对罗非鱼皮脱脂的最优工艺条件为pH9、加酶量0.5%、脱脂温度39℃、脱脂时间56 min,在此条件下鱼皮脱脂率为63.71%。
罗非鱼皮,脂肪酶,脱脂,响应面分析,胶原蛋白
罗非鱼(Oreochromis mossambicus)是我国重要的淡水养殖品种,2013年全球罗非鱼年产量达300万吨,其中中国养殖总量155万吨,但罗非鱼加工产品形态较单一,主要是条冻和鱼片[1]。近年来,鱼丸类的鱼糜产品广受欢迎,鱼肉加工量骤增。在鱼糜及鱼糜产品加工特别是淡水鱼的加工过程中,采肉率通常只有25%~30%左右,而剩余的60%~70%的鱼体都成为副产品,包括鱼皮、鱼骨、鱼头和内脏等。目前,由于大多数水产加工企业的技术装备较差,缺乏配套的工程化技术,水产加工副产物没有得到充分的增值加工,利用程度较低。鱼皮中富含胶原蛋白,从鱼皮中提取胶原蛋白可大幅提高鱼加工废弃物的经济价值,并可减少环境污染[2-3]。
胶原蛋白在食品、医药、美容行业应用广泛[4],但其提取工艺复杂且耗时长,在一定程度上增加了产品成本,限制了胶原蛋白的应用。鱼较之于一些哺乳动物如猪、牛等生长周期更短,因此鱼皮原料丰富,鱼皮胶原蛋白的提取成本更低。另一方面,鱼皮胶原蛋白也可避免某些宗教人群对于特定动物产品的排斥。从鱼皮提取胶原蛋白的过程中,脱脂是一道关键工序,脱脂过程会直接影响胶原蛋白的提取效果和产品品质。传统胶原蛋白提取工艺中,脱脂过程耗时较长。Nagai等[5]采用正丁醇浸泡方法对鱼皮进行脱脂,耗时48 h左右,期间需要多次更换浸泡液。张强等[6]使用正己烷对鲢鱼鱼皮进行脱脂,耗时6 h,需2次更换浸泡液。杨萌萌等[7]在提取牛筋胶原蛋白时,使用10%丁酮脱脂需18 h。目前,对鱼皮胶原蛋白提取的研究主要集中在提取方法的改进方面,以增加绝对提取率,而对脱脂工艺的研究较少且大多采用有机溶剂浸提法。与化学方法相比,酶反应方法效率更高且更安全,许晓红等[8]采用脂肪酶分别对猪皮、牛皮、山羊皮和绵羊皮等原皮及其脱灰裸皮进行脱脂,发现脂肪酶对不同组织结构和不同油脂含量的动物原料皮的脱脂效果有较大差异,猪皮的脂肪酶脱脂效果良好,脱脂率可达67%。本文利用脂肪酶对罗非鱼鱼皮进行脱脂处理,以脱脂率为指标,优化罗非鱼皮酶法脱脂的工艺条件。
1 材料与方法
1.1 材料与设备
罗非鱼(Oreochromis mossambicus)鱼皮 广东省明基水产品有限公司提供,-20℃保存;羟脯氨酸标准品 Sigma公司;猪胰脂肪酶(3000 U/g) 上海金穗生物科技有限公司;乳酸、正己烷、氢氧化钠、醋酸钠、氯化钠、异丙醇、无水乙醚等化学试剂 均为分析纯。
CT15RT台式高速冷冻离心机 上海天美生化仪器设备工程有限公司;HH数显恒温水浴锅 江苏金坛市金城国胜实验仪器厂;DHG-9123J精密恒温鼓风干燥箱 上海三发科学仪器有限公司;722E型可见分光光度计 上海光谱仪器有限公司;PHS-3C精密pH计 上海大普仪器有限公司;FD-1B-50冷冻干燥机 北京博医康实验仪器有限公司。
1.2 实验方法
1.2.1 罗非鱼鱼皮基本成分的测定 水分:参考GB 5009.3-2010《食品中水分的测定》;灰分:参考GB 5009.4-2010《食品中灰分的测定》;蛋白质:参考GB 5009.5-2010《食品中蛋白质的测定》;脂肪:参考GB/ T 5009.6-2003《食品中脂肪的测定》。
1.2.2 罗非鱼鱼皮的预处理 4℃条件下,鱼皮解冻、刮鳞、去掉鱼皮内侧残留肉质、大片脂质后,用去离子水洗净,沥干后将鱼皮剪成碎片(5 mm×5 mm),用滤纸吸去表面水分,放入保鲜袋中于-20℃冻藏备用。
1.2.3 罗非鱼皮酶法脱脂单因素实验 冷冻罗非鱼皮解冻后,用滤纸吸干表面水分。取适量鱼皮在特定温度、pH、反应时间、加酶量的反应液中脱脂。脱脂后,用去离子水反复洗涤鱼皮,置于105℃烘箱内干燥3 h,称重。
参考脂肪酶的最适反应条件,分别考察反应液pH、反应温度、反应时间和加酶量对罗非鱼皮脱脂率的影响。各组实验条件分别为:考察温度对罗非鱼皮酶法脱脂率影响时,反应时间设定60 min,加酶量0.5%,pH9,测定反应温度分别为29、34、39、44、49℃时罗非鱼皮的脱脂率;考察pH对罗非鱼皮酶法脱脂率影响时,反应时间设定60 min,加酶量0.5%,反应温度为39℃,测定pH分别为7、8、9、10、11时罗非鱼皮的脱脂率;考察加酶量对罗非鱼皮酶法脱脂率影响时,反应时间设定60 min,反应温度为39℃,pH9,测定加酶量分别为0.3%、0.4%、0.5%、0.6%、0.7%时罗非鱼皮的脱脂率;考察反应时间对罗非鱼皮酶法脱脂率影响时,反应温度设定39℃,加酶量0.5%,pH9,测定反应时间分别为40、55、70、85、100 min时罗非鱼皮的脱脂率。
1.2.4 脱脂率的计算 采用索氏抽提法,测定脱脂前鱼皮脂肪含量并通过鱼皮脱脂前后质量变化计算出脂肪脱除量,按式(1)计算脱脂率。
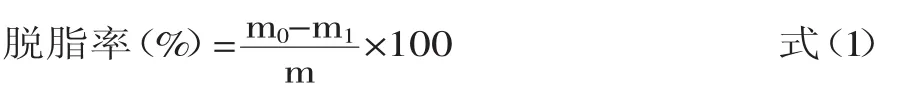
其中:m0为脱脂前罗非鱼皮质量(g);m1脱脂后罗非鱼皮质量(g);m为脱脂前罗非鱼皮中脂肪含量(g)。
1.2.5 罗非鱼皮酶法脱脂工艺条件的响应面优化 采用方差分析对4组单因素水平进行筛选,最终选取脱脂温度、脱脂时间和加酶量为主要考察因素。按Box-Benhnken中心组合实验设计原理设计3因素3水平响应面实验,以脱脂率为响应值,确定罗非鱼皮酶法脱脂工艺条件。实验因素与水平设计见表1。

表1 Box-Benhnken中心组合实验因素水平编码表Table1 Factors and levels of Box-Benhnken experimental design
1.3 数据处理
数据用均值±标准差表示(x±s),采用Microsoft Excel 2010及Design Expert 8.0.6软件进行分析。
2 结果与分析
2.1 罗非鱼鱼皮的基本组成成分
表2中列出了罗非鱼鱼皮的基本化学成分,从表2中可以看出,罗非鱼鱼皮中水分含量为64.02%,干物质是罗非鱼皮中除去水分后的物质总量,为35.98%,干物质中主要为蛋白质,约占干物质总量的94.88%。

表2 罗非鱼鱼皮基本化学组成(以湿基计)Table2 Basic chemical composition of tilapia skin(wet basic)
2.2 罗非鱼鱼皮酶法脱脂单因素实验结果及分析

图1 温度对罗非鱼皮脱脂率的影响Fig.1 Effect of temperature on defatted rate of tilapia skin
2.2.1 温度对罗非鱼皮脱脂率的影响 温度对罗非鱼皮脱脂率的影响见图1,单因素方差分析结果表明,在温度29~49℃范围内,温度对罗非鱼皮脱脂率有显著影响(p<0.05)。从图1中可以看出,随着温度的升高,鱼皮脱脂率逐渐升高,在44℃时,脱脂率达到最大值。当温度超过44℃后,继续升高温度,脱脂率缓慢降低。考虑到温度过高易使胶原蛋白发生变性,影响提取效果,且温度也会在一定程度上影响生产成本,同时从实验结果来看,在39℃时鱼皮脱脂率达到64%,与44℃时的脱脂率(65.20%)仅差1.20%,统计学上无显著差异,所以选定39℃为响应面实验中温度的中心水平。
2.2.2 pH对罗非鱼皮脱脂率的影响 pH对罗非鱼皮脱脂率的影响见图2,单因素方差分析结果表明pH对罗非鱼皮脱脂率的影响不显著(p>0.05)。从图2中可以看出,随着pH的升高,鱼皮脱脂率略有升高,并在pH9时,鱼皮脱脂率达到最大值。当pH超过9后,继续升高pH,脱脂率缓慢下降。原因是酶的活性基团的解离受pH影响,过高或过低的pH都会影响酶分子活性中心的构象[9],从而影响酶的催化效果。由于pH对鱼皮脱脂率的影响不显著,因此在后续实验中将脱脂条件设定为pH9,此因素不计入响应面实验进行研究。
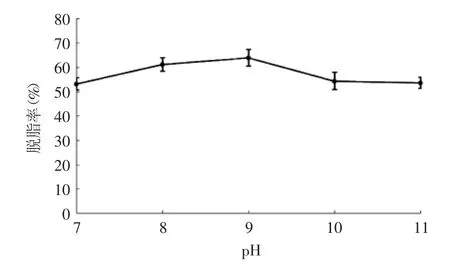
图2 pH对罗非鱼皮脱脂率的影响Fig.2 Effect of pH on defatted rate of tilapia skin
2.2.3 加酶量对罗非鱼皮脱脂率的影响 加酶量对罗非鱼皮脱脂率的影响见图3,单因素方差分析的结果表明,在加酶量0.3%~0.6%范围内,加酶量对罗非鱼皮脱脂率有显著影响(p<0.05)。从图3中可以看出,当加酶量低于0.5%时,随着加酶量的升高,鱼皮脱脂率逐渐升高,并在加酶量等于0.5%时,脱脂率达到最大值。加酶量高于0.5%后继续添加,脱脂率缓慢下降并趋于稳定值。所以选定0.5%为响应面实验中加酶量的中心水平。

图3 加酶量对罗非鱼皮脱脂率的影响Fig.3 Effect of enzyme dosage on defatted rate of tilapia skin
2.2.4 反应时间对罗非鱼皮脱脂率的影响 反应时间对罗非鱼皮脱脂率的影响见图4,单因素方差分析的结果表明,在反应时间40~70 min范围内,反应时间对罗非鱼皮脱脂率有显著影响(p<0.05)。从图4中可以看出,随着反应时间的延长,鱼皮脱脂率逐渐升高,并在反应时间等于55 min时,脱脂率达到最大值。继续延长反应时间,脱脂率缓慢下降。所以选定55 min为响应面实验中脱脂时间的中心水平。
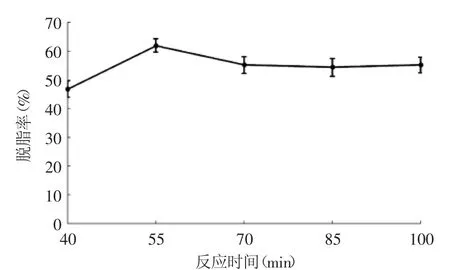
图4 反应时间对罗非鱼皮脱脂率的影响Fig.4 Effect of time on defatted rate of tilapia skin
2.3 罗非鱼皮酶法脱脂最佳工艺条件的确定
2.3.1 响应面分析实验结果 对酶法罗非鱼皮脱脂工艺进行响应面优化,实验结果见表3。通过数据分析软件Expert Design 8.0.6对表3中响应值与各因素进行回归拟合后,得到脱脂率(Y)对温度(X1)、时间(X2)和加酶量(X3)的二次多项回归方程为:
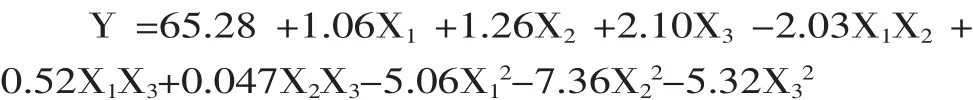

表3 响应面分析实验结果Table3 The results of response surface analysis
回归模型各项系数的显著性检验结果和方程的方差分析结果见表4。由表4可以看出,模型极显著(p<0.0001),说明该模型成立,本实验方法可靠[10]。失拟项不显著(p=0.0928>0.05),总决定系数R2=0.9984,表明回归方程无失拟因素存在,回归方程拟合度较好,在实验范围内可以用来解释和预测实验结果。方程一次项和二次项的影响均极显著;交互作用项中,X2(时间)和X3(加酶量)(p=0.24548>0.05)交互作用不显著,X1(温度)和X2(时间)(p<0.0001)、X1(温度)和X3(加酶量)(p<0.0001)交互作用极显著。由此可知,各因素对鱼皮脱脂率的影响不是简单的线性关系。

表4 方差分析表Table4 Analysis of variance
2.3.2 响应面图分析 响应面图能直观地反映各因素和及其之间的交互作用对响应值的影响[10-11]。根据上述二次多项回归方程所做的响应面图如图5~图7所示。从图5、图7中可以看出,随着脱脂时间的延长,鱼皮脱脂率呈现先升高后缓慢降低的现象,反应温度对脱脂率的影响也表现出类似的效果(见图5、图6)。溶液中的反应受限于溶质间的传质速率,而传质速率是随时间变化的[12]。反应初期,时间持续增加,反应传质速率增加,脱脂率升高;时间达到某一定值(约为55 min)后,鱼皮脱脂反应产生的大量游离脂肪酸和甘油酯重新合成大分子脂质[9,13],体系中总脂质含量回升,表现为脱脂率下降。酶反应需要在一定的温度和pH条件下进行。本实验中使用的脂肪酶为蛋白酶,当温度逐渐升高至酶最适温度过程中,鱼皮脱脂率逐渐升高;当温度继续升高时,高温使酶发生不同程度的变性,降低酶对脱脂反应的催化效果,鱼皮脱脂率下降。加酶量对鱼皮脱脂率的影响类似于反应时间和反应温度(见图6、图7)。碱性脂肪酶催化油脂水解的反应是可逆的,逆向反应时发生了酯交换,酯交换使游离脂肪酸重新合成大分子的甘油酯[9,13]。新甘油酯增加了反应体系的脂含量,表现为脱脂率缓慢下降的现象。
从图5~图7中可以看出,脱脂温度与加酶量、脱脂时间与脱脂温度交互作用图为椭圆形,交互作用项系数显著(p<0.01)。鱼皮脱脂率与脱脂时间、脱脂温度、加酶量交互作用较为复杂,随着各因素的水平值增加,脱脂率会出现一个峰值;当继续升高各水平值时,脱脂率又会随之下降。每个因素及其之间的交互作用对脱脂率的影响也存在差异。脱脂温度、加酶量、脱脂时间、脱脂温度与加酶量、脱脂时间与脱脂温度对鱼皮脱脂率的影响极其显著。由F值可知,实验因素对脱脂率影响的主次顺序为:X3>X2>X1,即加酶量>时间>温度。

图5 反应时间与反应温度对脱脂率的影响Fig.5 The effects of reaction time and temperature on defatted rate
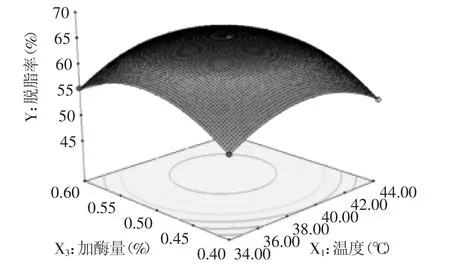
图6 反应温度与加酶量对脱脂率的影响Fig.6 The effects of reaction temperature and enzyme dosage on defatted rate
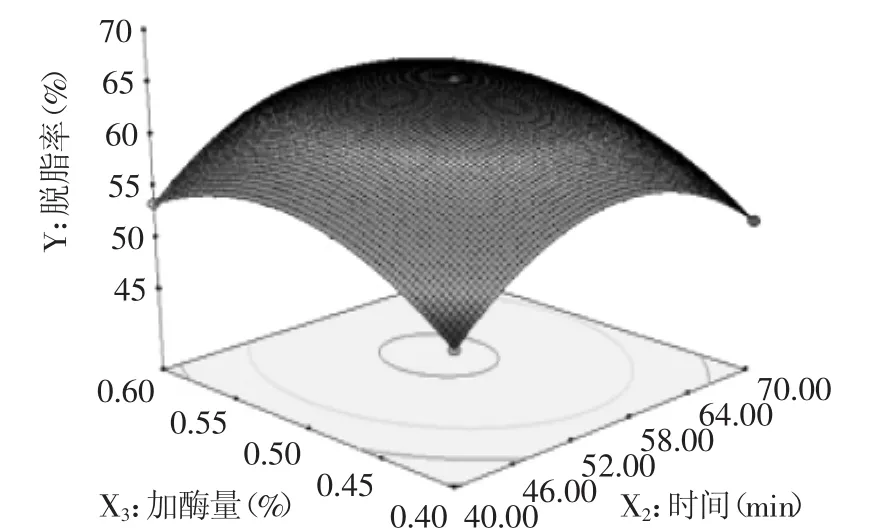
图7 反应时间与加酶量对脱脂率的影响Fig.7 The effects of reaction time and enzyme dosage on defatted rate
2.4 罗非鱼皮酶法脱脂工艺条件的确定和验证实验
结合回归模型的数学分析可知,罗非鱼鱼皮酶法脱脂的最佳工艺为:脱脂时间56.08 min、加酶量0.52%、脱脂温度39.51℃,在此条件下预测鱼皮脱脂率为65.58%。为了验证结论的可靠性,按照最佳脱脂条件进行验证实验。考虑到实验操作的可行性,将最佳脱脂条件修正为脱脂时间56 min、加酶量0.5%、脱脂温度39℃(因胶原蛋白在高温条件下易发生变性,将最佳脱脂工艺中鱼皮脱脂温度修正为稍低的温度),在此条件下测定的鱼皮脱脂率为63.71%,与理论预测值的误差为1.87%,说明采用响应面法优化得到的脱脂条件可靠。
李佳[14]在制备罗非鱼鱼皮明胶的过程中,使用脂肪酶对罗非鱼皮脱脂,采用正交实验法优化得到最佳脱脂工艺为:pH9,脱脂时间3 h,脱脂温度40℃,加酶量2%,脱脂率为67.5%。本实验无论是原料还是采用的方法都与李佳的研究类似,从实验结果比较来看,与其得到的实验结果相比,本实验得到的酶法脱脂工艺条件加酶量更少,脱脂时间缩短2 h。但是,由于原料鱼皮的脂肪含量和脂肪酶的来源、特性等均会对脱脂过程造成影响,因此不能只单纯从优化得到的具体工艺条件进行比较,还需考虑其他因素的影响。
由于整个脱脂过程是一个酶反应,酶反应具有一定的特殊性,如反应的可逆性、酶与底物的比例是否合适等。通过实验及与李佳的研究结果比较来看,原料鱼皮的脂肪含量可能会对实验结果产生影响,这可能会对本实验结果的进一步应用产生一定的限制,因此,在后续的研究中,将重点考察不同脂肪含量的鱼皮原料以及酶与底物的比例对酶法脱脂效果的影响,为此方法在更广泛的领域中应用提供参考。
3 结论
利用脂肪酶对罗非鱼皮进行脱脂,通过单因素实验和响应面法分析,考察反应时间、温度、加酶量和pH对鱼皮脱脂率的影响,并对罗非鱼皮酶法脱脂的工艺条件进行优化,得到罗非鱼皮酶法脱脂的最佳工艺为:脱脂时间56 min、加酶量0.5%、脱脂温度39℃,pH9,在此条件下,鱼皮的脱脂率为63.71%。脂肪酶法脱脂工艺可大大缩短鱼皮脱脂处理的时间,较有机溶剂脱脂方法更安全。
经本实验脱脂处理的罗非鱼将用于鱼皮提取胶原蛋白,由于脂肪酶的使用(主要是处理温度和酶对鱼皮的作用两方面)可能会对鱼皮胶原蛋白的性质产生影响,因此,后续实验将进一步研究脂肪酶法脱脂工艺对提取胶原蛋白理化特性的影响,探讨鱼皮脂肪酶脱脂的方法在实际胶原蛋白生产中应用的可行性。
[1]农业部渔业局.中国渔业统计年鉴[M].北京:中国统计出版社,2013.
[2]陈胜军,李来好.罗非鱼加工产业相关情况[J].科学养鱼,2014(9):16-17.
[3]吴祖兴.现代食品生产[M].北京:中国农业大学出版社,2000:63.
[4]ETHERINGTON D J,SIMS T J.Detection and estimation of collagen[J].Journal of the Science of Food and Agriculture,1981,32(6):539-546.
[5]NAGAI T,ARAKI Y,SUZUKI N.Collagen of the skin of ocellate puffer fish(Takifugu rubripes)[J].Food Chemistry,2002,78(2):173-177.
[6]张强,王倩倩,陆剑锋,等.不同方法提取鲢鱼皮胶原蛋白的理化特性比较[J].现代食品科技,2014(5):104-110.
[7]杨萌萌,郭兆斌,余群力,等.超声波辅助法提取胶原蛋白工艺研究[J].甘肃农业大学学报,2013,48(3):121-126.
[8]许晓红,毛洪超,陈敏,等.不同原料皮脂肪酶脱脂效果比较[J].皮革科学与工程,2014,24(1):35-38.
[9]阚建全.食品化学[M].北京:中国农业大学出版社,2008:257-258,192.
[10]JUN L,CHI Z,OU R,et al.Optimization of microwave-assisted extraction of flavonoids from Cryptotaenia japonica Hassk using response surfacemethodology[J].Advance JournalofFood Science and Technology,2013,5(3):310-317.
[11]TANG B K,LEE Y J,LEE Y R,et al.Examination of 1-methylimidazoleseriesionicliquidsintheextractionofflavonoids from Chamaecyparis obtuse leaves using a response surface methodology[J].Journal of Chromatography B,2013,933:8-14.
[12]BARTLE K D,BODDINGTON T,CLIFFORD A A,et al.Supercriticalfluid extraction and chromatography forthe determination of oligomers in poly(ethylene terephthalate)films [J].Analytical Chemistry,1991,63(20):2371-2377.
[13]安然.即食鱼皮胶冻加工工艺研究[D].福州:福建农林大学,2013.
[14]李佳.酶法制备罗非鱼鱼皮明胶的工艺研究[D].福州:福建农林大学,2011.
Optimization of enzymatic defatted conditions of tilapia skin by response surface methodology
JIANG Li,LU Jian-feng,LV Shun,JIANG Shao-tong,LIN Lin*
(College of Biotechnology and Food Engineering,Key Laboratory for Agriculture Products Processing of Anhui Province,Hefei University of Technology,Hefei 230009,China)
In this study,the tilapia skin was as the raw material,and the lipase was used to remove fat from tilapia skin.On the basis of single-factor experiments,Box-Behnken central composite design combined with response surface methodology(RSM)was utilized to optimize the defatted conditions of tilapia skin.Three variables(defatted temperature,defatted time and enzyme dosage)were involved in this experiment,and the defatted rate was as the measure indicator.The results showed that the optimum defatted conditions for tilapia skin were pH9,enzyme dosage 0.5%,temperature 39℃,and defatted time 56 min.The defatted rate at this condition could reach 63.71%.
tilapia skin;lipase;defatted;response surface analysis;collagen
TS254.9
A
1002-0306(2016)06-0211-05
10.13386/j.issn1002-0306.2016.06.035
2015-07-02
蒋丽(1990-),女,硕士研究生,研究方向:水产品加工副产物综合利用,E-mail:904582736@qq.com。
林琳(1978-),女,博士,副教授,研究方向:水产活性物质及功能特性,E-mail:linlin7805@163.com。
安徽省“115”产业创新团队项目(2012d5t146);广东省部产学研结合重点项目(2012B091000121)。
