酶法制备黑小麦麸皮阿魏酰低聚木糖的工艺优化
2016-09-16孙元琳陈树俊李云龙崔晓瑞山西大学生命科学学院山西太原00006运城学院生命科学系山西运城044000山西省农科院农产品综合利用研究所山西太原000
仪 鑫,孙元琳,陈树俊,陕 方,李云龙,崔晓瑞(.山西大学生命科学学院,山西太原00006;.运城学院生命科学系,山西运城044000;.山西省农科院农产品综合利用研究所,山西太原000)
酶法制备黑小麦麸皮阿魏酰低聚木糖的工艺优化
仪 鑫1,孙元琳2,*,陈树俊1,陕 方3,李云龙3,崔晓瑞2
(1.山西大学生命科学学院,山西太原030006;2.运城学院生命科学系,山西运城044000;3.山西省农科院农产品综合利用研究所,山西太原030031)
研究黑小麦麸皮阿魏酰低聚木糖(FOs)的酶法制备工艺。用木聚糖酶酶解水不溶性膳食纤维制备FOs,通过HPLC分析方法,并结合双波长法和薄层层析法对FOs的含量和组成进行分析。在加酶量、反应时间、pH、温度4个单因素实验基础上,采用四因素三水平的中心旋转设计,以FOs浓度为响应值,使用响应面分析法对FOs的制备工艺进行优化,得到最佳工艺参数为:加酶量15.5 mg/L,酶解时间22 h,温度46℃,pH4.8,在此条件下,FOs的浓度为0.4913 mmol/L。薄层层析和HPLC分析结果表明,酶解液中的低聚糖含有结合态阿魏酸,是阿魏酰低聚木糖。
黑小麦麸皮,阿魏酰低聚木糖,木聚糖酶,工艺优化
阿魏酰低聚木糖以低聚木糖为主链,阿拉伯糖为侧链,并由阿魏酸通过阿拉伯糖侧链酯键连接而成。低聚木糖是一种非消化性低聚糖,可以一直到达大肠,增加人体肠道内双歧杆菌的数量,是一种有效的双歧因子;阿魏酸具有抗氧化、降血脂、抗血栓、抗菌消炎等功能[1],也是一种有效的抗氧化剂,其衍生物糖酯具有更强的抗氧化活性[2]。阿魏酰低聚木糖兼具阿魏酸和低聚木糖这两种物质的特性,且因其结构中特殊的酯键,使阿魏酸能溶于水,具有亲水性、亲脂性和非离子性,渗透性强,容易进入人体线粒体发挥其抗氧化作用[3]。研究表明[4],阿魏酰低聚木糖有着比阿魏酸更强的抗氧化性,在DPPH和脂质过氧化体系中,均具有较强的清除能力;除此之外,可抑制蛋白非酶糖基化反应的发生,阻止产物的生成,保护人体红细胞,减少人体疾病的发生,增强人体的免疫力。有学者[5]在模拟的人体肠道环境中比较了阿魏酰低聚木糖和低聚木糖对双歧杆菌的增殖效果,结果表明,阿魏酰低聚木糖对双歧杆菌的增殖作用显著高于低聚木糖。因而,阿魏酰低聚木糖具有增殖双歧杆菌、改善肠道微生物菌群的作用。
黑小麦麸皮是黑小麦加工的主要副产物,其膳食纤维含量丰富,主要为戊聚糖、β-葡聚糖和纤维素[6]。黑小麦麸皮中含有丰富的酚酸类物质,如阿魏酸、芥子酸、香草酸等,其中阿魏酸的含量高于普通小麦麸皮中阿魏酸的含量[7]。目前,阿魏酰低聚木糖多通过酶解不溶性膳食纤维来制备,Wang Jing等[8]从小麦麸皮中通过酶法制备阿魏酰低聚木糖,潘海晓等[9]采用酶法酶解玉米麸皮制备阿魏酰低聚木糖,盛倩倩等[10]采用纤维素酶解法从米糠中制备阿魏酰低聚木糖。关于研究黑小麦阿魏酰低聚木糖的酶法制备鲜有报道,如何充分利用黑小麦麸皮,通过酶解的方法使其释放出生理活性物质—阿魏酰低聚木糖是本实验的研究重点。本实验以黑小麦麸皮为原料,采用木聚糖酶解麸皮膳食纤维获得阿魏酰低聚木糖(FOs)。采用响应面分析法对酶解工艺参数进行优化,以充分提取麸皮的生物活性物质,为黑小麦特色谷物资源的有效增值和综合利用提供理论依据。
1 材料与方法
1.1 材料与仪器
黑小麦 由山西省农科院棉花研究所提供;木聚糖酶(EC 3.2.1.8) 酶活≥60000 U/mg,德国Ruibio公司;标准木糖、阿拉伯糖 纯度≥99.0%,美国Sigma公司;标准阿魏酸 纯度≥98.0%,德国Ruibio公司;标准低聚木糖(DP2~7) 纯度≥95%,山东龙力生物科技有限公司;MOPS 吉泰生物科技有限公司;α-淀粉酶 酶活≥4 U/mg,酷尔生物科技有限公司;糖化酶(酶活≥100 U/mg)、中性蛋白酶(酶活≥60 U/mg)
北京奥博星生物科技有限公司;乙酸乙酯、甲醇、氨水、苯胺、二苯胺 均为分析纯。
LC1200型高效液相色谱仪、Cary5000紫外-可见-近红外分光光度计 美国Agilent公司。
1.2 实验方法
1.2.1 黑小麦麸皮不溶性膳食纤维的制备 将黑小麦麸皮粉碎,称取800 g麸皮,在121℃下进行高压蒸汽处理45 min。将处理过的黑小麦麸皮悬浮于6000 mL水中,加入耐温α-淀粉酶、糖化酶、中性蛋白酶以去除淀粉和蛋白质,高温灭酶后,离心(3000 r/min,15 min),弃去上清液,沉淀依次用热蒸馏水、无水乙醇洗涤,离心,将沉淀真空干燥,得到黑小麦麸皮不溶性膳食纤维[11]。
1.2.2 黑小麦阿魏酰低聚木糖的酶法制备工艺 称取5 g不溶性膳食纤维置于250 mL具塞锥形瓶中,加入100 mL醋酸-醋酸钠缓冲液,添加木聚糖酶液,在不同pH、温度条件下酶解不同时间。酶解结束后,100℃灭酶10 min,离心,取上清液检测FOs含量。
1.2.3 单因素实验 以木聚糖酶添加量(5.0、7.5、10、12.5、15、17.5、20.0、22.5 mg/L)、酶解时间(6、12、18、24、30、36 h)、pH(4.0、4.5、5.0、5.5、6.0)、酶解温度(35、40、45、50、55℃)等4个因素做单因素实验,每组实验平行进行3次,确定各因素适宜的范围。
1.2.4 响应面实验设计 在单因素实验基础上,确定中心组合实验设计的自变量及水平。根据Box-Behnken中心组合实验设计原理,以阿魏酰低聚木糖的浓度为指标,选取木聚糖酶添加量、酶解时间、温度、pH四个因素,设计四因素三水平响应面分析实验,用响应面分析法对数据进行回归分析及显著性检验,来确定最佳工艺参数。
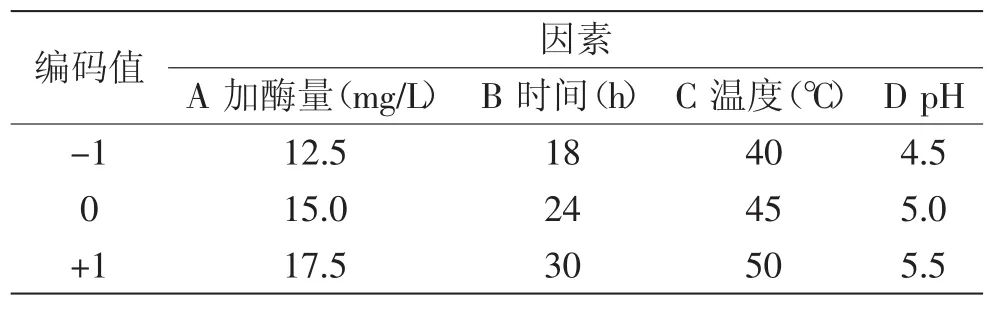
表1 因素水平编码表Table1 The coding table of factors and levels
1.2.5 阿魏酰低聚木糖的含量测定 采用双波长法测定FOs的浓度[12]。在MOPS缓冲液中(100 mmol/L,pH6.0)中进行检测,FOs浓度按如下公式计算。其中,ε286=14176 L·mol-1·cm-1,ε325=10350 L·mol-1·cm-1,ε′286=12465 L·mol-1·cm-1,ε′325=19345 L·mol-1·cm-1。
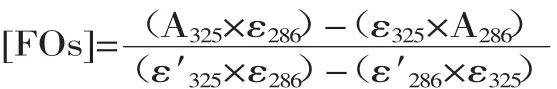
1.2.6 FOs组分分析 采用薄层层析法。展开剂:V乙酸乙酯∶V甲醇∶V蒸馏水∶V氨水=5∶9∶1∶1.5。显色剂:苯胺-二苯胺-磷酸[13]。酶解液经薄层层析后与标准品进行比对,对其进行分析。
1.2.7 酶解液中阿魏酸的HPLC检测 用乙酸乙酯萃取酶解液,重复萃取3次,合并并挥干其中的有机溶剂,用1 mL甲醇复溶,为酶解液中的游离态阿魏酸。萃取后的水相用2 mol/L NaOH酯解后,用6 mol/L HCl调节pH至2.0,经萃取复溶后得到结合态阿魏酸[1]。将游离态和结合态阿魏酸样品进行HPLC测定。
HPLC条件:C18柱(4.6 mm×150 mm,5 μm);流动相为甲醇-2%乙酸;梯度洗脱:0~10 min 0.5%→5.0%,10~20 min 5.0%→20.0%,20~40 min 20.0%→50.0%,40~48 min 50.0%→80.0%,48~55 min 80.0%→0.5%;柱温为室温;流速1.0 mL/min;检测波长320 nm;进样量20 μL,与标准品阿魏酸峰保留时间进行对比,对酶解液中是否存在阿魏酸进行鉴定。
1.3 数据统计分析方法
对实验所得数据利用Excel软件进行处理,分别计算平均值及标准差,通过Origin 7.5软件进行绘图,得到各因素对FOs浓度影响的折线误差图。
2 结果与分析
2.1 黑小麦麸皮不溶性膳食纤维的制备
黑小麦麸皮经121℃高压蒸汽处理使其内源性酶失活,经耐温α-淀粉酶、糖化酶、中性蛋白酶处理,去除麸皮中的淀粉和蛋白质,制得416.12 g不溶性膳食纤维,得率为52%。
2.2 酶解麸皮制备阿魏酰低聚木糖的单因素实验
2.2.1 木聚糖酶添加量对FOs浓度的影响 木聚糖酶添加量对酶解液FOs浓度的影响结果如图1所示。由图1可知,随着木聚糖酶添加量的增加,FOs浓度变化趋势是先增加后趋于平缓。这是因为底物浓度一定,在相同的时间内,随着酶量的增加,酶解效率提高,从水不溶性膳食纤维中释放的FOs增多,使FOs浓度升高;当底物中大部分FOs被释放出来后,即使酶量继续增加,FOs浓度先上升后下降。结果表明,木聚糖酶添加量大于12.5 mg/L,FOs浓度上升很快,当酶添加量达到17.5 mg/L时,FOs浓度较高,但从此时酶解液的薄层层析结果来看(如图2),酶解液中聚合度为3~5的FOs含量开始减少;当木聚糖酶添加量达到20 mg/L时,薄层层析结果显示,酶解液中聚合度为3~5的FOs明显减少。而木聚糖酶添加量为12.5 mg/L时,酶解液中FOs的浓度虽然没有酶添加量为20 mg/L酶解液中FOs浓度高,但聚合度为3~5的FOs含量显然比20 mg/L的酶解液中FOs含量多。结合FOs浓度变化及酶解液中低聚糖组成的变化,后续响应面实验木聚糖酶添加量确定为12.5、15.0、17.5 mg/L三个水平。
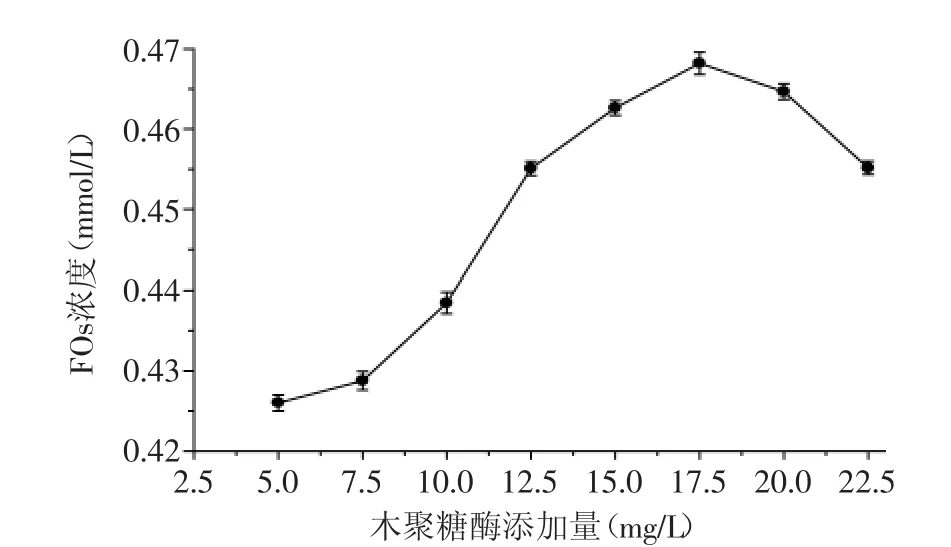
图1 木聚糖酶添加量对FOs浓度的影响Fig.1 Influence of xylanase amount on the concentration of FOs
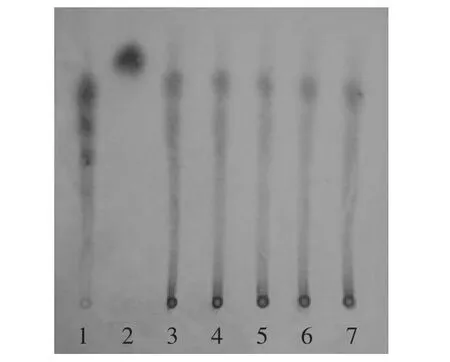
图2 不同木聚糖酶添加量酶解液的薄层层析Fig.2 TLC of hydrolyzate of different xylanase amount
2.2.2 酶解时间对FOs浓度的影响 酶解时间对酶解液FOs浓度的影响结果见图3。由图3可知,随着酶解时间的延长,FOs浓度逐渐增大,在24 h时,FOs的浓度达到最高值0.434 mmol/L,此后随着时间的延长,FOs浓度逐渐减小。这可能是因为在酸性环境下,随着酶解时间的延长,原来的酶解产物FOs的阿魏酸基团被酸解游离出来从而生成低聚木糖,导致FOs浓度下降。结果表明,酶解时间在18~30 h时,FOs浓度较大。因此,后续响应面实验酶解时间确定为18、24、30 h三个水平。
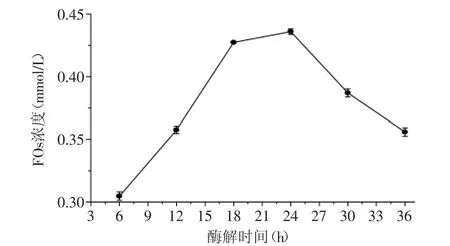
图3 酶解时间对FOs浓度的影响Fig.3 Influence of enzymolysis time on the concentration of FOs
2.2.3 pH对FOs浓度的影响 pH对酶解液FOs浓度的影响结果如图4所示。从图4中可以看出,FOs浓度的变化趋势是先增加后减小,在pH5.0时FOs的浓度达到最高值0.465 mmol/L,这是因为pH对木聚糖酶酶活的影响,在pH5.0的环境中酶活力较高。结果表明,pH在4.5~5.5时,酶活力较高,FOs浓度较高。因此,后续响应面实验pH确定为4.5、5.0、5.5三个水平。
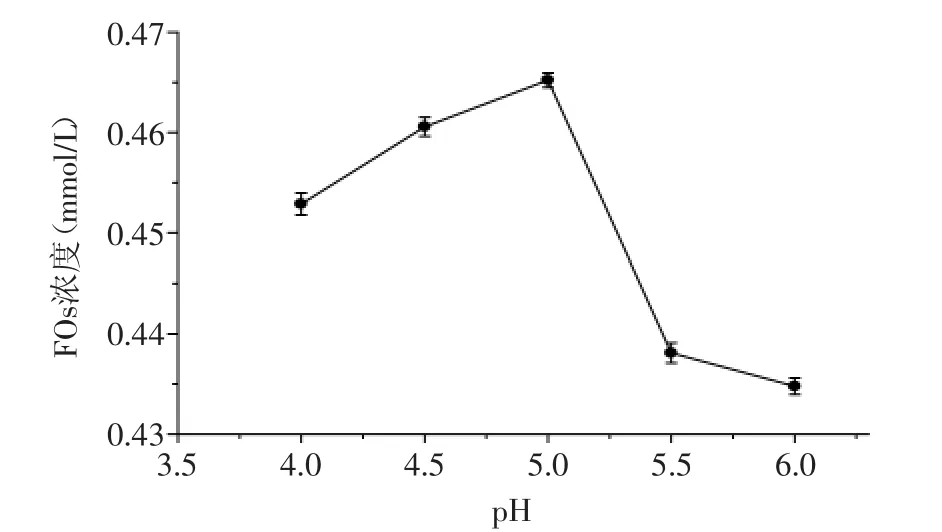
图4 pH对FOs浓度的影响Fig.4 Influence of pH value on the concentration of FOs
2.2.4 酶解温度对FOs浓度的影响 酶解温度对酶解液FOs浓度的影响结果如图5所示,随温度的升高,FOs浓度的变化趋势是先增大后减小,在45℃时达到最大值0.485 mmol/L。温度对FOs浓度的影响主要因为对酶活性的影响,即在35~45℃内,酶的活力随温度的升高而升高,温度升高加速了反应体系中酶分子与底物的碰撞机会;温度超过45℃时,酶的构象和参与酶促反应的功能团发生了变化,酶活力下降,导致酶解液中FOs浓度降低。实验结果表明,酶解温度在40~50℃时,酶活力较高,FOs浓度较大。因此,后续响应面实验酶解温度确定为40、45、50℃三个水平。
2.3 响应面分析
2.3.1 多元二次响应面回归模型的建立 实验设计方案与结果如表2所示。
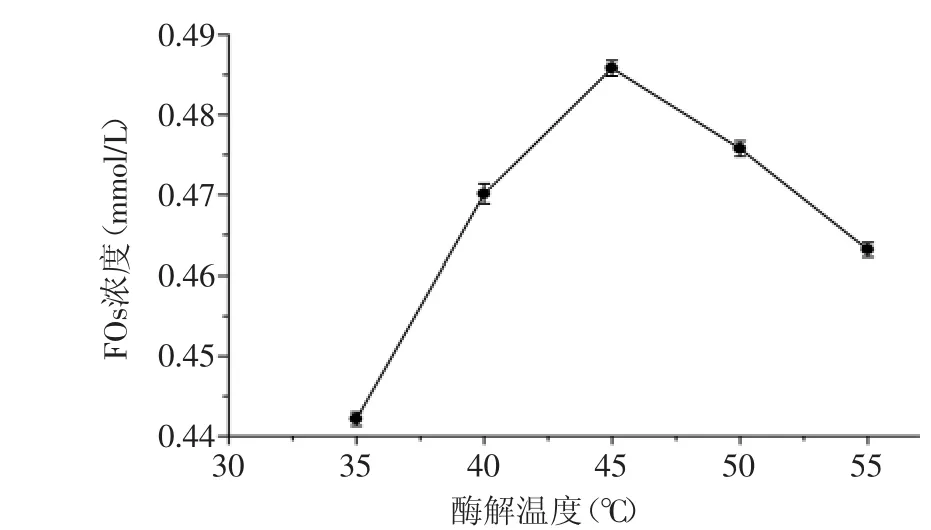
图5 温度对FOs浓度的影响Fig.5 Influence of temperature on the concentration of FOs
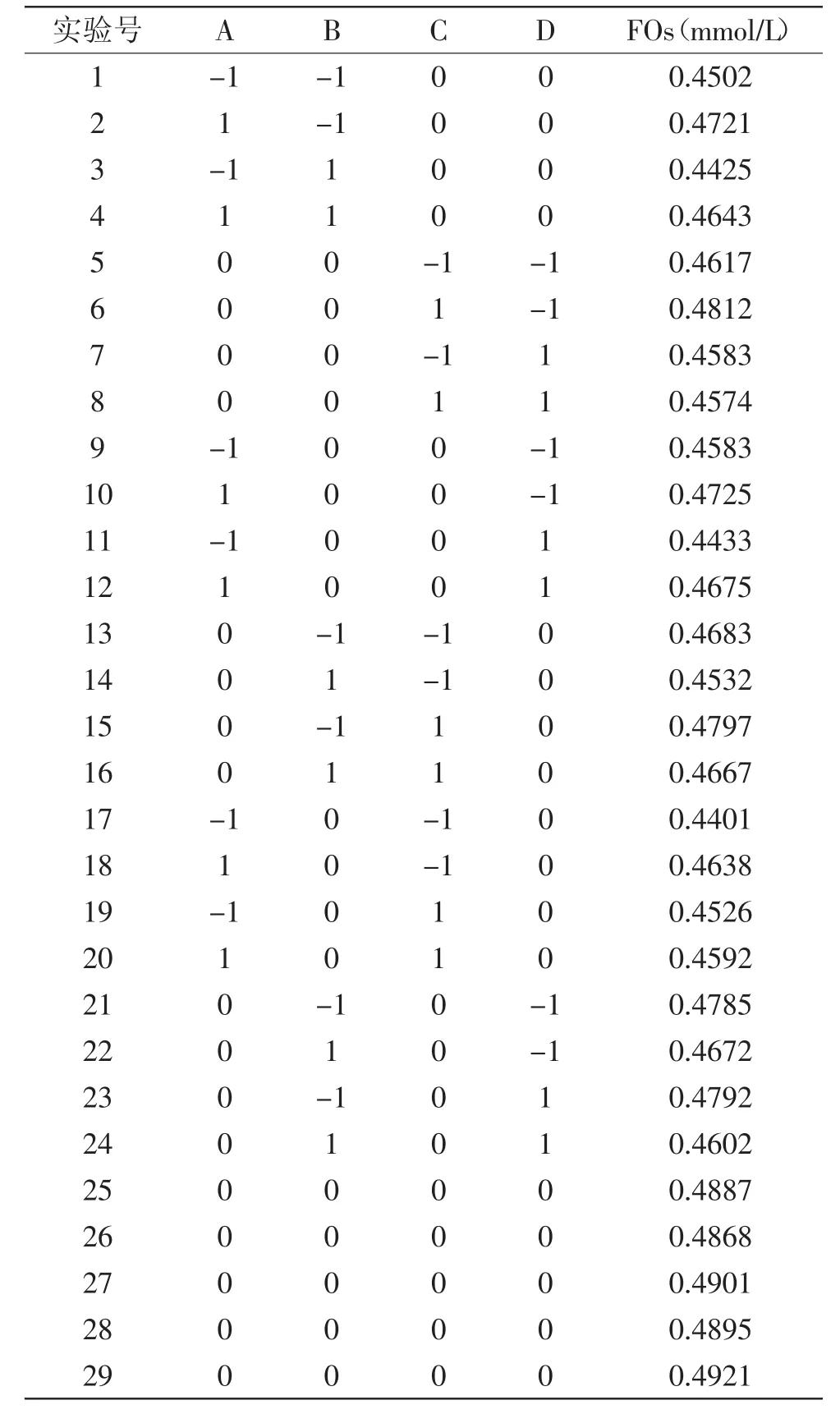
表2 响应面分析实验设计与结果Table2 The design and results of response surface experiments
2.3.2 方差分析与显著性检验 通过Design Expert数据分析软件进行回归分析,得到的方差分析结果如表3所示。由表3可知模型p值<0.0001,该二次方程模型达到极显著水平,决定系数R2为0.9688,说明响应值FOs的浓度有96.88%来源于所选的自变量,模型失拟项p值为0.0736>0.05,检验不显著,说明其他情况对模型干扰程度小,该响应面回归模型拟合度良好。在该模型中,对FOs浓度有显著影响的有A、B、C、 D、AC、CD、A2、B2、C2及D2,该模型信噪比为20.077,该值大于4则表明该模型可以用于预测,该模型拟合优度R2和调整R2分别为0.8307与0.9377,两者的差值在可以接受的范围内。对表2的实验数据进行二次多项式回归拟合,得到以加酶量、酶解时间、温度、pH为自变量的四元二次回归方程:

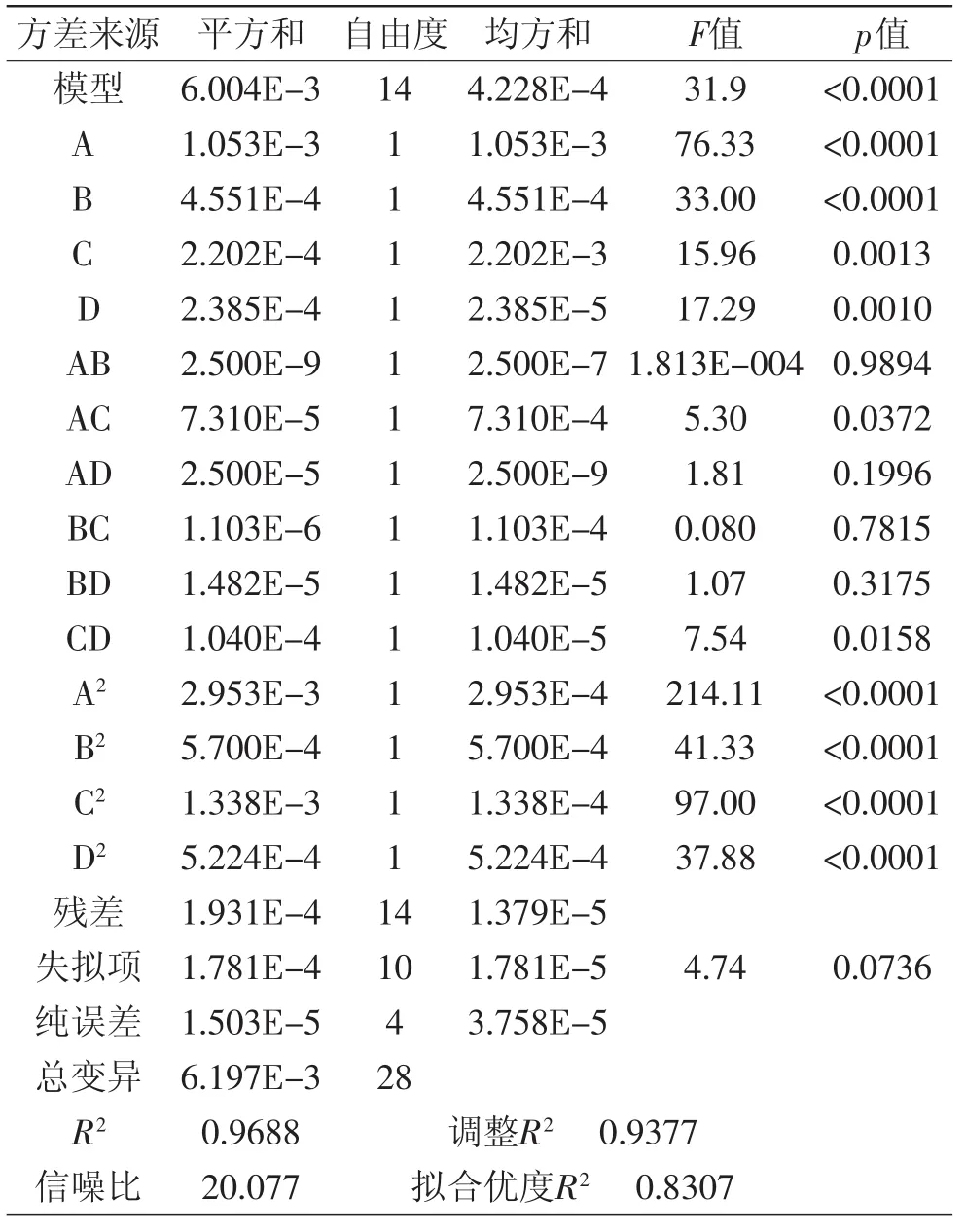
表3 方差分析结果Table3 The results of variance analysis
对实验数据进行多元回归拟合,得到二次回归方程的响应曲面图,见图6~图7。加酶量、酶解时间对FOs浓度的影响都极为显著,坡度较陡,说明影响较大,酶解温度和pH的曲线都比较平缓,说明影响较小。由图6可知,加酶量和温度交互作用显著,随着这两个因素的增大FOs的浓度有明显的增加。温度和pH交互作用次之,当温度在(-0.5~0.5)水平,pH在(-0.5~0.5)水平上,FOs浓度有较为明显的增加。
通过数据分析,酶法提取阿魏酰低聚木糖的最佳工艺条件为:加酶量15.48 mg/L,酶解时间22.20 h,温度45.78℃,pH4.77,在此条件下FOs的浓度为0.4921 mmol/L。考虑到可操作性,将条件调整为加酶量15.5 mg/L(930 U/mL),酶解时间22 h,温度46℃,pH4.8。进行验证实验得到FOs的浓度为0.4913 mmol/L,与理论值基本相符,进一步验证了回归模型的可靠性,因此响应面法对黑小麦麸皮阿魏酰低聚木糖的条件优化是可行的。
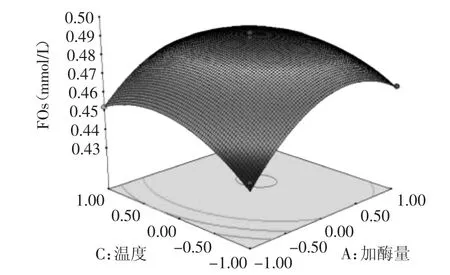
图6 加酶量和酶解温度对FOs浓度的影响Fig.6 Influence of xylanase amount and temperature on the concentration of FOs
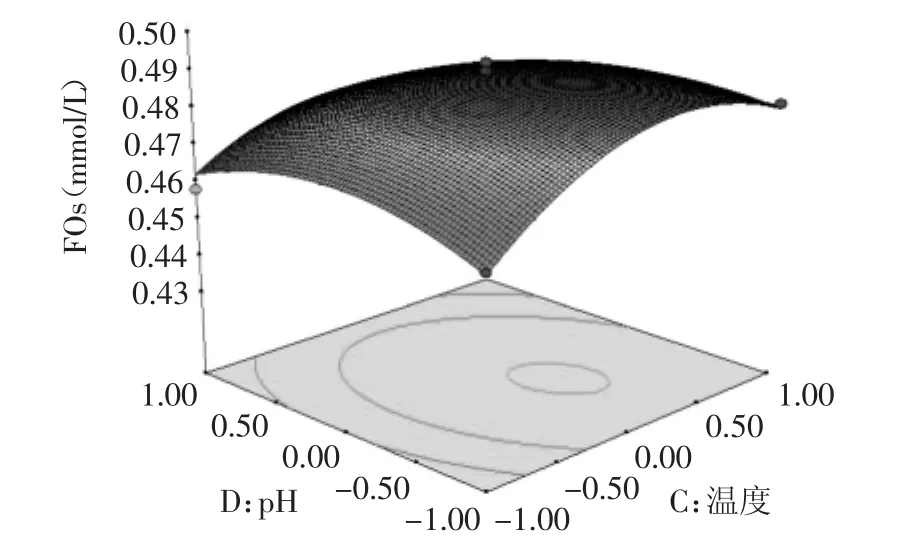
图7 酶解温度和pH值对FOs浓度的影响Fig.7 Influence of temperature and pH value on the concentration of FOs
2.4 薄层层析
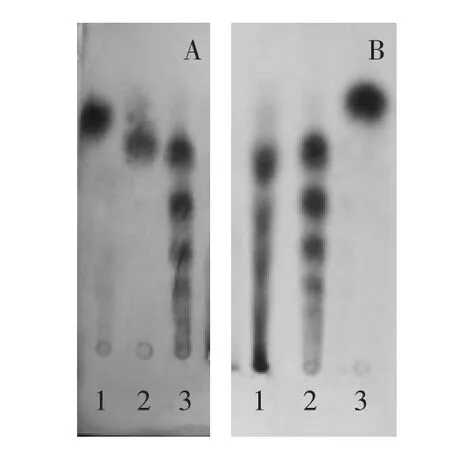
图8 酶解液FOs的薄层层析图Fig.8 TLC of FOs in enzymatic hydrolyzate
酶解液FOs的薄层层析结果如图8所示,图8A中阿拉伯糖的位置低于木糖的位置,说明带有阿拉伯糖基的低聚木糖薄层层析的迁移率会低于标准品低聚木糖。图8B薄层层析结果显示,酶解液中低聚木糖的迁移率都低于相应的标准品低聚木糖的位置,说明酶解液中的低聚木糖含有阿拉伯糖基,是阿拉伯低聚木糖;且酯合的阿魏酰基团会增加低聚木糖的相对分子质量,也会导致阿魏酰低聚木糖的迁移率低于标准品低聚木糖。
2.5 酶解液中阿魏酸的HPLC检测
采用HPLC对酶解液中的游离态和结合态阿魏酸进行检测,结果如图9所示。图9A为阿魏酸标准品的图谱,峰保留时间为28.796 min;与标准品阿魏酸的峰保留时间对比,图9B和图9C中均含有阿魏酸,分别为酶解液中游离态阿魏酸和结合态阿魏酸。比较图9B和图9C可以看出,酶解液中仅含有微量游离态阿魏酸,而大部分阿魏酸则是以结合态阿魏酸的形态存在,表明酶解液中的低聚糖是阿魏酰低聚木糖。
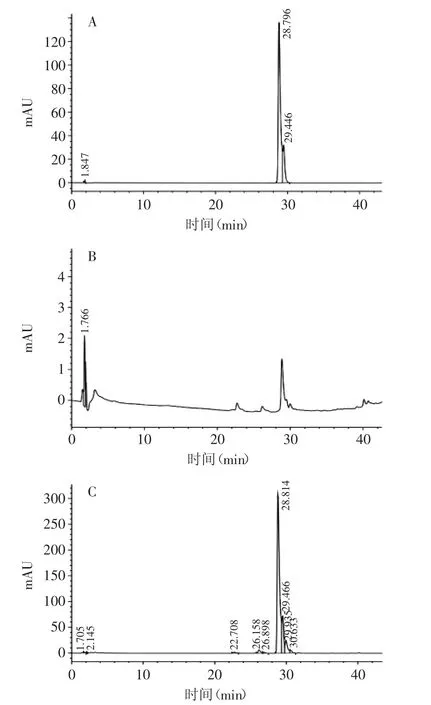
图9 酶解液中阿魏酸的HPLC图谱Fig.9 The HPLC chromatogram of ferulic acid in enzymatic hydrolyzate
3 结论
通过单因素实验及响应面分析,确定了木聚糖酶酶解黑小麦麸皮不溶性膳食纤维制备阿魏酰低聚木糖的最佳工艺参数为:加酶量15.5 mg/L(930 U/mL),反应时间22 h,pH4.8,温度46℃。在此优化工艺条件下,FOs的浓度为0.4913 mmol/L。薄层层析和HPLC分析结果表明,酶解液中的低聚糖含有结合态阿魏酸,是阿魏酰低聚木糖。
[1]王金,吴向阳,仰榴青.碱解小麦麦麸制备阿魏酸的工艺条件研究[J].食品科技,2008,33(4):107-109.
[2]Ishii.Structure and function of feruloylated polysaccharides [J].Plant Science,1997,127(2):111-127.
[3]曾彩凤.酶解玉米麸皮制备阿魏酰低聚糖及其抗氧化性质的研究[D].齐齐哈尔:齐齐哈尔大学,2012.
[4]Xiaoping Y,Jing W,Huiyuan Y.Feruloyl oligosaccharides stimulate growth of Bifidobacterium bifidum[J].Anaerobe,2005,11(4):225-229.
[5]解春艳,吴智艳,杜鹃,等.阿魏酰低聚糖研究进展[J].食品科学,2012,33(7):336-340.
[6]Gudipati Muralikrishna,M V S S T Subba Rao.Cereal noncellulosic polysaccharides structure and function relationship—an overview[J].Critical Reviews in Food Science and Nutrition,2007,47(6):599-610.
[7]孙元琳,崔璨,顾小红,等.黑小麦麸皮酚酸物质的定性分析与阿魏酸含量测定[J].中国粮油学报,2014,29(11):113-117.
[8]Wang Jing,Yuan Xiaoping,Sun Baoguo,et al.On-line separation and structure characterization of feruloylated oligosaccharides from wheat using HPLC-ESI-MNs[J].Food Chemistry,2009,115(4):1529-1541.
[9]潘海晓,刘海顺,王静,等.玉米麸皮中阿魏酰低聚糖的制备[J].北京工商大学学报:自然科学版,2011,29(3):33-37.
[10]盛倩倩,王文侠,宋丽春,等.米糠阿魏酰低聚糖的纤维素酶法提取工艺及其抗氧化活性[J].食品与发酵工业,2013,39 (12):197-203.
[11]Bunzel M,Ralph J,Marita JM,et al.Diferulates as structural components in soluble and insoluble cereal dietary fiber[J].J Sci Food Agric,2001,81(7):653-660.
[12]赵阳阳,欧仕益,林奇龄,等.低聚糖阿魏酸酯含量的快速测定方法[J].食品科学,2010,31(18):329-332.
[13]陈小娥,方旭波.壳寡聚糖的薄层层析[J].浙江海洋学院学报:自然科学版,2008,27(4):361-365.
Optimization of enzymatic preparation of feruloylated oligosaccharides from black-grained wheat
YI Xin1,SUN Yuan-lin2,*,CHEN Shu-jun1,SHAN Fang3,LI Yun-long3,CUI Xiao-rui2
(1.College of Life Sciences,Shanxi University,Taiyuan 030006,China;2.Department of Life Science,Yuncheng University,Yuncheng 044000,China;3.Institute of Farm Products Comprehensive Utilization,Shanxi Academy of Agricultural Sciences,Taiyuan 030031,China)
The enzymatic preparation of feruloylated oligosaccharides from black-grained wheat was studied.The insoluble dietary fiber was then hydrolyzed by xylanase to release feruloylated oligosaccharides(FOs).The content and composition of FOs were analyzed by HPLC,combining with dual-wavelength method and thin layer chromatography(TLC).Based on the single factor experiments of enzyme dosage,reaction time,pH,and temperature,with FOs concentration as response value,the process for enzymatic production of FOs was optimized by using response surface methodology employing a four-level,three-variable central composition rotatable design.The optimum reaction conditions were as follows:preparing for 22 h at 46℃,with enzyme concentration of 15.5 mg/L and pH4.8.Under the conditions,FOs content of the product was 0.4913 mmol/L.The results of TLC and HPLC showed that the oligosaccharides of hydrolyzate containing conjugated ferulic acid which was feruloylated oligosaccharides.
black-grained wheat;feruloylated oligosaccharides;xylanase;optimization
TS201.1
A
1002-0306(2016)06-0191-06
10.13386/j.issn1002-0306.2016.06.031
2015-07-23
仪鑫(1991-),女,硕士研究生,研究方向:农产品资源综合利用与开发,E-mail:15735172003@163.com。
孙元琳(1971-),女,教授,研究方向:农产品资源综合利用与开发,E-mail:sylwts@aliyun.com。
国家自然科学基金项目(31101244);山西省自然科学基金项目(2012011031-1);山西省高校优秀青年学术带头人支持计划资金;山西省教育改革项目(J2014105)。
