NADH氧化酶表达对干酪乳杆菌LC2W胞外多糖产量的影响
2016-09-16游春苹刘振民光明乳业研究院乳业生物技术国家重点实验室上海200436
李 楠,游春苹,刘振民(光明乳业研究院,乳业生物技术国家重点实验室,上海200436)
NADH氧化酶表达对干酪乳杆菌LC2W胞外多糖产量的影响
李 楠,游春苹,刘振民*
(光明乳业研究院,乳业生物技术国家重点实验室,上海200436)
为了考察NADH氧化酶基因(nox)对于干酪乳杆菌LC2W胞外多糖(EPS)产量的影响,本研究以变异链球菌(Streptococcus mutans)基因组为模板,PCR扩增得到1374 bp的nox序列,并构建乳杆菌重组表达质粒pIB184-nox。通过电转化,构建得到一株过表达NADH氧化酶基因的重组干酪乳杆菌LC-nox。该重组菌在无氧发酵时,NADH氧化酶活力为0.7 U/mL,在有氧发酵时,NADH氧化酶活力达到2.65 U/mL。通过HPLC检测发现,发酵液中的乳酸含量随NADH氧化酶活力升高而降低。节省的碳源用于EPS合成,使得重组菌LC-nox在有氧条件下EPS产量最高达263.7 mg/L,比出发菌株提高75.4%。为乳杆菌EPS合成调控提供了新的理论基础。
干酪乳杆菌,胞外多糖,辅因子工程,NADH氧化酶
胞外多糖(Exopolysaccharide,EPS)是微生物在生长代谢过程中分泌到细胞壁外,常渗于培养基中的一类糖类化合物[1]。这些高分子糖类聚合物因具有多种多样的化学组成和分子结构,赋予发酵食品优良的功能特性,可作为增稠剂、乳化剂和稳定剂等在食品和非食品工业中发挥重要作用[2-3]。乳酸菌具有公认的食用安全性(Generally recognized as safe,GRAS),其在发酵过程中产生的胞外多糖除了具有增稠、乳化、保湿和稳定等作用,同时还有助于改善发酵的流变学特性,减少发酵乳乳清析出现象,改善发酵乳质地和感官品质等[4-5]。一些乳酸菌胞外多糖还具有增强黏膜吸附作用、促进免疫、降低胆固醇和抗肿瘤等生理功能[6-8]。因此,产胞外多糖乳酸菌在食品工业中具有广阔的市场前景。然而,乳酸菌胞外多糖的产量一般来说都比较低,因此其工业化应用也受到一定的限制[9]。提高胞外多糖产量的研究,目前备受关注。通过筛选优良菌种,优化发酵条件,或对菌种进行改良,可以在一定程度上提高胞外多糖的产率[10-12]。近年来,随着一些乳酸菌全基因组序列的报道和胞外多糖合成相关基因簇的克隆和功能分析,使得利用基因工程技术提高胞外多糖的产量成为可能。目前,已有报道将eps基因簇进行同源或异源表达、对起始糖基转移酶和与糖核苷酸水平相关的基因进行过表达等研究,收到了一定的效果[13-16]。另外,还有研究者推测EPS合成可能与细胞内能量与辅因子代谢有关[17],但是未见报道。
干酪乳杆菌LC2W是光明乳业股份有限公司筛选到的具有降血压功能的专利益生菌,经体外免疫活性测试,其生理活性很可能与其所分泌的胞外多糖密切相关[18]。因此,对干酪乳杆菌LC2W胞外多糖的合成和调控机制进行研究具有重要意义。本研究对影响细胞内辅因子代谢水平的还原型烟酰胺腺嘌呤二核苷酸氧化酶基因(nox)进行了克隆和过表达,从代谢工程的角度对EPS合成进行了调控,以期为乳杆菌辅因子代谢工程的开展奠定基础。
1 材料与方法
1.1 材料与仪器
干酪乳杆菌LC2W(CGMCC NO.0828)、大肠杆菌DH5α 由本实验室保藏;变异链球菌CGMCC 1.2499 购自中国普通微生物菌种保藏管理中心;pIB184质粒 由中国科学院上海生命科学研究院杨晟研究员惠赠;LB培养基 每升含有10 g胰蛋白胨、5 g酵母浸提物、10 g NaCl,需要时添加氨苄青霉素至终浓度为100 μg/mL,红霉素至终浓度为200 μg/mL;MRS培养基 购自Merck公司(德国),需要时添加红霉素至终浓度为10 μg/mL;30%聚乙二醇(PEG,分子量1500)、还原型烟酰胺腺嘌呤二核苷酸(NADH)、氧化型烟酰胺腺嘌呤二核苷酸(NAD) 购自上海生工生物工程有限公司;琼脂糖凝胶回收试剂盒、质粒提取试剂盒、基因组提取试剂盒 购自天根生化科技(北京)有限公司;PrimeStar高保真酶、pGEM-T连接试剂盒、限制性内切酶BamHⅠ、SacⅠ 购自Takara宝生物工程(大连)有限公司;引物合成及基因测序
由上海英潍捷基生物有限公司完成。
UV-2450型紫外分光光度计 日本Shimadzu公司;ZHWY2102C恒温培养摇床 上海智城分析仪器制造有限公司;PowerPac Basic电泳仪、DYCP-31D水平电泳槽、GelDoc凝胶成像仪、电击杯 美国Bio-Rad公司;Veriti梯度基因扩增仪 美国Applied Biosystems;Eporator电转化仪、5424R冷冻离心机 德国Eppendorf公司;JY92-Ⅱ超声波细胞粉碎机 宁波新芝生物科技股份有限公司;A35厌氧工作站 英国Don Whitley Scientific公司;1260系列高效液相色谱仪 美国Agilent公司。
1.2 实验方法
1.2.1 nox基因的克隆 使用基因组提取试剂盒抽提变异链球菌(Streptococcus mutans)的基因组DNA。根据NCBI数据库公布的nox基因序列,设计引物。上游引物为nox-F:GGATCCatgagtaaaatcgttattgttggagc(下划线为BamHⅠ酶切位点);下游引物为nox-R:GAGCTC tcatttagcttttaatgctgctttgg(下划线为SacⅠ酶切位点)。
PCR反应以变异链球菌基因组为模板,采用高保真聚合酶PrimeStar进行扩增。扩增产物用1%琼脂糖凝胶电泳检测,电压100 V,电泳时间30 min;用胶回收试剂盒纯化PCR产物;将已纯化的PCR产物与pGEM-T载体以5∶1的摩尔比混合,在T4连接酶的作用下,室温连接6 h;取5 μL连接产物,加入100 μL大肠杆菌DH5α感受态,冰浴30 min;42℃热激90 s;冰上放置5 min后,加入900 μL LB培养基,37℃摇床复苏45 min;取100 μL涂布氨苄青霉素抗性平板,37℃培养12 h;挑取单菌落至5 mL LB液体培养基,37℃培养12 h后,用试剂盒提取质粒;所得质粒用限制性内切酶BamHⅠ、SacⅠ进行双酶切,37℃酶切3 h;酶切条带大小正确的质粒送测序鉴定,阳性质粒命名为T-nox。
1.2.2 表达载体的构建 含有正确插入片段的重组质粒T-nox,与表达质粒pIB184进行双酶切(BamHⅠ、SacⅠ),采用胶回收试剂盒纯化酶切产物。将pIB184线性化载体和插入片段nox按1∶4的摩尔比混合,室温连接6 h。连接产物转化至大肠杆菌DH5α感受态,涂布于含有红霉素的LB平板上37℃培养16 h,提取质粒后进行双酶切验证和测序鉴定,得到正确的目标重组表达载体命名为pIB184-nox。
1.2.3 干酪乳杆菌LC2W感受态制备 按文献[19]的方法进行。将MRS平板培养基上新鲜活化的干酪乳杆菌LC2W单菌落挑至5 mL MRS液体培养基,37℃静置过夜(约16 h);按2%的接种量转接至100 mL含1%甘氨酸的MRS培养基,37℃静置培养至OD600约为0.8(约4.5 h);将菌液冰浴15 min,然后4℃、5000×g离心10 min收集菌体;用100 mL冰冷的30%PEG洗涤三次;用1 mL冰冷的30%PEG重悬菌体,分装成每管100 μL,-80℃保存待用。
1.2.4 电转化 按文献[19]的方法进行。取5 μL pIB184-nox重组质粒与100 μL感受态细胞混合,转移到预冷的0.1 cm电击杯中,冰浴5 min,使用电转化仪在1 kV电压下进行电击。电击完毕后迅速加入1 mL复苏培养基(MRS+500 mmol/L蔗糖+20 mmol/L MgCl2+2 mmol/L CaCl2),37℃静置3 h;取100 μL菌液,涂布于含10 μg/mL红霉素的MRS平板。37℃厌氧培养约48 h,至长出单菌落。提取乳杆菌中质粒作为模板,用引物nox-F、nox-R进行PCR验证,并用限制性内切酶BamHⅠ、SacⅠ进行对质粒双酶切,37℃酶切3 h,PCR扩增条带及酶切片段大小均正确的阳性重组菌株命名为LC-nox。
1.2.5 发酵产EPS 从MRS平板上,挑取新鲜培养的干酪乳杆菌LC2W及其重组菌LC-nox的单菌落,分别接种于5 mL MRS液体培养基,37℃静置过夜(约16 h)。按3%的接种量转接至100 mL MRS培养基,无氧发酵置于厌氧箱静置培养,有氧发酵置于37℃摇床220 r/min振荡培养,重组菌株需加入红霉素至终浓度为10 μg/mL,发酵时间为36 h。期间每隔6 h取1 mL菌液测OD600,制作生长曲线。发酵结束后,收集发酵液进行EPS浓度测定。
1.3 测定方法
1.3.1 NADH氧化酶酶活测定 取1 mL发酵液,离心收集菌体(10000×g,10 min,4℃)。用50 mmol/L pH7.0的磷酸钾缓冲液洗涤菌体并重悬,冰浴超声(200 W,工作3 s,停5 s,60次循环),离心收集上清液,作为粗酶液。
NADH氧化酶酶活测定根据De Felipe等[20]的方法进行。酶活测定反应体系为1 mL,其中含有50 mmol/L pH7.0的磷酸钾缓冲液、0.3 mmol/L的NADH和0.3 mmol/L 的EDTA。反应在25℃进行,以加入100 μL粗酶液作为起始,观察340 nm处吸光值的下降情况。酶活单位定义:在上述反应条件下,每分钟催化1 μmol的NADH氧化为NAD,定义为一个酶活单位U。
1.3.2 EPS浓度测定 收集发酵液在沸水浴中放置10 min,冷却至室温后,离心(20 min,10000×g,4℃)。收集上清液,加入3倍体积无水乙醇,4℃放置12 h。离心(20 min,10000×g,4℃)后,沉淀溶于发酵液1/10体积的去离子水,加入三氯乙酸至终浓度为8%,4℃放置12 h。离心(20 min,10000×g,4℃),上清液在去离子水中利用透析袋(截留分子量为12~14 ku)进行透析,4℃放置3 d,每8 h换一次水。用硫酸-苯酚法[21],进行粗多糖的测定。
1.3.3 乳酸测定 取1 mL发酵液,离心(10000×g,10 min,4℃)收集上清液,采用高效液相色谱法测定发酵液中乳酸的含量,色谱条件如下:Sepax Bio-C18反相柱(4.6 mm×150 mm,3 μm),检测波长为210 nm,流动相为乙腈∶0.1%磷酸(5∶95),流速为0.5 mL/min,柱温为30℃,进样量为20 μL。乳酸标准品按常规方法配制[22],用相同流动相进行测定并制作工作标准曲线(y=1.3316x-17.271,R2=0.9992),采用面积外标法以对样品进行定量分析。
2 结果与分析
2.1 nox基因的克隆
以变异链球菌基因组DNA为模板进行扩增后,PCR产物通过1%琼脂糖凝胶电泳检测;经切胶回收后,与pGEM-T载体连接、转化;从大肠杆菌中提取重组质粒T-nox,进行双酶切验证,结果如图1。成功得到大小为1374 bp的序列,进行测序,在NCBI上与变异链球菌的nox基因序列进行比对,同源性为100%。
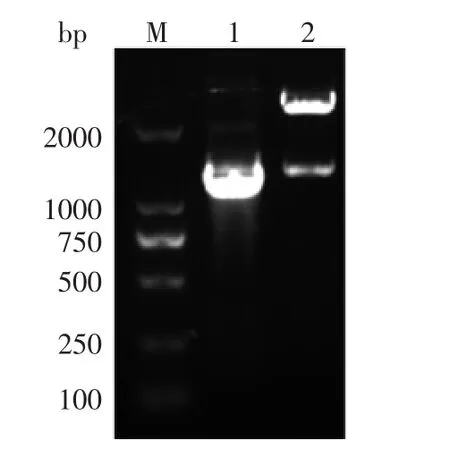
图1 nox基因克隆琼脂糖凝胶电泳分析图Fig.1 Electrophoresis of PCR amplification and double digestion of nox gene from S.mutans
2.2 干酪乳杆菌重组质粒pIB184-nox的构建
用BamHⅠ和SacⅠ限制性内切酶,将目的基因片段nox从重组质粒T-nox上切下,回收片段后,与同样酶切、回收的pIB184线性化载体进行连接,构建得到重组表达载体pIB184-nox,如图2所示。该表达质粒含有P23组成型启动子,在乳酸菌中能够广泛识别[23],目的基因位于其下游,能够随菌体生长得到表达。
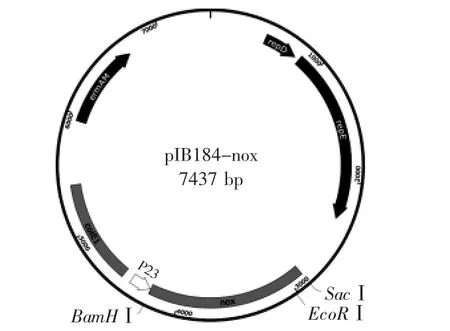
图2 干酪乳杆菌重组表达载体pIB184-noxFig.2 The map of recombinant expression plasmid pIB184-nox in L.casei
2.3 重组干酪乳杆菌LC-nox的构建及鉴定
通过电转化的方法,将重组表达质粒pIB184-nox转入干酪乳杆菌LC2W中,经红霉素抗性平板的筛选,从重组菌中抽提质粒后进行验证。经过质粒PCR验证和酶切鉴定,结果如图3所示,所得片段大小在1374 bp左右,证实重组干酪乳杆菌LC-nox已成功构建。2.4 发酵产EPS比较
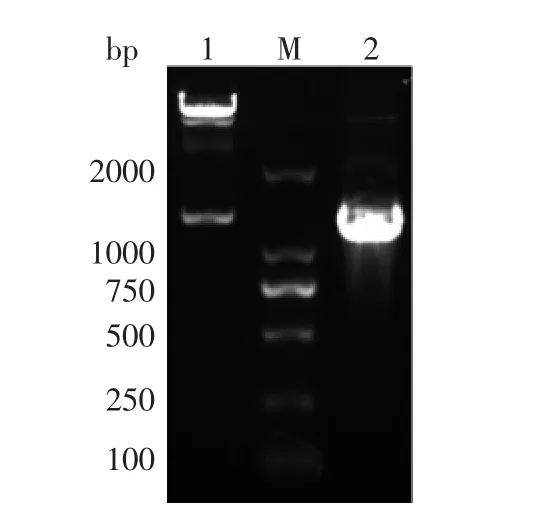
图3 重组干酪乳杆菌酶切鉴定和PCR验证图Fig.3 Identification of recombinant L.casei with double digestion and PCR amplification
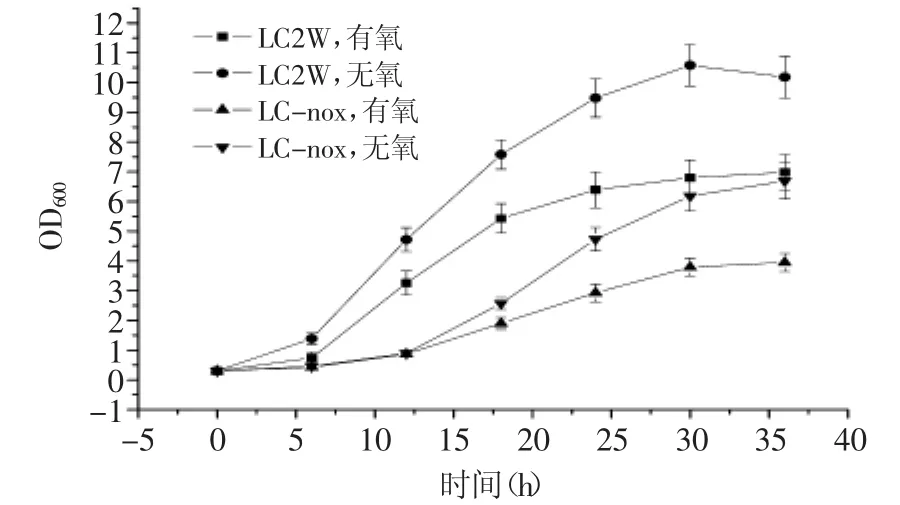
图4 菌体在不同条件下的生长曲线Fig.4 Growth curve of L.casei under different conditions
将干酪乳杆菌LC2W出发菌株与其重组菌LC-nox同时进行发酵产EPS实验,菌株生长情况如图4所示。干酪乳杆菌LC2W本身属于兼性厌氧微生物,在无氧条件下生长时,36 h OD600能达到10.18,明显好于其有氧条件下生长。其重组菌LC-nox同样如此,36 h OD600为6.69,而在有氧条件下生长时,OD600仅为3.95,说明氧气对于该菌体的生长具有一定抑制作用。
发酵结束后,测定发酵液中EPS含量,结果如图5所示。通过表达NADH氧化酶,重组干酪乳杆菌LC-nox在无氧发酵时,EPS产量为202.7 mg/L,比出发菌株LC2W提高34.9%;而重组菌LC-nox在有氧发酵时,EPS产量最高,为263.7 mg/L,比其无氧条件下EPS产量提高30.0%,比出发菌株提高75.4%。通过上述实验结果可以看出,EPS产量提高并非是由于氧气胁迫引起的,因为在出发菌株LC2W发酵中并未观察到这一现象。
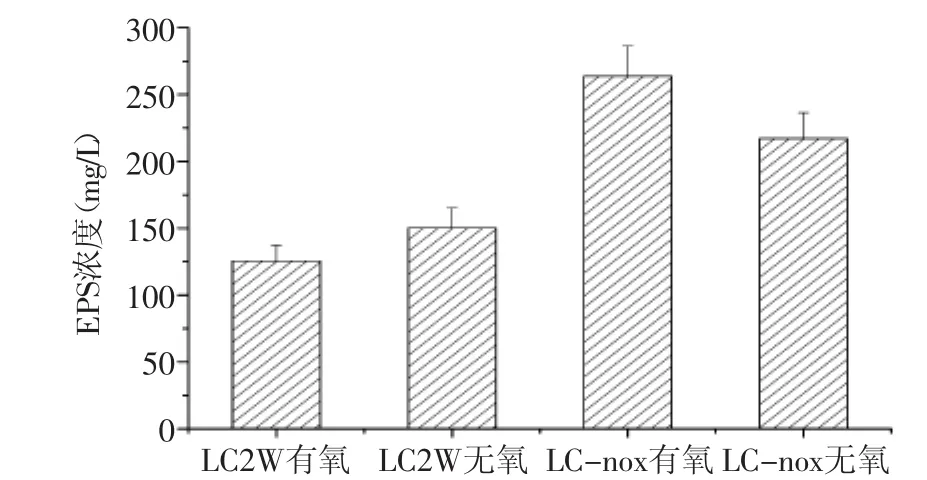
图5 不同菌株EPS发酵产量比较Fig.5 Comparison of EPS yield between different strains
2.5 NADH氧化酶酶活及乳酸产量比较
表1为不同菌株在有氧及无氧发酵时NADH氧化酶酶活及乳酸产量比较。由表1可知,与干酪乳杆菌LC2W出发菌株相比,重组菌株LC-nox的NADH氧化酶活力明显提高,无氧条件下提高了14倍,而有氧条件下提高了44倍以上。乳酸产量则与NADH氧化酶呈负相关,重组菌株LC-nox比出发菌株有不同程度的减少,这与实验设计的目的是一致的。在菌体糖酵解过程中,丙酮酸到乳酸的转化过程需要提供NADH作为还原力,而NADH氧化酶负责催化NADH转变为NAD,减少了细胞内还原力的供应,因而导致乳酸产量的减少。而氧气的存在,可以进一步消耗NADH,减少乳酸产生,节省的碳源能够用于促进EPS合成,提高其产量。
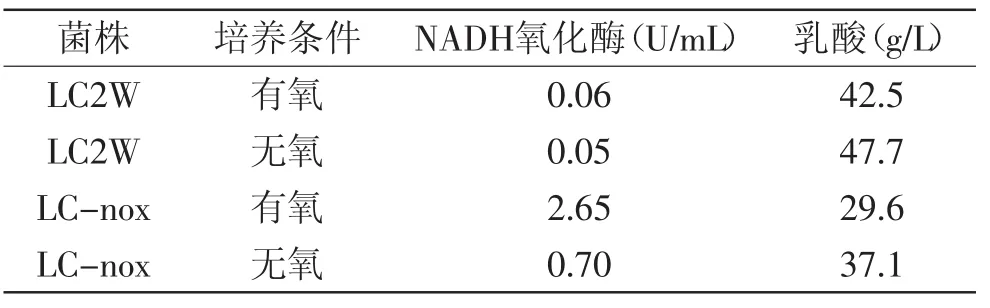
表1 NADH氧化酶酶活及乳酸产量比较Table1 Comparison of NADH oxidase activity and lactate concentration in L.casei
3 结论
本研究利用辅因子代谢工程的手段,构建了一株过表达NADH氧化酶的重组干酪乳杆菌。研究结果表明,通过提高菌体内的NADH氧化酶活力,能够竞争性的减少乳酸产生,节省的碳源用于EPS合成,使得产量有大幅度的提高。另外,在有氧发酵条件下,重组干酪乳杆菌的NADH氧化酶酶活能够得到进一步提高,使得EPS产量最高达263.7 mg/L,比出发菌株提高75.4%。由此可见,利用代谢工程技术,提高乳酸菌胞外多糖产量,具有很大的可行性和应用前景。
[1]张丽,张兰威,韩雪.乳酸菌胞外多糖的研究进展[J].食品工业科技,2012,33(17):378-387.
[2]Patel S,Majumder A,Goyal A.Potentials of exopolysaccharides from lactic acid bacteria[J].Indian J Microbiol,2012,52(1):3-12.
[3]王亚峰,霍贵成.乳酸菌胞外多糖的应用[J].食品工业科技,2005,26(5):176-178.
[4]Laws A P,Marshall V M.The relevance of exopolysaccharides to the rheological properties in milk fermented with ropy strains of lactic acid bacteria[J].Int Dairy J,2001,11(9):709-721.
[5]罗玲泉,刘成国,黄永锋.乳酸菌胞外多糖及其对酸乳品质的影响[J].食品工业科技,2007,28(6):233-236.
[6]Hongpattarakere T,Cherntong N,Wichienchot S,et al.In vitro prebiotic evaluation of exopolysaccharides produced by marine isolated lactic acid bacteria[J].Carbohyd Polym,2012,87(1):846-852.
[7]Hidalgo-Cantabrana C,López P,Gueimonde M,et al.Immune modulation capability of exopolysaccharides synthesised by lactic acid bacteria and Bifidobacteria[J].Probiotics and Antimicrobial Proteins,2012,4(4):227-237.
[8]Fanning S,Hall L J,Cronin M,et al.Bifidobacterial surfaceexopolysaccharide facilitates commensal-host interaction through immune modulation and pathogen protection[J].Proc Natl Acad Sci,2012,109(6):2108-2113.
[9]LawsA P,Gu Y C,Marshall V M.Biosynthesis,characterisation,and design of bacterial exopolysaccharides from lactic acid bacteria[J].Biotechnol Adv,2001,19(8):597-625.
[10]Lamothe G,Jolly L,Mollet B,et al.Genetic and biochemical characterization of exopolysaccharide biosynthesis by Lactobacillus delbrueckii subsp.bulgaricus[J].Arch Microbiol,2002,178(3):218-228.
[11]李盛钰,曾宪鹏,杨贞耐.提高乳酸菌胞外多糖产量的途径[J].食品与生物技术学报,2009,28(3):289-293.
[12]姚晶,任婧,吴正钧,等.乳酸菌胞外多糖的生物合成及其遗传调控[J].食品与发酵工业,2011,37(2):1-16.
[13]Boels I C,Van Kranenburg R,Kanning M W,et al.Increased exopolysaccharideproduction in Lactococcuslactisdue to increased levels of expression of the NIZO B40 eps gene cluster [J].Appl Environ Microbiol,2003,69(8):5029-5031.
[14]Jolly L,Stingele F.Molecular organization and functionality of exopolysaccharide gene clusters in lactic acid bacteria[J].Int Dairy J,2001,11(9):733-745.
[15]Degeest B,De Vuyst L.Correlation of activities of the enzymes α-phosphoglucomutase,UDP-galactose 4-epimerase,and UDP-glucose pyrophosphorylase with exopolysaccharide biosynthesis by Streptococcus thermophilus LY03[J].Appl Environ Microbiol,2000,66(8):3519-3527.
[16]Welman A D,Maddox I S,Archer R H.Metabolism associated with raised metabolic flux to sugar nucleotide precursors ofexopolysaccharides in Lactobacillus delbrueckii subsp.bulgaricus[J].J Ind Microbiol Biotechnol,2006,33(5):391-400.
[17]Welman A D,Maddox I S.Exopolysaccharides from lactic acid bacteria:perspectives and challenges[J].Trends in Biotechnol,2003,21(6):269-274.
[18]Ai L Z,Zhang H,Guo B H,et al.Preparation,partial characterization and bioactivity ofexopolysaccharides from Lactobacilluscasei LC2W [J].Carbohyd Polym,2008,74(3):353-357.
[19]任婧,李楠,陈臣,等.干酪乳杆菌LC2W最优电转化条件的建立[J].食品安全质量检测学报,2014,5(4):1028-1032.
[20]De Felipe F L,Kleerebezem M,De Vos W M,et al.Cofactor engineering:a novelapproach tometabolic engineering in Lactococcus lactis by controlled expression of NADH oxidase[J].J Bacteriol,1998,180(15):3804-3808.
[21]Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric Method for Determination of Sugars and Related Substances[J].Anal Chem,1956,28(3):350-356.
[22]De Baere S,Eeckhaut V,Steppe M,et al.Development of HPLC-UV method for the quantitative determination of four short-chain fatty acids and lactic acid produced by intestinal bacteria during in vitro fermentation[J].J Pharm Biomed Anal,2013,80:107-115.
[23]Biswas I,Jha J K,Fromm N.Shuttle expression plasmids for genetic studies in Streptococcus mutans[J].Microbiology,2008,154(8):2275-2282.
Impact of overexpression of NADH oxidase on exopolysaccharide production in Lactobacillus casei LC2W
LI Nan,YOU Chun-ping,LIU Zhen-min*
(Dairy Research Institute,Bright Dairy&Food Co.,Ltd.,State Key Laboratory of Dairy Biotechnology,Shanghai 200436,China)
To investigate the effect of NADH oxidase gene(nox)on the production of exopolysaccharide from Lactobacillus casei LC2W,nox gene was obtained by PCR amplification with the genomic DNA of Streptococcus mutans as template.It was subcloned into a lactobacilli vector to construct the recombinant expression plasmid pIB184-nox.By electroporation,pIB184-nox was introduced into Lactobacillus casei LC2W,resulting in the recombinant strain designated as LC-nox.Under anaerobic condition,LC-nox overexpressed NADH oxidase to a level of 0.7 U/mL,while it was elevated to 2.65 U/mL under aerobic condition.Detected by HPLC,the lactate concentration in the fermentation broth showed negative correlation with NADH oxidase activity.The carbon source saved was used for the biosynthesis of exopolysaccharide(EPS).The highest yield of EPS was reached at 263.7 mg/L under aerobic fermentation,which was increased by 75.4%compared to that of the starting strain.A novel theoretical basis was provided for the regulation of EPS biosynthesis in lactobacillus.
Lactobacillus casei;exopolysaccharide;cofactor engineering;NADH oxidase
TS252.4
A
1002-0306(2016)06-0182-05
10.13386/j.issn1002-0306.2016.06.029
2015-08-24
李楠(1983-),男,博士研究生,研究方向:益生菌改造和代谢机理研究,E-mail:linan@brightdairy.com。
刘振民(1974-),男,博士,高级工程师,研究方向:乳酸菌、发酵乳、干酪和功能性乳品,E-mail:liuzhenmin@brightdairy.com。
上海市科研计划项目(14R21420100);国家“十二五”科技支撑计划(2013BAD18B01);国家“十二五”863项目(2011AA100901)。
