乳化盐强化对乳蛋白浓缩物加工性质的影响
2016-09-16孙颜君乳业生物技术国家重点实验室光明乳业股份有限公司上海乳业生物工程技术研究中心上海200436
孙颜君(乳业生物技术国家重点实验室,光明乳业股份有限公司,上海乳业生物工程技术研究中心,上海200436)
乳化盐强化对乳蛋白浓缩物加工性质的影响
孙颜君
(乳业生物技术国家重点实验室,光明乳业股份有限公司,上海乳业生物工程技术研究中心,上海200436)
研究乳化盐强化对乳蛋白浓缩物85(MPC85)基本成分、粒径、溶解性和表面疏水性(H0)以及蛋白分子量的影响。结果表明,柠檬酸钠(SCS)单独使用或者与焦磷酸钠(SPP)复配均能够显著改变MPC85的粒径和溶解性,且缩短了达到稳定粒径和溶解性所需要的时间(p<0.05)。其中,单独使用SCS可使得MPC85粒径由31.37 μm降低至20.67 μm,达到稳定粒径值的时间缩短至360 min。SCS与SPS按照不同比例使用时,随着SCS占比的增加,粒径值显著降低(p<0.05),且溶解性由77.42%增加至81.43%,同时达到稳定溶解度的时间缩短;乳化盐可以改变蛋白构象,使得更多疏水基团暴露,从而提高H0;复配乳化盐会降低分子量>60 ku的蛋白含量,且SPP和磷酸三钠(SPS)使得MPC85形成小分子量蛋白,分子量介于κ-CN与β-LG之间。
乳化盐,牛乳浓缩蛋白85,加工性质,蛋白分子量
乳蛋白浓缩物(milk protein concentrate,MPC)是近年来新兴的乳蛋白制品,在食品加工中可作为重要的乳蛋白来源。乳蛋白浓缩物的传统生产多采用酸沉淀或者酶凝的方法,工艺中的高热处理或者pH改变都会导致乳清蛋白发生不同程度的变性[1]。随着膜分离技术的发展,可采用膜分离来生产MPC产品,且可通过改变分离条件来调整MPC干物质中蛋白含量,常见的MPC产品干物质中蛋白含量为35%~85%,通常根据干物质中蛋白含量命名为MPC35、MPC42、MPC56和MPC85等。
MPC用于再制干酪中,可以提高产品中蛋白的含量,并改善产品的质地和组织状态,且MPC呈现淡淡的奶香味,不会对产品的风味产生不良影响。但由于其较高的蛋白含量,在常温下呈现较差的溶解性。在MPC的生产过程中,可溶性物质会透过膜孔径进入透过端,截留液中离子平衡改变,直接影响酪蛋白胶束结果,从而改变MPC的部分加工性质。
盐类在牛乳中含量较少,但会影响乳制品的口感、风味和产品货架期[2]。国外已有相关研究通过改变MPC中盐含量来改变其加工性质。Carr等[3]生产MPC70过程中,通过在膜过滤浓缩液中添加单价盐来改善MPC的溶解性;Bhaskar等[4]通过离子交换柱处理原料乳,调节超滤/洗滤前截留液的pH,或者洗滤过程中加入单价盐等手段,目的是去除原料乳中钙离子含量,从而改善MPC的部分加工性质。而关于乳化盐在MPC加工工艺中的应用,目前尚未有相关研究。
再制干酪生产中,乳化盐有着广泛的应用,其主要作用是脱钙,即切断天然干酪中酪蛋白磷酸钙的蛋白质网络结构和调节pH,这能够促进天然干酪中蛋白质水合,形成再制干酪均匀的质地和稳定的结构[5]。
本文首次研究了在脱脂牛乳中加入不同的乳化盐,包括柠檬酸钠(Sodium citrate,SCS)、焦磷酸钠(Sodium pyrophosphate,SPP)和磷酸三钠(Sodium phosphate,SPS)单体以及三者以不同比例组成的混合物对MPC85粒径、溶解性和表面疏水性(Hydrophobicity,H0)等性质的影响,并进一步研究了MPC85中蛋白分子量的变化,旨在为MPC的加工工艺及其应用提供一定理论支持。
1 材料与方法
1.1 材料与仪器
脱脂乳 光明乳业华东中心工厂;柠檬酸钠、磷酸三钠和焦磷酸钠 均为分析纯,国药集团化学试剂有限公司;“福临门”玉米胚芽油 中粮食品营销有限公司;8-苯胺-1-萘磺酸(ANS) 梯希爱(上海)化成工业发展有限公司。
Mastersizer3000激光粒度分析仪 英国马尔文仪器有限公司;SP-754PC分光光度计 上海光谱仪器有限公司;IKAT25高速剪切分散机 德国IKA公司;EPS301电泳仪 美国GE healthcare公司;F-2500荧光分光光度计 日本日立公司。
1.2 实验方法
1.2.1 MPC85的生产 将600 kg新鲜原料脱脂乳采用管式(Ultra high temperature,UHT)杀菌器进行巴氏杀菌(72℃,15 s),UHT出口温度调节至50℃。每批MPC85生产以60 kg脱脂乳为原料,每批脱脂乳中分别加入SCS、SPS和SPP的单体以及三种乳化盐的复配体,其中三种乳化盐两两以一定比例进行混合,混合的比例分别为8∶92、50∶50和92∶8(见表1),乳化盐添加量为脱脂乳质量0.3%(w/w)。脱脂乳与乳化盐搅拌混匀后,采用10 ku再生纤维素膜分三段过滤,第一阶段浓缩3倍,即截留液体积为20 kg时停止过滤;第二阶段过滤前在截留液中加入40 kg去离子水,继续浓缩3倍后停止;第三阶段添加去离子水工艺同阶段二,继续浓缩至6倍,即截留液体积为10 kg时停止过滤,此时截留液中固形物含量为16.55%。膜分离条件为:进料压力为1.7 bar,出口压力为1.05 bar,超滤起始阶段膜通量为63 L·m-2·h-1,随着超滤进行,膜通量下降至57 L·m-2·h-1,加入去离子水后膜通量恢复至63 L·m-2·h-1左右。
收集膜分离后的截留液,在65~70℃下蒸发浓缩至固形物含量为25.10%~25.74%,然后进行喷雾干燥,进风温度为180℃,出风温度为80℃,所制得的MPC85产品密封后于4℃下保存。不同比例SPS与SPP加入脱脂乳中,会形成颗粒状凝块,因此无法进行后续的膜分离、蒸发浓缩以及喷雾干燥工艺。本研究制得乳化盐强化的MPC85产品9种,未添加乳化盐的产品作为对照样品。
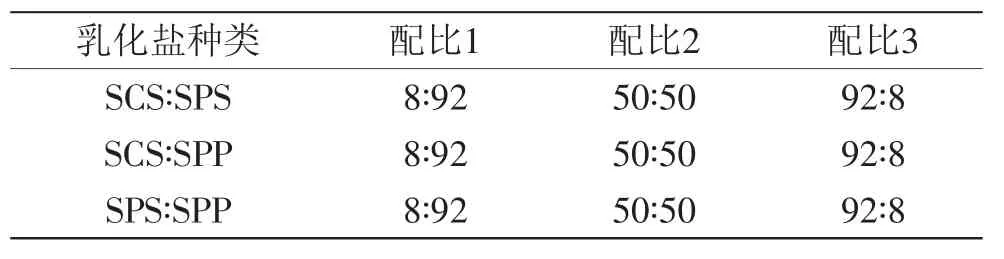
表1 不同乳化盐复配比例Table1 The ratio of different emulsifying salts
1.2.2 成分的测定 参考国标方法测定MPC85产品的水分[6]、灰分[7]、蛋白质[8]、脂肪[9]、乳糖[10]和钙含量[11]。
1.2.3 粒径分析 参考孙颜君等[12]方法,配制5%(w/w)MPC85溶液,用马尔文激光粒度分析仪Mastersizer 3000测定粒径,以去离子水为分散相,搅拌速率为2000 r/min,样品和水相的折射率设为1.56和1.33,记录测定结果中的D50值。
为观察MPC85在复水过程中的粒径变化,MPC85乳粉以5%(w/w)复水,使用玻璃棒缓慢搅拌2 min使得粉末没于水中,乳化分散器以3000 r/min转速搅拌10 min后静置,开始静置前1 h内每隔10 min取样,随后的过程中每隔60 min进行取样,最后一次取样为开始静止后960 min。整个过程在25℃水浴控温下进行。按照上述方法进行粒径测定。每个样品测定三次,并取平均值作为最终测定结果。
1.2.4 溶解性测定 溶解性测定参考孙颜君[13]等的方法略加改进,称取1.2.1制备的MPC85粉末分别配制成5%的溶液(w/w),并取10 g溶液于50 mL的离心管中,室温下(25℃)4400 r/min离心10 min,取离心前溶液和离心后上清液5 g分别置于预先恒重(105℃,5 h恒重)的平板中,将平板于105℃下烘干4 h左右至样品恒重,最后所有平板置于干燥器冷却至室温。分别计算上清液和原样液中的固形物质量分数,按照以下公式进行计算溶解性。
溶解性(%)=上清液中固形物质量分数×100/原样液中固形物质量分数
为观察MPC85在复水过程中不同时间点的溶解性变化,MPC85分散工艺同1.2.3,在开始静置后30、60、90、360、420、720、800和1000 min取样并按照上述方法测定溶解性。整个过程在25℃水浴控温下进行。每个样品测定三次,并取平均值作为最终测定结果。
1.2.5 表面疏水性(H0)的测定 参考Hayakawa等[14]的方法略加改进。以8-苯胺-1萘磺酸(8-anilino-1-naphthalene sulfonate,ANS)作为荧光探针进行测定。配制3%(w/w)的MPC85溶液,用磷酸缓冲液(0.1 mol/L,pH7.0)分别稀释至质量浓度为0.05~0.4 g/L之间,取不同稀释度的样品2 mL,分别在其中加入10 μL浓度为8 mmol/L的ANS(采用0.1 mol/L,pH7.0的磷酸缓冲液配制)。采用荧光分光光度计在390 nm的激发波长和468 nm的发射波段下进行测定,狭缝宽度都为2.5 nm。以样品质量浓度和荧光强度绘制标准曲线,曲线的斜率即表示该样品的H0。
1.2.6 聚丙烯酰胺凝胶电泳(SDS-PAGE)分析 采用还原性SDS-PAGE测定MPC85蛋白分子量。将1.2.1所制得的MPC85配制成3%(w/w)的溶液,采用去离子水稀释4倍取10 μL与2×SDS样品缓冲液(配方见表2,混合均匀,室温放置备用)以1∶1比例进行混合,沸水浴加热5 min,100 r/min离心取10 μL上样。添加SPS-SPP的样品,应在牛乳形成凝胶前快速取样进行实验。分离胶和浓缩胶的质量分数分别为12%和5%,初始阶段将EPS301电泳仪的电压设置为80 V,待样品进入分离胶后增加压力至120 V。电泳结束后,将凝胶用考马斯亮蓝R250溶液染色2 h,然后用15 mL脱色液(甲醇∶冰醋酸∶双蒸水=1∶1∶8)摇床脱色过夜至背景清晰。所得蛋白条带采用AlphaEase FC凝胶成像系统进行拍照,并用其自带的AlphaEase FC分析软件进行灰度扫描分析定量。通过对比样品的条带和Marker来确定MPC80中的分子量。

表2 2×SDS样品缓冲液配方Table2 Ingredients of 2×SDS sample buffering
1.2.7 数据统计分析 每组实验重复测定3次,最后结果以均值±标准方差(mean±SD)表示。采用SPSS 18.0软件对实验结果在p<0.05水平上进行显著性分析。
2 结果与分析
2.1 不同MPC85基本成分的测定
表3总结了对照、单体和复配乳化盐强化MPC85的基本成分。从表3可知,对照样品总钙含量高于乳化盐强化样品(p>0.05)。MPC80中大部分的钙离子主要与磷酸丝氨酸残基结合,加入的乳化盐会与磷酸丝氨酸或者胶体磷酸钙竞争性的结合酪蛋白胶束上的钙离子,形成的可溶性无机钙盐,在膜分离过程中可溶性无机盐会进入透过端,从而降低了MPC80中的钙含量[15]。Eshpari H等[16]采用添加了葡萄糖酸内酯(GDL)的脱脂乳来生产MPC80,所得到的MPC80中钙含量显著低于未添加GDL的产品。
如1.2.1所述,不同比例SPP与SPS加入至牛乳中后,会快速在牛乳中形成凝胶状颗粒物。Clausi等[17]在牛乳布丁的配方中,比较了SPP单体及其SPP与SPS复配对凝胶性的影响,结果发现只使用SPP需数个小时才能形成凝胶结构,一旦加入SPS,形成凝胶的时间缩短至10 min,这可能是因为SPS有助于磷酸丝氨酸与钙形成化合物,并与酪蛋白胶束之间形成钙桥[18]。
2.2 粒径测定
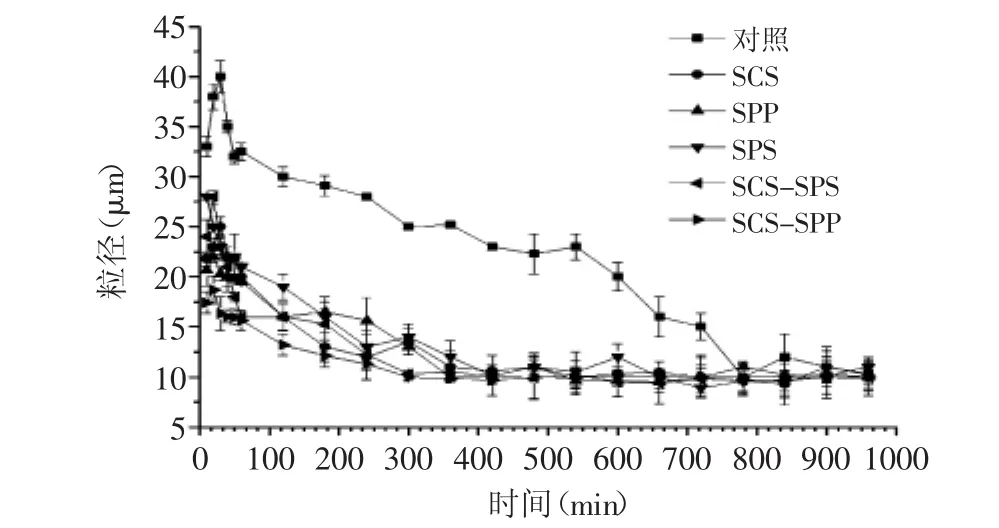
图1 不同乳化盐强化MPC85对复水过程中粒径变化的影响Fig.1 The particle size change of MPC85 powders fortified with different kinds of emulsifying salts in the hydration processing
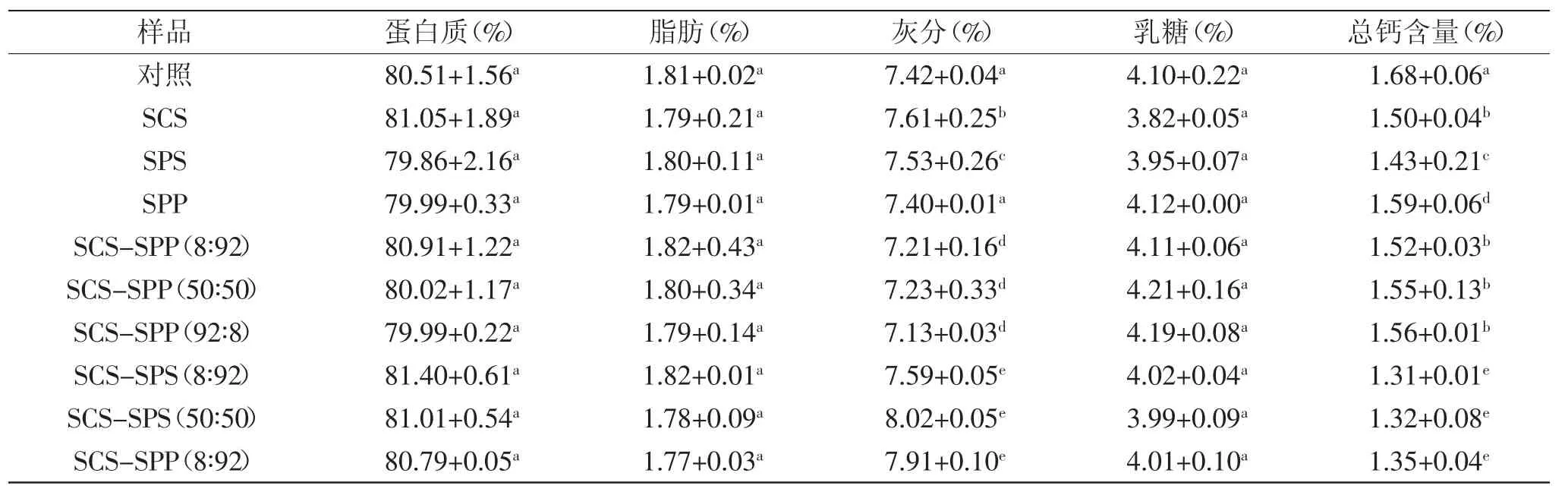
表3 不同乳化盐强化MPC85基本成分Table3 Composition of different emulsifying salts fortified MPC85
图1为MPC85在复水过程中粒径的变化(其中复配乳化盐比例均为50∶50),由图1可知,在初始的60 min内,所有MPC85的粒径呈现上升趋势。Famelart[19]将粉体的溶解过程分为四个阶段,分别为浸润、下沉、分散和溶解,并指出在浸润和下沉阶段,粒径呈现上升趋势。由此可推断,本研究中,在前60 min内,样品处于浸润和下沉阶段。在720 min后,对照样品的粒径由40.12 μm降低至15.0 μm,且在720~1000 min之间粒径达到稳定的状态,这表明样品处于完全溶解阶段。由图1可知,不同种类的乳化盐可缩短粒径达到稳定值所需要的时间。加入SCS后,MPC85粒径由31.37 μm降低至20.67 μm,粒径达到稳定值的时间为360 min,SPP和SPS为420 min。为保证样品的充分溶解,本研究中监测了1000 min内粒径的变化。与单体乳化盐相比,复合乳化盐可进一步缩短粒径达到稳定值的时间,这是因为复合乳化盐中与酪蛋白胶束的钙离子竞争性结合的基团数量增加,可快速降低MPC85粒径。
由图1可知,加入SCS、SPP和SPS后,溶解终点处MPC85粒径有不同程度的降低,其中加入SPS和SCS 后MPC85粒径下降最为显著(p<0.05),与对照样品比较,SCS和SPS强化MPC85粒径分别降低了34.11%和30.58%。SCS和SPS样品之间没有显著差异(p>0.05)。可能因为乳化盐中的磷酸根或者柠檬酸根会与磷酸丝氨酸或者酪蛋白磷酸钙竞争性的结合酪蛋白胶束上的钙离子,形成磷酸钙或者柠檬酸钙,这样会打破酪蛋白胶束的结构,从而降低粒径[15]。
由图2可知,当SCS与SPS以不同比例复配,MPC85粒径随着SCS所占比例增加而降低(p<0.05)。SCS与SPS和SPP分别进行配比,相同的SCS比例中,SPSSCS比SPP-SCS能够更大程度降低MPC85粒径,这是因为不同种类的乳化盐对钙离子有不同的亲和能力,因此从酪蛋白胶束上置换酪蛋白磷酸钙的能力也不尽相同[20]。
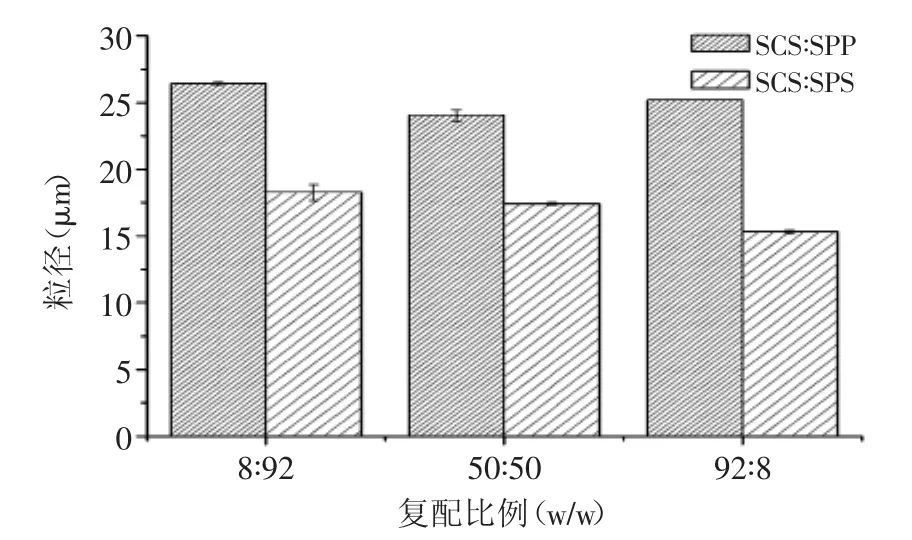
图2 不同比例乳化盐复配对MPC85粒径的影响(溶解10 min)Fig.2 Effect of different ratio of binary emulsifying salts on the particle size of MPC85(after solubilizing for 10 min)
2.3 溶解性测定结果
在MPC的应用中,最关注其溶解性,通常要求MPC能够快速且充分的溶解,这样其他加工性质如乳化性、起泡性和凝胶性才能够较好的呈现。由图3可知,溶解1000 min处,加入单体SCS、SPS和SPP的MPC溶解性有不同程度的提高,分别比对照样品提高了80.32%、78.23%和55.80%。且SCS、SPC和SPP强化MPC85样品之间,溶解性差异显著(p<0.05)。这与Bhaskar等[4]的研究结果相一致,Bhaskar研究表明添加了SCS后,MPC的溶解性增加了8%,可能是因为改变了蛋白粉中酪蛋白胶束的结构。从图3可知,随着溶解时间的延长,溶解性逐渐增加,且在1000 min时达到稳定值。这与2.2中粒径变化趋势相一致,随着溶解时间延长,粒径不断降低直至达到稳定值。因此,衡量MPC产品的溶解性除了关注不溶解性物质外,还应关注溶解速率,而且粒径变化大小和变化速率可以作为判定溶解性的一个重要指标。
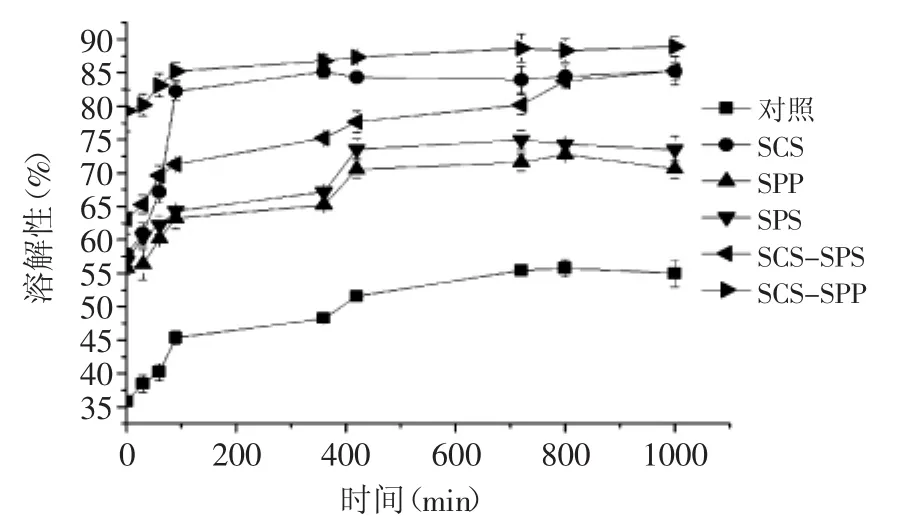
图3 不同MPC85溶解性随时间变化Fig.3 The profile of MPC85 solubility as time prolonged
由图4可知,SCS-SPP和SCS-SPS复配添加,随着SCS比例的增加,MPC85的溶解性显著增加(p<0.05)。SCS∶SPP比例为92∶8时,MPC85溶解性最佳,为75.14%。Schuck等[21]研究也发现采用柠檬酸可以提高酪蛋白粉的溶解性,与对照样品比较,添加柠檬酸后MPC85溶解性提高了13%。
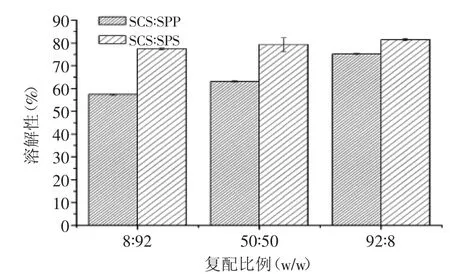
图4 溶解10 min时,复配乳化盐对MPC85溶解性的影响Fig.4 Effect of binary emulsifying salts mixtures on the solubility of MPC85 after solubilizing for 10 min
乳化盐能够改变MPC85溶液中的离子环境,离子环境会影响蛋白之间的相互作用,这也有助于溶解性的提高。通常来说,高浓度离子环境下蛋白的溶解性较好[22]。Skiand等[23]生产MPC80工艺中,在洗滤所用的去离子水中添加不同浓度和种类的盐类,结果表明离子强度和种类都会显著影响MPC80的溶解性。比较不同带电量离子发现,单价离子能够更好的提高MPC80的溶解性,且单价离子中Na+提高MPC80溶解性效果优于K+。乳化盐种类和浓度能够改变酪蛋白胶束中酪蛋白和钙离子的平衡,促使离子钙的形成,从而增加乳清中离子钙含量[21]。
2.4 表面疏水性测定
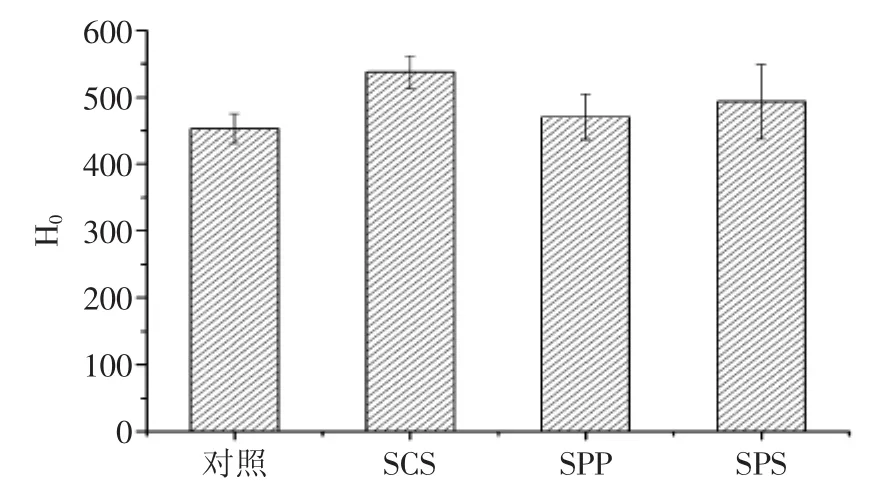
图5 溶解10 min时,不同乳化盐强化对MPC85溶液H0的影响Fig.5 Effect of monomer emulsifying salt on the H0of MPC85 after solubilizing for 10 min
由图5可知,不同单体乳化盐均能够显著提高MPC85 的H0(p<0.05)。与对照样品比较,SCS、SPP和SPS强化MPC85的H0值分别提高了18.61%、3.86%和8.98%。SCS强化的MPC85具有较高的H0,约为537.3。蛋白中的疏水基团可以与ANS探针结合,添加不同乳化盐后,蛋白构象发生变化,蛋白分子内部的疏水集团暴露于蛋白表面,与ANS结合位点增加,从而H0值增加[24]。不同乳化盐强化MPC85呈现不同的H0,原因是乳化盐改变蛋白质构象的能力和离子强度的差异性,这些都会影响疏水基团的暴露程度,造成H0之间的差异。
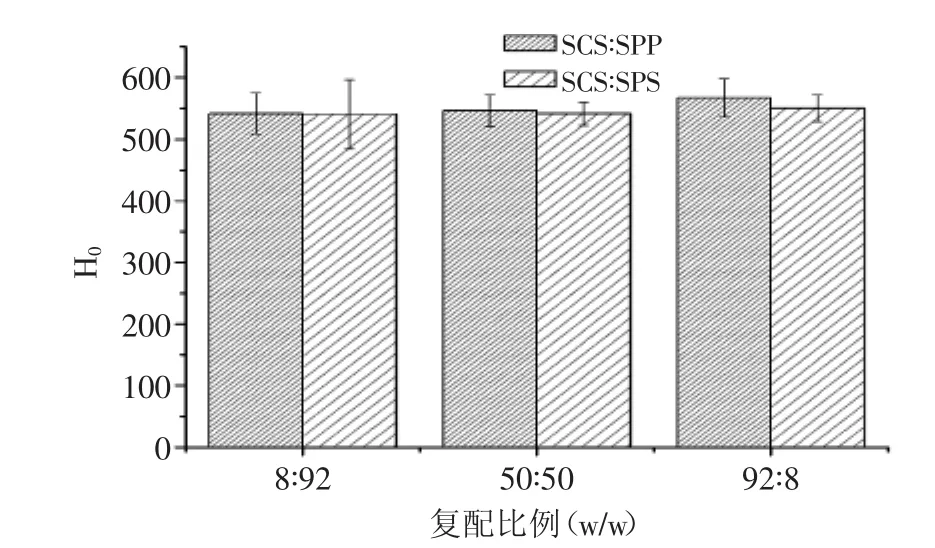
图6 溶解10 min时,乳化盐复配对MPC85 H0的影响Fig.6 Effect of different ratio of binary emulsifying salts on the H0of MPC85 after solubilizing for 10 min
SCS与SPP和SPS复配后(图6),随着SCS比例的增加,H0相应增加(p<0.05)。当SCS比例为8%时,其与SPP和SPS复配不会对MPC85的H0造成影响(p>0.05),当SCS比例增加至92%时,与对照样品比较,差异较为显著(p<0.05)。这与粒径的研究结果相吻合,SCS与SPP或SPS复配后,会降低蛋白的粒径,减少蛋白聚合物的形成,从而使得更多的基团暴露在蛋白表面。除了蛋白质之间的疏水相互作用,巯基和二硫键作用也会影响H0,分子内交互作用在形成凝胶的过程中不是决定因素,但是有助于形成稳定的凝胶结构[25]。
2.5 乳化盐对MPC85蛋白分子量的影响
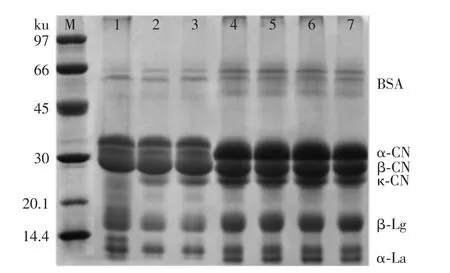
图7 不同乳化盐强化对MPC85蛋白分子量的影响Fig.7 Effect of different emulsifying salts fortified on the protein molecular weight of MPC85
由以上研究可知,添加乳化盐后会影响MPC85中蛋白的粒径、溶解性和H0等指标,可通过SDS-PAGE来进一步验证以上性质变化是否与蛋白分子量改变有关。通过灰度扫描定量分析对照样品与单体乳化盐强化的MPC85,各个蛋白的SDS-PAGE条带差异并不显著(图7),且由表4可知,MPC85中主要蛋白的相对含量没有显著差异(p>0.05)。SCS∶SPP(50∶50)与SCS∶SPS(50∶50)强化MPC85中酪蛋白含量显著低于对照样品,且加入SPP∶SPS(50∶50)的MPC85中,κ-酪蛋白(κ-CN)与β-乳球蛋白(β-Lg)之间有更多的小分子量蛋白条带出现,这表明SPP和SPS结合CN胶束上的酪蛋白磷酸钙,使得酪蛋白胶束分散成为低分子量聚合物。但复配乳化盐强化的MPC85样品中,分子量>60 ku的蛋白含量有所降低,这表明复配乳化盐能够更好的促进酪蛋白和Lg的溶解,并改变MPC溶液中的离子平衡和蛋白所带的电荷量,这会改变酪蛋白胶束结构,从而影响蛋白的溶解性、粒径和分子量等[26]。关于添加盐类对于MPC蛋白SDS-PAGE条带的影响,Mao等[25]也有相关研究,在其研究中,以未添加NaCl的MPC80作为对照样品,150 mmol/L NaCl洗滤生产的MPC80中κ-CN和β-Lg含量较高。
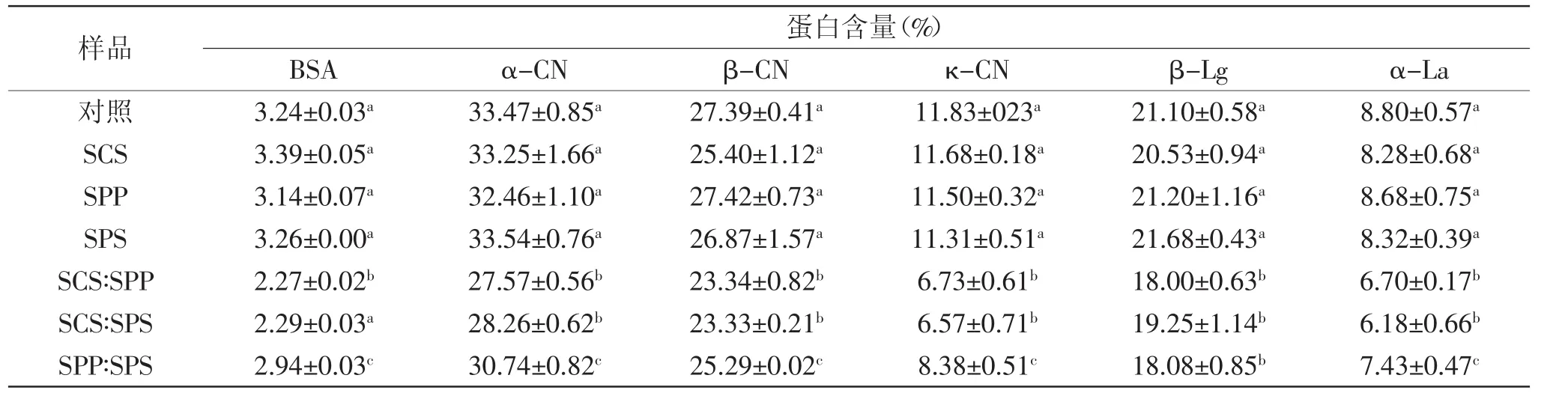
表4 不同乳化盐强化MPC85中主要蛋白质组分的相对含量(%)Table4 Relative content(%)of the main protein in different ES fortified MPC85
3 结论
乳化盐强化的MPC85产品中总钙含量都低于对照样品;单体乳化盐显著降低MPC85的粒径,溶解性和表面疏水性显著提高(p<0.05)。复配乳化盐中离子竞争性与MPC85中酪蛋白胶体上钙离子结合,改变酪蛋白胶束结构,易于在溶液中分散,因此复合乳化盐强化的MPC85不仅溶解性较好,且能够在短时间内充分溶解。柠檬酸钠和焦磷酸钠(配比92∶8)强化的MPC85溶解性最佳,为81.43%。乳化盐与MPC85中蛋白结合后,会改变蛋白的结构,使得更多疏水基团暴露,从而提高H0。单体乳化盐强化对于MPC85中主要蛋白成分的相对含量没有显著影响,复配乳化盐强化后>60 ku的蛋白条带减少关于乳化盐对于MPC性质影响机理有待于进一步研究。
[1]Yanjun S,Jianhang C,Shuwen Z,et al.Effect of power ultrasound pre-treatment on the physical and functional properties of reconstituted milk protein concentrate[J].Journal of Food Engineering,2014,124:11-18.
[2]Albarracin W,Perez M T,Antequera T,et al.Use of simultaneous brine thawing/salting in dry-cured Iberian ham production[J].Journal of Food Engineering,2011,104:316-321.
[3]Carr A,Bhaskar V,Ram S.Monovalent salt enhances solubility of milk protein concentrate.USA.096208[P].2002-04-15.
[4]Bhaskar G V,Singh H,Blazey N D.Milk protein products and processes.US.0096036[P].2003-02-16.
[5]郭本恒,刘振民.干酪科学与技术[M].北京:中国轻工业出版社,2015:12-13.
[6]GB 5009.3,食品安全国家标准:食品中水分的测定[S].2010.
[7]GB 5009.4,食品安全国家标准:食品中灰分的测定[S].2010.
[8]GB 5009.5,食品安全国家标准:食品中蛋白质的测定[S].2010.
[9]GB 5413.3,食品安全国家标准:食品中脂肪的测定[S].2010.
[10]GB 5413.5,食品安全国家标准:食品中乳糖的测定[S].2010.
[11]GB 5413.21,食品安全国家标准:食品中钙的测定[S].2010.
[12]孙颜君,刘鹭,李红娟,等.超声波处理对乳蛋白浓缩物加工特性的影响[J].中国乳品工业,2013,41(3):12-15.
[13]孙颜君,莫蓓红,郑远荣,等.热处理和调节pH改性乳清蛋白浓缩物对搅打稀奶油加工性质的影响[J].食品工业科技,2015,36(2):133-138.
[14]Hayakawa S,Nakai S.Relationships of hydrophobicity and net charge to the solubility of milk and soy proteins[J].Journal of Food Science,1985,50:486-491.
[15]Esther K,Marcel M,Thom S,et al.Effect of calcium chelators on physical changes in casein micelles in concentrated micellar casein solutions[J].International Dairy Journal,2014,12(21):907-913.
[16]Eshpari H,Tong P S,Corredig M.Changes in the physical properties,solubility,and heat stability of milk protein concentrates prepared from partially acidified milk[J].Journal of Dairy Science,2014,12(97):7394-7401.
[17]Clausi A S.Pudding composition and process of producing the same.General Foods Corporation assignee.US,2801924[P].1957-05-23.
[18]Kaliappan S,Lucey J A.Influence of mixtures of calciumchelating salts on the physicochemical properties of casein micelles[J].Journal of Dairy Science,2011,94:4255-4263.
[19]Famelart M H,Le G Y,Raulot K.Casein micelle dispersions into water,NaCl and CaCl2:Physicochemical characteristics of micelles and rennet coagulation[J].International Dairy Journal,1999,9(3):293-297.
[20]Kort D,Minor M,Snoeren T H M,et al.Calcium binding capacity of organic and inorganic ortho-and polyphosphates[J].Journal of Dairy Science and Technology,2009,89:283-299.
[21]Schuck P,Davanel A,Mariette F,et al.Rehydration of casein powders:effects of added mineral salts and salt addition methods on water transfer[J].International Dairy Journal,2002,12:51-57.
[22]Xiong Y L.Influence of pH and ionic environment on thermal aggregation of whey proteins[J].Journal of Agriculture Food Chemistry,1992,40:380-384.
[23]Sikand V,Tong P,Walker J.Effect of adding salt during the diafiltration step of milk protein concentrate powder manufacture on mineral and soluble protein composition[J].Dairy Science and Technology,2013,93(4):401-413.
[24]Mao X,Tong P,Gualco S,et al.Effect of NaCl addition during diafiltration on the solubility,hydrophobicity,and disulfide bonds of 80%milk protein concentrate powder[J].Journal of Dairy Science,2013,95:3481-3488.
[25]Mine Y.Recent advances in the understanding of egg white protein functionality[J].Trends in Food Science&Technology,1995,6(7):225-232.
[26]Ahmad S,Plot M,Rousseau F,et al.Physico-chemical changes in casein micelles of buffalo and cow milk as a function of alkalinisation[J].Dairy Science and Technology,2009,89:387-403.
Effect of emulsifying salts modification on the functionality of milk protein concentrate
SUN Yan-jun
(State Key Laboratory of Dairy Biotechnology,Bright Dairy and Food Co.,Ltd.,Shanghai Engineering Research Center of Dairy Biotechnology,Shanghai 200436,China)
The research presented the effect of emulsifying salts on the composition,particle size(D50),solubility,surface hydrophobicity(H0),and molecular weight of MPC85.The results showed that SCS monomer or mixtured with SPP could change the particle size and solubility of MPC85 significantly(p<0.05)and also shorten the time to reach the stable particle and solubility.The addition of SCS decreased the particle size of MPC85 from 31.37 μm to 20.67 μm.In the rehydration process,MPC85 fortified with SCS came to a stable particle size within only 360 min.And as a function of SCS increased,not only the particle size of SCS-SPS fortified MPC85 decreased significantly(p<0.05),also the solubility of MPC85 increased from 77.42%to 81.43%.At the same time,the time to reach to stable solubility was shortened.Emulsifying salts(ES)could change the structure of protein,then exposing more of the hydrophobic grouping,which improved H0of MPC85.The molecular weight of protein>60 ku was decreased with the binary ES.Several lower protein presented between κ-CN and β-LG in MPC85 with SPP and SPS.
emulsifying salts;milk protein concentrate 85;functionality;molecular weight of protein
TS201.1
A
1002-0306(2016)06-0164-06
10.13386/j.issn1002-0306.2016.06.025
2015-08-24
孙颜君(1988-),女,硕士,工程师,研究方向:乳品科学与加工,E-mail:15921569362@163.com。
上海市科技人才计划项目(14XD1420300)。
