一种蛹虫草多糖的结构特征及体外抗氧化活性
2016-09-16陈小丽巫光宏黄卓烈广东海洋大学水产学院广东湛江54088华南农业大学生命科学学院广东广州5064
陈小丽,巫光宏,黄卓烈(.广东海洋大学水产学院,广东湛江54088;.华南农业大学生命科学学院,广东广州5064)
一种蛹虫草多糖的结构特征及体外抗氧化活性
陈小丽1,巫光宏2,黄卓烈2
(1.广东海洋大学水产学院,广东湛江524088;2.华南农业大学生命科学学院,广东广州510642)
采用分子筛层析法从人工培养蛹虫草子实体中分离纯化得到一种多糖W-CBP80Ⅰ,进而分别采用凝胶渗透色谱(GPC)、气-质联用(GC-MS)、红外光谱(IR)、核磁共振(1H NMR和13C NMR)研究其理化性质和结构特征。结果表明:W-CBP80Ⅰ含有α-糖苷键,并主要由甘露糖、半乳糖和葡萄糖组成。它主要成分为低分子量多糖,分子量为8.93×103。此外,W-CBP80Ⅰ具有体外清除DPPH,羟基和超氧阴离子自由基活性。
蛹虫草,多糖,结构特征,抗氧化
越来越多的研究发现,包括癌症、血管疾病、糖尿病和神经退行性疾病等在内的人类许多疾病具有一个共同特征,即:源自机体的自由基及其他活性氧的异常产生和/或清除[1-2]。因此,基于保健和预防疾病的目的,寻找天然抗氧化物质并开发为功能食品和药物显得尤为重要。目前已有许多研究发现不同来源的多糖能够有效清除自由基[3-4]。
蛹虫草(Cordyceps militaris)被认为是名贵的冬虫夏草(C.sinensis)的重要替代品,这主要是由于两者多糖具有高度相似性,且前者人工培养较为成功[5]。蛹虫草多糖是其主要活性成分之一,具有多种功效,包括抗氧化[6]、免疫调节[7-8]、降血糖[9]、抗肿瘤[7]、抗血管生成[10]以及抗炎活性[11]等。多糖的理化性质及结构分析主要包括:溶解度、比旋光度、粘度、相对分子量、空间构象、单糖组成、构效关系等[4,12]。由于结构极其复杂,加上现阶段分析手段有限,因而多糖结构的研究多不完善,仍有待继续深入探索。
尽管多糖结构鉴定有一定难度,但是对于构效关系研究却是必需的。一般采用气相色谱分析单糖组成及比例,半乳糖苷酶解、1H-NMR及IR分析糖苷键构型,完全甲基化与GC及GC-MS、经高碘酸氧化和Smith降解分析多糖分枝情况等[12]。
本研究中探讨一种蛹虫草水溶性多糖W-CBP80Ⅰ是否具有体外抗氧化活性,并描述其结构特征,以期进一步揭示其结构、性质与功能的关系。
1 材料与方法
1.1 材料与仪器
蛹虫草C19子实体 深圳澎源生物技术有限公司提供;甲硫氨酸、氯化硝基四氮唑蓝、核黄素和1,1-二苯基苦基苯肼(DPPH) 购自Sigma公司,均为分析纯试剂;Sephadex G-100 GE公司产品;Sephadex G-200 上海索莱宝生物科技有限公司产品;Dextran系列标准品 色谱纯,分子量为738~8.35×105,共9种,Fluka公司产品。
RE52-2旋转蒸发器、CXG-1电脑恒温层析柜 海沪西分析仪器厂有限公司;Nicolet Magna 760型傅立叶变换红外光谱仪 美国尼高力公司;Agilent 1100高效液相色谱仪、Agilent 6890GC/5973MS气相色谱/质谱联用仪 美国安捷伦公司;Bruker AVANCE III 500M NMR型超导核磁共振谱仪 瑞士Bruker公司。
1.2 实验方法
1.2.1 多糖的分离纯化 按照Chen X L[13]方法进行提取及分离纯化,即采用终浓度50%的乙醇提取出多糖后,再将剩余溶液加乙醇至终浓度为80%,得80%醇析粗多糖(W-CBP80)。W-CBP80以0.4 mL/ min流速经Sephadex G-100分子筛层析进一步纯化,采用硫酸-苯酚法检测总糖含量。收集主峰部分即为W-CBP80Ⅰ,冷冻干燥备用。
1.2.2 多糖纯度检测、分子量及单糖组成分析 多糖纯度采用Sephadex G-200柱层析(2.6 cm×40 cm,蒸馏水平衡和洗脱,流速为0.4 mL/min)和凝胶渗透色谱(GPC)检测。分子量和单糖组成根据Chen X L[13]分别采用GPC、GC-MS(DB-1石英毛细管柱,15 m×0.2 mm,0.33 μm)法分析。GPC采用0.05 mol/L NaH2PO4-Na2HPO4缓冲液(pH=6.7,加0.05%NaN3)为流动相,流速0.8 mL/min,进样量为20 μL。将9种不同分子量的多糖标样按黄晓兰[14]方法建立普适校正曲线,多糖样品在同样条件下测定,计算分子量。GC-MS色谱条件按文献设置[13],采用葡萄糖、阿拉伯糖、木糖、半乳糖、甘露糖、核糖作为标准单糖,分析W-CBP80Ⅰ的单糖组成。
1.2.3 W-CBP80Ⅰ的IR和NMR光谱1H NMR和13C NMR的检测:适量的W-CBP80Ⅰ加约0.6 mL氘代溶剂,按标准程序采集数据。检测温度采样次数(扫描次数,NS)32,1H共振频率500 MHz,温度(T)293.7 K;13C共振频率125 MHz,温度(T)294.7 K。IR光谱采用KBr压片法分析。
1.2.4 多糖体外清除自由基作用 多糖对DPPH自由基、羟自由基和超氧阴离子自由基的清除作用分别采用3.0 mL的DPPH乙醇体系、3.0 mL的Fenton体系以及4.0 mL的甲硫氨酸-氯化硝基四氮唑蓝-核黄素体系进行[13]。DPPH实验中,1.5 mL 0.1 mmol/L的DPPH溶液与1.5 mL不同浓度的W-CBP80或W-CBP80Ⅰ充分混合,以只含蒸馏水和DPPH的溶液体系为对照,分别以试剂空白液作为空白对照,25℃水浴30 min,测517 nm吸光值。羟自由基清除采用固定反应时间法,在相同体积的反应体系中加入一系列不同浓度的W-CBP80、W-CBP80Ⅰ,补加蒸馏水至3 mL,混匀,37℃水浴保温30 min,以只含蒸馏水和反应试剂的体系为对照,测定510 nm吸光值。超氧阴离子清除实验中,在反应体系中加入梯度用量的W-CBP80Ⅰ,用50 mmol/L PBS(pH7.8)补足至4 mL,以不加多糖的反应液作对照,经6500 K标准光光照30 min,测定560 nm吸光值。清除活性计算公式为:清除率(%)=[(Ac-As)/Ac]×100,其中Ac和As分别为对照和多糖处理组的吸光值。采用SPSS16.0计算IC50。
2 结果与讨论
2.1 W-CBP80Ⅰ的分离纯化
采用Sephadex G-100柱层析纯化后得到一个多糖峰,收集主峰部分即为W-CBP80Ⅰ(图1)。WCBP80Ⅰ经Sephadex G-200柱层析,只有一个多糖峰,且峰形窄、分布对称,蛋白含量低,表明纯度较高(图2)。它在GPC图谱中出现三个峰(图3),相对含量分别为1.35%、1.93%和96.73%,表明其主要含低分子量多糖,同时有少量高分子量和中分子量多糖。

图1 W-CBP80的Sephadex G-100柱层析图Fig.1 Elution profile of W-CBP80 in Sephadex G-100 column chromatograph
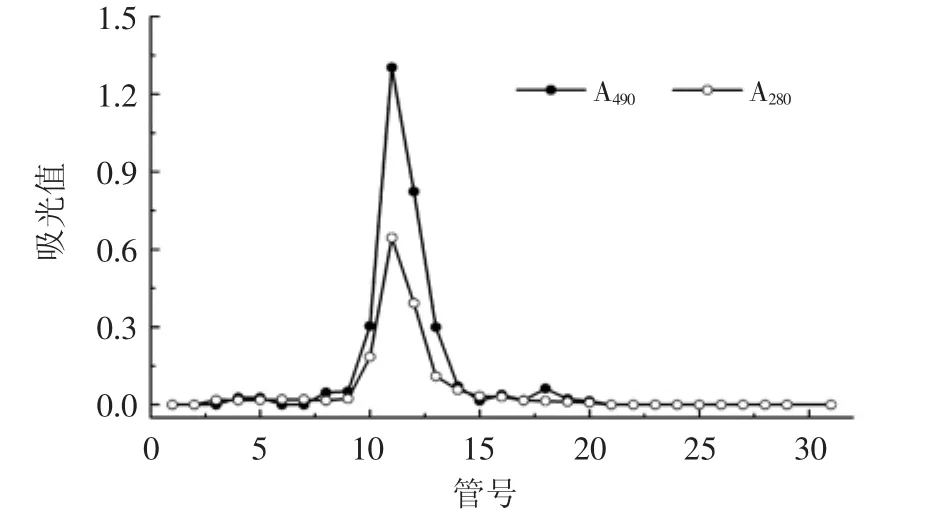
图2 W-CBP80Ⅰ的Sephadex G-200柱层析图Fig.2 Elution profile of W-CBP80Ⅰin Sephadex G-200 column chromatography
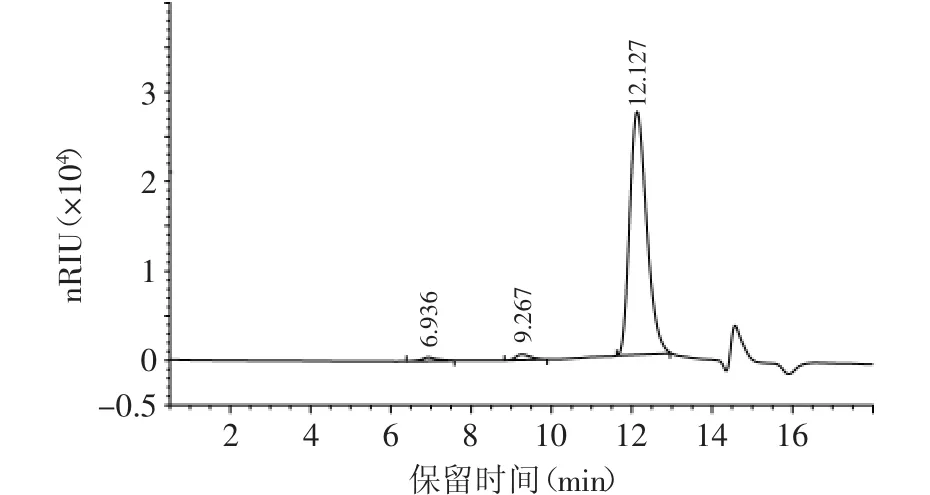
图3 W-CBP80Ⅰ的GPC图谱Fig.3 GPC profile of W-CBP80Ⅰ
2.2 W-CBP80Ⅰ单糖组成及分子量
GC-MS结果表明(表1),W-CBP80Ⅰ的单糖成分主要为甘露糖、半乳糖和葡萄糖,含量分别为31.18%、29.58%、28.80%。同时含有少量的阿拉伯糖(5.90%)、鼠李糖(1.79%)、木糖(1.76%)以及核糖(1.00%)。尽管单糖组成与W-CBP50Ⅱ相似[13],但是每种单糖含量有很大区别。GPC结果见表2,表明W-CBP80Ⅰ主要由小分子量多糖组成,分子量为8.93×103,这与已研究的一种水提多糖W-CBP50Ⅱ的分子量相近[13]。
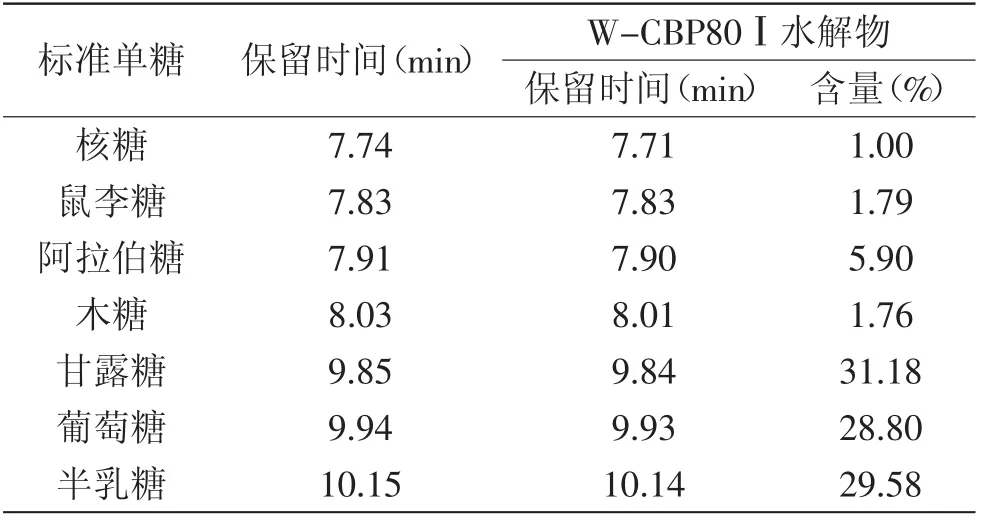
表1 W-CBP80Ⅰ组成单糖的GC-MS分析结果Table1 Results of the monosaccharide composition of W-CBP80Ⅰdetermination with GC-MS
2.3 W-CBP80Ⅰ的结构特征
W-CBP80Ⅰ的结构特征采用红外光谱(IR)和核磁共振NMR进行分析。W-CBP80Ⅰ的IR结果见图4,显示:样品在4000~400 cm-1区具有多糖类物质的一般特征。其红外光谱与W-CBP50Ⅱ的红外光谱相似,只是少量吸收峰强度和峰位有小范围变化。羟基的伸缩振动吸收峰3422 cm-1附近,峰强度低于W-CBP50Ⅱ;2888 cm-1附近的吸收峰是C-H的伸缩振动峰,是糖类的特征吸收峰;1413 cm-1附近的吸收峰是C-O的伸缩振动或者C-H及O-H的弯曲振动;1060 cm-1和1112 cm-1为吡喃糖环的醚键(C-O-C)的C-O伸缩振动,是吡喃糖环羟基的变角振动吸收峰,说明其中的单糖以吡喃糖苷的形式存在。在842 cm-1处的吸收峰是α型端基差向异构体的C-H变角振动引起,表明α-构象环的存在[15-16]。在1655 cm-1附近的峰是C=O伸缩振动峰。

图4 W-CBP80Ⅰ的红外图谱Fig.4 IR spectrum of W-CBP80Ⅰ
由图5可知,W-CBP80Ⅰ1H NMR谱中有两个异头质子信号5.122、5.115 ppm,表明其含有α型糖苷键。4.688 ppm的强信号是溶剂共振峰或β型糖苷键的信号[12,17],因此W-CBP80Ⅰ可能既有α糖苷键,又有β糖苷键。

图5 W-CBP80Ⅰ的1H NMR图谱Fig.51H NMR spectra of W-CBP80Ⅰ
由图6可知,W-CBP80Ⅰ的13C NMR谱有96.441 和92.256 ppm两个异头碳信号,表明其含有α糖苷键[12],这与1H NMR谱结果以及IR中842 cm-1出现吸收峰结果吻合[18]。据此推断W-CBP80Ⅰ中主要含有α糖苷键。但是,其他四种单糖信号未得到,可能是由于它们含量很低的原因。
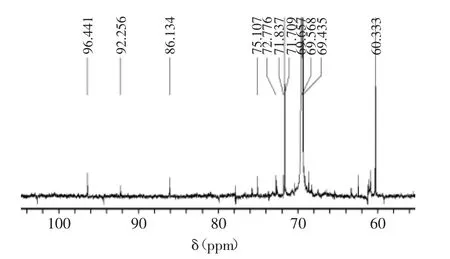
图6 W-CBP80Ⅰ的13C NMR图谱Fig.613C NMR spectra of W-CBP80Ⅰ
国内外研究者已从蛹虫草中分离得到几种具有抗氧化活性的多糖[6-7],包括P70-1[19]、CPS-1[11]、CM-jd-CPS2和CM-jd(Y)-CPS2[20]。W-CBP80Ⅰ与它们在单糖组成、糖苷键及分子量方面存在较大区别。CM-jd-CPS2和CM-jd(Y)-CPS2均主要含甘露糖、葡萄糖和半乳糖[20],但三者含量差异大,有别于W-CBP80Ⅰ的情况。W-CBP80Ⅰ含有少量阿拉伯糖和核糖,而CPS-1[11]、P70-1[19]、CM-jd-CPS2和CM-jd(Y)-CPS2[20]中不含此两种单糖。CPS-1和P70-1都含有β糖苷键,它们的IR谱中分别在890、893 cm-1出现吸收峰[11,19],而W-CBP80Ⅰ的IR谱中842 cm-1的吸收峰表明其主要含α糖苷键,它的1H NMR和13C NMR也支持此结论。

表2 W-CBP80Ⅰ分子量测定结果Table2 Result of molecular weight of W-CBP80Ⅰ
另外,尽管W-CBP80Ⅰ与此前报道的W-CBP50Ⅱ[13]在分子量上具有相似性,但二者在单糖含量、IR吸收特征及1H NMR谱信号方面有诸多不同。鉴于二者分子量相近,暗示前者可能含有更多分支[21]。
2.4 自由基清除活性
DPPH法已成为体外研究天然产物抗氧化活性广泛使用的方法。目前普遍认为的机理是:抗氧化物质清除DPPH自由基是由于它们的氢贡献能力。超氧阴离子是机体中产生的第一种自由基,氧化性较弱。它能够通过歧化反应产生包括羟自由基在内的较强的活性氧种类。而羟自由基是机体中最活跃的活性氧,能够造成多种损伤[16,22]。
由图7和图8可知,W-CBP80和W-CBP80Ⅰ都具有自由基清除活性,且具有剂量依赖性。W-CBP80能够清除DPPH·和羟自由基:0.366 mg/mL的W-CBP 80对DPPH·的清除率为84.18%,IC50为0.106 mg/mL;0.575 mg/mL的W-CBP80对羟自由基的清除率为34.23%(图7)。W-CBP80Ⅰ能够清除DPPH·、羟自由基和超氧阴离子自由基:0.243 mg/mL的W-CBP80Ⅰ对DPPH自由基的清除率为89.14%,IC50为0.103 mg/mL;0.596 mg/mL的W-CBP80Ⅰ对羟自由基的清除率为44.69%;0.177 mg/mL的W-CBP80Ⅰ对超氧阴离子自由基的清除率为50.40%(图8)。由此可见,W-CBP80Ⅰ对羟自由基清除活性强于W-CBP80,而二者对DPPH清除能力相当。W-CBP80Ⅰ对三种自由基清除顺序为:DPPH自由基>超氧阴离子自由基>羟自由基,这与之前报道的多糖W-CBP50Ⅰ的活性一致[13]。
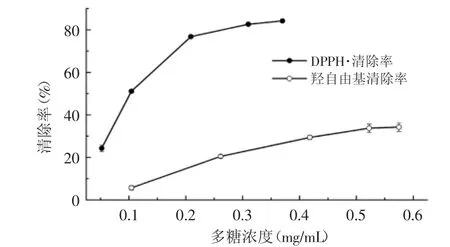
图7 W-CBP80对DPPH和羟自由基清除活性Fig.7 Scavenging effect of W-CBP80 on DPPH and hydroxyl radical

图8 W-CBP80Ⅰ对DPPH自由基、羟自由基和超氧阴离子自由基的清除活性Fig.8 Scavenging effect of W-CBP80Ⅰon DPPH,hydroxyl and superoxide radical
粗多糖W-CB80和纯化的多糖W-CBP80Ⅰ对DPPH的清除活性均强于羟自由基清除活性,这与W-CBP50Ⅱ的活性一致。然而,二者对羟自由基的清除活性比P70-1和CMP-1的都弱[19,23]。此外,尽管有许多抗氧化的文献报道,机理却并不清楚。清除DPPH和羟自由基的可能机理是,多糖W-CBP80和W-CBP80Ⅰ中的羟基能够提供氢原子给DPPH和羟自由基,从而将它们转变成非自由基产物或对机体无毒的产物,终止自由基介导的反应[18]。多糖超氧阴离子自由基的清除机理仍未充分了解。它可能与酚类化合物对超氧阴离子自由基的清除机理相似,即还原活性对清除自由基起作用,且可能与酚羟基数量有关[24]。
3 结论
采用乙醇分级沉淀结合分子筛层析法从蛹虫草中分离多糖W-CBP80Ⅰ。W-CBP80Ⅰ多糖经Sephadex G-200和GPC鉴定纯度较高,主要含分子量较小的多糖(96.73%),分子量为8.93×103,含少量大分子(1.35%)和中分子多糖(1.93%)。W-CBP80Ⅰ的单糖组分主要为葡萄糖(28.80%)、甘露糖(31.18%)和半乳糖(29.58%),少量阿拉伯糖(5.90%),微量的核糖(1.00%)、鼠李糖(1.79%)及木糖(1.76%)。W-CBP80Ⅰ中的单糖主要以α型异头结构体的环形结构存在,也可能有β型,糖苷键为α型。W-CBP80和W-CBP80Ⅰ都具有体外自由基清除活性:W-CBP80清除DPPH自由基的IC50为0.106 mg/mL;0.575 mg/mL的W-CBP80对羟自由基的清除率为34.23%。W-CBP80Ⅰ清除DPPH的IC50为0.103 mg/mL;0.596 mg/mL的W-CBP80Ⅰ对羟自由基的清除率为44.69%;0.177 mg/mL的WCBP80Ⅰ对超氧阴离子的清除率为50.40%,显示出其具有作为抗氧化剂在功能食品中应用的潜力。
[1]Domann F E.Aberrant Free Radical Biology is a Unifying Theme in the Etiology and Pathogenesis of Major Human Diseases [J].International Journal of Molecular Sciences,2013,14(4):8491-8495.
[2]Gutowski M,Kowalczyk S.A study of free radical chemistry:their role and pathophysiological significance[J].Acta Biochim Pol,2013,60(1):1-16.
[3]Stachowiak B,Regula J.Health-promoting potential of edible macromycetes under special consideration of polysaccharides:a review[J].Eur Food Res Technol,2012,234(3):369-380.
[4]Hu D J,Cheong K L,Zhao J,et al.Chromatography in characterization of polysaccharides from medicinal plants and fungi[J].Journal of Separation Science,2013,36(1SI):1-19.
[5]Wu D,Xie J,Wang L,et al.Characterization of bioactive polysaccharides from Cordyceps militaris produced in China using saccharide mapping[J].Journal of Functional Foods,2014,9:315-323.
[6]Chen R,Jin C,Li H,et al.Ultrahigh pressure extraction of polysaccharides from Cordyceps militaris and evaluation of antioxidant activity[J].Sep Purif Technol,2014,134:90-99.
[7]Jing Y S,Cui X L,Chen Z Y,et al.Elucidation and biological activities of a new polysaccharide from cultured Cordyceps militaris[J].Carbohyd Polym,2014,102:288-296.
[8]Zhu L,Tang Q,Zhou S,et al.Isolation and Purification of a Polysaccharide from the Caterpillar Medicinal Mushroom Cordyceps militaris(Ascomycetes) FruitBodies and Its Immunomodulation of RAW 264.7 Macrophages[J].International Journal of Medicinal Mushrooms,2014,16(3):247-257.
[9]Li S P,Zhang G H,Zeng Q,et al.Hypoglycemic activity of polysaccharide,with antioxidation,isolated from cultured Cordyceps mycelia[J].Phytomedicine,2006,13(6):428-433.
[10]Zeng Y,Han Z,Qiu P,et al.Salinity-induced anti-angiogenesis activities and structural changes of the polysaccharides from cultured cordyceps militaris.[J].PLOS ONE,2014,9(9):e103880.
[11]Yu R,Song L,Zhao Y,et al.Isolation and biological properties of polysaccharide CPS-1 from cultured Cordyceps militaris[J].Fitoterapia,2004,75(5):465-472.
[12]张惟杰.糖复合物生化研究技术[M].第二版.杭州:浙江大学出版社,1999.
[13]Chen X L,Wu G H,Huang Z L.Structural analysis and antioxidant activities of polysaccharides from cultured Cordyceps militaris[J].Int J Biol Macromol,2013,58:18-22.
[14]黄晓兰,吴惠勤,黄芳,等.破壁与不破壁灵芝孢子粉多糖的分析[J].中草药,2006,37(6):813-816.
[15]Ding X,Hou Y,Hou W.Structure elucidation and antioxidant activity of a novel polysaccharide isolated from Boletus speciosus Forst[J].Int J Biol Macromol,2012,50(3):613-618.
[16]Yao L,Zhao Q,Xiao J,et al.Composition and antioxidant activity ofthe polysaccharides from cultivated Saussurea involucrata[J].Int J Biol Macromol,2012,50(3):849-853.
[17]Bock K,Pedersen C,Pedersen H.Carbon-13 Nuclear Magnetic Resonance Data for Oligosaccharides[M].Academic Press,1984.
[18]Niu Y,Yan W,Lv J,et al.Characterization of a Novel Polysaccharide from Tetraploid Gynostemma pentaphyllum Makino [J].J Agr Food Chem,2013,61(20):4882-4889.
[19]Yu R M,Yang W,Song L Y,et al.Structural characterization and antioxidant activity of a polysaccharide from the fruiting bodies of cultured Cordyceps militaris[J].Carbohyd Polym,2007,70(4):430-436.
[20]Wu F Y,Yan H,Ma X N,et al.Comparison of the structural characterization and biological activity of acidic polysaccharides from Cordyceps militaris cultured with different media[J].World J Microb Biot,2012,28(5):2029-2038.
[21]Cheng H N,Neiss T G.Solution NMR Spectroscopy of Food Polysaccharides[J].Polymer Reviews,2012,52(2):81-114.
[22]Zhou C,Yu X,Zhang Y,et al.Ultrasonic degradation,purification and analysis of structure and antioxidant activity of polysaccharide from Porphyra yezoensis Udea[J].Carbohyd Polym,2012,87(3):2046-2051.
[23]Jing Y,Cui X,Chen Z,et al.Elucidation and biological activities of a new polysaccharide from cultured Cordyceps militaris[J].Carbohyd Polym,2014,102:288-296.
[24]Liu F,Ooi V E C,Chang S T.Free radical scavenging activities of mushroom polysaccharide extracts[J].Life Sci,1997,60(10):763-771.
Structural characterization of a polysaccharide from cultured Cordyceps militaris with antioxidant activity
CHEN Xiao-li1,WU Guang-hong2,HUANG Zhuo-lie2
(1.Fisheries College,Guangdong Ocean University,Zhanjiang 524088,China;2.College of Life Science,South China Agricultural University,Guangzhou 510642,China)
A polysaccharide W-CBP80Ⅰ was isolated from the fruiting bodies of cultured Cordyceps militaris and characterized using GPC,GC-MS,IR,1H NMR and13C NMR.The results indicated that it contained α-type glycosidic linkages and was mainly composed of α-mannose,α-galactose and α-glucose.Its main component was low molecular weight polysaccharide with Mwof 8.93×103.In addition,W-CBP80Ⅰ exhibited scavenging capacities against DPPH,hydroxyl and superoxide radicals in the antioxidant assay in vitro.
Cordyceps militaris;polysaccharide;structure characterization;antioxidation
TS201.1
A
1002-0306(2016)06-0155-05
10.13386/j.issn1002-0306.2016.06.023
2015-08-24
陈小丽(1978-),女,博士,研究方向:多糖生物化学,E-mail:lilychen77@163.com。
