钛表面微纳结构制备及原位沉积磷酸钙*
2016-09-16肖东琴谭震翁杰匙峰冯刚
肖东琴 谭震 翁杰 匙峰 冯刚
(1. 南充市中心医院·川北医学院第二临床学院组织工程与干细胞研究所,四川 南充 637000;2. 西南交通大学 材料先进技术教育部重点实验室,四川 成都 610031)
·论著·
钛表面微纳结构制备及原位沉积磷酸钙*
肖东琴1,2谭震2翁杰2匙峰2冯刚1
(1. 南充市中心医院·川北医学院第二临床学院组织工程与干细胞研究所,四川 南充 637000;2. 西南交通大学 材料先进技术教育部重点实验室,四川 成都 610031)
目的钛表面结构及成分会影响钛和骨组织的界面键合,为增强钛表面的生物活性,促进材料与骨组织的键合,本文旨在钛表面构建微纳结构并原位沉积磷酸钙。方法首先,通过碱热处理,在钛表面构建微纳结构。将处理后的钛置于添加环己烷六羧酸(H6L)的钙磷溶液中,进行水热处理。采用SEM,EDX,XRD及FTIR等分析手段对材料进行表征。此外,考察了钛碱热处理与原位沉积磷酸钙钛表面成骨细胞生长情况。结果240 ℃碱热处理下,钛表面生成平均长度在8 μm左右的钛酸钠纳米线。经过二次水热后,磷酸钙颗粒在纳米线上发生原位沉积,而未加入H6L的钙磷溶液中,纳米线上没有发生磷酸钙沉积。这说明,H6L的加入有利于磷酸钙在纳米线上沉积。细胞结果表明,原位沉积磷酸钙的钛表面更有利于细胞增殖。结论本文通过二次水热的方法,成功在钛表面制备出含磷酸钙/纳米线的多级微纳结构,有望应用于骨植入材料表面改性。
钛;纳米线;磷酸钙;水热处理;原位沉积
钛及钛合金因其具有良好的生物相容性、机械性能和优异的耐腐蚀性能,广泛应用于人体植入材料[1]。尽管其具有良好的生物相容性,但在植入初期不能与骨发生直接键合,缺乏生物活性[2]。因此,对钛表面进行改性,已引起人们的广泛关注。研究表明:具有纳米表面结构的钛金属比传统的钛金属有更好的细胞粘附性及成骨分化能力[3]。同时,Zhao等人认为,微纳米结构对成骨细胞的增殖,蛋白质合成,碱性磷酸酶合成,胶原蛋白的分泌,细胞外基质矿化具有增强效应[4]。通过热处理形成的具有微纳米结构的多孔钛,新骨生成量明显高于普通多孔钛,具有优良的骨传导能力[5]。磷酸钙具有优异的骨诱导性,有利于新骨形成[6]。因此,在钛及钛合金表面制备磷酸钙生物活性涂层可以有效结合两种材料的优势。金属表面磷酸钙涂层的制备方法包括等离子喷涂,生物矿化,磁控溅射,溶胶-凝胶法和电化学方法等[7-9]。通常在钛金属表面制备磷酸钙涂层,均需解决金属基底与涂层界面的结合问题[10]。因此,如何在已构建的钛纳米结构表面沉积磷酸钙,形成具有优良界面结合和促进骨键合的植入材料已成为亟待解决的问题。本文通过碱热处理,在钛表面制备纳米线结构。然后二次水热,采用小分子调控磷酸钙生长,使其在钛纳米线上原位沉积,从而成功构建了具有多级微纳结构的钛植入体表面。
1 实验方法
1.1钛表面纳米结构制备将钛箔(纯度>99.9%)剪成块状,大小为1 cm×10 cm。配置浓度为1 M的氢氧化钠(NaOH)溶液,量取60 mL注入反应釜中。然后,将钛箔放入反应釜中,置于240 ℃下,反应5小时。反应结束后,取出并用去离子水冲洗,最后在60℃烘箱中烘干备用。
1.2原位沉积磷酸钙分别称取0.708 g四水硝酸钙(Ca(NO3)2·4H2O),0.644 g十二水磷酸氢二钠(NaHPO4·12H2O),0.15 g环己烷六羧酸(H6L)溶于60 mL去离子水中,搅拌溶解,并用HNO3调节溶液pH值至2.5,加入2.00 g尿素(CO(NH2)2),持续搅拌直到完全溶解。将配置好的溶液注入反应釜中,并将碱热处理后的钛箔置于反应釜内,150 ℃下反应3小时。结束后取出并用去离子水冲洗,60 ℃烘干待用。
1.3测试与表征利用扫描电子显微镜(SEM,FEI Quanta 200)观察样品表面形貌,X射线能谱仪(EDS)分析样品表面元素成分;并用X射线衍射仪(XRD,PhilipsX′Pert Pro)分析样品物相成分,红外光谱仪(FT-IR,Nicolet 5700)分析样品化学结构,酶标分析仪(μ-Quant,DNM-9602G)测定吸光度值。
1.4体外细胞实验选取水热碱处理和原位沉积磷酸钙的钛箔作为试验样品,每组5个平行样。将试样置于24孔板中,再将成骨细胞(取自大鼠颅盖骨)按照接种密度为1×104个/孔接种于材料上,在CO2恒温培养箱中37 ℃培养。培养24小时后,取出试样用PBS漂洗3次,2.5%戊二醛溶液固定,梯度乙醇脱水处理,再用乙酸乙酯脱脂,真空干燥后喷金,用SEM观察细胞形貌。培养第1、3、5及7天后采用Alamar Blue法检测成骨细胞活性与增殖情况。即弃除孔板中培养基,加入Alamar Blue工作液(α-MEM∶Alamar Blue= 9∶1)1 mL,放入CO2恒温培养箱中37 ℃孵育4小时后,吸取上清液200 μl置于96孔板中测定其在570 nm波长处吸光度值。
2 结果
2.1钛表面纳米结构SEM分析图1为水热反应下钛表面制备纳米线结构的SEM图。由图可知,钛箔表面形貌呈现大量纳米线状结构,且较为均匀,长度为5~10 μm,宽度为50~200 nm。纳米线表面较为平整光滑。从对应的XRD图谱可知,样品在2θ=35.3°、38.4°、40.4°、53.2°和63.2°分别对应于钛标准图谱(JSPDS 00-001-1198)的(100),(002),(101),(102),(110)晶面,而出现的36.5°,48.5°则对应于钛酸盐(JSPDS 00-048-0693)的(251),(063)晶面。由此可知,经水热碱液处理后,钛箔表面形成的纳米线主要成分是钛酸盐(NayH2-yTinO2n+1)[11]。
Dong等人研究了240 ℃条件下NaOH溶液浓度对钛网表面形貌的影响[12],采用0.25 M NaOH溶液水热处理时,表面形成了钛纳米棒状结构,浓度升至1 M后,钛表面形成宽约50~100 nm,长5~10 μm的钛纳米线,与本实验结果类似。本课题组前期研究了不同温度碱热处理对钛表面结构的影响,温度为180 ℃, 200 ℃,240 ℃时,分别得到片层状,纳米棒状以及纳米线状结构[13]。研究表明,金属钛表面的纳米线,能够模仿自然细胞外基质的结构,促进细胞增殖粘附[14]。同时,其较高的比表面积,有利于药物的吸附与控释。所以本实验选择温度为240 ℃,浓度为1 M NaOH进行第一步水热制备钛表面纳米线结构。
2.2原位沉积磷酸钙的SEM分析图2(a、b)为钛表面微纳结构上原位沉积磷酸钙的SEM图。由图可知,二次水热后钛纳米线上原位沉积了珠子状物质,且该物质并未形成较厚涂层覆盖原有钛纳米线微结构(图2(a))。从图2(b)中可以看出,钛纳米线中部被捆扎,且纳米线表面变得粗糙,表面有珠子状物质生成。对珠子状物质进行EDX图谱(图2(c))分析可知,其主要成分为Ca、P、Ti、O,其中Ca/P摩尔比为1.6。
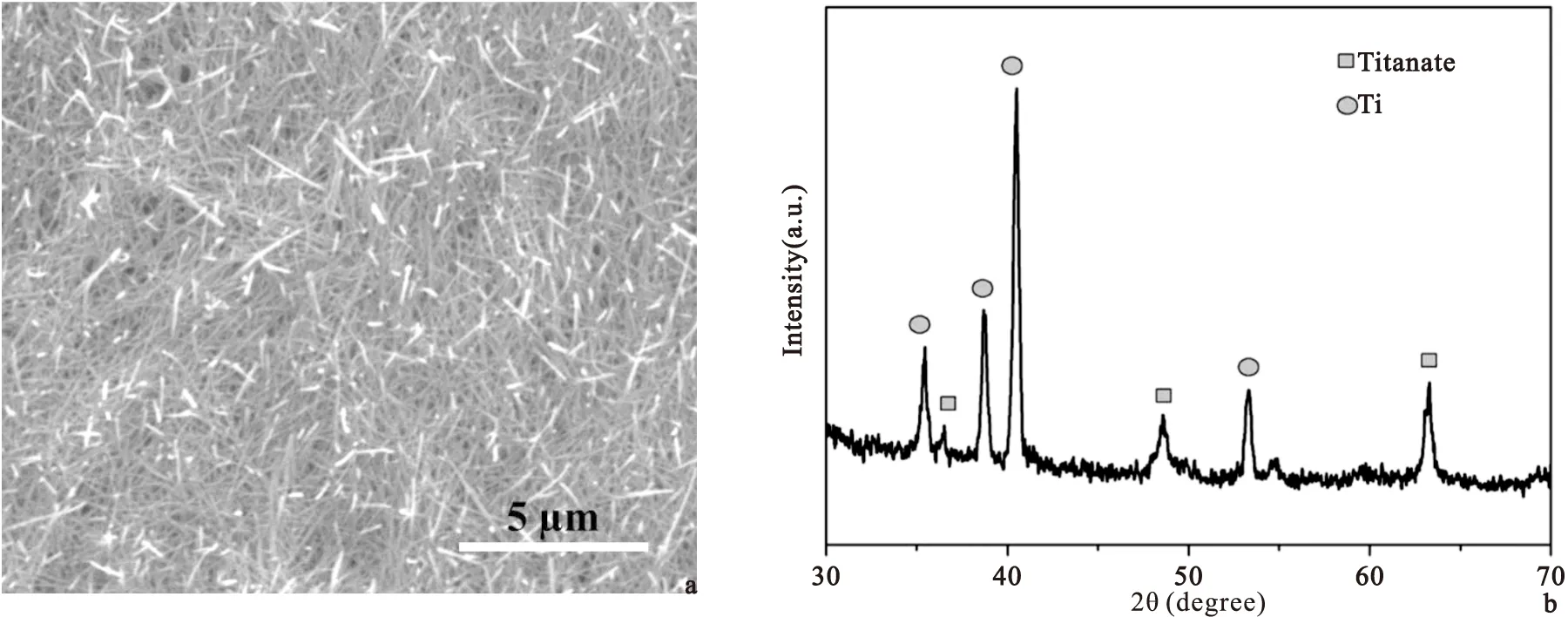
图1钛表面微纳米结构的(a)SEM图及对应的(b)XRD图谱
Figure1(a) SEM images of nano-structure on Ti surface and (b) corresponding XRD spectrum
原钛纳米线中的钠离子并未检测到,其原因可能是钙离子取代了钛纳米线(主要由钛酸钠构成)中的钠离子[14]。
水热矿化液中钙磷离子浓度会影响磷酸钙的成核、生长。Zhang等人的研究表明当钙离子浓度高于0.1M时,沉积的磷酸钙涂层完全覆盖于纳米线之上,进而掩盖了纳米线本身的结构[15]。本实验将钙离子浓度降低到0.05M,磷酸钙沉积在纳米线表面,并保存钛表面纳米线本身的微结构,从而构建具有多级微纳结构的钛表面。究其原因在于钙磷离子浓度的降低,会在磷酸钙成核后,抑制磷酸钙的生长[16]。就反应温度而言,宋等人发现水热合成磷酸钙时,温度在90℃时形成主相为羟基磷灰石的混合磷酸钙[17]。当温度达到150℃时,产物为纯相羟基磷灰石,且随着反应时间的延长其长径比不断升高。因此,本实验为不覆盖原有钛纳米线结构的基础上,原位沉积磷酸钙,合成具有多级微钠结构表面的钛植入体,选择实验条件为150℃,3小时。
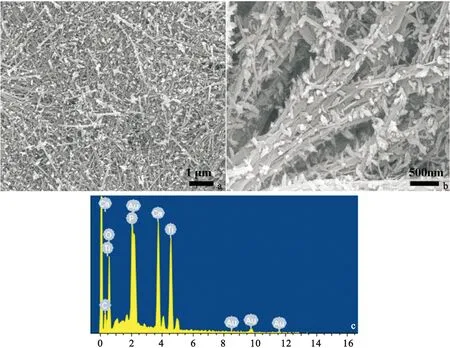
图2原位沉积磷酸钙的SEM与EDX图
Figure2(a,b) SEM images of in-situ deposited calcium phosphate on Ti nanowire and (c) corresponding EDX graph
2.3原位沉积磷酸钙的结构、组成分析图3a为二次水热反应后钛表面的XRD图谱。S1为反应溶液添加了H6L的反应产物,S2为反应溶液未添加H6L的反应产物。与钛、钛酸盐(JSPDS 01-089-5009)和羟基磷灰石(HA,JSPDS 00-001-1008)标准图谱对比,可以看出除原有的钛与钛酸盐的峰外,S1在2θ=25.7°,28.7°,32.0°,49.5°出现了HA的特征峰,并且从图2c可知,钛表面含有Ca、P成分,说明钛表面生成了主相为HA的磷酸钙。而在S2的XRD图谱中,并未出现HA的特征峰。图3b为原位沉积磷酸钙的FTIR图,其中S1为反应溶液添加H6L的反应产物,S2为反应溶液未添加H6L的反应产物。分析可知,H6L调控水热沉积磷灰石的样品在1090cm-1处检测到PO43-,在1440cm-1处检测到CO32-。PO43-的出现说明生成了磷酸钙,而磷酸钙中CO32-存在可能是由于尿素分解形成,也不排除样品吸附CO2,生成CO32-[18-19]。由此可见,溶液中添加H6L后,有利于磷酸钙在纳米线上的沉积,与XRD结果一致。Zhao等人采用电化学法,在模拟体液溶液中,通过控制反应电流在钛纳米线上沉积磷酸钙颗粒[20]。而本文则在水热条件下通过小分子调控磷酸钙生长,在钛纳米线上原位沉积磷酸钙,生成多级微钠结构钛表面。
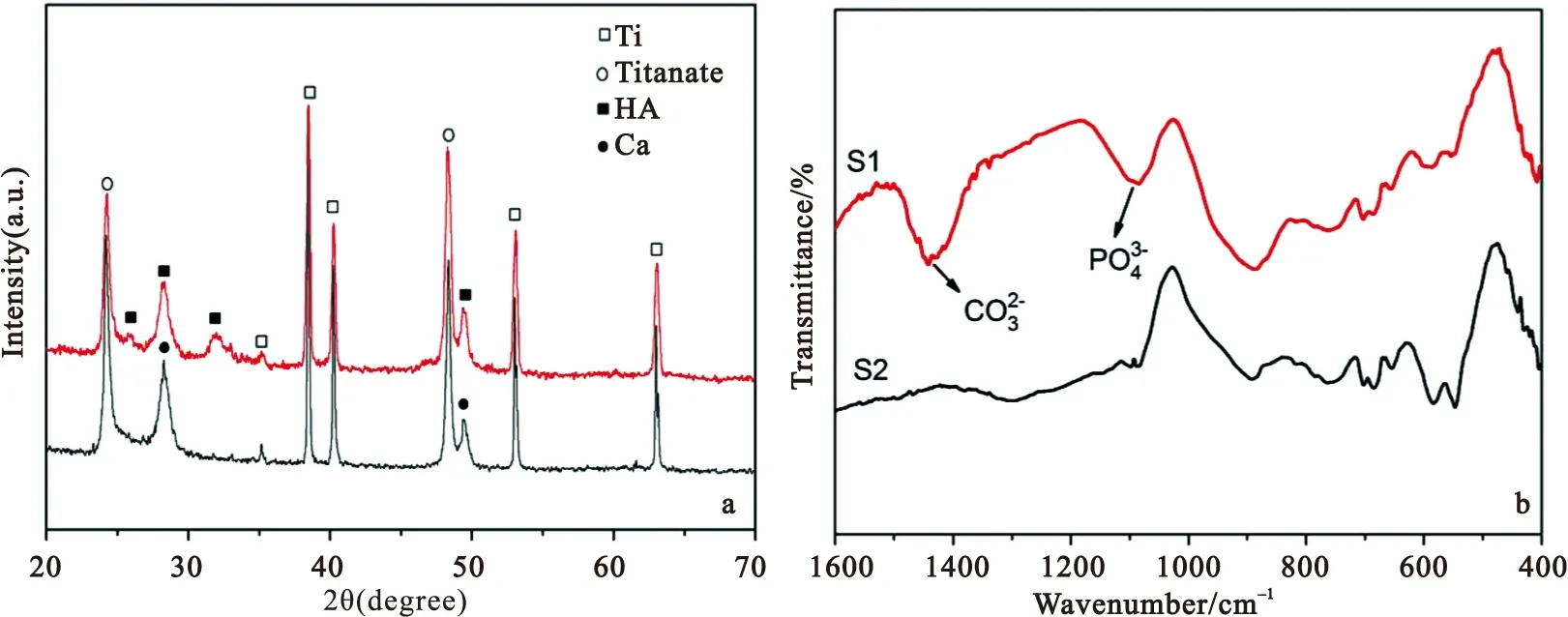
图3原位沉积磷酸钙的XRD图与FTIR图(S1为反应溶液添加了H6L的反应产物,S2为反应溶液未添加H6L的反应产物)
Figure3(a) XRD spectrum of in-situ deposited calcium phosphate on Ti surface and (b) corresponding FTIR spectrum
2.4钛表面碱热处理及原位沉积磷酸钙样品体外生物相容性为考察钛表面纳米线与原位沉积磷酸钙后样品的生物相容性,我们研究了成骨细胞在两种样品表面的铺展、粘附以及增殖情况。图4为成骨细胞在钛纳米线与原位沉积磷酸钙样品表面培养1天的SEM形貌。由图4可知,细胞在两种样品表面铺展、粘附良好,细胞伪足清晰可见。结合Alamar Blue检测结果由图5可知,细胞在接种5天后,原位沉积磷酸钙样品表面细胞增殖情况明显优于钛纳米线表面。综上说明,二次水热后,在钛纳米线上原位沉积磷酸钙,相比于钛纳米线,更有利于细胞的增殖生长。
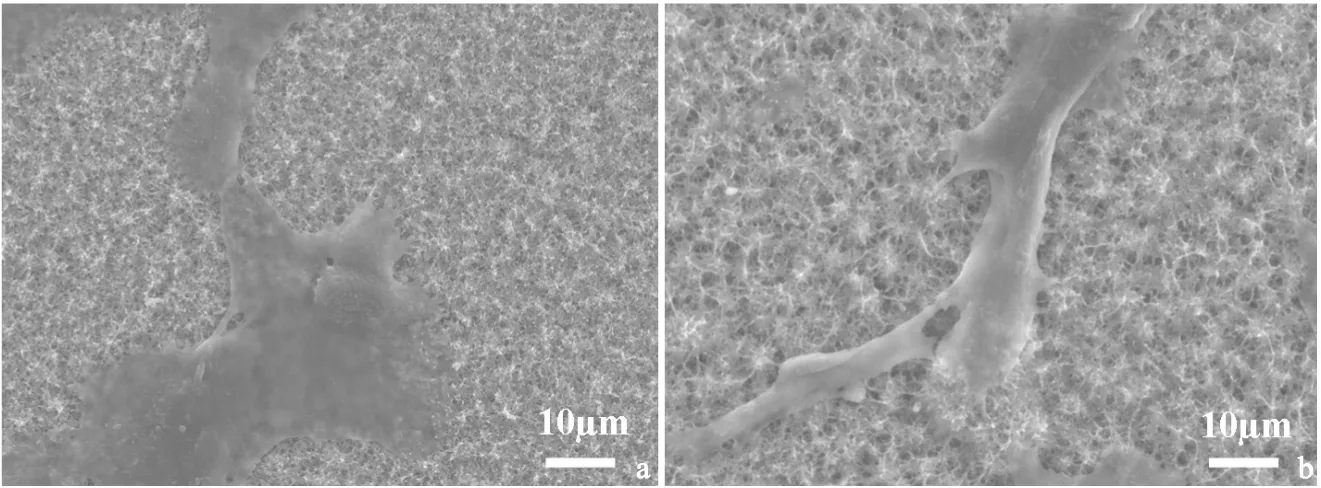
图4钛表面纳米线(a)与原位沉积磷酸钙(b)样品表面细胞粘附图
Figure4SEM images of cell adhesion on (a) Ti nanowires and (b) in-situ deposited calcium phosphate surface
Ding等人采用1 M NaOH,220 ℃反应8小时水热反应得到钛纳米线结构,进行成骨细胞(MG-63)培养,发现钛纳米线不利于细胞增殖[21]。本实验在钛纳米线上原位沉积磷酸钙以后,相比于钛纳米线,细胞增殖情况良好。因此,在钛纳米线上沉积磷酸钙,有利于提高其生物相容性。
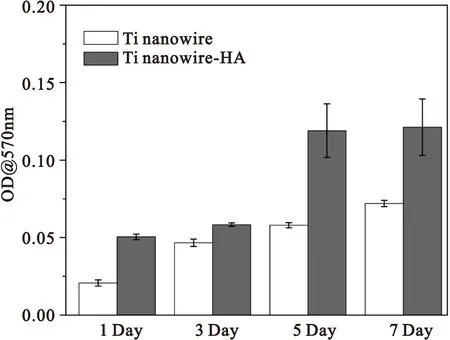
图5细胞在不同样品表面增殖情况
Figure5Cell proliferation on different Ti surfaces
3 讨论
本实验采用二次水热的方法,在钛表面纳米线上原位沉积磷酸钙晶体,既保留了原钛表面纳米线结构,又制备出纳米线/磷酸钙多级微纳结构,赋予钛表面生物活性。我们对其反应机理进行推测,开始反应溶液中的钙磷离子在酸性溶液中均匀分布。随着反应的进行,溶液中尿素逐步分解,溶液的pH值升高。反应溶液中的小分子模板剂H6L,分子结构中含有6个羧基,在碱性条件下脱质子化,易与反应溶液中的钙离子发生螯合作用,形成Ca-H6L螯合物。Zhang等认为,H6L易吸附在钛纳米线上,进而与钙螯合,使钙磷离子聚集在纳米线周围,从而在纳米线上沉积磷酸钙颗粒[15]。至于H6L如何在纳米线上吸附,仍需进一步研究。同时,Ouyang等认为,由于钙离子比钠离子活泼,所以钙离子取代了钛酸钠中的钠离子,有效促进羟基磷灰石的定向生长[14]。所以,磷酸钙在钛纳米线上的沉积有可能是钙离子取代纳米线中钠离子所引发的。Ca-H6L中的钙取代纳米线中的钠离子,H6L中的羧基进一步螯合溶液中自由钙离子,进而吸引磷酸根、氢氧根,形成磷酸钙晶核,沉积在钛纳米线上。
在本实验中,采用二次水热的方法,既保持了钛纳米线本身的结构特征,又在纳米线上原位沉积磷酸钙颗粒,赋予钛表面骨诱导性,成功制备了钛纳米线/磷酸钙多级微纳结构。这种多级微纳结构有利于成骨细胞生长,促进骨植入体与组织的键合[22]。
4 结论
采用二次水热的方法,在保持钛表面原纳米线结构的基础上,原位沉积磷酸钙晶体,制备出了具有纳米线/磷酸钙多级微纳结构的钛表面。实验结果表明,小分子调控剂H6L的添加,能促进磷酸钙晶体在钛纳米线上的成核、生长。钙磷离子浓度的降低,能有效控制磷酸钙的生长,使其在纳米线上原位沉积而不至于覆盖纳米线原有结构。且钛纳米线原位沉积磷酸钙后构建的多级微纳结构更有利于细胞生长。此方法操作简单,有望应用于钛植入体表面改性,增强其生物活性。
[1]Titanium in medicine: material science, surface science, engineering, biological responses and medical applications[M]. Springer Science & Business Media, 2012.
[2]Hu X, Shen H, Cheng Y,etal. One-step modification of nano-hydroxyapatite coating on titanium surface by hydrothermal method[J]. Surface and Coatings Technology, 2010, 205(7): 2000-2006.
[3]Webster TJ, Siegel RW, Bizios R. Osteoblast adhesion on nanophase ceramics[J]. Biomaterials, 1999, 20(13): 1221-1227.
[4]Zhao L, Mei S, Chu P K,etal. The influence of hierarchical hybrid micro/nano-textured titanium surface with titania nanotubes on osteoblast functions[J]. Biomaterials, 2010, 31(19): 5072-5082.
[5]Fan X, Feng B, Liu Z,etal. Fabrication of TiO2 nanotubes on porous titanium scaffold and biocompatibility evaluation in vitro and in vivo[J]. Journal of Biomedical Materials Research Part A, 2012, 100(12): 3422-3427.
[6]Wang H, Zhi W, Lu X,etal. Comparative studies on ectopic bone formation in porous hydroxyapatite scaffolds with complementary pore structures[J]. Acta Biomaterialia, 2013, 9(9): 8413-8421.
[7]Vahabzadeh S, Roy M, Bandyopadhyay A,etal. Phase stability and biological property evaluation of plasma sprayed hydroxyapatite coatings for orthopedic and dental applications[J]. Acta Biomaterialia, 2015, 17: 47-55.
[8]Noorakma ACW, Zuhailawati H, Aishvarya V,etal. Hydroxyapatite-coated magnesium-based biodegradable alloy: cold spray deposition and simulated body fluid studies[J]. Journal of Materials Engineering and Performance, 2013, 22(10): 2997-3004.
[9]Franco RL, Chiesa R, Beloti MM,etal. Human osteoblastic cell response to a Ca- and P-enriched titanium surface obtained by anodization[J]. Journal of Biomedical Materials Research Part A, 2009, 88(4): 841-848.
[10] Rajesh P, Muraleedharan CV, Komath M,etal. Laser surface modification of titanium substrate for pulsed laser deposition of highly adherent hydroxyapatite[J]. Journal of Materials Science: Materials in Medicine, 2011, 22(7): 1671-1679.
[11] Suzuki Y, Pavasupree S, Yoshikawa S,etal. Natural rutile-derived titanate nanofibers prepared by direct hydrothermal processing[J]. Journal of Materials Research, 2005, 20(04): 1063-1070.
[12] Dong W, Zhang T, Epstein J,etal. Multifunctional nanowire bioscaffolds on titanium[J]. Chemistry of Materials, 2007, 19(18): 4454-4459.
[13] 张成栋. 水热法制备多级微纳结构钛基磷酸钙复合涂层[D]. 西南交通大学, 2013.
[14] Ouyang J, Sun X, Chen X,etal. Preparation of layered bioceramic hydroxyapatite/sodium titanate coatings on titanium substrates using a hybrid technique of alkali-heat treatment and electrochemical deposition[J]. Journal of Materials Science, 2014, 49(4): 1882-1892.
[15] Zhang CD, Xiao DQ, Fu YK,etal. Fabrication of Nanostructured Hierarchical Coatings Composed of Calcium Phosphate/Titanate on Titanium Substrate[J]. Key Engineering Materials, 2014, 575: 253-258.
[16] Tan J, Saltzman WM. Biomaterials with hierarchically defined micro-and nanoscale structure[J]. Biomaterials, 2004, 25(17): 3593-3601.
[17] 宋云京, 李木森, 温树林, 等. 温度和 pH 值对羟基磷灰石粉体合成的影响[J]. 硅酸盐通报, 2003, 22(2): 7-10.
[18] 肖东琴, 王东微, 任俊臣, 等. 掺铜羟基磷灰石微球的制备及表征[J]. 无机材料学报, 2014, 29(7): 769-775.
[20] Zhao H, Dong W, Zheng Y,etal. The structural and biological properties of hydroxyapatite-modified titanate nanowire scaffolds[J]. Biomaterials, 2011, 32(25): 5837-5846.
[21] Ding X, Yang X, Zhou L,etal. Titanate nanowire scaffolds decorated with anatase nanocrystals show good protein adsorption and low cell adhesion capacity[J]. International Journal of Nanomedicine, 2012, 8(1): 569-579.
[22] 鲁雄, 冯波, 翁杰, 等. 生物材料表面微纳结构对成骨相关细胞的影响[J]. 中国材料进展, 2013, 32(10): 611-622.
Fabrication of micro/nano-structure on titanium surface and in-situ deposition of calcium phosphate
XIAO Dongqin1,2,TAN Zhen2,WENG Jie2,et al
(1.ResearchInstituteofTissueEngineeringandStemCell,TheSecondClinicalInstituteofNorthSichuanMedicalCollege·NanchongCentralHospital,Nanchong637000,Sichuan,China;2.KeyLabofAdvancedTechnologiesofMaterials,MinistryofEducation,SouthwestJiaotongUniversity,Chengdu610031,China)
ObjectiveTitanium (Ti) and alloys are widely used in the bone repair due to their good biocompatibility. The bonding between Ti implants and tissues is significantly affected by Ti surface microstructure and composition. Therefore, in order to enhance the biological activity of the titanium surface and promote the bonding of materials and bone tissues, the study was aimed to construct micro/nano-structures on titanium surface and in-situ deposition of calcium phosphate. MethodsFirst, alkali-heat treatment was used to construct microstructures on titanium surface. Then, CaP crystals were deposited on the treated Ti surface from solutions containing cyclohexanehexacarboxylic acid (H6L) under hydrothermal conditions. Products were characterized by scanning electron microscope equipped with energy disperse spectroscopy, X-ray diffraction and Fourier transform infrared spectroscope spectrometry. In addition, the cell growth on the alkali-heat treated Ti surface and calcium phosphate in-situ deposited Ti surface was also investigated. ResultsNanowires (mean length: ~ 8 μm) formed on the Ti surface at 240 ℃. After the two-step hydrothermal treatment, calcium phosphate particles are deposited on the titanium nanowire, and calcium phosphate could not deposit on titanium nanowire without H6L in solution. The results proved that H6L was beneficial for calcium phosphate deposition on the titanium nanowire. Moreover, cell results indicated that Ti surface modified by calcium phosphate in-situ deposition was more favorable for cell proliferation. ConclusionThe two-step hydrothermal method was successfully used to fabricate hierarchical structure composed of calcium phosphate/nanowire and is expected to be applied to the surface modification of bone implants.
Titanium; Nanowires; Calcium phosphate; Hydrothermal treatment; In-situ deposition
国家自然科学基金面上研究项目(51572228);四川省科技厅应用基础研究项目(2016JY0123);四川省教育厅创新团队资助项目(13TD0030);四川教育厅重大培育项目(15CZ0021)
翁杰,教授,主要研究方向:生物医用材料, E-mail: jweng@swjtu.edu.cn
R 318.08
A
10.3969/j.issn.1672-3511.2016.08.007
2016-04-22; 编辑: 张文秀)
