软骨脱细胞基质-Ⅱ型胶原制备组织工程软骨纳米支架的实验研究*
2016-09-16蒋婷杨泽龙李小兵冯刚
蒋婷 杨泽龙 李小兵 冯刚
( 川北医学院第二临床医学院·南充市中心医院 1.烧伤整形美容外科,2.骨科, ;3.组织工程与干细胞研究所, 四川 南充 637000)
·论著·
软骨脱细胞基质-Ⅱ型胶原制备组织工程软骨纳米支架的实验研究*
蒋婷1杨泽龙2李小兵1冯刚3
( 川北医学院第二临床医学院·南充市中心医院 1.烧伤整形美容外科,2.骨科, ;3.组织工程与干细胞研究所, 四川 南充 637000)
目的探索软骨脱细胞基质CAEM-Ⅱ型胶原(COLⅡ)通过静电纺丝法制备组织工程纳米支架的可行性。方法将兔肋软骨脱细胞、脱脂、酶解后干燥获得CAEM,再将CAEM和COLⅡ按质量比1∶2的比例混合,通过静电纺丝技术制备组织工程纳米支架,通过测定其吸水率、降解率等检测支架的理化性能,用CCK8法评价其细胞毒性及粘附性情况。结果CAEM -COLⅡ纳米支架纤维直径为(627±165.4)nm,吸水率为(623.0±27.4)%,35天降解率为(45.6±5.8)%,CCK8法检测结果显示CAEM-COLⅡ复合支架对软骨细胞具有良好的粘附性,生物学性能良好。结论CAEM- COLⅡ纳米支架能为软骨细胞的生长和增殖提供优良的微环境,在组织工程软骨重建中具有潜在的应用价值。
组织工程纳米支架;Ⅱ型胶原;软骨脱细胞基质;静电纺丝
创伤和关节退行性变导致的关节软骨缺损是临床常见疾病,常导致关节疼痛、畸形及功能障碍,使患者的生活质量明显下降,甚至丧失劳动能力。目前临床治疗主要依靠非手术治疗和关节置换手术。非手术治疗能使部分患者的疼痛症状明显缓解,使关节功能得到一定程度地改善。但许多患者进行非手术治疗后效果差而不得不选择手术,手术治疗近期效果良好。而手术风险及并发症使少部分患者面临更加痛苦的境地。21世纪初有研究者通过软骨细胞注射或软骨细胞膜片移植的方法来治疗软骨缺损疾病,部分患者获得一定的疗效。不过如何让细胞在软骨缺损处浓聚及细胞膜片如何牢固固定等问题难以解决,使得这些方法无法得到临床医生的认可及推广应用,但这开启了组织工程软骨治疗软骨缺损疾病的崭新一页。本研究着重在于探索通过静电纺丝技术制备软骨脱细胞基质-Ⅱ型胶原(Cartilage acellular extracellular matrix-Collagen Ⅱ,CAEM -COLⅡ)组织工程软骨纳米支架,通过对支架理化性能及细胞毒性的检测,显示该支架在软骨组织工程构建中具有潜在的应用价值。
1 材料与方法
1.1主要实验动物、试剂及仪器成年日本大耳兔10只,1周龄日本大耳兔2只,由川北医学院实验动物中心提供。所用动物实验方案均通过川北医学院动物实验管理委员会批准。三氟乙醇(成都贝斯特试剂有限公司,中国)、Trition X-100(北京化学试剂公司),胃蛋白酶(上海蓝季科技发展有限公司),乙二胺四乙酸(EDTA)、碳化二亚胺(EDC)、DNase、RNase、盐酸胍 (Sigma公司,美国),Tris-HCl、高压电源(天津东文公司,中国)、恒流注射泵(保定兰格公司,中国)、扫描电镜(Hitachi公司,日本)、CO2培养箱(Thermo公司,美国)、真空干燥箱(上海一恒科技有限公司),FD-1冷冻干燥机(北京博医康),Biofuge Primo R低温离心机(Thermo Scientific, 美国)。
1.2方法
1.2.1脱细胞基质的制备将成年兔肋软骨去除表面的软组织后,剪碎至约0.5 cm大小,加入5倍软骨体积的0.25%胰酶37 ℃消化35 min, 600 g离心5分钟,PBS洗3次。加入2倍软骨体积,PH为7.5含1%TritonX-100和0.35 mg/L PMSF的10 mmol/L的Tris-HCL缓冲液,在4 ℃下持续震荡24 h去细胞,600 g离心5 min后PBS洗三次。加入1倍软骨体积的50 u/mL DNA酶和1 u/mL RNA酶37 ℃消化过夜,再次400 g离心5 min后,ddH2O洗3次后收集软骨脱细胞基质碎粒。将软骨碎粒放入50 mL离心管,倒入适量液氮将其充分冷冻,取出冷冻后的软骨粒立即放入粉碎机粉碎成粉末状。加入适量甲醇-氯仿液(体积比为2∶1)脱脂24小时,400 g离心5 min,PBS洗3次,获得不溶性软骨细胞外基质沉淀。加入至少5倍体积的1%胃蛋白酶(w/v)在20 ℃下酶解36小时,400 g离心5分钟去沉渣,再将所获得的液体低温冷冻干燥84小时后获得可溶性软骨脱细胞基质。
1.2.2COLⅡ的提取参照前期文献报告[1]。
1.2.3纳米支架的制备将软骨脱细胞基质和COLⅡ按1∶2(w∶w)的比例混合,溶于三氟乙醇和ddH2O(v∶v=1∶1)溶剂中,常温磁力搅拌72小时后制成10%(w/v)的静电纺丝溶液。经过前期预实验情况,固定电纺条件,空调控制室温为25 ℃~30 ℃,湿度为40%,纺丝电压为15 Kv,送液速度为6 ml/h,接收距离为10 cm,静电纺丝采用铜板接收。将接收纳米纤维的铜板置于真空干燥箱,真空度-0.1 MPa,室温干燥3天后,收集纤维膜行相关参数检测。
1.2.4支架电镜观察及纤维直径测定,按文献的方法[2]:材料表面经离子喷射仪喷金后在扫描电镜下观察其表面形貌及纤维直径和孔隙情况;选取每个材料的10 000倍电镜图片,利用Image-Pro Plus 6.0 专业图像分析软件,随机测定每个图片内20根纤维直径,再用SPSS 18软件计算出纤维的平均直径及标准差。
1.2.5支架吸水率的测定取数个样品分别称重得W1,再将样品浸入双蒸水中,在设定的时间点取出后称重得W2,按公式吸水率=(W1-W2)/W1计算出材料的吸水率。
1.2.6CCK8法检测细胞毒性与粘附情况支架材料剪成适当大小,环氧乙烷消毒后置于96孔培养板中,软骨细胞接种密度为5×104cell/mL,分别在3 h、 6 h、9 h、12 h、24 h吸出旧培养液后加入PBS冲洗三次,再向孔内加入无血清和双抗的培养液200 μL及20 μL的CCK8培养1~4 h,测定其在450 nm的吸光度,每个时间点均有三个样本。以相同密度的软骨细胞接种于细胞培养板为对照组并设置相应时间点作比较。
2 结果
2.1材料大体观察软骨细胞外基质提取物(图1),纳米支架大体形态(图2)。纳米丝光镜下观察(图3)及支架在电镜下形态(图4)显示纳米纤维直径相对均匀,无明显串珠形成,纳米纤维间孔隙相通,表面形貌良好。
2.2支架物理性能检测材料吸水能力在4小时达到饱和,吸水率平均为(623.0±27.4)%(图5)。材料降解在14天后逐渐平稳,35天降解率为(45.6±5.8)%(图6)。纳米纤维的直径为(627±165.4)nm。

图1软骨细胞外基质
Figure1Cartilage acellular extracellular matrix

图2材料实体图
Figure2Entity graph of the material

图3纳米纤维光镜下观察(×400)
Figure3Nanometer fiber were observed under the light microscope

图4扫描电镜下观察(×5000)
Figure4Scanning electron microscope
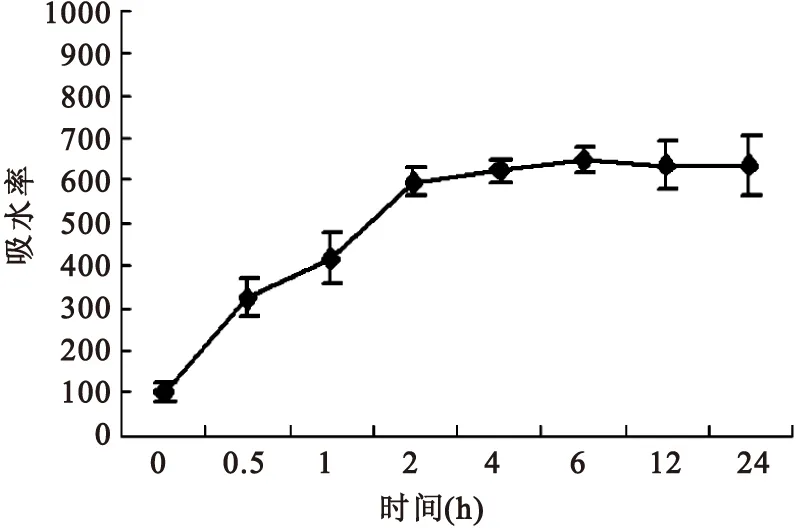
图5材料吸水率曲线
Figure5Water absorption rate curve of the material
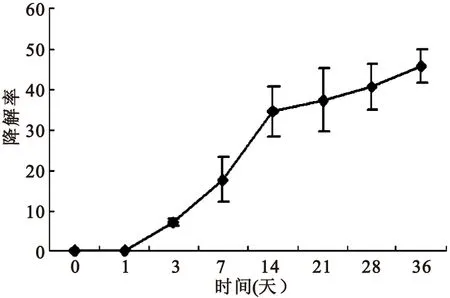
图6材料降解曲线
Figure6Degradation rate curve of the material
2.3细胞粘附性检测实验组和对照组在3 h、6 h、 9 h、12 h、24 h差异无显著统计学意义(P>0.05)。CCK8检测结果表明软骨脱细胞基质- COLⅡ纳米支架对细胞具有良好的粘附性,生物学性能良好,见图7。
3 讨论
组织工程软骨是目前研究较多,发展最为热门的科学之一。对种子细胞的研究非常广泛,但如何有效维持种子细胞的表型一直是困扰研究者们的问题,至今尚未取得突破性进展。目前通常利用细胞因子来维持软骨细胞或诱导后的类软骨细胞表型,但随着体外连续培养时间的延长,种子细胞表型逐渐丧失并向“类成纤维细胞”分化,难以成功构建出组织工程软骨。如何改善组织工程支架的生物学性能逐渐受到科研工作者们的关注。
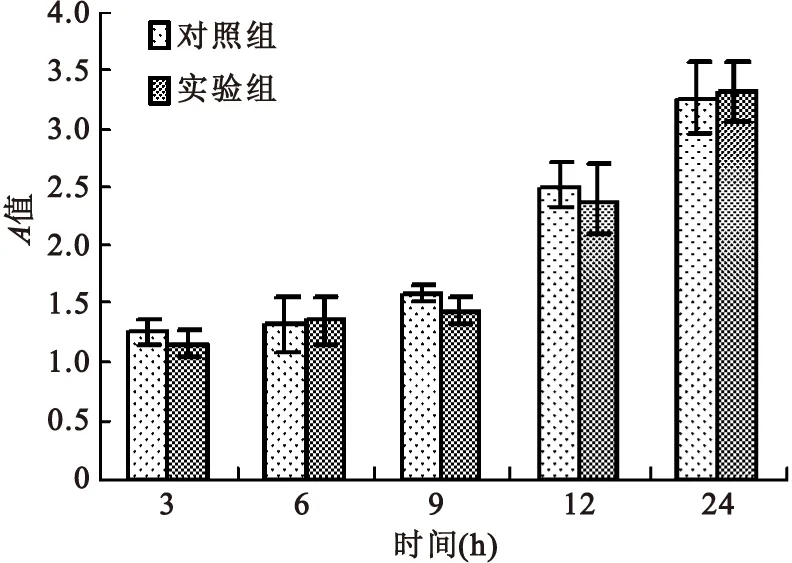
图7细胞粘附评价
Figure7Cell adhesion evaluation
理化性能及生物学功能良好的支架是组织工程软骨构建能否取得成功的关键之一,支架不仅为种子细胞提供生长分化及代谢的场所,同时还决定着重建组织器官的基本形态和功能[1]。目前常用于组织工程支架制备的原料主要分为天然材料、人工合成材料及两者的混合材料三大类,它们各自具有优缺点,难以相互替代。人工合成材料构建的支架,最大的优点在于具有良好的机械性能,为构建组织提供较好的表面形貌。人工合成材料其生物相容性相对较差,缺乏细胞生长粘附因子,在体内降解速度不易控制,降解产物具有一定的细胞毒性[3-5]。但并不说明人工合成材料就无法获得更好的应用前景。Pan等利用不同孔隙率的聚乳酸双层支架复合骨髓基质干细胞修复兔关节软骨缺损,经过12周后观察发现,不同孔隙率的聚乳酸支架比单一孔隙率支架对软骨缺损修复具有更良好的效果[6]。Hung等以聚氨酯为原料并携带细胞因子,利用低温3D打印技术制备出三维支架,该支架复合骨髓基质干细胞对兔膝关节缺损表现出较好的修复功能[7]。
天然材料及其衍生物具有良好的生物相容性、可降解性能支持软骨细胞粘附定植,能较好维持软骨细胞表型从而被广大研究者青睐。天然软骨细胞外基质材料制备支架的常用方法为脱细胞软骨块、脱细胞软骨外基质经低温冷冻干燥法制备支架。孙良等通过软骨脱细胞后制成支架,将骨髓基质干细胞接种于该支架后连续体外培养,骨髓基质干细胞能在支架表层生长[8]。这说明经软骨脱细胞制备的支架孔隙稀少,细胞难以长入支架内部,无法将大量的种子细胞浓聚于支架中,因此无法作为软骨组织工程理想的支架。低温冷冻法一般是将软骨脱细胞后粉碎,经低温冷冻干燥,制备出特定形状的三维多孔支架,经体外实验表明细胞外基质支架具有良好的生物学性能[9-11]。
COLⅡ是关节软骨细胞外基质的主要固相成分,占关节软骨(AC)干重的50%~80%,主要构成AC的纤维骨架,与高含水量的PG长链共同构成网络状基质[1]。大量的研究证实,COLⅡ具有促进软骨细胞粘附、增殖和维持软骨细胞表型的作用[12-15]。在既往的研究中,以软骨细胞外基质微粒为基本单位构建的支架容易脆裂,而且软骨外基质微粒内部的胶原、透明质酸、胶原等的分子信号不能充分显露。本研究以软骨脱细胞基质经脱脂脱细胞去抗原后,再酶解使其以分子状态成为可溶性基质,再通过加入COLⅡ充分搅拌混匀调节溶液粘度,利用静电纺丝技术,制备出纳米级组织工程软骨支架,初步取得了较好的效果。经过多次对比试验发现,静电纺丝条件为电纺液中胶原和细胞外基质质量比为大于2∶1,电纺液最佳浓度为10%,温度为25 ℃,湿度为40%,接收板距离为10 cm, 静电纺丝速度为1 mL/h。
4 结论
软骨脱细胞基质-COLⅡ构建的组织工程软骨支架,具有较均一的纳米级直径,均匀的孔隙大小、较高的吸水率、良好的细胞粘附性能。该支架在结构和成分上能较好地模拟软骨细胞生长的微环境,在软骨组织工程中具有一定的应用前景。
[1]蒋婷, 杨泽龙, 李凌云, 等. Ⅱ型胶原-透明质酸-软骨脱细胞基质制备组织工程软骨支架的实验研究[J]. 西部医学, 2013, 25(8): 1132-1135.
[2]杨泽龙. 利用胶原-透明质酸-硫酸软骨素三元纳米支架修复兔关节软骨缺损的实验研究[D]. 泸州医学院, 2014: 1-105.
[3]Li WJ, Richard T, Chukwuka O. A three-dimensional nanofibrous scaffold for cartilage tissue engineering using human mesenchymal stem cells. Biomaterials, 2005, 26(6): 599-609.
[4]Liao J, Guo X, Grande-Allen KJ,etal. Bioactive polymer/extracellular matrix scaffolds fabricated with a flow perfusion bioreactor for cartilage tissue engineering. Biomaterials, 2010, 31(34): 8911-8920.
[5]Chung C, Burdick JA. Engineering cartilage tissue[J]. Adv Drug Deliv Rev, 2008, 60(2): 243-262.
[6]Pan Z, Duan P, Liu X,etal. Effect of porosities of bilayered porous scaffolds on spontaneous osteochondral repair in cartilage tissue engineering[J]. Regen Biomater, 2015, 2(1):9-19.
[7]Hung KC, Tseng CS, Dai LG,etal. Water-based polyurethane 3D printed scaffolds with controlled release function for customized cartilage tissue engineering[J]. Biomaterials, 2016, 83(2):156-168.
[8]孙良, 李丕宝, 栾保华. 脱细胞基质软骨支架的制备[J]. 中国组织工程研究, 2015, 19(16): 2494-2499.
[9]姚军, 卢世壁, 彭江, 等. 关节软骨细胞外基质源性软骨组织工程取向支架的制备[J]. 中国组织工程研究与临床康复, 2009, 13(3): 432-436.
[10] 杨强, 彭江, 卢世壁, 等. 软骨脱细胞基质多孔支架与骨髓基质干细胞体外构建组织工程软骨的研究[J]. 中华医学杂志, 2011, 91(17): 1161-1166.
[11] 余晓明, 孟昊业, 孙振, 等. 生物反应器中的力学刺激促进组织工程软骨再生[J]. 中国组织工程研究, 2016, 20(2): 185-190.
[12] 杨泽龙, 陈竹, 刘康, 等. Ⅱ型胶原-透明质酸构建组织工程软骨复合三维纳米支架的体外实验研究[J]. 中国修复重建外科杂志, 2013, 27(10): 1240-1245.
[13] Zhang S, Chen L, Jiang Y,etal. Bi-layer collagen/microporous electrospun nanofiber scaffold improves the osteochondral regeneration[J]. Acta Biomater, 2013, 9(7):7236-7247.
[14] Chen WC, Wei YH, Chu IM,etal. Effect of chondroitin sulphate C on the in vitro and in vivo chondrogenesis of mesenchymal stem cells in crosslinked type II collagen scaffolds[J]. J Tissue Eng Regen Med, 2013, 7(8):665-672.
[15] Choi B, Kim S, Lin B,etal. Cartilaginous extracellular matrix-modified chitosan hydrogels for cartilage tissue engineering[J]. ACS Appl Mater Interfaces, 2014, 6(22):20110-20121.
The study on preparation of nanofiber scaffolds with CAEM- COLⅡ for cartilage tissue engineering
JIANG Ting1, YANG Zelong,LI Xiaobin1,et al
(1.DepartmentofBurnandPlasticSurgery,NanchongCentralHospital·heSecondClinicalCollegeofNorthSichuanMedicalCollege,Nanchong637000,Sichuan,China;2.DepartmentofOrthopaedicSurgery,NanchongCentralHospital·TheSecondClinicalCollegeofNorthSichuanMedicalCollege,Nanchong637000,Sichuan,China;3.TissueEngineeringandStemCellInstitute,NanchongCentralHospital·TheSecondClinicalCollegeofNorthSichuanMedicalCollege,Nanchong637000,Sichuan,China)
ObjectiveTo explore the feasibility of preparation of nanofiber scaffolds by electrostatic spinning with cartilage acellular extracellular matrix (CAEM) and collagen Ⅱ (COLⅡ) for cartilage tissue engineering. Methods CAEM was obtained from the rabbit rib cartilage after removing the chondrocytes, degreasing, enzymolysis and drying. CAEM and COLⅡ were Mixed according to the ratio of 1∶2. The nanofiber scaffolds were prepared by electrostatic spinning for cartilage tissue engineering. The physical-chemical properties of the scaffolds were detected through mensurating the porosity, water absorption rate, and degradation rate. The cytotoxicity and cell adhesion were evaluated by CCK8 test. ResultsThe diameter of the CAEM-COLⅡ nanofiber scaffolds was 627nm±165.4nm. The water absorption rate was 623.0%±27.4%, and the degradation rate was 45.6%±5.8% after 35 days. CCK8 test showed that the CAEM-COLⅡ blend scaffolds had good cell adhesion and physical-chemical properties. ConclusionThe CAEM-COLⅡnanofiber scaffolds could provide fine microenvironment for the growth and proliferation of chondrocyte. It had potential application value in cartilage tissue engineering.
Tissue engineering nanofiber scaffolds; Collagen Ⅱ; Cartilage acellular extracellular matrix; Electrostatic spinning
国家自然科学基金青年基金(81301568);川北医学院博士科研启动基金(CBY15-QD03)
R 318.08
A
10.3969/j.issn.1672-3511.2016.08.005
2016-04-22; 编辑: 张文秀)
