基于柱后衍生发芽糙米中γ-氨基丁酸HPLC检测方法的建立及应用
2016-09-16王丽群潘媛媛孟庆虹张志宏卢淑雯黑龙江省农业科学院食品加工研究所黑龙江哈尔滨50086赛默飞世尔科技中国有限公司北京00085
王丽群,潘媛媛,孟庆虹,张志宏,严 松,高 扬,卢淑雯*(.黑龙江省农业科学院食品加工研究所,黑龙江 哈尔滨 50086;.赛默飞世尔科技(中国)有限公司,北京 00085)
基于柱后衍生发芽糙米中γ-氨基丁酸HPLC检测方法的建立及应用
王丽群1,潘媛媛2,孟庆虹1,张志宏1,严松1,高扬1,卢淑雯1*
(1.黑龙江省农业科学院食品加工研究所,黑龙江 哈尔滨 150086;2.赛默飞世尔科技(中国)有限公司,北京 100085)
建立了一种能与17种常见氨基酸分离的发芽糙米中γ-氨基丁酸的检测方法,即采用Hypercarb column色谱柱,以邻苯二甲醛作为衍生试剂进行柱后衍生,检测波长为338 nm,γ-氨基丁酸的定量线性范围为0.2~50 mg/L,线性方程为A=0.304 3C+0.065 3,相关系数R2为0.999 9。确定了发芽糙米中γ-氨基丁酸的提取条件,发芽糙米经20%甲醇-水提取后,用1.0%甲酸稀释,进样检测,回收率可达97.7%。按照上述提取与检测方法,对不同种糙米制品中γ-氨基丁酸含量进行了测定,发芽糙米中γ-氨基丁酸含量明显高于普通糙米,发芽糙米经高温挤压与模拟蒸煮处理后,其γ-氨基丁酸含量均无明显变化。
γ-氨基丁酸;发芽糙米;高效液相色谱法;挤压
γ-氨基丁酸(γ-aminobutyric acid,GABA)通常被称为大脑天然冷静剂[1-2],因具有抑制大脑过度兴奋、减缓神经紧张以及降血压、解酒、利尿及助眠等功效[3],而受到国内外食品与医药领域研究人员的普遍关注。目前,在诸多食品原料及其制品中均已发现GABA的存在,并以发酵食品和稻米类制品中含量最多[4-5]。GABA在发酵食品中主要由微生物(如乳酸菌、红曲霉等)[6-7]代谢产生,而在稻米类制品中则主要是在糙米萌发的过程中产生[8-10]。发芽糙米是由糙米经水浸泡几个小时后,在一定的温度和湿度条件下孵育而成,其口感良好,营养丰富并含有多种益生组分而易于为人们所接受。作为γ-氨基丁酸的主要植物来源[11-12],与发芽糙米及其制品相关的研究已成为新的热点。但截至目前,已发表的关于发芽糙米中γ-氨基丁酸含量检测方法方面的研究并不多,并且存在一些尚未解决的问题,如:(1)与其他物料相比,发芽糙米中淀粉含量较高,在加工和提取过程中,发芽糙米米粉中的淀粉易随温度升高而发生糊化,从而造成样品中GABA的提取率偏低;(2)在各种检测方法中,发芽糙米中富含的多种氨基酸都会干扰GABA的测定结果;(3)同其他氨基酸一样,GABA检测目前采用最多的是以邻苯二甲醛、对苯二甲醛-2-巯基乙醇、丹磺酰氯、2,4,6-三硝基苯磺酸及氯甲酸-9-芴基甲酯等进行柱前衍生的液相色谱方法[13-15],但柱前衍生的缺点在于前处理复杂,并容易引入过多衍生副产物,干扰衍生产物的测定。
鉴于以上存在的问题,本研究建立了一种能够与17种常见氨基酸分离的GABA柱后衍生的高效液相色谱测定方法,设计了简易有效的糙米样品中GABA提取方案,从不同加工处理获得的发芽糙米样品入手,按照上述GABA提取方案与检测方法,对发芽糙米样品中GABA含量进行测定,旨在为发芽糙米及其他食品中GABA柱后衍生HPLC检测方法的应用提供参考。
1 材料与方法
1.1材料与试剂
稻米原料:黑龙江省农科院栽培所培育粳稻品种X;γ-氨基丁酸标准品、17种氨基酸混标(≥98.0%):美国Sigma公司;甲醇、乙腈(色谱纯):美国Fisher Scientific公司;七氟丁酸、甲酸(分析纯):美国Acors公司;叠氮化钠、邻苯二甲醛、3-巯基丙酸、硼酸均为分析纯:国药集团化学试剂有限公司。
1.2仪器与设备
戴安U3000液相色谱:美国Thermo Fisher公司;DGP-3600 RS泵、WPS-3000TRS自动进样器、TCC-3000RS柱温箱、VWD-3100检测器、变色龙6.8色谱软件、FC-2K实验室砻谷机:日本大竹制作所;JXFM110锤式旋风磨:上海嘉定粮油仪器有限公司;EV-25双螺杆挤压机:法国CLEXTRAL公司。
1.3方法
1.3.1色谱条件
色谱柱:戴安Hypercarb column(5 μm,4.6 mm× 150 mm);流动相:流动相A为0.4%七氟丁酸,流动相B为0.1%七氟丁酸-乙腈,流速为0.5 mL/min,梯度洗脱条件如表1所示,紫外检测波长为338 nm,柱温为室温,进样量10 μL。

表1 梯度洗脱程序Table 1 Gradient elution program
1.3.2γ-氨基丁酸标准溶液的配制
称取GABA固体对照品10 mg于10 mL容量瓶中,用20 mg/L叠氮化钠溶液溶解并定容,配制成1 mg/mL的标准储备液。
1.3.3 17种氨基酸混合溶液的配制
17种氨基酸混标储备液为2.5 μmol/mL(0.1 mol/L HCl),直接用20 mg/L叠氮化钠溶液稀释至目标浓度。
1.3.4γ-氨基丁酸衍生化
0.4 mol/L硼酸缓冲液(pH=10.0)的配制:称取24.8 g硼酸,14.1 g氢氧化钠,用水稀释并定容至1 000 mL容量瓶中,摇匀备用。
邻苯二甲醛衍生试液配制:称取200 mg邻苯二甲醛,用甲醇溶解并定容至100 mL容量瓶中,加入3-巯基丙酸(200 μL),摇匀,室温避光密封备用。
设置硼酸缓冲液与衍生试液的混合体积比为4∶1,并调节混合后的溶液流速为0.3 mL/min。
1.3.5糙米样品的制备
糙米生米粉:取稻米1 kg,经砻谷获得糙米,通过锤式旋风磨碾磨获得糙米生米粉,过100目筛,备用。
发芽糙米生米粉:取稻米1 kg,经砻谷获得糙米,糙米经25℃浸泡0.5 h,沥干后,置于25℃、湿度98%恒温恒湿箱中,发芽15 h,收集发芽糙米,于55℃鼓风干燥箱中干燥1.5~2 h,至发芽糙米中水分含量为15%左右,经锤式旋风磨碾磨获得发芽糙米生米粉,过100目筛,备用。
高温膨化发芽糙米粉:以发芽糙米生米粉为原料,采用双螺杆挤压机(配有6节加热段),将米粉倒入挤压机的进料器中,模头温度125℃,六节加热段温度参数依次为30℃、60℃、90℃、120℃、140℃、和150℃。进料速度控制在3 kg/h,进水量0.2 kg/h。挤压后,收集挤压物,磨粉,过100目筛,备用。
模拟蒸煮发芽糙米粉:以发芽糙米生米粉为原料,采用双螺杆挤压机(配有6节加热段),将米粉倒入挤压机的进料器中,模头温度80℃,六节加热段温度参数依次为30℃、40℃、60℃、70℃、80℃、和80℃。进料速度控制在3 kg/h,进水量0.8 kg/h。挤压后,收集挤压物,在80℃条件下,热风干燥10 min,磨粉,过100目筛,备用。
1.3.6发芽糙米中γ-氨基丁酸提取方法比较
称取发芽糙米生米粉样品1 g于50 mL离心管中,分别加体积分数为80%甲醇水溶液、体积分数为20%甲醇水溶液及纯水溶液8 mL,摇匀,于40℃水浴振荡提取30 min,4℃条件下12 000 r/min离心10 min。取上清液,分别用1%和0.1%甲酸水溶液稀释1倍,0.22 μm尼龙膜过滤后进样检测。加标回收实验中,取糙米粉样品1 g,加入对照品,放置30 min老化后,提取方式同样品。
1.3.7糙米样品中GABA含量及其回收率测定
分别取糙米生米粉、发芽糙米生米粉、高温膨化发芽糙米粉及模拟蒸煮发芽糙米粉样品按1.3.6确定的样品前处理方法提取GABA,按1.3.1色谱分析方法进行GABA含量测定,回收率测定方法参照1.3.6方法。
2 结果与分析
2.1 GABA检测方法的建立
2.1.1 GABA色谱分离结果
利用柱后邻苯二甲醛衍生法,按照1.3.1的参数条件对GABA标准溶液进行了检测,GABA先经过在Hypercarb色谱柱分离,其标准溶液色谱图如图1所示。由图1可知,GABA保留时间为7.80 min。

图1 GABA标准溶液色谱图Fig.1 The chromatogram of GABA standard solution
鉴于糙米中含有的氨基酸对GABA含量测定的干扰,按照相同的参数条件对17种常见氨基酸进行检测分析,叠加谱图见图2。

图2 GABA和17种常见氨基色谱叠加图Fig.2 Chromatographic overlay chart of GABA and 17 common amino acids
从图2可以看出,GABA可与17种常见氨基酸完全分离(除色谱图中可见的10种氨基酸外,其他7种氨基酸在胱氨酸后被快速洗脱,分别为Leu-亮氨酸、Ile-异亮氨酸、Met-蛋氨酸、His-组氨酸、Arg-精氨酸、Phe-苯丙氨酸和Tyr-酪氨酸),在糙米GABA检测过程中,可以避免样品中常见氨基酸对GABA测定的影响。
2.1.2标准曲线
以GABA质量浓度为1 mg/mL的溶液作为标准储备液,用超纯水进行系列稀释,所得工作曲线质量浓度分别为0.2 mg/L、0.5 mg/L、1.0 mg/L、5.0 mg/L、10.0 mg/L和50.0 mg/L,以GABA质量浓度(C)为横坐标,峰面积(A)为纵坐标绘制标准曲线,标准曲线回归方程为A=0.304 3C+ 0.065 3,相关系数R2=0.999 9,在0.2~50 mg/L范围内线性关系良好。
2.1.3定量限及重复性试验
取质量浓度为0.2 mg/L的GABA标准溶液、以进样量10μL信噪比为20计算定量限,得知方法定量限为0.02 mg/g。
取质量浓度为10.0 mg/L的GABA重复进样5次,重复进样叠加图见图3,保留时间标准偏差为0.30%,峰面积的标准偏差为2.73%,重复性试验表明方法精密度良好。

图3 GABA重复进样叠加图Fig.3 Chromatographic overlay chart of GABA repeat injections
2.2糙米中GABA提取的前处理方法
对于糙米的前处理,参考文献[9]采用体积分数为80%甲醇水溶液振荡提取后浓缩、定容检测。采用该方法,测得各样品中GABA含量偏低,且回收率仅为60%左右。本文根据GABA极易溶于水的性质,分别采用体积分数为20%甲醇水溶液及超纯水进行提取试验,为防止GABA在分析过程中吸附在基质中,而造成回收率偏低,试验设计在提取溶液中加入甲酸,结果发现,样品出现GABA峰拖尾及干扰峰,判断在酸性条件下,样品中某些干扰组分被提取出来,从而影响GABA的测定。因此,本实验选择在进样前分别用1%甲酸和0.1%甲酸进行稀释,试验结果见表2。
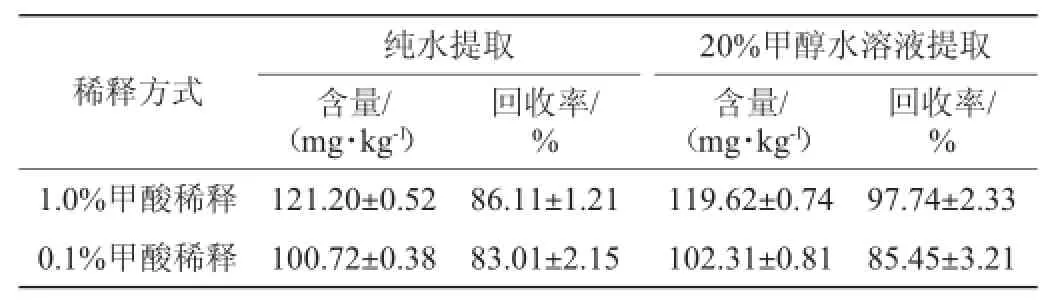
表2 不同提取方法的GABA回收率对比Table 2 The comparison of the GABA recovery rate by different extraction method
由表3可知,采用纯水提取-0.1%甲酸稀释的方法样品回收率为86.11%,但由于糙米样品用纯水提取时,极易出现乳化作用形成胶体,不利于离心过滤,而相对于纯水提取法,20%甲醇水溶液提取-1.0%甲酸稀释法,回收率为97.74%,且重现性较好,因此,本实验最终选用20%甲醇水溶液提取-1.0%甲酸稀释一倍后进样的前处理方法。
2.3不同糙米样品中GABA含量及回收率的测定
按照2.1建立的GABA检测方法,以及2.2确定的糙米中GABA提取方法,对糙米生米粉、发芽糙米生米粉、高温膨化发芽糙米粉、模拟蒸煮发芽糙米粉样品中GABA含量进行测定,测定结果见表3。

表3 糙米中GABA含量及加标回收率Table 3 The content of GABA in brown rice and standard recovery rate
发芽糙米制品在提取过程中易于糊化,从而影响GABA的提取率。由表4可知,不同糙米样品中GABA的回收率在96.50%~107.01%,说明文中建立的提取与检测方法准确度高,适用于各类糙米制品中GABA含量的检测。此外,糙米生米粉中GABA含量仅为发芽糙米样品中GABA含量的23.90%,说明糙米经过发芽处理后GABA含量得到很大地提高,这与先前报道的研究结果一致[5,16]。同时,通过高温膨化和模拟蒸煮处理的发芽糙米粉样品中GABA含量与发芽糙米生米粉相比均无显著差异(P>0.05)。
3 结论
本研究建立了一种能够与17种常见氨基酸分离的GABA柱后衍生液相色谱测定方法,使GABA目标色谱峰能与常见的17种氨基酸实现完全基线分离,方法的灵敏度、选择性及回收率能够满足各类样品中GABA的定量检测。此外,针对发芽糙米开发了GABA的样品处理方法,即20%甲醇水溶液提取-1.0%甲酸稀释进样,解决了发芽糙米及其制品易于糊化从而造成GABA提取率偏低的问题。发芽糙米中GABA含量为普通糙米的4倍,且富含GABA米粉样品中GABA含量并没有受到不同挤压工艺的影响,由此说明文中采用的挤压工艺可用于发芽糙米类制品的生产,但更多工艺参数对发芽糙米中GABA含量及功能性质的影响还需要做进一步研究。
[1]MAYER R,CHERRY J,RHODES D.Effects of heat shock on amino acid metabolism of cowpea cells[J].Plant Physiol,1990,94∶796-810.
[2]WU F F,YANG N,TOURE A,et al.Germinated brown rice and its role in human health[J].Crit Rev Food Sci Nutr,2013,53(5)∶451-463.
[3]FABIOLA C,PATRICIO J C,CRISTINA M V,et al.Effects of germination on the nutritive value and bioactive compounds of brown rice breads[J].Food Chem,2015,173∶298-304.
[4]渠岩,王夫杰,李平兰,等.γ-氨基丁酸及其在大豆发酵食品中的研究进展[J].中国酿造,2010,29(3):1-4.
[5]刘颖,王秋,TATYANA K K,等.富含γ-氨基丁酸的发芽糙米制备工艺的研究[J].食品工业,2015,36(4):82-86.
[6]谢芳,曾庆坤,杨承剑,等.水牛乳中高产γ-氨基丁酸乳酸菌的筛选与鉴定[J].中国酿造,2015,34(4):102-105.
[7]陈勉华,吉达维,马人杰,等.不同发酵基质对红曲重要代谢产物的影响[J].中国酿造,2013,32(3):22-24.
[8]KOMATSUZAKI N,TSUKAHARA K,TOYOSHIMA H,et al.Effect of soaking and gaseous treatment on GABA content in germinated brown rice[J].J Food Eng,2007,78(2)∶556-560.
[9]KIM H S,LEE E J,LIM S T,et al.Self-enhancement of GABA in rice bran using various stress treatments[J].Food Chem,2015,172∶657-662.
[10]PARISUT C,KAMOLWAN J,ANUVAT J,et al.Antioxidant activity,free gamma-aminobutyric acid content,selected physical properties and consumer acceptance of germinated brown rice extrudates as affected by extrusion process[J].LWT-Food Sci Technol,2015(64)∶490-496.
[11]林亲录,王婧,陈海军.γ-氨基丁酸的研究进展[J].现代食品科技,2008,24(5):496-500.
[12]白松,林向阳,阮榕生,等.γ-氨基丁酸的分布和制备[J].现代食品科技,2005,21(2):202-205.
[13]陈恩成,张名位,彭超英,等.比色法快速测定糙米中γ-氨基丁酸含量研究[J].中国粮油学报,2006,21(6):125-128.
[14]程威威,吴跃,林亲录,等.HPLC法测定发芽糙米中γ-氨基丁酸中不同衍生方式的比较研究[J].中国农学通报,2014,30(9):279-284.
[15]HAYAT A,JAHANGIR T M,KHUHAWAR M Y,et al.Simultaneous HPLC determination of gamma amino butyric acid(GABA)and lysine in selected Pakistani rice varieties by pre-column derivatization with 2-hydroxynaphthaldehyde[J].J Cereal Sci,2014(60)∶356-360.
[16]马丽,唐坚,王梦晗,等.低温胁迫对糙米发芽及γ-氨基丁酸含量的影响[J].食品工业科技,2014,35(4):278-281.
Establishment and application of the HPLC determination method for γ-aminobutyric acid in germinated brown rice based on postcolumn derivation
WANG Liqun1,PAN Yuanyuan2,MENG Qinghong1,ZHANG Zhihong1,YAN Song1,GAO Yang1,LU Shuwen1*
(1.Food Processing Research Institute,Heilongjiang Academy of Agricultural Science,Harbin 150086,China;2.Thermo Fisher Scientific(China)Co.,Ltd.,Beijing 100085,China)
A determination method forγ-aminobutyric acid(GABA)separated with 17 common amino acids in germinated brown rice was established by HPLC.GABA was separated by Hypercarb chromatographic column,then derived by o-phthalaldehyde as derivative reagent.The detection wavelength was 338 nm.The quantitative linear range of GABA was from 0.2 mg/L to 50 mg/L,and the linear equation wasA=0.304 3C+0.065 3(R2= 0.999 9).The extraction condition of GABA in germinated brown rice was determined.The germinated brown rice was extracted by 20% methanol-water,and diluted and by 1.0%formic acid,and then determined by HPLC.The recovery rate could reach to 97.7%.According to the extraction conditions and detection method,the content of GABA from different brown rice products was determined.The results showed that the content of GABA in germinated brown rice was obviously higher than ordinary brown rice.By high temperature extrusion and simulation cooking,the content of GABA in germinated brown rice had no significant change.
γ-aminobutyric acid;germinated brown rice;HPLC;extrusion
R155.5
0254-5071(2016)02-0144-04
10.11882/j.issn.0254-5071.2016.02.033
2015-11-05
农业部公益性行业(农业)专项(201403063);黑龙江省农业科学院引进博士人员科研启动金(201507-47);现代农业产业技术体系建设专项资金资助项目(CARS-01-34)
王丽群(1982-),女,助理研究员,博士,研究方向为农产品加工及贮藏工程。
卢淑雯(1968-),女,研究员,博士,研究方向为稻米加工。
