Her2和TopoⅡ在乳腺癌组织中的表达水平与新辅助化疗疗效的关系研究
2016-09-15贾新建
贾新建
(四川省德阳市人民医院乳腺外科, 四川 德阳 618000)
Her2和TopoⅡ在乳腺癌组织中的表达水平与新辅助化疗疗效的关系研究
贾新建
(四川省德阳市人民医院乳腺外科, 四川 德阳 618000)
目的:研究Her2和TopoⅡ在乳腺癌组织中的表达水平与新辅助化疗疗效。方法:以数字法抽选本院乳腺癌组织标本68例,新辅助化疗前后均具有组织Her-2、TopoⅡ等检测实验报告资料,并与患者临床疗效进行对比分析。结果:经新辅助化疗后,Her-2阳性表达率由85.29%(58/68)下降到60.29%(41/68),TopoⅡ阳性表达率由92.65%(63/68)下降到80.88%(55/68)(P<0.05);在治疗有效的患者中,Her-2阳性组表达率26.83%(11/36)明显低于阴性组92.59%(25/36),TopoⅡ阳性组表达率45.45%(25/55)明显低于阴性组84.62%(11/13)(P<0.05),同组间Her2、TopoⅡ表达率比较差异有统计学意义(P<0.05);Her2和TopoⅡ在1、2、4年生存率阳性组均低于阴性组(P<0.05)。结论:Her2和TopoⅡ对乳腺癌化疗效果有一定指导作用,对于判断乳腺癌预后也有一定参考价值。
Her2; TopoⅡ; 乳腺癌; 新辅助化疗
【Abstract】Objective:To study the curative effectof Her2 and TopoⅡin breast cancer and the effectof neoadjuvant chemotherapy.M ethods:68 cases were selected in our hospital for breast cancer tissue samples from the digitalmethod,detected Her-2,Topo IIassay and compared with the clinical curative effect of the patients.Results:After neoadjuvant chemotherapy,the expression rate of HER-2 dropped from 85.29%(58/ 68)to 60.29%(41/68),the expression rate of TopoⅡdropped from 92.65%(63/68)down to 80.88%(55/ 68)(P<0.05);in the effective treatment of patients,the expression rate of Her-2 positive group was 26.83% (11/36),which was significantly lower than the negative group 92.59%(25/36),the expression rate of Topo IIpositive group was 45.45%(25/55),which was significantly lower than the negative group 84.62%(11/ 13)(P<0.05),therewere significant differences in the expression rates of Her2 and Topo in the same group (P<0.05);Her2 and Topo IIsurvival rate in positive group were lower than those in negative group in 1,2,4 (P<0.05).Conclusion:Her2 and Topo II have a certain guiding role in the breast cancer chemotherapyeffect,and have certain reference value for judging the prognosis of breast cancer.
【Key words】Her2; Topo II; Breast cancer; Neoadjuvant chemotherapy
本文为探究Her2和TopoⅡ在乳腺癌组织中的表达水平与新辅助化疗疗效的关系,观察并分析我院乳腺癌患者相关临床病理指标,现报道如下。
1 临床资料
1.1 一般资料:以数字法抽选2010年1月至2012年1月本院乳腺癌组织标本68例,经病理证实病理类型均为浸润性导管癌[1]。所有乳腺癌标本均已进行Her -2、TopoⅡ等检测实验并有完整资料。患者新辅助化疗前未进行相关内分泌治疗或放化疗。组织标本均来源于女性,年龄24~75岁,平均(47.2±2.7)岁,临床分期包括IIA期、IIB期、IIIA期、IIIB期、IIIC期,分别21例、17例、19例、9例、2例。本研究中,新辅助化疗患者的临床病理特征按当前蒽环类化疗时的情况分析。
1.2 新辅助化疗方案:具体方法为化疗前给予静脉滴注10mg盐酸阿扎司琼注射液,然后以TEC化疗方案:
多西他赛 75mg/m2,表柔比星 80mg/m2,环磷酰胺500mg/m2,21d/疗程。化疗一个疗程。
1.3 检测方法和结果判定:即用型鼠抗人TopoⅡα单克隆抗体及SP试剂盒均为北京中杉生物技术公司产品。采用免疫织化SP法,乳腺癌组织标本经4%甲醛固定,石蜡包埋,切片厚度5μm,染色程序严格按照MaxVisionTM试剂盒规程要求进行。Her-2阳性细胞表现为细胞膜呈黄褐色;TopoⅡ阳性细胞表现为细胞核出现棕褐色物质,一张切片选取10个高倍视野,阳性细胞数大于10%为Her-2阳性表达或TopoⅡ阳性表达。
1.4 疗效判断:采用国际规定的RECIST实体瘤疗效评价标准。CR:所有目标病灶消失;PR:基线病灶长径总和缩小>30% ;PD:基线病灶长径总和增加>20%或出现新病灶。SD:基线病灶长径总和有缩小但未达PR或有增加但未达PD。所有病例均有可测量的目标病灶,每2个化疗周期后进行疗效评价。CR+ PR为有效,PD+SD为无效。
1.5 统计学方法:采用SPSS17.0进行统计分析,计量资料服从正态分布,以均数±标准差(¯x±s)表示,组间比较采用t检验,计数资料的比较采用χ2检验,P<0. 05为有统计学意义。
2 结 果
2.1 化疗前后乳腺癌组织中Her2、TopoⅡ表达水平比较:经新辅助化疗后,Her2阳性表达率由85.29%(58/ 68)下降到60.29%(41/68),TopoⅡ阳性表达率由92. 65%(63/68)下降到80.88%(55/68),化疗前后比较差异有统计学意义(P<0.05),见表1。
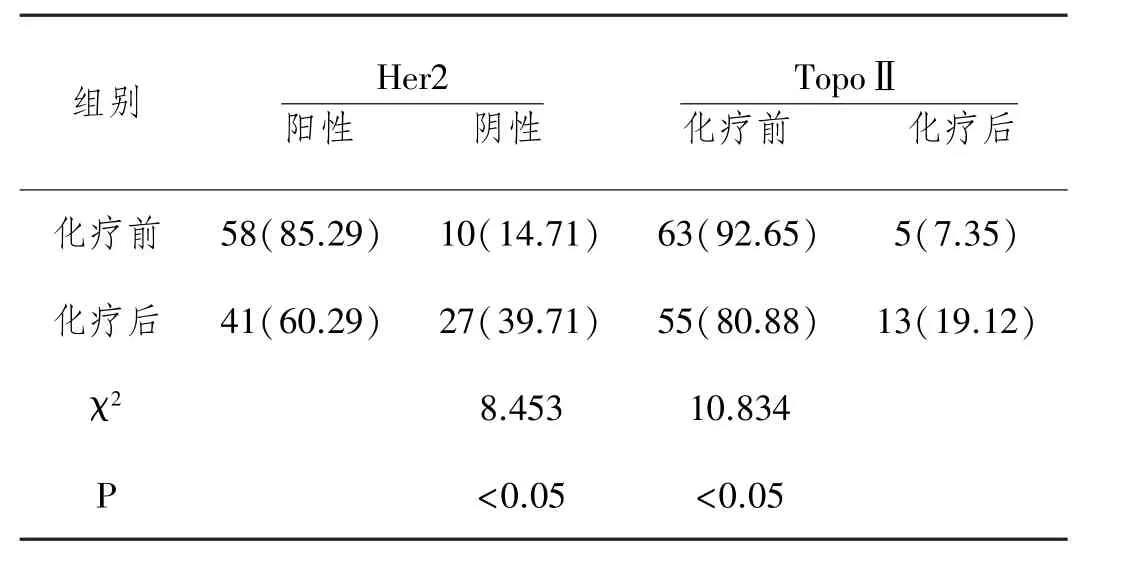
表1 化疗前后乳腺癌组织中Her2 TopoⅡ表达水平比较n(%)
2.2 化疗后显效和无效患者Her2、TopoⅡ表达水平对比:68例乳腺癌患者经新辅助化疗后,治疗有效率为52.94%(36/68),在治疗有效的患者中,Her2阳性组表达率26.83%(11/36)明显低于阴性组92.59%(25/ 36),TopoⅡ阳性组表达率45.45%(25/55)明显低于阴性组84.62%(11/13),两组比较差异有统计学意义(P <0.05);同组间Her2、TopoⅡ表达率比较差异有统计学意义(P<0.05),见表2。
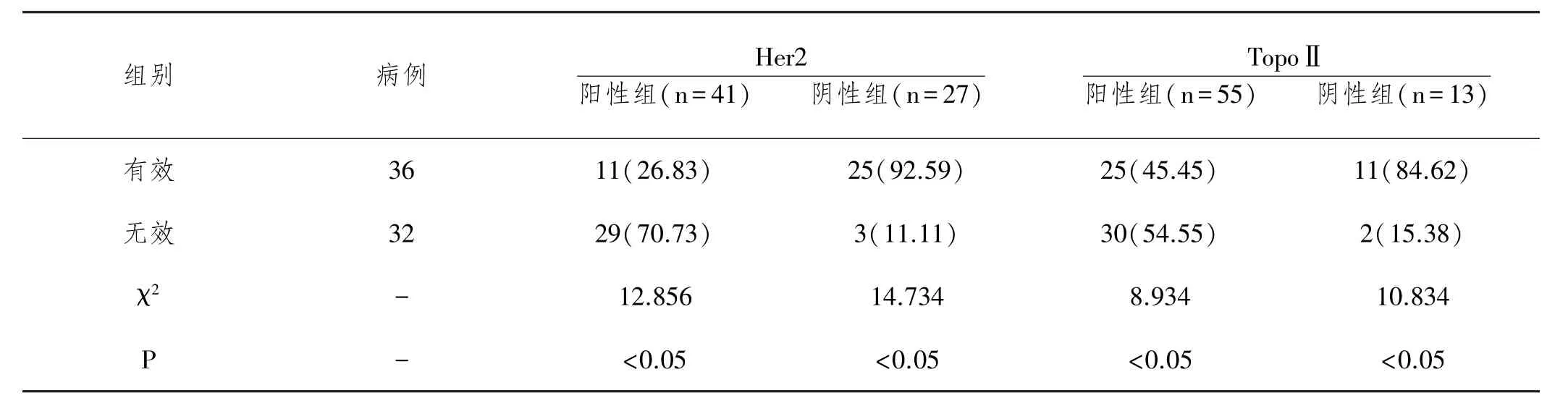
表2 化疗后有效和无效患者Her2 TopoⅡ表达水平对比n(%)
2.3 Her2、TopoⅡ表达水平与患者长期生存情况的比较:从Her2阳性组分的1、2、4年生存率分别为43.90%(18/41)、34.15%(14/41)、24.39%(10/41),均显著低于阴性组的生存率85.19%(23/27)、74.07% (20/27)、55.56%(15/27);从TopoⅡ阳性组分的1、2、4年生存率分别为41.82%(23/27)、30.91%(17/ 27)、18.18% (10/27),均显著低于阴性组的生存率84.62%(11/13)、69.23%(9/13)、53.85%(7/13),两组比较差异有统计学意义(P<0.05),见表3。
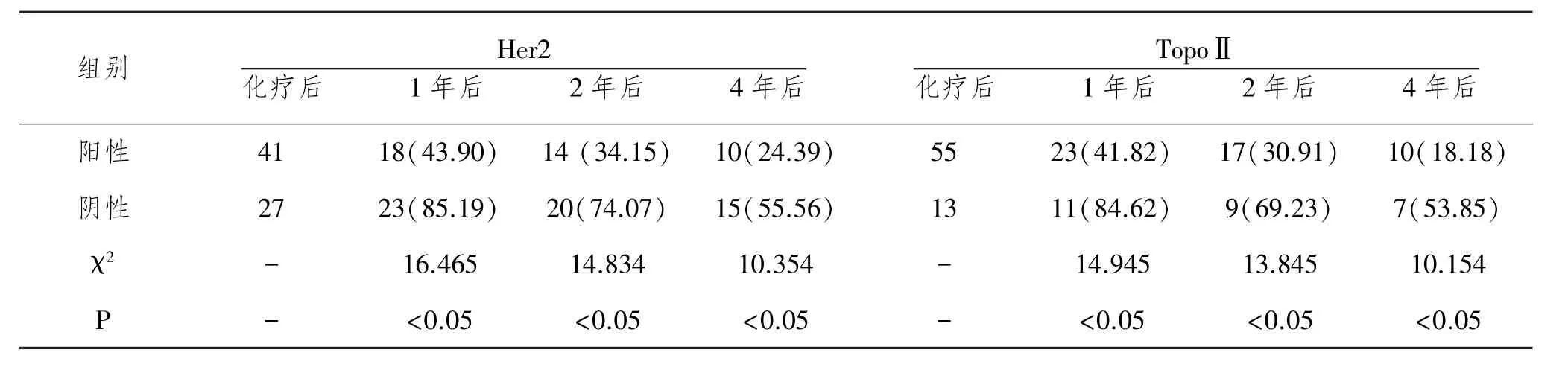
表3 Her2 TopoⅡ表达水平与患者长期生存情况的比较n(%)
3 讨 论
乳腺癌作为临床严重的恶性肿瘤之一,常用治疗方法为外科手术治疗、化疗、放射治疗等,目前仍无统一的标准治疗方案,随着不断的研究和进展。在治疗乳腺癌的过程中发现该病具有易发生转移、预后不良等特点,转移性乳腺癌5年存活率仅24%,且大部分患者无有效的治疗方案[2]。为了提高治疗效果,在新辅助化疗方案的研究过程中,临床试验结果显示,多药联合或序贯治疗有更佳的临床疗效,主要采用包含蒽环类药物进行化疗,如EORTC10902临床试验中术前采用4个疗程的FEC,并联合新型药物,如紫杉类药物、长春瑞滨、卡培他滨等[3]。
新辅助化疗已经在临床上得到广泛运用,但由于肿瘤细胞存在多药耐药的医学难关,导致化疗效果难以达到理想状态,因此化疗疗效判断与抗肿瘤药物化学治疗疗效的临床标志物息息相关,其中Her2和TopoⅡ在乳腺癌组织中的表达水平可以进行进一步的探讨。据文献报道,约10% ~35%的乳腺癌患者对新辅助化疗方案不敏感,治疗后非但肿瘤未得到控制,反而有一定程度的肿瘤进展[4]。
根据王云翔[5]临床研究显示,对于Her-2阳性患者,对蒽环类化疗方案具有相对较高的敏感性(尤其是对于Topo IIα阳性患者),而更为重要的是,其对于含靶向药物的新辅助化疗方案具有显著的预测意义。根据肖海凤[6]等的研究,TopoⅡα在乳腺癌组织中的阳性表达率为73.0%,TopoⅡα的阳性表达与年龄、肿瘤大小、位置、有无腋窝淋巴结转移及ER、PR的表达无明显相关性(P>0.05),而与Her-2的表达有关(P=0. 026),且呈正相关性。应用蒽环类药物化疗的患者中,TopoⅡα阳性表达者有效率是TopoⅡα阴性表达者的3.077倍(P=0.032)。TopoⅡα阳性表达组的无病进展期较TopoⅡα阴性表达组明显延长。本次研究中结果显示,经新辅助化疗后,Her2阳性表达率由85.29% (58/68)下降到60.29%(41/68),阳性表达率由92. 65%(63/68)下降到80.88%(55/68),两组比较差异有统计学意义(P<0.05);在治疗有效的患者中,Her2阳性组表达率26.83%(11/36)明显低于阴性组92.59% (25/36),TopoⅡ阳性组表达率45.45%(25/55)明显低于阴性组92.59%(11/13),两组比较差异有统计学意义(P<0.05);同组间Her2、TopoⅡ表达率比较差异有统计学意义(P<0.05)。该结果表明Her2、TopoⅡ的表达对乳腺癌患者化疗药物的选择及预后的判断具有重要的指导价值,与另两位笔者研究观点相符。
临床研究,Her-2、Topo II高表达乳腺癌被认为对含葱环类新辅助化疗药物敏感,但目前这些生物学预测因子在新辅助化疗疗效评价中的价值尚存争议,尚未有公认预测新辅助化疗疗效有效方法。Her2和TopoⅡ在1、2、4年生存率阳性组均低于阴性组,两组比较差异有统计学意义(P<0.05)。结果表明,新辅助化疗降低了Her-2、Topo II阳性表达水平,Her-2、Topo II阳性表达越低其化疗疗效越佳;反之,其阴性表达率越高,腺癌患者的近远期疗效越佳。因此,Her-2、Topo II表达水平与新辅助化疗疗效的相关性分析存在临床意义,此两项指标对选择敏感患者有所帮助也为判断患者进行新辅助化疗临床疗效提供参考。
[1] 谢闵,许增祥,孙圣荣.环氧化物酶-2、血管内皮生长因子、拓扑异构酶Ⅱ在三阴性乳腺癌中的表达及临床意义[J].中华实验外科杂志,2014,31(8):1799~1802.
[2] 王妍,李德昌,郑吉春.乳腺浸润性导管癌中多药耐药基因的表达及意义[J].中国老年学杂志,2013,33(18):4446~4448.
[3] Katie J,Aldred,Heidi A,Schwanz,Gangqin.Overcoming target-mediated quinolone resistance in topoisomerase IV by introducingmetal-ion-independent drug-enzyme interac-tions[J].ACS chemical biology,2013,8(12):2660~2668.
[4] 石海洲,王笃杰,丁文贤,等.新辅助化疗对晚期乳腺癌患者血浆microRNA及肿瘤相关指标的影响研究[J].中国实用医刊,2015,4(22):4~6.
[5] 王云翔,范宇,张勤,等.TopoIIα蛋白在不同分子亚型乳腺癌中的表达及其预后价值[J].中国煤炭工业医学杂志,2013,11(4):974~975.
[6] 肖海凤,于国华,刘淑真,等.TopoⅡα在乳腺癌中的表达与蒽环类药物敏感性的分析[J].潍坊医学院学报,2013,05(2):389~391.
Study on the Relationship between the Expression of Her2 and Topo II in Breast Cancer w ith Neoadjuvant Chemotherapy
JIA Xinjian
(The People's Hospital ofDeyang,Sichuan Deyang 618000,China)
1006-6233(2016)08-1287-04
A 【doi】10.3969/j.issn.1006-6233.2016.08.021
四川省德阳市科技局科研项目,(编号:2011sz040-7)
