基于ERGO/AuNPs的电化学DNA传感器的制备及应用
2016-09-15许世超张雪平李润兰张忆一周晶晶
许世超,张雪平,李润兰,张忆一,周晶晶
(1.天津工业大学环境与化学工程学院,天津 300387;2.天津工业大学省部共建分离膜与膜过程国家重点实验室,天津300387;3.天津工业大学水质安全评价与保障技术工程中心,天津300387)
基于ERGO/AuNPs的电化学DNA传感器的制备及应用
许世超1,2,3,张雪平1,李润兰1,张忆一1,周晶晶1
(1.天津工业大学环境与化学工程学院,天津 300387;2.天津工业大学省部共建分离膜与膜过程国家重点实验室,天津300387;3.天津工业大学水质安全评价与保障技术工程中心,天津300387)
制备了一种基于电还原石墨烯(ERGO)、金纳米粒子(AuNPs)修饰玻碳电极的电化学DNA传感器,应用于大肠杆菌O157:H7的快速、灵敏检测.首先将滴加在玻碳电极表面的氧化石墨烯进行电还原,然后通过电沉积方法将金纳米粒子均匀平铺在电极表面.利用金纳米粒子和氨基之间的共价键作用将端氨基修饰的探针DNA固定在电极表面,完成电化学DNA传感器的制备,并对目标DNA进行了定性与定量检测.实验结果表明:所制备的传感器具有良好的选择性、准确性,并且操作简单易行,对目标DNA的检测限为7.735×10-13mol/L,检测范围为1×10-12~1×10-8mol/L.
电化学DNA传感器;电还原石墨烯;金纳米粒子;大肠杆菌检测
电化学DNA传感器是把分析化学领域的电化学分析检测方法与DNA生物技术相结合,通过检测目标DNA杂交前后的电信号变化实现对目标检测物的定性定量检测[1],具有制备简单快速、经济环保、选择性好、灵敏度高等优势,已被广泛应用于环境监测、药物分析、食品安全检验、临床疾病诊断和新药开发等领域[2-4].纳米材料的开发与应用为电化学DNA传感器的制备提供了新的途径[5-6].石墨烯由于良好的机械性质、大的比表面积、极强的导电导热性能而引起了广泛关注[7-9].Sun等[4]应用石墨烯等设计了一种电化学DNA传感器,实现了对单核细胞增多性李斯特氏菌的检测;Zhang等[10]制备了一种用于检测HIV病毒的电化学DNA传感器,并将其制作成微电极阵列,实现了电化学传感器的器件化和实际应用.本文采用电还原石墨烯和金纳米粒子对玻碳电极(GCE)修饰,增强电子在电极表面的传输[11],设计了一种用于检测大肠杆菌O157:H7的电化学DNA传感器.
1 实验部分
1.1实验药品及仪器
所用药品包括:亚甲基蓝(MB)、氯金酸、石墨粉,天津市风船化学试剂科技有限公司产品;三(羟甲基)氨基甲烷(Tris)、乙二胺四乙酸(EDTA),上海市晶纯化学试剂公司产品;铁氰化钾、浓硫酸、氯化钠、磷酸二氢钾、磷酸氢二钠、30%过氧化氢,均为天津市光复科技发展有限公司产品;DNA特征片段,天津市博益特生物科技有限公司产品;Tris-HCl缓冲液(pH= 7.2,50 mmol/L,含20 mmol/L NaCl)、磷酸盐缓冲溶液(PBS)(pH=7.0,0.1 mol/L)、柠檬酸钠缓冲液(2×SSC)(pH=7.0)、TE缓冲液(pH=8.0),均为自配.
所用仪器包括:LK2006A型电化学工作站,天津市兰力科化学电子高技术有限公司提供;Nicolet 6700型红外光谱仪,美国赛默飞世尔科技公司产品;JEM-2100型透射电子显微镜,日本电子株式会社产品;S4800型扫描电子显微镜,日本日立公司产品.
所用DNA序列包括:
端氨基标记的探针DNA:5’-NH2-GGTAGCGTCGCATTACGAGATGTGGTGCGG-3’
完全互补目标DNA:5’-CCGCACCACATCTCGTAATGCGACGCTACC-3’
单碱基错配目标DNA:5’-CCGCACTACATCTCGTAATGCGACGCTACC-3’
两碱基错配目标DNA:5’-CCGAACCACATCTCGTAATACGACGCTACC-3’
多碱基错配目标DNA:5’-CCGTGACACACATCGTGATGCGGTGCTAGC-3’
1.2实验步骤
本实验设计流程如图1所示.
1.2.1电化学DNA传感器的制备
首先,将制备好的氧化石墨烯配制成2.0 g/mL的溶液,滴加在预处理干净的电极表面,静置10 min后用清水冲洗.在0.1 mol/L PBS缓冲液中进行循环伏安扫描,扫描范围-1.7~0 V,扫速50 mV/s,至峰形及峰电流值稳定不变为止,完成氧化石墨烯的电还原.之后,将电极取出并用2次水冲洗干净,放在5.0 mmol/L的氯金酸溶液中进行电沉积,电势-0.4 V,沉积时间300 s,在电极表面形成一层致密的金纳米粒子膜.最后,将5 μL端氨基修饰的探针DNA(10 μmol/L)和10 μL Tris-HCl缓冲液滴加在修饰完成的电极表面,40℃条件下保持1 h,完成传感器的制备.将制备完成的传感器置于2×10-5mol/L的亚甲基蓝溶液中自组装5 min,使亚甲基蓝分子充分连接在DNA链上,指示DNA链段的连接数量.将制备好的传感器以不同扫速(0.05、0.1、0.2、…、0.9、1.0 V/s)在 0.1 mol/L PBS缓冲液中进行循环伏安扫描,以研究电子在电极表面的扩散机理.
1.2.2目标DNA检测
将单链DNA修饰的玻碳电极置于一定浓度的目标DNA的2×SSC溶液中,在37℃条件下进行DNA杂交实验,杂交时间1 h.杂交完成后,使杂交溶液自然冷却至室温,然后将电极取出,并用Tris-HCl缓冲液和超纯水依次冲洗电极表面,将未杂交形成双链结构的DNA除去,最后浸入亚甲基蓝溶液中二次浸泡5 min,指示目标DNA的杂交数量.本文对该传感器的选择性和检测限进行研究.传感器选择性实验中,目标DNA选用不同碱基错配的DNA,浓度为0.5 μmol/L;检测限测定实验中,完全互补DNA的浓度分别为1.0×10-12、1.0×10-11、1.0×10-10、1.0×10-9、1.0×10-8mol/L.检测时,采用差分脉冲伏安法,扫描底液为Tris-HCl缓冲液,扫描范围-0.8~0.2 V,脉冲幅度50 mV,脉冲宽度50 ms,扫描速率25 mV/s.
2 结果与讨论
2.1石墨烯的结构表征
氧化石墨烯的表面形貌如图2所示.
由图2可以看出,氧化石墨烯呈片层结构,表面粗糙,有明显褶皱和卷曲,这是为了降低它的表面能,使其片层稳定存在.从氧化石墨烯的透射电镜图可以很明显地看到氧化石墨烯经超声剥离后的薄片层结构,颜色较深的部分为片层的重叠,可以看到明显的褶皱,与扫描电镜图相对应.

图2 氧化石墨烯的扫描电镜图和透射电镜图Fig.2 SEM and TEM images of GO
氧化石墨烯的傅里叶红外谱图如图3所示.
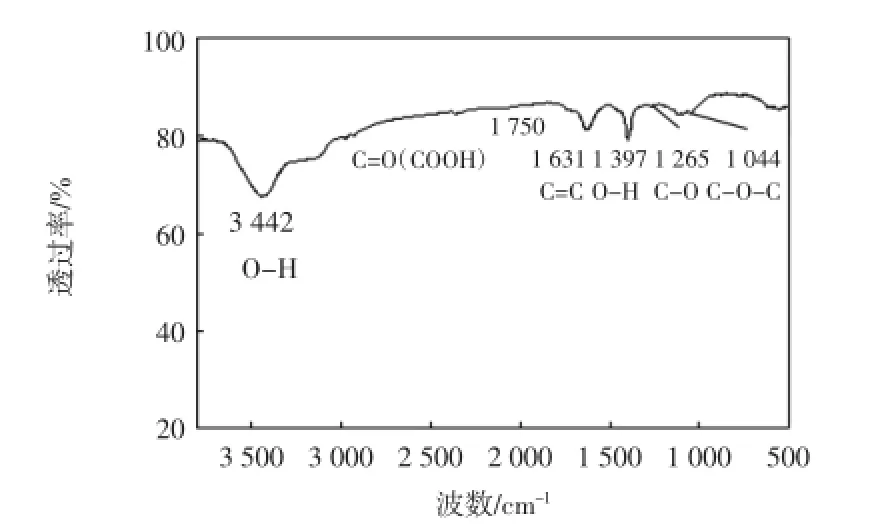
图3 氧化石墨烯的傅里叶红外谱图Fig.3 IR spectrum of GO
由图3可以看出,3 430 cm-1附近较宽、较强的吸收峰为—OH的伸缩振动峰;1 750 cm-1附近的吸收峰为羧基上的—C=O伸缩振动峰;而1 631 cm-1附近的吸收峰则归属于氧化石墨烯碳六元环结构单元上的—C=C—伸缩振动峰;1 265 cm-1左右的吸收峰为C—O伸缩振动峰,1 044 cm-1左右吸收峰则属于C—O—C;此外,1 397 cm-1附近的吸收峰为O—H变形振动峰.说明氧化石墨烯表面含有丰富的羟基、羧基、环氧基等官能团,为其结合其他分子提供了有利条件.
2.2电化学DNA传感器结构表征
传感器制备过程中电极表面形貌如图4所示.

图4 电极表面形貌图Fig.4 SEM images of GCE surface
由图4(b)可以看出,石墨烯在电极表面铺设均匀,无明显聚集;由图4(c)可以看到,经过电沉积后电极表面形成了一层致密的纳米金膜,将石墨烯层完全覆盖,金纳米粒子粒径较大、颗粒较均一,有轻微团聚,这是由于电沉积时氯金酸浓度太大,同时电沉积时间、沉积电位也对金纳米粒子粒径有显著影响. 图5所示为两步修饰电极步骤的电化学表征.

图5 电还原石墨烯和金纳米粒子修饰电极过程的循环伏安表征图Fig.5 CV characterization of electrode modification process with ERGO and AuNPs
由图5可以看到,电化学还原石墨烯和金纳米粒子的修饰使得电信号有较明显的增大作用,这是由于二者的存在增大了电活化面积,加快了电子在电极表面的传输速率.为研究电子在电极表面的扩散机理,将制备好的传感器不同扫速在PBS缓冲液中进行循环伏安扫描,如图6所示.
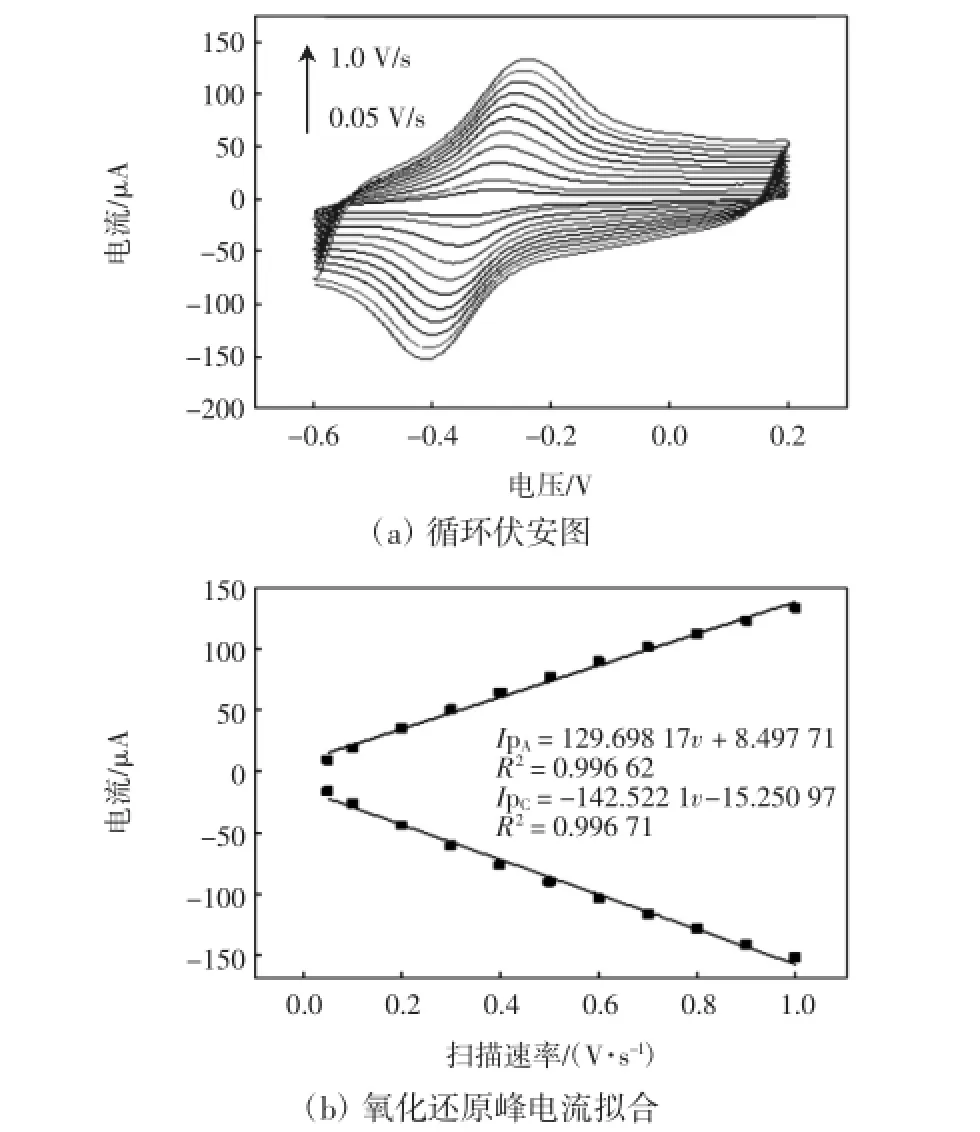
图6 传感器在PBS缓冲液中不同扫速下的循环伏安图以及氧化还原峰电流拟合直线图Fig.6 CV of sensor at different scan rates in PBS buffer,and linear fitting curves about redox peak currents
由图6可以看出,随着扫速增大,电信号值增大,峰电位差也略有增加.将氧化峰和还原峰电流值对扫速进行线性拟合,得到两条直线,相性相关度均达到0.99以上,说明电子在电极表面的传递属于表面控制过程.应用拉维龙方程[12-13]进行计算

式中:ip为还原峰电流值;v为扫速;A为电极表面面积;n为电子转移数;F为法拉第常数;R为摩尔气体常数;T为热力学温度;Ks为直接电子传递速率常数;m为一个与峰电位差和电子转移数n的乘积(nΔEp)相关的量.可以算得本实验中电化学DNA传感器电极表面含有5.37×10-12mol/cm的ssDNA探针.
2.3对目标DNA的检测效果
DNA杂交过程的循环伏安表征如图7所示.
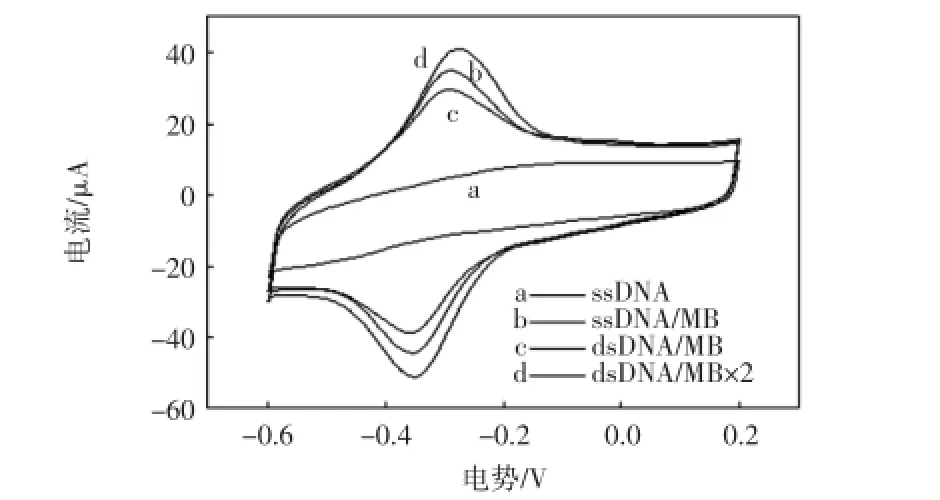
图7DNA杂交过程的循环伏安表征图Fig.7 Cyclic voltammograms of DNA hybridization process
由图7中b、c曲线可以看到,目标DNA杂交完成后,电信号值有一个明显的降低,这是因为目标DNA的磷酸骨架显电负性,对电子传递有阻碍作用.然而,由图7中b、d曲线看出,二次浸泡亚甲基蓝后,电信号值几乎成倍增加,这是因为双链DNA为亚甲基蓝提供了更多的结合位点.由此也能说明,目标DNA成功地与探针DNA实现了杂交.
将传感器与同一浓度的各种DNA分别进行杂交并浸泡亚甲基蓝,以考察该传感器的选择性,结果如图8所示.
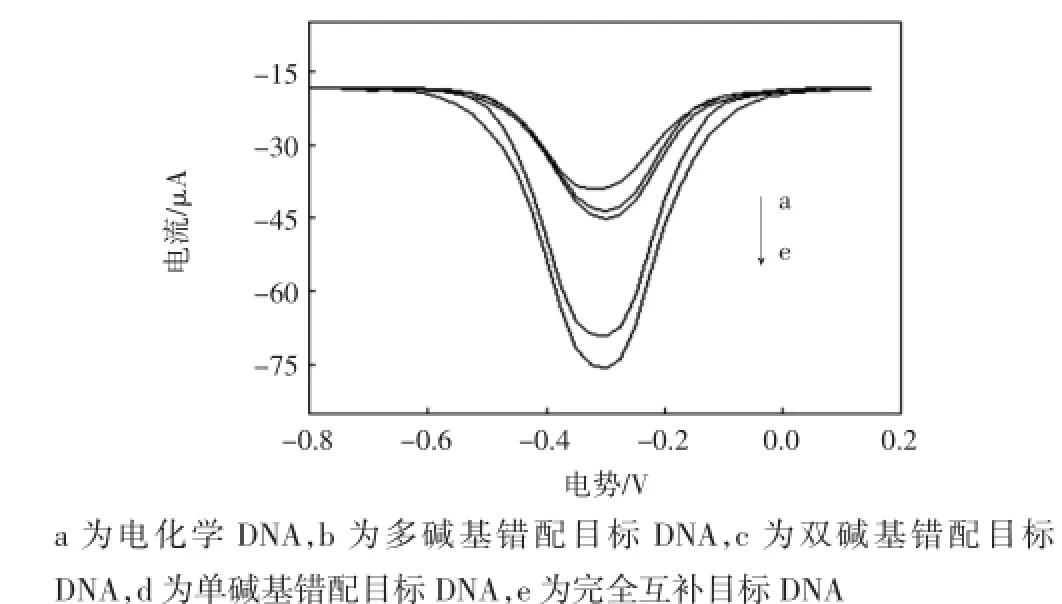
图8 传感器与各种DNA杂交后的差分脉冲伏安图Fig.8 Differential pulse voltammograms(DPVs)after hybridization of biosensor with different DNAs
由图8可以看出,当与完全互补的DNA进行杂交后,其电信号值最大,且与其他几种情形下的信号值差别较大,说明可以很好地区分不同的DNA,即该传感器的选择性还是不错的.
将传感器对不同浓度的目标DNA进行杂交,采用差分脉冲伏安法对电流值进行检测,结果如图9所示.
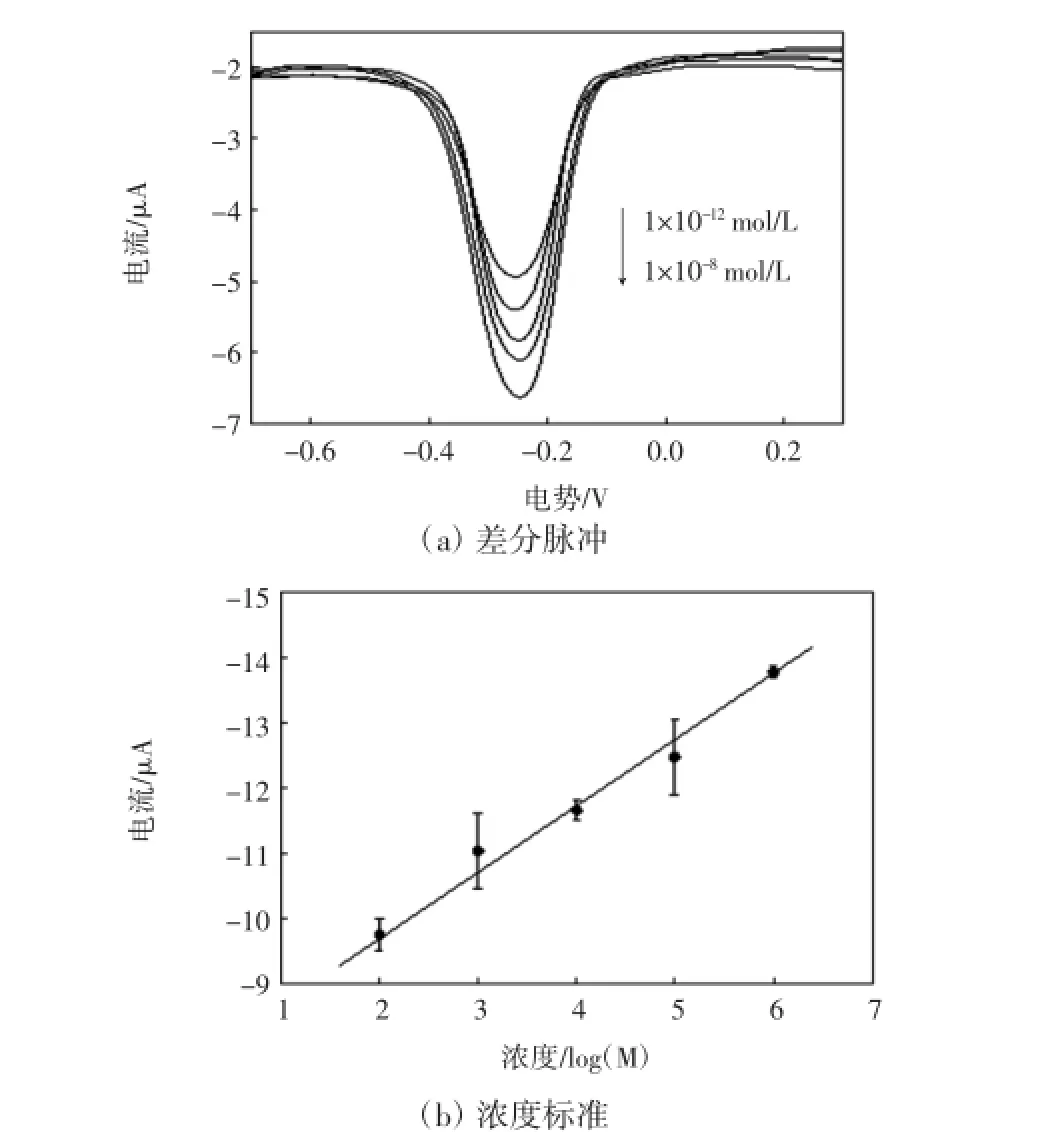
图9 传感器与不同浓度目标DNA杂交的差分脉冲曲线及浓度标准曲线Fig.9 DPVs and standard concentration curves of electrochemical DNA biosensor hybridized with target DNA in different concentrations
由图9可以看出,电流值大小与目标DNA浓度呈正相关关系.将电流值与目标DNA浓度进行线性拟合,可以得到一条直线,线性相关度在0.99以上.采用3σ法对检测限进行计算,可得实验中传感器的检测限为7.735×10-13mol/L,检测范围为1×10-12~1× 10-8mol/L,检测效果优于其他类似大肠杆菌0157:H7传感器[14-15].
3结论
本实验成功制备了基于电还原石墨烯和金纳米粒子的电化学DNA传感器用于检测大肠杆菌O157:H7.证明了传感器表面电子的传递属于表面控制过程,计算得电极表面探针DNA的浓度大约是5.37× 10-12mol/cm.最终得到传感器的检测限是7.735×10-13mol/L,检测范围是1×10-12~1×10-8mol/L.所得传感器的选择性好,灵敏度也较高,对大肠杆菌O157:H7的实际检测应用具有一定的指导意义.然而,就电化学DNA传感器而言,由于国内起步较晚,发展尚不完善,在提升电极材料性能、发展更高效的DNA固定方法、DNA微电极阵列等方面需要引起大家更广泛的关注.
[1]THEVENOT D,TOTH K,DURST R.Electrochemical biosensors:Recommended definitions and classification[J].Biosensors and Bioelectronics,2001,16(1):121-131.
[2]ZHANG S,WRIGHT G,YANG Y.Materials and techniques for electrochemical biosensor design and construction[J]. Biosens Bioelectron,2000,15:273-282.
[3]IVNITSKI D,ABDEL-HAMI I,ATANASOV P.Application of electrochemical biosensors for detection of food pathogenic bacteria[J].Electroanalysis,2000,12:317-325.
[4]SUN W,QI X,ZHANG Y.Electrochemical DNA biosensor for the detection of Listeria monocytogenes with dendritic nanogold and electrochemical reduced graphene modified carbon ionic liquid electrode[J].Electrochim Acta,2012,85:145-151.
[5]杨海朋,陈仕国,李春辉,等.纳米电化学生物传感器[J].化学进展,2009,21(1):210-216. YANG H P,CHEN S G,LI C H,et al.Nano electrochemical biosensor[J].Advances in Chemical,2009,21(1):210-216 (in Chinese).
[6]项纯.谈纳米材料修饰电极在生物电化学中的应用 [J].中国新技术新产品,2009(9):17-20. XIANG C.Application of nanomaterials in biological electrochemistry[J].China New Technology and New Products,2009 (9):17-20(in Chinese).
[7]LI P,LIU J,WANG H.Electrochemical performance and detection of 8-hydroxy-2-deoxyguanosine at single-stranded DNA functionalized graphene modified glassy carbonel ectrode [J].Biosensors and Bioelectronics,2014,67:139-145
[8]VASILIOS G,MICHAL O.Functionalization of graphene:Covalent and non-covalent,approaches,derivatives and applications[J].Chemical Review,2012,112:6156-6214
[9]CHEN D,FENG H,LI J.Graphene oxide:Preparation,functionalization,and electrochemical applications[J].Chemical Review,2012,112:6027-6053.
[10]ZHANG D,PENG Y,QI H.Label-free electrochemical DNA biosensor array for simultaneous detection of the HIV-1 and HIV-2 oligonucleotides incorporating different hairpin-DNA probes and redox indicator[J].Biosensors and Bioelectronics,2010,25(5):1088-1094.
[11]RAO C N R,BISWAS K,SUBRAHMANYAM K S.Graphene the new nanocarbon[J].Journal of Materials Chemistry,2009,19:2457-2469.
[12]LAVIRON E.General expression of the linear potential sweep voltammogram in the case of diffusionless electrochemical systems[J].Journal of Electroanalytical Chemistry and Interfacial Electrochemistry,1979,101(1):19-28.
[13]LAVIRON E.The use of linear potential sweep voltammetry and of ac voltammetry for the study of the surface electrochemical reaction of strongly adsorbed systems and of redox modified electrodes[J].Journal of Electroanalytical Chemistry and Interfacial Electrochemistry,1979,100(1):263-270.
[14]ZHANG Y,ZHANG K,MA H.Electrochemical DNA biosensor based on silver nanoparticles/poly(3-(3-pyridyl)acrylic acid)/carbon nanotubes modified electrode[J].Analytical Biochemistry,2009,387(1):13-19.
[15]MIAO X,GUO X,XIAO Z.Electrochemical molecular beacon biosensor for sequence-specific recognition of double-stranded DNA[J].Biosensors and Bioelectronics,2014,59:54-57.
Preparation and applications of electrochemical DNA biosensor based on ERGO/AuNPs
XU Shi-chao1,2,3,ZHANG Xue-ping1,LI Run-lan1,ZHANG Yi-yi1,ZHOU Jing-jing1
(1.School of Environmental and Chemical Engineering,Tianjin Polytechnic University,Tianjin 300387,China;2.State Key Laboratory of Separation Membranes and Membrane Processes,Tianjin Polytechnic University,Tianjin 300387,China;3.Tianjin Engineering Center for Safety Evaluation of Water Quality&Safeguards Technology,Tianjin Polytechnic University,Tianjin 300387,China)
A new electrochemical DNA biosensor was prepared based on glassy carbon electrode(GCE)modified by electrically reduced graphene(ERGO)and gold nanoparticles(AuNPs),which was applied to detect the target DNA of Escherichia Coli O157:H7 rapidly and sensitively.After the electrochemical reduction of the graphene oxide on the surface of GCE,a stable Au-nanoparticles film will be formed on the surface of electrode through electrodeposition.Moreover,probe DNA was attached on electrode surface through the covalent band between AuNPs and amino-groups of DNA end.At this point,the electrochemical DNA biosensor was obtained.At last,the qualitative and quantitative analyses of target DNA were represented.Results showed this fabricated electrochemical DNA biosensor was of good selectivity,sensitivity and easy operation,the limit and range of detection for target DNA were 7.735×10-13mol/L and 1×10-12—1×10-8mol/L,respectively.
electrochemical DNA biosensor;electrically reduced graphene;Au-nanoparticles(AuNPs);detection of Escherichia Coli
TP212.3
A
1671-024(2016)04-0059-05
10.3969/j.issn.1671-024x.2016.04.010
