氯沙坦对华法林诱导的大鼠血管钙化的作用研究
2016-09-15邵娟李敏才吴基良
邵娟 李敏才 吴基良
437100 咸宁,湖北科技学院糖尿病及心脑血管病重点实验室
·基础研究·
氯沙坦对华法林诱导的大鼠血管钙化的作用研究
邵娟李敏才吴基良
437100 咸宁,湖北科技学院糖尿病及心脑血管病重点实验室
目的观察氯沙坦对华法林诱导的大鼠血管钙化模型的影响,并探讨其可能的作用机制。方法28只5周龄雄性SD大鼠按随机数字表法分为4组:对照组(C)、模型组(M)、模型+低剂量氯沙坦组(M+L)、模型+高剂量氯沙坦组(M+H)(每组7只)。造模成功后取各组大鼠主动脉进行HE染色和茜素红染色,观察血管壁形态学变化和钙盐沉积情况。实时荧光定量PCR检测缝隙连接蛋白(Cx43)mRNA表达,Western blot检测丝裂原活化蛋白激酶(MAPK)、Cx43和基质Gla蛋白(MGP)表达情况。结果华法林能够诱导大鼠血管钙化模型。与对照组比较,模型组Cx43 mRNA和蛋白表达显著上调(3.98±0.65比1.06±0.31,P<0.01;1.91±0.45比1.03±0.07,P=0.029),MAPK家族中细胞外信号调节激酶(ERK)活性显著增加(1.40±0.19比1.04±0.04,P=0.032),MGP表达显著下降(0.19±0.07比1.00±0.02,P<0.01)。与模型组比较,两种剂量氯沙坦干预组Cx43 mRNA和蛋白表达均显著下调(2.28±0.47比3.98±0.65,P=0.021;1.07±0.24和0.64±0.24比1.91±0.45,P=0.047和0.013),ERK活性显著降低(0.76±0.04和0.69±0.09比1.40±0.19,均为P<0.01),MGP表达显著增加(0.45±0.08和0.83±0.10比0.19±0.07,P=0.013和P<0.01)。结论氯沙坦可以抑制华法林诱导的大鼠血管钙化,可能与下调Cx43表达及ERK活性,增加MGP表达有关。
氯沙坦;血管钙化;缝隙连接蛋白43;细胞外信号调节MAP激酶类;基质Gla蛋白
Fund program:National Science Foundation of China (No.81270355); National Science Foundation of Hubei Province (No.2014CFB211)
血管钙化是许多心血管疾病普遍存在的病理改变,是心脑血管事件发生率和死亡率显著增加的重要危险因素[1]。既往认为血管钙化是一个被动的钙磷沉积于血管壁的过程,近年来研究表明血管钙化是一个与骨发育类似的、主动的可调控的生物学过程[2]。其中血管平滑肌细胞(vascular smooth muscle cells,VSMCs)向成骨细胞表型转化是血管钙化的中心环节[3]。多条信号通路及细胞因子共同参与了该病理过程,但具体的调控机制尚不清楚。
氯沙坦是一种血管紧张素Ⅱ的1型受体(AT1R)阻断剂,能阻断肾素-血管紧张素系统激活,从而发挥一系列生理效应。已有研究表明,阻断肾素-血管紧张素系统能够降低动脉粥样硬化、糖尿病、慢性肾病等疾病的发病率和死亡率[4-5]。有报道称,氯沙坦可以抑制高脂饲料诱导的新西兰兔动脉粥样硬化及血管钙化[6]。本研究旨在华法林诱导的大鼠血管钙化模型基础上,观察氯沙坦对血管钙化的影响,并探讨可能的作用机制。
1 材料与方法
1.1实验动物
5周龄雄性SD大鼠28只,80~100 g(清洁级),购自武汉大学实验动物中心(合格证号:NO.42000500004280)。
1.2主要试剂
华法林和氯沙坦购自Maya试剂公司,茜素红购自Sigma,抗Cx43抗体购自Abcam公司,抗MGP抗体购自Santa Cruz公司。抗MAPK抗体及抗GAPDH抗体购自Cell Signaling Technology公司。Trizol试剂(北京艾德莱生物),逆转录试剂盒(GeneCopoeia,USA),SYBR Premix Ex TaqTM(Takara,Japan),PCR扩增引物由擎科生物公司合成。普通PCR仪(Bio-Rad,USA),752紫外分光光度计(上海舜宇恒科学仪器有限公司),7900荧光定量PCR仪(ABI,USA)。
1.3大鼠血管钙化模型建立及实验分组
参照文献[7]建立大鼠血管钙化模型,28只5周龄雄性SD大鼠适应性喂养1周后,按随机数字表法分为4组,每组各7只:对照组(C组)、模型组(M组)、模型+低剂量氯沙坦组(M+L组)、模型+高剂量氯沙坦组(M+H组)。C组:普通饲料喂养,给予和模型组等容量生理盐水皮下注射;M组:每天早上8点给予华法林(15 mg/100 g)和维生素K1(1.5 mg/100 g)皮下注射1次,晚上8点第2次给予华法林(15 mg/100 g)皮下注射,持续2周;M+L组:在模型组基础上于第2周每天早上9点给予氯沙坦(1 mg/100 g)皮下注射持续1周;M+H组:在模型组基础上于第2周每天早上9点给予氯沙坦(2 mg/100 g)皮下注射持续1周。在第1次给予华法林皮下注射前24 h及48 h,所有大鼠分别给予维生素K1(1.5 mg/100 g)皮下注射1次预防出血。待造模完成后处死大鼠取主动脉,收集标本于-80℃冰箱保存或甲醛固定。
1.4HE染色
取大鼠主动脉血管,4%中性甲醛固定,石蜡包埋连续切片,常规脱蜡、脱水后行苏木素-伊红染色(HE染色),于显微镜下观察拍照。
1.5茜素红染色
取大鼠主动脉血管,4%中性甲醛固定,石蜡包埋连续切片,常规脱蜡至水,用1%茜素红染色10 min,常规脱水透明,中性树胶封片,显微镜观察其形态特征。
1.6实时荧光定量PCR(qRT-PCR)检测
按Trizol试剂盒说明书提取组织总RNA,采用752紫外分光光度计对RNA浓度进行测定。根据逆转录试剂盒说明,逆转录合成cDNA。再根据SYBR Premix Ex TaqTM试剂盒说明,以合成的cDNA为模板进行qRT-PCR反应。Cx43引物序列:Cx43上游引物为5′-TGCTCCTCACCAACGGCTCCACT-3′,下游5′-GCGCTGTAGTTCGCCCAGTTTT-3′; 以GAPDH为内参,GAPDH上游引物5′-ACAGCAACAGGGTGGTGGAC-3′,下游5′-TTTGAGGGTGCAGCGAACTT-3′。逆转录条件:94℃ 4 min;94℃ 30 s,56℃ 30 s,72℃ 25 s,30个循环;72℃ 4 min,4℃ 4 min。qRT-PCR反应条件:50℃ 2 min,95℃ 10 min;95℃ 30 s,60℃ 30 s,40个循环。实验重复3次,根据2-△△Ct法计算相对表达量并进行统计。
(2)第二阶段。经过专业组织的基本技能比赛、专业技能比赛和指导教师的筛选,挑选优秀学生进入电信学院科技创新中心、名师工作室、技能竞赛等团队,学院提供专门的场地并划拨专项经费进行扶持,由专业骨干教师指导团队学生、带领他们参加国家、省、市级技能竞赛或完成企业合作项目开发,其他学生则准备专业技能考证。
1.7Western blot检测
将主动脉从-80℃冰箱中取出置于冰上匀浆提取总蛋白,用BCA法进行蛋白定量。样品通过8%SDS-PAGE电泳分离,并转移到PVDF膜上;经5%脱脂奶粉室温封闭1 h后,加一抗(Cx43 1∶8 000、GAPDH 1∶1 000,MAPK 1∶1 000,MGP 1∶300)稀释液,4℃孵育过夜;经洗涤后,用HRP标记的二抗稀释液(1∶5 000)室温孵育1 h,以ECL发光试剂盒显影;图像分析软件扫描条带灰度值,计算蛋白表达相对定量,实验重复3次。
1.8统计学方法

2 结果
2.1氯沙坦对华法林和维生素K1诱导的血管钙化的影响
HE染色的形态学特征:VSMCs排列紊乱,血管壁结构松散、厚度增加、弹性降低,部分管壁中层断裂,这些都是血管钙化的典型病变。经钙化特异性染色——茜素红染色后,模型组中部分血管区域呈现深红色条纹样钙盐沉积特征。表明华法林和维生素K1联合应用能够诱发血管钙化。经过氯沙坦处理后发现血管壁结构形态和钙盐沉积情况均明显减轻(图1、2)。
2.2氯沙坦对主动脉Cx43 mRNA及蛋白表达的影响
缝隙连接是存在于相邻细胞间的膜通道结构,基本组成单位是连接蛋白(connexin,Cx),在VSMCs及成骨细胞中存在着丰富的缝隙连接,主要表达Cx43。有研究发现,Cx43能调控成骨样细胞分化及骨形成过程[8-9]。在本实验中,qRT-PCR结果表明,与对照组比较,模型组Cx43 mRNA表达水平显著性增高;两种剂量氯沙坦干预组Cx43 mRNA表达水平较模型组均不同程度降低,且高剂量氯沙坦处理组降低更明显(图3)。Western blot结果显示,与对照组比较,模型组Cx43蛋白表达水平显著增高;两种剂量氯沙坦处理组Cx43蛋白表达水平较模型组均显著降低,且高剂量组降低更显著(图4)。
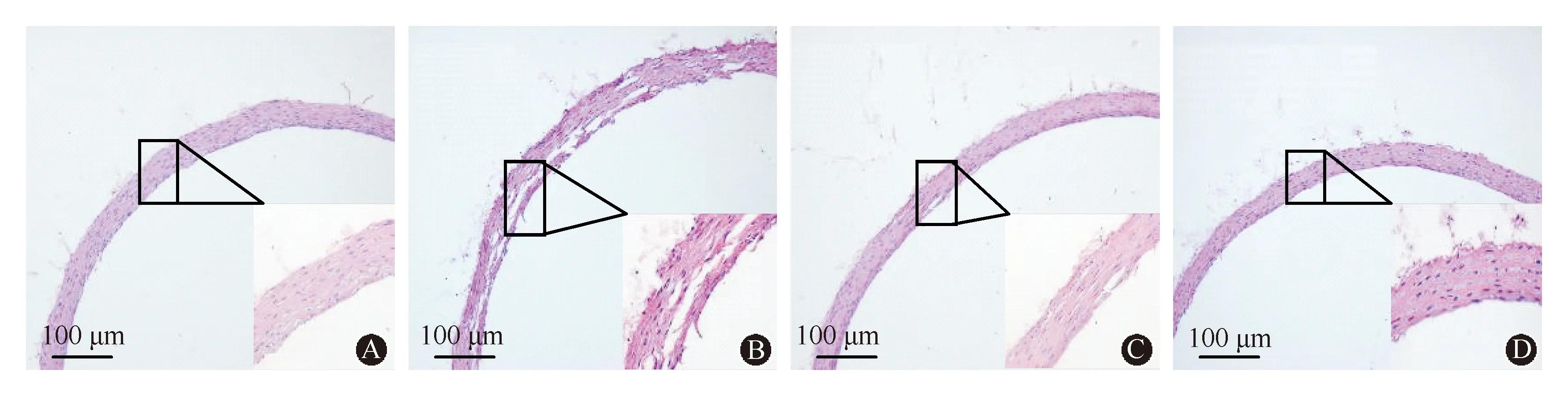
A:对照组;B:模型组;C:模型+低剂量氯沙坦组;D:模型+高剂量氯沙坦组图1 大鼠主动脉HE染色(×100)

A:对照组;B:模型组;C:模型+低剂量氯沙坦组;D:模型+高剂量氯沙坦组图2 大鼠主动脉茜素红染色(×100)

与对照组比较,aP<0.01 ;与模型组比较,bp<0.05 图3 qRT-PCR检测主动脉Cx43 mRNA表达(n=7)

与对照组比较,aP<0.01 ;与模型组比较,bP<0.05 图4 Western blot 检测主动脉Cx43蛋白表达(n=7)
2.3氯沙坦对主动脉MAPK蛋白表达的影响
MAPK是一类细胞信号调节激酶,MAPK信号途径对调控细胞增殖及分化起关键作用,也是血管钙化过程中一条重要的信号通路。Western blot结果显示,与对照组比较,模型组主动脉MAPK中的ERK信号磷酸化被激活,但未检测到c-jun氨基末端激酶(JNK)及丝裂原活化蛋白激酶(P38)信号活化。两种剂量氯沙坦干预组均能显著降低ERK磷酸化水平,且高剂量组降低更明显(图5)。
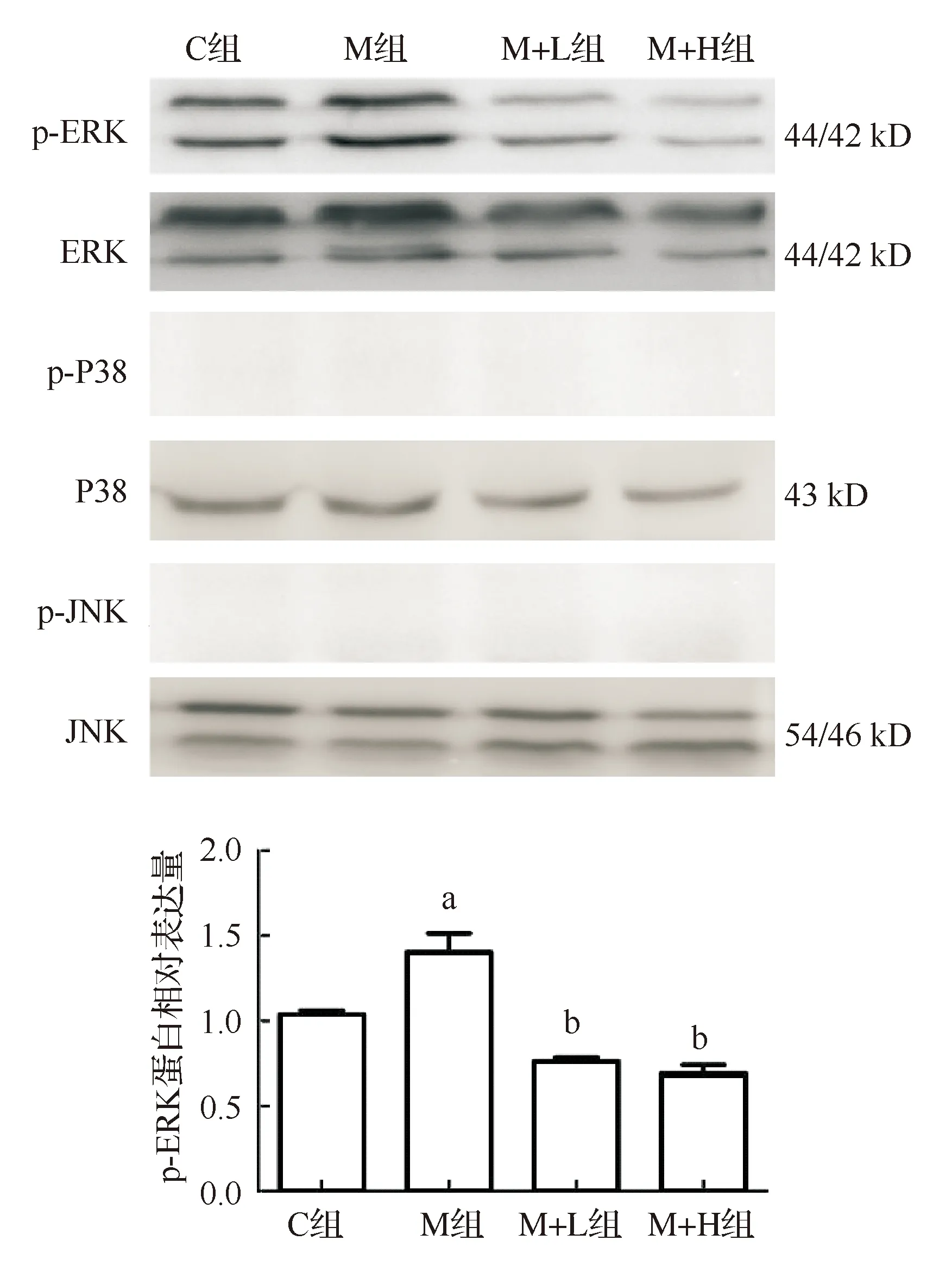
与对照组比较,aP<0.05;与模型组比较,bP<0.01图5 Western blot 检测主动脉MAPK蛋白表达(n=7)
2.4氯沙坦对主动脉MGP表达的影响
MGP是体内最重要的钙化抑制物,MGP能够与矿化物、钙离子等结合抑制矿化物和钙结晶的生长。MGP表达的减少常预示着VSMCs表型向成骨样细胞表型的转换,更易发生血管钙化。在本实验中,与对照组相比,模型组MGP的表达明显下降;与模型组相比,两种剂量氯沙坦干预组均能显著增加MGP的表达,且具有一定剂量依从性(图6),提示氯沙坦有可能通过上调MGP的表达抑制大鼠血管钙化的发生。
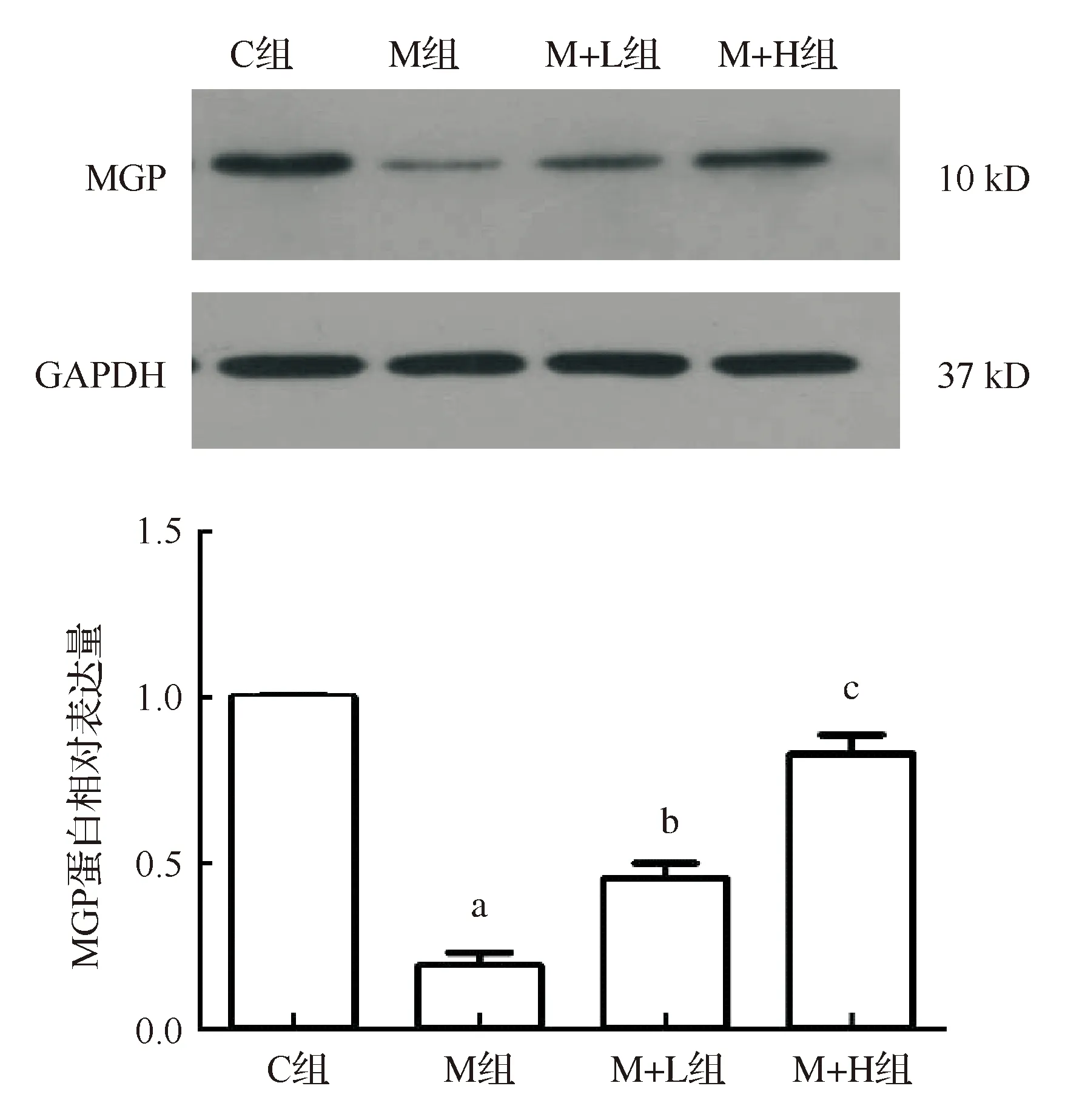
与对照组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01图6 Western blot检测主动脉MGP表达(n=7)
3 讨论
血管钙化常涉及动脉内弹力膜及中层弹性纤维钙化,引起动脉变硬及管腔压力增加。常见于动脉粥样硬化、糖尿病和慢性肾病等疾病,与心血管疾病高发病率及死亡率密切相关[10]。近年来,许多研究表明血管钙化是一个类似于骨形成的主动调节过程,VSMCs发生成骨样细胞分化在其中起关键作用。华法林是维生素K的抑制剂,基质Gla蛋白(matrix gla protein,MGP)是一种血管钙化抑制因子,其活化需要通过以维生素K为辅因子的羧化作用。华法林通过拮抗维生素K而抑制MGP活化发挥其致动脉钙化作用。我们使用华法林诱导大鼠主动脉血管钙化,经钙化特异性茜素红染色表现为内弹力膜增厚,钙盐沉积和中层弹性纤维钙化等形态学改变。经氯沙坦处理后能明显减轻血管钙化情况。
在心血管系统中,心肌细胞及VSMCs间存在着丰富的缝隙连接,主要表达Cx43。Cx43也是成骨细胞中的主要连接蛋白,是细胞骨化的重要标记物。有研究表明,在机械应激引起的后纵韧带骨化症(OPLL)患者韧带组织中,Cx43表达上调,从而促进了韧带细胞的成骨样分化[8]。我们的研究发现,在血管钙化模型组中Cx43 mRNA及蛋白表达明显上调,与前述研究一致,经氯沙坦干预后Cx43表达均显著下调。
MAPK是细胞内的一类丝氨酸/苏氨酸蛋白激酶,包括ERK、JNK和P38。研究证实MAPK信号途径能将细胞外刺激信号转导至细胞及核内,在细胞增殖、分化及凋亡过程中具有至关重要的作用。许多研究表明,ERK参与了调控VSMCs的成骨样分化过程,但这一过程尚存在争议。Ding等[11]研究表明,纤维连接蛋白能通过ERK信号途径促进VSMCs的成骨样分化。Wu等[12]研究表明,过表达Rap1A能增强ERK/P38磷酸化从而促进C2C12成骨样分化。而Liu等[13]研究证实,硒通过抑制氧化应激及ERK激活抑制H2O2诱导的VSMCs钙化。Liang等[14]研究证实,胃饥饿素能通过ERK信号途径抑制VSMCs的成骨分化,且这种抑制作用具有时间和剂量依赖性。我们的研究表明,氯沙坦在抑制血管钙化过程中抑制了ERK磷酸化水平,但未检测到JNK及P38信号活化。
MGP是由平滑肌细胞及软骨细胞合成的一种细胞外基质蛋白,含有5个γ-羧谷氨酸(Gla)残基,经过以维生素K为辅因子的羧化酶羧化后与羟基磷灰石晶体具有高度亲和力,可显著抑制钙盐沉积及羟基磷灰石晶体,是一种强有力的抑制血管钙化的因子。我们的研究表明,氯沙坦可以明显上调MGP的表达,且具有一定的剂量依从性。提示我们氯沙坦可能通过上调MGP的表达抑制大鼠血管钙化的发生。
综上所述,本研究发现氯沙坦在华法林诱导的血管钙化过程中起抑制作用,这种作用可能是通过氯沙坦下调Cx43的表达及ERK活性,上调钙化抑制因子MGP的表达,从而抑制VSMCs成骨样分化来实现的,为血管钙化的临床防治提供了一个新思路。但本研究尚未涉及Cx43、ERK及MGP在氯沙坦抑制血管钙化过程中的上下游关系。
利益冲突:无
[1] Lee MJ,Shin DH,Kim SJ,et al.Progression of aortic arch calcification over 1 year is an independent predictor of mortality in incident peritoneal dialysis patients [J].PLoS One,2012,7(11):e48793.DOI:10.1371/journal.pone.0048793.
[2] Thompson B,Towler DA.Arterial calcification and bone physiology:role of the bone-vascular axis [J].Nat Rev Endocrinol,2012,8(9):529-543.DOI:10.1038/nrendo.2012.36.
[3] McCarty MF,DiNicolantonio JJ.The molecular biology and patho-physiology of vascular calcification [J].Postgrad Med,2014,126(2):54-64.DOI:10.3810/pgm.2014.03.2740.
[4] Volpe M,Cosentino F,Tocci G,et al.Antihypertensive therapy in diabetes:the legacy effect and RAAS blockade [J].Curr Hypertens Rep,2011,13(4):318-324.DOI:10.1007/s11906-011-0205-z.
[5] Han H.Blood pressure medications:ACE-I/ARB and chronic kidney disease [J].J Ren Nutr,2013,23(6):e105-e107.DOI:10.1053/j.jrn.2013.08.003.
[6] Ruan LM,Cai W,Chen JZ,et al.Effects of Losartan on expression of connexins at the early stage of atherosclerosis in rabbits[J].Int J Med Sci,2010,7(2):82-89.DOI:10.1053/j.jrn.2013.08.003.
[7] Schurgers LJ,Spronk HM,Soute BA,et al.Regression of warfarin-induced medial elastocalcinosis by high intake of vitamin K in rats [J].Blood,2007,109(7):2823-2831.
[8] Chen D,Liu Y,Yang H,et al.Connexin 43 promotes ossification of the posterior longitudinal ligament through activation of the ERK1/2 and p38 MAPK pathways [J].Cell Tissue Res,2016,363(3):765-773.DOI:10.1007/s00441-015-2277-6.
[9] Yang H,Shi L,Shi G,et al.Connexin 43 Affects Osteogenic Differentiation of the Posterior Longitudinal Ligament Cells via Regulation of ERK Activity by Stabilizing Runx2 in Ossification [J].Cell Physiol Biochem,2016,38(1):237-247.DOI:10.1159/000438625.
[10] O′Neill WC,Lomashvili KA.Recent progress in the treatment of vascular calcification [J].Kidney Int,2010,78(12):1232-1239.DOI:10.1038/ki.2010.334.
[11] Ding HT,Wang CG,Zhang TL,et al.Fibronectin enhances in vitro vascular calcification by promoting osteoblastic differentiation of vascular smooth muscle cells via ERK pathway [J].J Cell Biochem,2006,99(5):1343-1352.
[12] Wu Y,Zhou J,Li Y,et al.Rap1A Regulates Osteoblastic Differe-ntiation via the ERK and p38 Mediated Signaling[J].PLoS One,2015,10(11):e143777.DOI:10.1371/journal.pone.0143777.
[13] Liu H,Lu Q,Huang K.Selenium suppressed hydrogen peroxide-induced vascular smooth muscle cells calcification through inhibiting oxidative stress and ERK activation [J].J Cell Biochem,2010,111(6):1556-1564.DOI:10.1002/jcb.22887.
[14] Liang QH,Jiang Y,Zhu X,et al.Ghrelin attenuates the osteoblastic differentiation of vascular smooth muscle cells through the ERK pathway [J].PLoS One,2012,7(4):e33126.DOI:10.1371/journal.pone.0033126.
(本文编辑:谭潇)
Effects of losartan on warfarin-induced vascular calcification in rats
ShaoJuan,LiMincai,WuJiliang
KeyLaboratoryonCardiovascular,CerebrovascularandMetabolicDiseaseofHubeiProvince,HubeiUniversityofScienceandTechnology,Xianning437100,ChinaCorrespondingauthor:LiMincai,Email:mincaili@163.com;WuJiliang,Email:xywjl@163.com
ObjectiveTo investigate the effects and mechanism of losartan regulating vascular calcification in rat vascular calcification models induced by warfarin.MethodsTwenty eight 5-week-old male Sprague-Dawley (SD) rats were randomly divided into 4 groups:Control (C),Model (M),Model+Low losartan (M+L),Model+High losartan (M+H).Vascular calcification was confirmed by HE and Alizarin Red staining to observe morphology and calcium deposition of vascular wall.The expression of Connexin43 (Cx43) mRNA was detected by real-time quantitative PCR.The expression of mitogen-activated protein kinase (MAPK),Cx43 and Matrix Gla Protein (MGP) were analyzed by western blot.ResultsThe vascular calcification could be induced by warfarin in rats.Compared with C group,The expressions of Cx43 mRNA and protein in aorta in model group were up-regulated significantly (3.98±0.65vs.1.06±0.31,P<0.01;1.91±0.45vs.1.03±0.07,P=0.029).Meanwhile,the extracellular signal-regulated kinase (ERK) activity was significantly increased (1.40±0.19vs.1.04±0.04,P=0.032) and the expression of MGP was significantly decreased (0.19±0.07vs.1.00±0.02,P<0.01).Compared with M group,the expression of Cx43 mRNA and protein of aorta in M+L and M+H group were down-regulated significantly (2.28±0.47vs.3.98±0.65,P=0.021;1.07±0.24 and 0.64±0.24vs.1.91±0.45,P=0.047 and 0.013) and ERK activity was significantly decreased (0.76±0.04 and 0.69±0.09vs.1.40±0.19,bothP<0.01).Meanwhile,the expression of MGP was significantly increased (0.45±0.08 and 0.83±0.10vs.0.19±0.07,P=0.013 andP<0.01).ConclusionsWarfarin-induced vascular calcification in rats could be suppressed by losartan.The mechanism may be related with inhibition of Cx43 expression and ERK activation,and increased MGP expression.
Losartan;Vascular calcification;Connexin 43;Extracellular signal-regulated MAP kinases;Matrix gla protein
李敏才,电子信箱:mincaili@163.com;吴基良,电子信箱:xywjl@163.com
10.3969/j.issn.1007-5410.2016.04.010
国家自然科学基金项目(81270355);湖北省自然科学基金项目(2014CFB211)
2016- 03-07)