纳米羟基磷灰石携载lefty-1基因对人乳腺癌细胞的杀伤效应
2016-09-15钟云平姚晨雪宋国龙解纯刚孔祥东
钟云平,姚晨雪, 宋国龙,赖 文,陈 岑,解纯刚,孔祥东
(浙江理工大学,a. 生命科学学院;b. 材料与纺织学院,杭州 310018)
纳米羟基磷灰石携载lefty-1基因对人乳腺癌细胞的杀伤效应
钟云平a,姚晨雪a, 宋国龙a,赖文b,陈岑a,解纯刚a,孔祥东a
(浙江理工大学,a. 生命科学学院;b. 材料与纺织学院,杭州 310018)
采用聚乙烯亚胺为调控剂,氯化钙和磷酸氢二钠为原料,共沉淀法合成一种长梭状纳米羟基磷灰石。通过场发射扫描电镜、X射线粉末衍射、红外吸收光谱和热重分析仪对材料性能进行表征。体外降解实验表明羟基磷灰石颗粒具有可降解性,在弱酸性条件下更容易降解,具有pH值响应性。颗粒与质粒DNA体外负载曲线及基因释放曲线结果表明,长梭状羟基磷灰石颗粒能够有效地携载并且表现对质粒DNA的持续释放。体外转染实验证实颗粒携载pEGFP-C1-lefty-1质粒后在细胞中成功表达绿色荧光蛋白。MTT结果表明所制备的羟基磷灰石颗粒对人乳腺上皮细胞表现极低的细胞毒性,具有良好的生物相容性,携载pEGFP-C1-lefty-1质粒后对人乳腺癌细胞具有良好的杀伤效果。
羟基磷灰石;lefty-1;人乳腺癌细胞;杀伤效应;聚乙烯亚胺
0 引 言
羟基磷灰石(hydroxyapatite, HAp)是人体骨骼和牙齿的主要无机成分,具有良好的生物相容性而不会引起机体的免疫反应[1]。通过某些蛋白质,例如丝素蛋白等调控合成纳米HAp[2-3],负载药物时具有负载率高、缓释性好等药物载体性能[4];作为基因载体,纳米HAp具有生物可降解性、易于实现靶向性和保护DNA等的优势[5-6]。通常质粒DNA进入细胞后很快被核酸酶消化降解,但HAp颗粒有保护DNA功能,能够与质粒DNA形成致密的结构,使质粒DNA不被核酸酶消化降解[7]。HAp颗粒的表面电荷和粒径是影响转染效率的重要因素[8-9]。Chen等[10]用12-氨基十二烷酸对颗粒进行修饰使其表面带有正电荷,转染成骨细胞时发现转染效率明显提高。Gao等[11]发现粒径小于40 nm的颗粒,由于细胞直接吞噬作用,其转染效率有了明显的提高。采用聚乙烯亚胺(PEI)对HAp颗粒进行表面修饰,可提高其携载质粒DNA的能力[12]和转染效率[13]。Murankami等[14]在HAp颗粒表面包裹上PEI涂层,发现颗粒对ADP、AMP和ATP的吸附力明显提高。Peng等[15]以聚乙二醇(PEG)和PEI为调控剂,共沉淀法合成一种PEG-PEI/Fe3O4磁性纳米颗粒,发现对质粒DNA具有高负载效率。
乳腺癌的发病率近年来不断提高,2013年美国乳腺癌的新发病例达到了23万例[16];在中国乳腺癌的年龄标化发病率(ASR)为21.6例/10万人,并且新发病增长率是世界水平的2倍[17]。乳腺癌的发生是一个多因素、多基因参与的过程。Strizz等[18]发现乳腺癌中Nodal蛋白的表达量增加。Kirsammer等[19]发现Nodal信号在乳腺癌中呈高水平表达,通过激活ERK信号,促进肿瘤的浸润性和转移性。Lefty基因表达的lefty蛋白由lefty-1和lefty-2蛋白组成[20],在肿瘤组织中呈极低水平表达;研究证明两种蛋白均抑制Nodal信号通路[21-22],促进恶性肿瘤细胞的凋亡,显示出抗肿瘤活性。
本文通过采用氯化钙和磷酸氢二钠为原料、PEI为调控剂,通过共沉淀法合成出一种纳米HAp颗粒,研究其携载lefty-1基因后对人乳腺癌细胞的杀伤效应。
1 材料与表征方法
1.1实验材料与仪器
材料:聚乙烯亚胺、氯化钙(CaCl2)和磷酸氢二钠(Na2HPO4)购自于sigma公司,pEGFP-C1-lefty-1质粒由上海捷瑞生物工程有限公司合成,无水乙醇为市售分析纯,去离子水由Milipore纯水仪制备。
仪器:Nicolet 5700傅立叶变换红外光谱仪(Thermo Electron公司),ARL-X’TRA型X-射线粉末衍射仪(美国热高公司),ZEISS-ULTRA55场发射扫描电镜(日本Hitachi公司),Pyris 1 TGA热重分析仪(美国铂金-埃尔默公司),集热式恒温加热磁力搅拌器(杭州惠创仪器设备有限公司),ELx 800酶标仪(BioTek公司),Nanodrop 2000(Thermo公司),INTEGRA真空安全吸液器(VACUSAFE公司)。
1.2P-HAp颗粒的合成
P-HAp颗粒的制备方法按照以下步骤:
a) 分别配制0.1 mM的CaCl2、Na2HPO4溶液和0.1 mM的PEI水溶液;
b) 在30 mL Na2HPO4溶液中加入210 mL去离子水,200 r/min匀速搅拌10min,反应在70 ℃集热式恒温加热磁力搅拌器里进行;
c) 加入10 mL PEI水溶液,用NaOH溶液调节pH值为10,200 r/min搅拌30 min;
d) 滴加50 mL CaCl2溶液,速度为20滴/min,滴加过程中调节反应温度、搅拌速度,pH值保持不变;
e) 滴加完毕后,继续搅拌反应4 h,将反应完成后的颗粒8 000 r/min沉淀离心收集,再用去离子水和无水乙醇分别洗涤3次;
f) 将离心后得到的沉淀以两种方式保存,一种保存在无水乙醇溶液中,以备后续的FE-SEM等测试;另一种60 ℃恒温干燥箱中干燥48 h后收集,以备后续的FT-IR,XRD,TGA等测试;将合成的颗粒记为P-HAp。
1.3P-HAp颗粒的表征测试
1.3.1场发射扫描电镜(FE-SEM)
将保存在无水乙醇中的P-HAp颗粒超声分散后滴加一滴至清洗干净的硅片表面,待无水乙醇挥发后将硅片粘贴到导电胶上,采用FE-SEM(加速电压为3.0 kV)对颗粒形貌进行观察。
1.3.2X射线粉末衍射仪(XRD)
将干燥后的P-HAp颗粒研磨成粉末状,均匀地置于载玻片表面,采用X-射线粉末衍射仪(管电压40 kV,管电流35 mA,扫描速度为5 °/min,扫描范围2θ=10°~60°)进行物相和结晶性能分析。
1.3.3红外吸收光谱仪(FT-IR)
采用溴化钾压片法,将干燥后的P-HAp颗粒研磨成粉末与溴化钾混合,质量比约为1∶100,充分研磨后将混合物进行压片(30 MPa,45s)。利用傅立叶变换红外光谱仪(扫描范围为4500~400 cm-1)对样品进行分析。
1.3.4热重分析仪(TGA)
将干燥后的P-HAp颗粒研磨成粉末状,采用热重分析仪(加热速度10℃/min,升温范围为20~800℃)对水分和有机物含量进行分析。
1.4P-HAp颗粒体外降解实验
1.4.1P-HAp颗粒的降解
将磷酸盐缓冲液(PBS溶液)设置4个不同pH值,pH值分别为4.5、5.6、6.5和7.4。将50 mg P-HAp颗粒重悬于10 mL的PBS溶液中,使P-HAp悬液浓度达到5 mg/mL。4组颗粒悬液放置在水浴恒温振荡器中,振荡速率为120 r/min,温度为37℃;分别在降解1、3、5、7、14、21、28、35、42、49、56、63、70、77、84 d和91d后,10 000 r/min离心5 min收集上清液,并重新补足10 mL PBS溶液,振荡重悬,继续降解。
1.4.2钙离子浓度测定方法
钙离子浓度测定操作方法参照钙离子浓度试剂盒(DICA-500,Bioassay Systems),取5 μL样品加入到96孔板中,加入200 μL工作液,充分混合,室温孵育3 min,用酶标仪读取OD 612 nm的值,对照钙离子浓度标准曲线计算出对应的钙离子浓度,最后计算出P-HAp颗粒的降解百分比。
1.5P-HAp颗粒与pEGFP-C1-lefty-1质粒负载曲线
将干燥后的P-HAp颗粒于超净工作台紫外灭菌24 h后,配制浓度为0.1、0.5、1、5、10 mg/mL的悬液,并室温下30 kHz的频率超声5 min。将100 μg pEGFP-C1-lefty-1质粒加入到200 μL不同浓度的P-HAp悬液,混合均匀后,37℃水浴条件下孵育2 h;将形成的P-HAp-pEGFP-C1-lefty-1复合物4℃条件下10 000 r/min离心5 min,收集上清液,Nanodrop 2000测量上清液中DNA浓度,计算出不同浓度P-HAp悬液对pEGFP-C1-lefty-1质粒的负载效率。
1.6P-HAp-pEGFP-C1-lefty-1的基因释放曲线
按照步骤1.5取1 mg/mL P-HAp悬液组,离心吸取上清液后,在沉淀中分别加入200 μL pH值为5.6和7.4的PBS溶液,置于37℃水浴条件下,分别在0.5、1 、2 、12、24 、48 、72、96 、120、144 、168 h后吸取5 μL上清液,同时补足等量的PBS。Nanodrop 2000测量上清液中DNA浓度,计算出在不同时间段质粒DNA释放百分比。
1.7P-HAp-pEGFP-C1体外转染细胞
在2 mL无血清DMEM培养基中加入25 μL 1 mol/L的CaCl2溶液,使培养基中的Ca2+浓度达到10 m mol/L,再分别加入500 μL 400 μg/μL质粒DNA和200 μL 1 mg/mL的HAp悬液,混合均匀置于37℃、5% CO2的细胞培养箱中孵育20 min后备用。将处于对数生长期的MCF-7细胞(人乳腺癌细胞株)和MDA-MB-231细胞(人乳腺癌细胞株),以每孔2×104个细胞的密度接种24孔细胞培养板中,每孔加入1 mL培养基,置于细胞培养箱中培养24 h后,将配置好p-HAp-pEGFP-C1-lefty-1复合物加入到24孔板中,每孔加入200 μL,继续培养48 h和72 h后荧光倒置显微镜观察并拍照。
1.8P-HAp颗粒生物相容性
将处于对数生长期的Hs 578bst细胞(人乳腺上皮细胞株)以每孔5 000个细胞的密度铺于96孔细胞培养板中,将96孔板置于细胞培养箱下培养24 h后,每孔加入10 μL不同浓度梯度的P-HAp悬液,在分别培养24 、48 、72 h后,每孔加入20 μL 5 mg/mL的MTT(3-(4, 5-二甲基噻唑-2)-2, 5-二苯基四氮唑溴盐)溶液,继续培养4 h后用真空安全吸液器吸去培养液,每孔加入150 μL二甲基亚砜溶液(DMSO),平板振荡器上振荡10 min后,酶标仪OD 490 nm处读取各孔的吸光值,按照公式:
细胞生存率= (OD实验组-OD调零孔)/(OD对照组-OD调零孔)×100%
(1)
计算出细胞生存率,以颗粒浓度为横坐标、细胞生存率为纵坐标绘制细胞生长活力图。
1.9P-HAp-pEGFP-C1-lefty-1对乳腺癌细胞的杀
伤效应
将处于对数生长期的MCF-7、MDA-MB-231和Hs 578bst细胞铺于96孔细胞培养板中,细胞密度为5 000个每孔;将96孔板置于细胞培养箱下培养24 h后,每孔加入20 μL P-HAp-pEGFP-C1-lefty-1复合物,分别培养24 、48 、72 h后,每孔加入20 μL 5 mg/mL的MTT溶液,继续培养4 h后用真空安全吸液器吸去培养液,每孔加入150 μL DMSO溶液,平板振荡器上振荡10 min后,酶标仪OD 490 nm处测量各孔的吸光值,按照步骤1.8中的公式计算出细胞生存率。
2 实验结果与分析
2.1P-HAp颗粒的表征
图1为P-HAp颗粒在的场发射扫描电镜图。从图中可以观察到,所合成的P-HAp颗粒形貌呈两端细长,中间较粗的长梭状结构;颗粒长度为300~400 nm,中间长度为30~40 nm,颗粒的分散性好,粒径大小比较均匀。
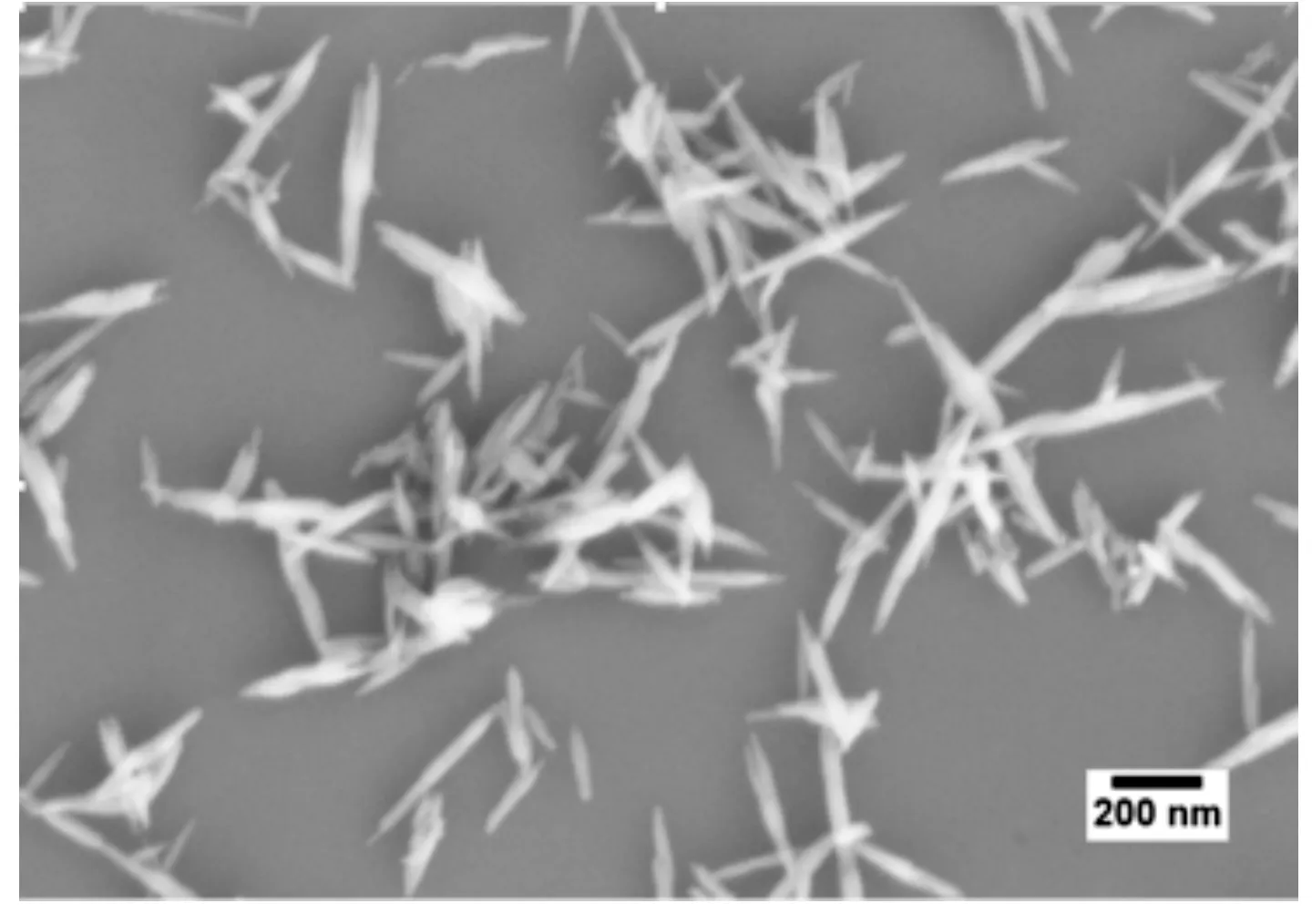
图1 P-HAp颗粒场发射扫描电镜照片
图2(a)为P-HAp颗粒的X射线粉末衍图。通过与HAp的标准粉末衍射数据(JCPDS#9-432)进行衍射峰对比分析,制备的P-HAp颗粒主要晶型为羟基磷灰石。

图2(c)为P-HAp颗粒的X射线能谱图(EDS)。从图中可以观察到,钙、磷和氧元素都被检测出来,这与羟基磷灰石的元素组成相符合;少量钠元素被检测出来,说明合成原料磷酸氢二钠有残留;碳元素也被检测出来,说明合成过程中空气中的CO2参与的反应,生成了部分的CaCO3沉淀。
图2(d)为P-HAp颗粒的热重分析结果。图中曲线表明P-HAp颗粒热失重分为两步,第一步是150℃以下质量比为2.55%的热失重,其原因是结合水的失去;第二步为150~600℃质量比为8.96%的热失重,其原因是有机物PEI的分解,说明所合成的P-HAp颗粒中有机物PEI的含量为8.96%。
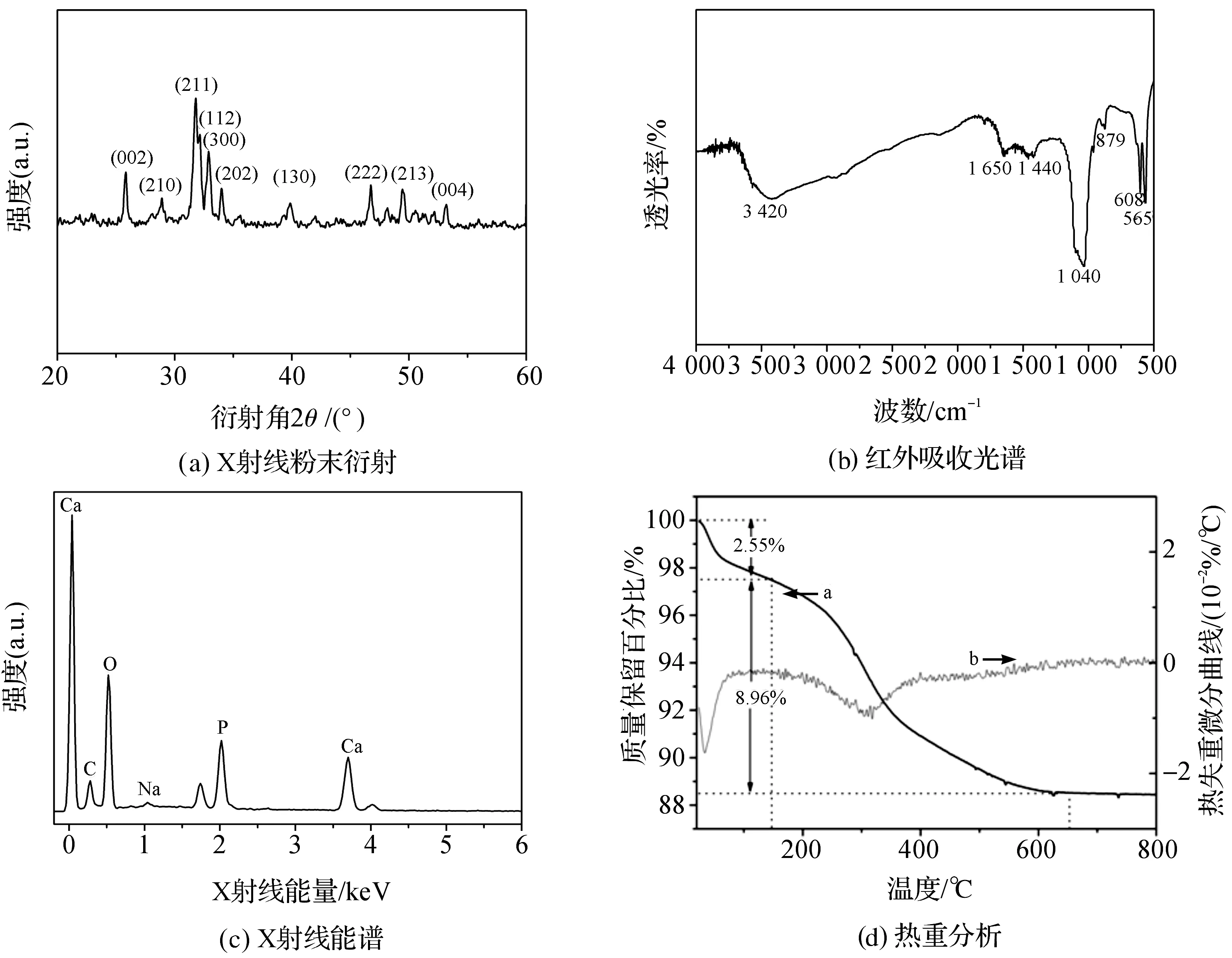
图2 P-HAp颗粒材料性能表征结果
2.2P-HAp颗粒的体外降解曲线
P-HAp颗粒体外降解曲线选取降解天数为横坐标,降解百分比为纵坐标,如图3所示。在pH值为 4.5的PBS溶液中,P-HAp颗粒降解速度最快,降解百分比最大,降解91 d后,其降解百分比达到56.7%;随着pH值的增大,颗粒的降解速度逐渐变小,降解百分比也变小;在pH值为5.6的条件下,91 d后颗粒的降解百分比达到40.6%;而在pH值为6.5和7.4的条件下,91 d后颗粒的降解百分比分别为28.5%和18.2%,表明P-HAp颗粒的体外降解具有pH值响应性。从生物安全性和恶性肿瘤酸性微环境这两点考虑,HAp颗粒在弱酸性pH值下缓慢降解性这一特征,为其作为缓释性基因载体提供基础依据。
2.3P-HAp与pEGFP-C1-lefty-1质粒体外负载曲线
图4为P-HAp与pEGFP-C1-lefty-1质粒的体外负载曲线。从图4中可以观察到,随着P-HAp悬液浓度的增加,与颗粒结合的质粒DNA的量也逐渐

a. pH=4.5,b. pH=5.6,c. pH=6.5,d. pH=7.4图3 P-HAp颗粒体外降解曲线图
增加;在颗粒浓度为0.1 mg/mL时,质粒DNA结合百分比为25.9%;而当浓度为10 mg/mL时,质粒DNA结合百分比达到90.8%。说明经PEI调控合成的HAp颗粒具有很好的基因负载效率,体外能够有效地结合质粒DNA。
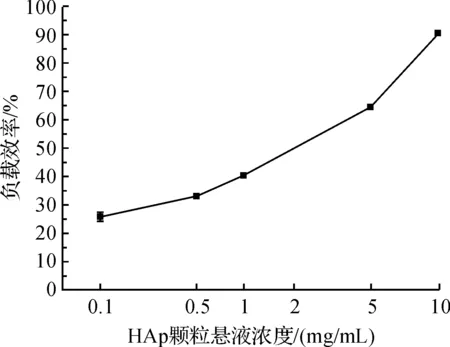
图4 P-HAp与质粒DNA结合曲线
2.4P-HAp-pEGFP-C1-lefty-1体外基因释放曲线
图5为P-HAp-pEGFP-C1-lefty-1在pH值为5.6(曲线a)和7.4(曲线b)PBS溶液中体外基因释放曲线。在pH值为5.6的条件下,前6 h内其基因释放量呈指数增长,6~144 h时间段里呈类线性增长,并且在144 h后达到平台期,其最大释放量为18.3%;在pH值为7.4的条件下,前6 h内其基因释放量呈指数增长,其后基因缓慢释放,并且在96 h后达到平台期,其最大释放量为9.8%。说明与HAp颗粒结合的质粒DNA在弱酸性pH值下更容易释放,进一步为其作为缓释性基因载体提供基础依据。

图5 P-HAp-pEGFP-C1基因释放曲线
2.5P-HAp-pEGFP-C1的体外转染实验
图6为P-HAp颗粒、pEGFP-C1质粒和P-HAp-pEGFP-C1复合物的体外转染人乳腺癌细胞(MCF-7、MDA-MB-231)48 h和72 h后的荧光图。pEGFP-C1质粒带有绿色荧光蛋白基因,表达的绿色荧光蛋白在蓝光激发下会发出绿色荧光。从图6中可以观察到,Mock组(P-HAp颗粒)由于没有携带pEGFP-C1质粒,无论是MCF-7细胞还是MDA-MB-231细胞,整个视野中都没有检测到绿色荧光;pEGFP-C1质粒组对于两种细胞的转染效率都很低,在转染48 h和72 h后,整个视野中只有极少数的细胞表达绿色荧光蛋白。图6(a)中与pEGFP-C1组相比,P-HAp-pEGFP-C1对MCF-7细胞具有更高的转染效率,整个视野中观察到更多绿色荧光蛋白,这是由于PEI带正电荷,细胞膜表面带负电荷,这样细胞能够有效地吸附P-HAp-pEGFP-C1复合物,提高转染效率,并且在转染72 h后绿色荧光蛋白的表达量更多。但对于MDA-MB-231细胞,P-HAp-pEGFP-C1组的转染效率没有明显变化。图6(b)中与pEGFP-C1组相比,在转染48 h和72 h后,视野中观察到的绿色荧光蛋白量并没有显著的差异,仍保持着较低转染水平。
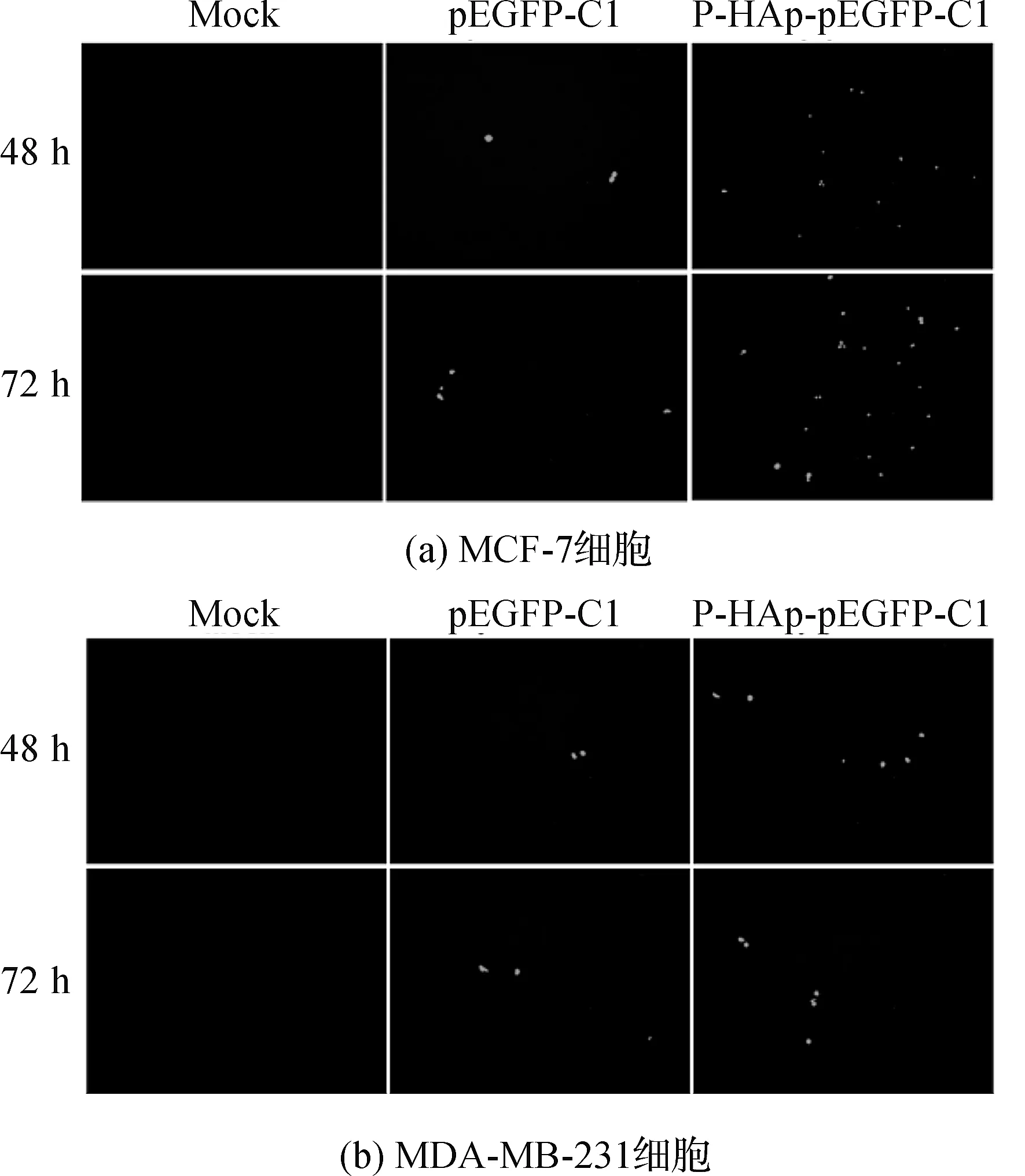
图6 荧光显微镜检测P-HAp-pEGFP-C1转染荧光图
2.6P-HAp颗粒的生物相容性
图7为P-HAp颗粒对Hs 578bst细胞毒性实验结果,P-HAp悬液的终浓度为0.001、0.005、0.01、0.05、0.1、0.5、1 mg/mL。随着P-HAp悬液浓度的增加,Hs 578bst细胞的存活率并没有显著的变化,且细胞存活率都在80%以上。不同时间处理组(24、48 、72 h)的细胞存活率也都在80%以上,表明P-HAp颗粒对Hs 578bst细胞表现出极低的细胞毒性。
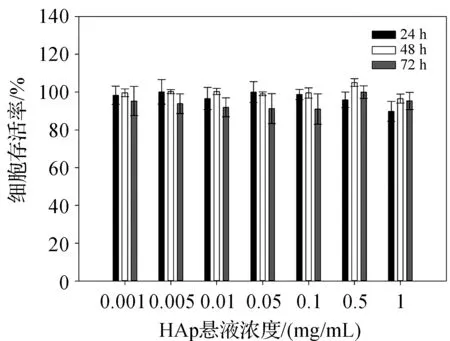
图7 P-HAp生物相容性结果
2.7P-HAp-pEGFP-C1-lefty-1对乳腺癌细胞的杀
伤效应
图8为P-HAp-pEGFP-C1-lefty-1复合物对乳腺癌细胞的杀伤效果图。从图8中可以观察到终浓度为0.1 mg/mL的P-HAp悬液对MCF-7细胞、MDA-MB-231细胞和Hs 578bst细胞均表现出极低细胞毒性,三种细胞的细胞存活率在培养24、48、72 h后也没有显著的变化,且都在80%以上。P-HAp颗粒携载pEGFP-C1-lefty-1质粒后对人乳腺癌细胞(MCF-7和MDA-MB-231细胞)具有较显著杀伤效果,但对人乳腺上皮细胞(Hs 578bst细胞)不表现杀伤作用。对于MCF-7细胞,加入P-HAp-pEGFP-C1-lefty-1复合物后,在培养24 h和72 h后其细胞存活率分别为65.3%和50.4%;而对于MDA-MB-231细胞,在培养24 h和72 h后细胞存活率分别为72.9%和62.8%,说明P-HAp-pEGFP-C1-lefty-1的杀伤作用随着时间的延长而增强,且对MCF-7细胞具有更强的杀伤作用,推测是P-HAp-pEGFP-C1对MCF-7细胞具有更高的转染效率的原因。Cavallar等[23]发现lefty蛋白能够有效促进人肝癌细胞(HepG2)的凋亡。Topczewska等[24]在研究Nodal信号和恶性黑色素瘤的发生关系时,发现lefty蛋白能够降低黑色素瘤细胞的浸润性和集落形成。本实验研究首次证实了纳米HAp颗粒携载lefty-1基因对乳腺癌细胞的杀伤效果。
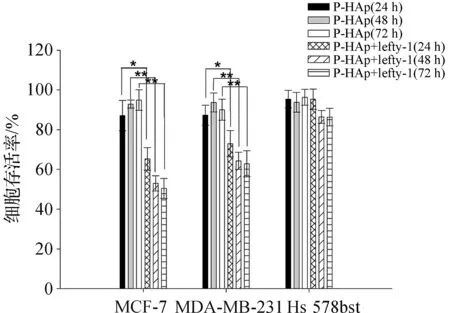
图8 P-HAp-pEGFP-C1对人乳腺癌细胞杀伤结果
3 结论
a) 以有机物PEI为模板调控合成了主要晶型为羟基磷灰石的纳米颗粒,其形貌为长梭状,长度为300~400 nm,中间宽度为30~40 nm,颗粒分散性好,尺度均匀。
b) 合成的纳米HAp颗粒可有效吸附质粒DNA,在弱酸性pH条件下可实现对质粒DNA的持续释放,具有一定的pH响应性。
c) 纳米HAp颗粒对人乳腺上皮细胞表现出极低的细胞毒性,具有良好的生物相容性,携载pEGFP-C1-lefty-1质粒后,可成功转染人乳腺癌细胞MCF-7和MDA-MB-231,并在细胞内表达绿色荧光蛋白标记的lefty-1蛋白,对人乳腺癌细胞的杀伤效率达到40%左右。本研究首次证明了人源lefty-1基因对人乳腺癌细胞的杀伤效应,纳米HAp携载lefty-1基因用于乳腺癌治疗研究有望成为乳腺癌基因治疗的一个新方向。
[1] HAHN B D, LEE J M, PARK D S, et al. Enhanced bioactivity and biocompatibility of nanostructured hydroxyapatite coating by hydrothermal annealing[J]. Thin Solid Films, 2011, 519(22): 8085-8090.
[2] REN Y J, SUN X D, CUI F Z, et al. Preparation and characterization of Antheraea pernyi silk fibroin based nanohydroxyapatite composites[J]. Journal of Bioactive and Compatible Polymers, 2007, 22(5): 465-474.
[3] PAN M L, KONG X D, CAI Y R, et al. Hydroxyapatite coating on the titanium substrate modulated by a recombinant collagen-like protein[J]. Materials Chemistry and Physics, 2011, 126(3): 811-817.
[4] GAO C, CAI Y R, KONG X D, et al. Development and characterization of injectable chitosan-based hydrogels containing dexamethasone/rhBMP-2 loaded hydroxyapatite nanoparticles[J]. Materials Letters, 2013, 93(1): 312-315.
[5] XU S J, KONG X D, ZHAO R B, et al. New gene therapy vector nanohydroxyapatite[J]. Materal Sciences, 2013, 3(1): 11-15.
[6] 赵瑞波, 杨新燕, 韩华锋, 等. 基于纳米羟基磷灰石基因载体转染效率及靶向性的研究进展[J]. 材料导报, 2014, 28(9): 124-128.
[7] OLTON D, LI J H, WILSON M E, et al. Nanostructured calcium phosphates (nanocaps) for nonviral gene delivery: influence of the synthesis parameters on transfection efficiency[J]. Biomaterials, 2007, 28(6): 1267-1279.
[8] NADRA I, BOCCACCINI A R, PHILIPPIDIS P, et al. Effect of particle size on hydroxyapatite crystal-induced tumor necrosis factor alpha secretion by macrophages[J]. Atherosclerosis, 2008, 196(1): 98-105.
[9] WANG J W, CHEN C Y, KUO Y M. Preparation and characterization of chitosan-coated hydroxyapatite nanoparticles as a promising nonviral vector for gene delivery[J]. Journal of Applied Polymer Science, 2011, 121(6): 3531-3540.
[10] CHEN L, MCCRATE J M, LEE J C, et al. The role of surface charge on the uptake and biocompatibility of hydroxyapatite nanoparticles with osteoblast cells[J]. Nanotechnology, 2011, 22(10): 105-114.
[11] GAO H J, SHI W D, FREUND L B. Mechanics of receptor-mediated endocytosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(27): 9469-9474.
[12] WU X W, DING D L, JIANG H Y, et al. Transfection using hydroxyapatite nanoparticles in the inner ear via an intact round window membrane in chinchilla[J]. Journal of Nanoparticle Research, 2012, 14(1): 1-13.
[13] ZHAO R B, YANG X Y, CHEN C, et al. The anti-tumor effect of p53 gene-loaded hydroxyapatite nanoparticles in vitro and in vivo[J]. Journal of Nanoparticle Research, 2014, 16(4): 1-15.
[14] MURANKAMI Y, SUGO K, HIRANO M, et al. Surface chemical analysis and chromatographic characterization of polyethylenimine-coated hydroxyapatite with various amount of polyethylenimine[J]. Talanta, 2011, 85(3): 1298-1303.
[15] PENG J, ZOU F, LIU L, et al. Preparation and characterization of PEG-PEI/Fe3O4nano-magnetic fluid by co-precipitation method[J]. Transactions of Nonferrous Metals Society of China, 2008, 18(2): 393-398.
[16] DESANTIS C, MA J M, BRYAN L, et al. Breast cancer ctatistics, 2013[J]. CA: a Cancer Journal for Clinicians, 2014, 64(1): 52-62.
[17] FAN L, WEIPPL K S, LI J J, et al. Breast cancer in China[J]. The Lancet Oncology, 2014, 15(7): e279-e289.
[18] STRIZZI L, HARDY K M, MARGARAN N V, et al. Potential for the embryonic morphogen nodal as a prognostic and predictive biomarker in breast cancer[J]. Breast Cancer Research, 2012, 14(3): 75-86.
[19] KIRSAMMER G, STRIZZI L, MARGARYAN N V, et al. Nodal signaling promotes a tumorigenic phenotype in human breast cancer[C]// Seminars in Cancer Biology. Academic Press, 2014, 29: 40-50.
[20] CONSTAN D B, ROBERTSON E J. Tissue-specific requirements for the proprotein convertase furin/spc1 during embryonic turning and heart looping[J]. Development, 2000, 127(2): 245-254.
[21] HAMADA H. In search of turing in vivo: understanding nodal and lefty behavior[J]. Developmental Cell, 2012, 22(5): 911-912.
[22] SAKUMA R, OHSNISHI Y I, MENO C, et al. Inhibition of nodal signalling by lefty mediated through interaction with common receptors and efficient diffusion[J]. Genes to Cells, 2002, 7(4): 401-412.
[23] CAVALLARI C, FONSATO V, HERRERA M B, et al. Role of lefty in the anti tumor activity of human adult liver stem cells[J]. Oncogene, 2013, 32(7): 819-826.
[24] TOPCZEWSKA J M, POSTOVIT L M, MARGARYAN N V, et al. Embryonic and tumorigenic pathways converge via nodal signaling: role in melanoma aggressiveness[J]. Nature Medicine, 2006, 12(8): 925-932.
(责任编辑:许惠儿)
Killing Effect of Nano-hydroxyapatite Loading Lefty-1 Gene on Human Breast Carcinoma Cells
ZHONGYunpinga,YAOChenxuea,SONGGuolonga,LAIWenb,CHENCena,XIEChunganga,KONGXiangdonga
(a. College of Life Sciences; b. College of Materials and Textile,Zhejiang Sci-Tech University,Hangzhou 310018, China)
In this study, the co-precipitation method had been used to synthesize a long spindle nano-hydroxyapatite by using polyethylenimine (PEI) as a regulating agent, calcium chloride and sodium hydrogen phosphate as raw materials. The material properties were characterized by using field emission scanning electron microscope (FE-SEM), X-ray powder diffraction pattern (XRD), infrared absorption spectrum (FT-IR) and thermogravimetric analysis (TGA). As indicated in the degradation experiment in vitro, HAP particles is degradable, can be degraded more easily in acidic conditions and has pH-responsiveness. The result of in vitro load curve and gene release curve of particles and plasmid DNA shows that the long spindle HAP particles can more effectively load and continuously release plasmid DNA. The results of in vitro transfection experiment indicate that green fluorescent protein was successfully expressed in cells after particles loading pEGFP-C1-lefty-1 plasmid. According to the MTT result, the prepared HAP particles show an extremely low cytotoxicity to mammary epithelial cells and a good biocompatibility. After pEGFP-C1-lefty-1 plasmid is loaded, the HAP particles has a good killing effect on human breast carcinoma cells.
hydroxyapatite; lefty-1; human breast carcinoma cell; killing effects; polyethylenimine
10.3969/j.issn.1673-3851.2016.05.022
2015-12-23
国家自然科学基金项目(50942023,51272236);浙江理工大学521人才培养计划资助项目(1610032521302)
钟云平(1990-),男,浙江湖州人,硕士研究生,主要从事生物材料方面的研究。
孔祥东,E-mail:kongxiangdong@gmail.com
Q279
A
1673- 3851 (2016) 03- 0450- 08 引用页码: 050704
