漆树籽粕多糖的提取工艺优化及抗氧化活性研究
2016-09-14陈虹霞王成章叶建中李文君中国林业科学研究院林产化学工业研究所生物质化学利用国家工程实验室国家林业局林产化学工程重点开放性实验室江苏省生物质能源与材料重点实验室江苏南京20042中国林业科学研究院林业新技术研究所北京0009
陈虹霞,王成章,2,*,叶建中,周 昊,2,陶 冉,李文君(.中国林业科学研究院林产化学工业研究所,生物质化学利用国家工程实验室,国家林业局林产化学工程重点开放性实验室,江苏省生物质能源与材料重点实验室,江苏南京20042;2.中国林业科学研究院林业新技术研究所,北京0009)
漆树籽粕多糖的提取工艺优化及抗氧化活性研究
陈虹霞1,王成章1,2,*,叶建中1,周昊1,2,陶冉1,李文君1
(1.中国林业科学研究院林产化学工业研究所,生物质化学利用国家工程实验室,国家林业局林产化学工程重点开放性实验室,江苏省生物质能源与材料重点实验室,江苏南京210042;2.中国林业科学研究院林业新技术研究所,北京100091)
以脱脂后的漆树籽粕为原料,采用热回流提取漆树籽粕多糖,通过单因素实验和正交实验优化该方法的最佳工艺条件,并进一步研究漆树籽粕多糖对羟自由基和ABTS+自由基的清除能力。结果表明:最佳工艺条件为提取时间2.5 h,料液比1∶20(g∶mL),提取温度80℃和提取次数2次,此时籽粕多糖的得率为1.561%。漆树籽粕多糖对清除羟自由基和ABTS+自由基的IC50分别为8.515 mg·mL-1和7.03 mg·mL-1,当漆树籽粕多糖的浓度为25 mg·mL-1时,对羟自由基的清除率达到61.5%,当浓度为10 mg·mL-1时,对ABTS+自由基的清除率达到58.4%。体外抗氧化实验表明漆树籽粕多糖抗氧化活性作用明显。
漆籽,籽粕,多糖,提取,抗氧化活性
漆树(Rhus succedanea L)是漆树科漆树属的一种落叶乔木,是我国重要的经济林树种,广泛分布于四川盆地。漆籽为漆树的果实,我国每年产漆籽量约为200多万吨,漆籽的外果皮中富含漆蜡,因其具较好的黏弹性能,广泛应用于高级化妆品、润滑剂和绿色表面活性剂等领域[1]。漆蜡是漆籽中的主要经济产品,其加工方式主要为压榨法和溶剂法,漆树籽粕是漆蜡生产完后的主要附产物,其每年的产量约为100万吨,但目前对其加工利用较弱,大部分都作为燃料焚烧。因此从漆树籽粕中发现具有高活性的天然化合物引起了广泛关注。
多糖是一类具有复杂结构的高分子化合物,广泛存在于植物、动物和微生物中[2]。越来越多的研究发现,多糖对于人类具有很高的价值,特别是植物多糖因其充足资源和低毒高效的药理活性广泛应用于食品和药物领域[3-4]。研究发现目前从植物中分离得到数百种植物多糖,大量的药理实验表明,多糖具有调节免疫、抑菌、抗病毒、抗氧化等[5-7]作用。
目前国内外对漆籽的研究主要集中在漆蜡和漆籽油的提取、脱色以及漆脂改性等方面[8-10]。为了提高漆籽资源的综合效益,增加漆树籽粕的经济价值,本文利用热回流浸提方法对漆树籽粕中的多糖进行提取并采用单因素和正交实验对其工艺进行优化。在此基础上,进一步研究漆树籽粕多糖的体外抗氧化活性。
1 材料与方法
1.1材料与仪器
漆树籽2014年10采集于湖南桃源,自然晾干、粉碎成粉末,备用;石油醚、乙醇、丙酮、乙醚、葡萄糖、苯酚、浓硫酸、铁氰化钾、三氯乙酸、氯化铁、ABTS、过硫酸钾、甲醇、抗坏血酸、BHT购自国药集团化学试剂有限公司;蒸馏水自制。
MULTISKAN GO酶标仪Thermo fisher scientific. oy;离心机长沙湘仪离心机仪器有限公司;HH-4恒温水浴锅上海江星仪器有限公司;FD-1冷冻干燥仪北京博医康实验仪器有限公司。
1.2实验方法
1.2.1葡萄糖标准曲线的绘制精确称取葡萄糖标准品10 mg,加入蒸馏水溶解并定容到50 mL,得到1 mg/mL的标准品标准溶液。分别移取0、0.1、0.2、0.3、0.4、0.5、0.7、0.9 mL的1 mg/mL标准溶液至10 mL的试管中,补加蒸馏水至终体积为1.0 mL,分别加入1.0 mL 5%的苯酚,摇匀后,加入3.5 mL的浓硫酸,迅速振荡摇匀,室温下静置25 min,在490 nm处测吸光度。绘制吸光度与浓度的标准曲线,并拟合线性回归方程。回归方程Y=0.0081X-0.0139,相关系数R=0.9996。葡萄糖在20~180 μg区间具有良好的线性关系。
1.2.2热回流浸提漆树籽粕多糖漆籽粉末,加入料液比1∶10(g∶mL)的石油醚在70℃下,提取4次,每次3 h,过滤,滤液合并,真空浓缩为漆蜡。滤渣干燥,即为漆树籽粕。取漆树籽粕10 g,放入500 mL烧瓶中,按一定的料液比加入一定的蒸馏水,在一定的温度下,提取一定时间后过滤,得到滤液。在旋转蒸发仪上60℃真空浓缩至50 mL,加入无水乙醇,与多糖水溶液的体积比约为25∶1,在4℃下静置24 h,离心(8000 r/min)得到沉淀,再用乙醚、丙酮(体积比约为10∶1)洗多糖沉淀两次,最后将沉淀冷冻干燥得到各多糖提取物。按照1.2.1的方法在490 nm下测定吸光度。漆树籽粕多糖的得率(%)=(多糖的质量/原料的质量)×100。
1.2.3单因素实验设计根据单因素实验设计,选择提取温度90℃,料液比1∶10(g∶mL),提取2次,提取时间2 h为固定条件,考察提取时间(0.5、1、1.5、2、2.5、3、3.5、4 h),提取温度(50、60、70、80、90、100℃),料液比(1∶5、1∶10、1∶15、1∶20、1∶25、1∶30、1∶35 g/mL)和提取次数(1、2、3和4次)对热回流提取漆树籽粕粗多糖得率的影响。
1.2.4正交实验设计通过在单因素实验的基础上,选择提取温度90℃,料液比1∶20(g∶mL),提取次数2次,提取时间2 h为固定条件,利用正交实验设计对提取漆树籽粕多糖的三个主要因素提取时间(A)、料液比(B)、提取温度(C)进行优化,选用L9(33)正交表,进行三因素三水平9组实验,各因素水平表如表1所示。

表1 正交实验设计因素-水平表Table 1 Factors and levels of orthogonal experiment methodology
1.2.5漆树籽粕多糖对羟自由基清除能力的测定将漆树籽粕多糖提取物用蒸馏水配制成0.1~50 mg/mL的浓度梯度,以VC和BHT作为对照组进行实验。取1 mL样品溶液,加入1 mL浓度为9 mmol/L的FeSO4溶液,混合均匀后加入1 mL浓度为8.8 mmol/L的过氧化氢和1 mL浓度为9 mmol/L的水杨酸乙醇溶液,于37℃水浴中反应1 h,于510 nm处测其吸光度,空白对照对蒸馏水代替样品溶液[11]。对羟基自由基清除能力的测定按以下公式进行计算:
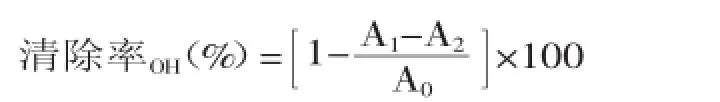
式中:A0为空白对照的吸光度;A1为样品的吸光度;A2为50%乙醇溶液代替水杨酸乙醇溶液的吸光度。
1.2.6对ABTS+自由基清除能力的测定储备液的制作:将7.4 mmol/L的ABTS溶液与2.6 mmol/L的过硫酸钾溶液等量混合,在黑暗处常温静置反应15 h,然后取1 mL溶液用甲醇稀释,得到溶液在732 nm处的吸光度为0.74[12]。
将不同浓度的漆树籽粕多糖提取物、VC和BHT 150 μL加入2.85 mL的上述储备液,混合均匀,在黑暗处常温静置反应2 h,在732 nm处测吸光度,计为A1。以蒸馏水作为空白对照,在黑暗处常温静置反应2 h,在732 nm处测吸光度,计为A2。
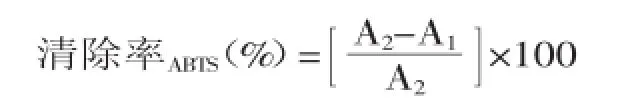
式中:A1为待测样品、ABTS在样品溶剂存在体系存在下的吸光度,A2为ABTS在样品溶剂存在下的吸光度。1.2.7数据分析采用Origin 7.5软件进行绘图及计算,采用SPSS 19.0方差分析进行显著性检验。
2 结果与讨论
2.1单因素实验
2.1.1提取时间对多糖提取得率的影响从图1中可以看出,当时间在0.5~2.5 h之间,多糖的得率增长较快,多糖的得率从0.693%增加至1.409%,提取时间在2.5 h后,多糖的得率增长缓慢。提取时间对漆树籽粕多糖的得率影响较大,说明提取时间的长短直接影响水与植物细胞中多糖化合物的接触程度,提取时间长,多糖化合物萃取得比较完全。
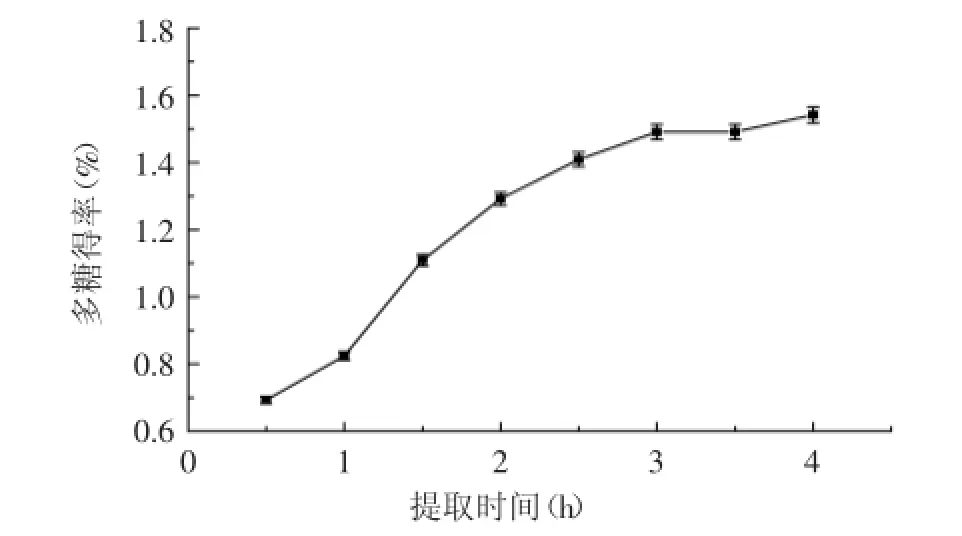
图1 提取时间对热回流提取漆树籽粕多糖得率的影响Fig.1 Effect of extracting time on the yield of crude polysaccharides from the seed cakes of Rhus succedanea L
2.1.2提取温度对多糖提取得率的影响如图2所示,随着提取温度的上升,漆树籽粕粗多糖的得率先增大而后缓慢减少,温度从50~80℃,多糖的得率从0.662%增至1.355%,说明温度的增大有利于多糖化合物的溶出。但是温度增至90~100℃时,多糖得率略微有些下降,说明在高温条件下,较多色素类及其他化合物溶出,杂质量多,且高温会使多糖类化合物发生降解。

图2 提取温度对热回流提取漆树籽粕多糖得率的影响Fig.2 Effect of extracting temperature on the yield of crude polysaccharides from the seed cakes of Rhus succedanea L
2.1.3料液比对多糖提取得率的影响如图3所示,料液比从1∶5(g∶mL)上升至1∶25(g∶mL),漆树籽粕多糖得率从0.605%上升至1.465%,料液比的增大对多糖的溶出具有较大影响,特别是料液比从1∶5(g∶mL)增加到1∶10(g∶mL),多糖提取得率增加速度较快,而后增加缓慢。说明当水量较大时,能够与籽粕组织细胞中的多糖进行充分接触,从而大大增加了传质效率。
2.1.4提取次数对多糖提取得率的影响如图4所示,提取1次时多糖的得率为1.073%,提取2次时多糖的得率为1.314%,而后增加次数,多糖的增长缓慢。缩合考虑多糖得率以及能耗,选择热回流提取漆树籽粕多糖的提取次数2次为宜。
2.2正交实验优化
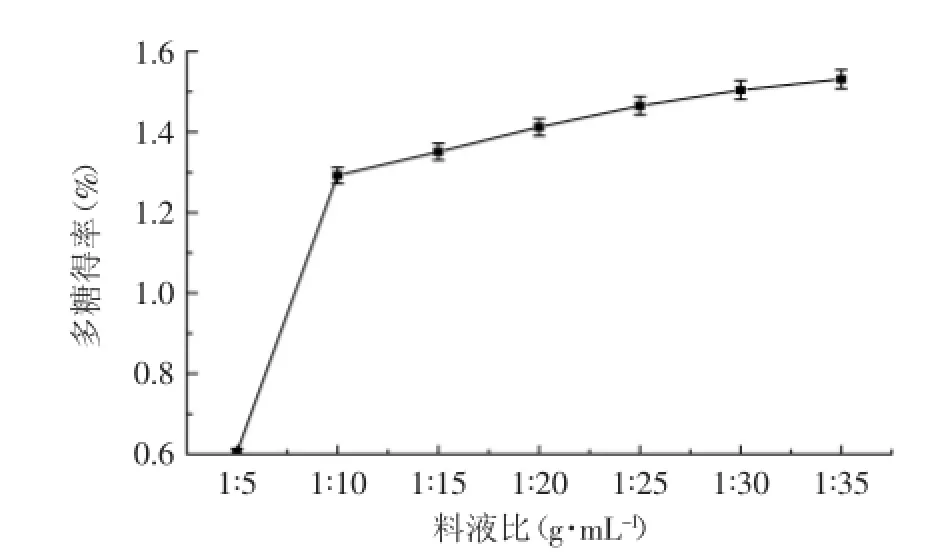
图3 料液比对热回流提取漆树籽粕多糖得率的影响Fig.3 Effect of extracting ratio of material to water on the yield of crude polysaccharides from the seed cakes of Rhus succedanea L

图4 提取次数对热回流提取漆树籽粕多糖得率的影响Fig.4 Effect of extraction times to water on the yield of crude polysaccharides from the seed cakes of Rhus succedanea L

表2 正交实验结果Table 2 Results of the orthogonal test
提取时间、料液比和提取温度是影响漆树籽粕多糖得率的主要因素,以漆树籽粕多糖得率为考察指标,按照L9(34)进行正交实验设计,每组实验重复3次,取平均值,实验结果见表2,方差分析见表3。
根据直观分析,从R值可以看出,各因素对漆树籽粕多糖得率的影响大小为提取温度>料液比>提取时间。从表2可以看出,热回流提取漆树籽粕多糖的最佳工艺条件为A2B2C2或A2B3C2,即提取时间2.5 h,料液比1∶20(g∶mL)或1∶25(g∶mL),提取温度80℃。方差分析显示,各因素存在显著性影响。考虑到实际应用,料液比越高,能耗越高,所以最终的最佳工艺条件选择提取时间2.5 h,料液比1∶20(g∶mL),提取温度80℃和提取次数2次。
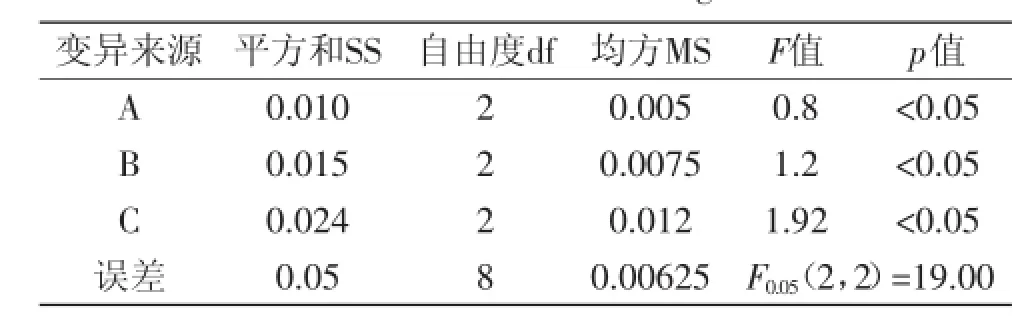
表3 正交实验方差分析表Table 3 ANOVA table of orthogonal test
以正交实验设计得到的最佳工艺条件,即提取时间2.5 h,料液比1∶20(g∶mL),提取温度80℃和提取次数2次,进行3次热回流提取多糖的平行实验,取平均值,漆树籽粕多糖得率为1.561%。
2.3漆树籽粕多糖的抗氧化作用
2.3.1漆树籽粕多糖对羟基自由基的清除能力化合物的抗氧化活动归因于各种反应和机制,如自由基清除、还原能力,防止连锁启动和螯和催化反应过程中的金属离子等。羟自由基被认为是氧化应激损伤主要原因,其很容易穿过细胞膜,与大多数生物大分子反应,如碳水化合物、蛋白质和DNA[13]。不同浓度的VC、BHT和漆树籽粕多糖提取物对羟基自由基的清除能力如图5所示。漆树籽粕多糖提取物对羟基自由基具有较强的清除能力,浓度从0.1 mg·mL-1增加至25 mg·mL-1时,对羟基自由基的清除率显著增大(p<0.01),当浓度为25 mg·mL-1时,清除率为61.5%。其作用效果低于VC和BHT,其IC50为8.515 mg·mL-1。说明漆树籽粕多糖中的含有羟基官能团能提供氢质子,从而能够有效阻止自由基反应,将自由基转化为无毒的物质[14]。
2.3.2漆树籽粕多糖对ABTS+自由基的清除能力ABTS+自由基是抗氧化活性测定应用中最广泛的人工合成自由基之一。在有供氢能力的活性物存在时,ABTS+自由基与之反应,由蓝绿色变成没有颜色的ABTS[15]。利用该方法研究漆树籽粕多糖提取物的抗氧化能力。由图6可知,对ABTS+自由基的清除率与漆树籽粕多糖的浓度呈正相关,当浓度从0.1 mg·mL-1增加至10 mg·mL-1时,清除率随着浓度的增大显著增强(p<0.01)。当浓度在10 mg·mL-1时,清除率为58.4%,清除效果低于VC和BHT,其IC50值为7.03 mg·mL-1。以上数据可以说明漆树籽粕多糖具有较强的抗氧化活性。
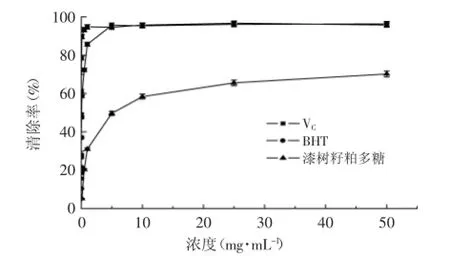
图6 漆树籽粕多糖对ABTS自由基的清除能力Fig.6 ABTS radical acavenging activity of crude polysaccharides from the seed cakes of Rhus succedanea L
3 结论
采用热回流提取漆树籽粕多糖,通过单因素和正交实验进行提取工艺优化,得到最佳工艺条件为:提取时间2.5 h,料液比1∶20(g∶mL),提取温度80℃和提取次数2次,在此条件下籽粕多糖的得率为1.561%。研究漆树籽粕多糖对羟自由基和ABTS+自由基的清除能力,并与VC和BHT进行对比,结果表明漆树籽粕多糖具有一定的抗氧化活性,其清除能力低于VC和BHT。当浓度为25 mg·mL-1时,对羟自由基的清除率为61.5%,IC50为8.515 mg·mL-1。当浓度为10 mg·mL-1时,对ABTS+自由基的清除率为58.4%,IC50值为7.03 mg·mL-1。
[1]董艳鹤,王成章,宫坤,等.漆树资源的化学成分及其综合利用研究进展[J].林产化学与工业,2009,29(B10):225-232.
[2]Zong A Z,Cao H Z,Wang F S.Anticancer polysaccharides from natural resources:A review of recent research[J].Carbohydrate Polymers,2012,90(4):1395-1410.
[3]Cho E J,Hwang H J,Kim S W,et al.Hypoglycemic effects of exopolysaccharides produced by mycelial cultures of two different mushrooms Tremella fuciformis and Phellinus baumii in ob/ob mice[J].Applied Microbiology and Biotechnology,2007,75(6):1257-1265.
[4]Suvakanta D,Narsimha M P,Pulak D,et al.Optimization and characterization of purified polysaccharide from Musa sapientum L. as a pharmaceutical excipient[J].Food Chemistry,2014,149:76-83.
[5]Abou Zeid A H,Aboutabl E A,Sleem A A,et al.Water soluble polysaccharides extracted from Pterocladia capillacea and Dictyopteris membranacea and their biological activities[J]. Carbohydrate Polymers,2014,113:62-66.
[6]Facchini J M,Alves E P,Aguilera C,et al.Antitumor activity ofPleurotusostreatuspolysaccharidefractionsonEhrlich tumor and Sarcoma 180[J].International Journal of Biological Macromolecules,2014,68:72-77.
[7]Pakrokh Ghavi P.The extraction process optimization of antioxidant polysaccharides from Marshmallow(Althaea officinalisL.)roots[J].International Journal of Biological Macromolecules,2015,75:51-57.
[8]董艳鹤,王成章,叶建中,等.漆蜡的提取工艺及其化学成分[J].北京林业大学学报,2010,(4):256-260.
[9]董艳鹤,王成章,陈虹霞,等.漆蜡的吸附脱色工艺研究[J].林产化学与工业,2011,31(2):91-95.
[10]陈虹霞,王成章,叶建中,等.漆蜡脂肪酸甲酯磺酸盐的制备及其性能研究[J].中国油脂,2014,39(5):37-40.
[11]Chung S K,Osawa T,Kawakishi S.Hydroxyl radical scavenging effects of species and scavengers from brown mustard (Brassia nigra)[J].Bioscience Biotehnology and Biochemistry,1997,61:118-123.
[12]Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying and improved ABTS radical cation ecolorization assay [J].Free Radic Biol Med,1999,26(9):1231-1237.
[13]Chance B,Sies H,Boveris A.Hydroperoxide metabolism in mammalian organs[J].Physiological Reviews,1979,59:527-605.
[14]Bohn J A,BeMiller J N.(1→3)-β-d-Glucan as biological response modifiers:A review of structure-functional activity relationships[J].Carbohydrate Polymers,1995,28:3-14.
[15]Miller N J,Rice-Evans C A,Davies M J,et al.A novel method for measuring antioxidant capacity and its application to monitoring the antioxidant status in premature neonates[J].Clin Sci,1993,84:407-412.
Extraction optimization of crude polysaccharides from the seed cakes of Rhus succedanea L and its antioxidant activity
CHEN Hong-xia1,WANG Cheng-zhang1,2,*,YE Jian-zhong1,ZHOU Hao1,2,TAO Ran1,LI Wen-jun1
(1.Institute of Chemical Industry of Forestry Products,CAF Key and Open Lab on Forest Chemical Engineering,SFA,Nanjing 210042,China;2.Institute New Technology of Forest,CAF,Beijing 100091,China)
Single factor and orthogonal methodology were used to optimize the extraction conditions of crude polysaccharides from the seed cakes of Rhus succedanea L,then the antioxidant(scavenging hydroxyl and ABTS radicals)of the crude polysaccharides from the seed cakes of Rhus succedanea L were possessed.The optimum extraction conditions were as follows:extraction time 2.5 h,ratio of material to water 1∶20(g∶mL),extraction temperature 80℃,and extraction times 2.Under the optimized conditions,an experimental yield was 1.561%.The IC50values scavenging hydroxyl and ABTS+radicals of the crude polysaccharides were 8.515 mg·mL-1and 7.03 mg·mL-1,respectively.The hydroxyl radical scavenging ability of polysaccharides reached 61.5%at 25 mg·mL-1.The ABTS+radicals scavenging ability of polysaccharides reached 58.4%at 10 mg·mL-1.The seed cakes polysaccharides displayed significant antioxidant.
Rhus succedanea L;seed cakes;polysaccharides;extraction;antioxidant activity
TS255.1
B
1002-0306(2016)04-0254-05
10.13386/j.issn1002-0306.2016.04.043
2015-08-24
陈虹霞(1983-),女,博士研究生,助理研究员,主要从事天然产物化学方面的研究,E-mail:shirenyahui@126.com。
王成章(1966-),男,博士,研究员,主要从事天然产物研究与利用方面的研究,E-mail:wangczlhs@sina.com。
国家林业局948技术引进项目(2015-4-46);中国林科院林业新技术所基本科研业务费专项资金(CAFINT2013C03);国家国际科技合作专项(2014DFR31300)。
