一株产胆盐水解酶植物乳杆菌的发酵培养基的优化
2016-09-14唐雅茹于上富国立东王娜娜霍贵成东北农业大学乳品科学教育部重点实验室黑龙江哈尔滨50030黑龙江中医药大学药学院黑龙江哈尔滨50030
唐雅茹,于上富,国立东,2,王娜娜,霍贵成,*(.东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨50030;2.黑龙江中医药大学药学院,黑龙江哈尔滨50030)
一株产胆盐水解酶植物乳杆菌的发酵培养基的优化
唐雅茹1,于上富1,国立东1,2,王娜娜1,霍贵成1,*
(1.东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨150030;2.黑龙江中医药大学药学院,黑龙江哈尔滨150030)
为了提高植物乳杆菌Lactobacillus plantarum KLDS1.0386的胆盐水解酶产量,本实验通过响应面法对其发酵培养基进行优化。通过单因素实验、Plackett-Burman实验、最陡爬坡实验和Box-Behnken实验,最终获得最优培养基为:葡萄糖18.2 g/L、蛋白胨15.03 g/L、酵母粉9.97 g/L、乙酸钠3.13 g/L、柠檬酸氢二铵2.00 g/L、磷酸氢二钾2.00 g/L、硫酸锰0.25 g/L、硫酸镁0.58 g/L。优化前植物乳杆菌KLDS1.0386产胆盐水解酶的比酶活为1.04 U/mg,经过培养基的优化后,胆盐水解酶的比酶活为3.37 U/mg,比优化前提高了3.24倍。且实验结果与模型预测结果误差在允许范围内,说明该模型可以投入使用。
植物乳杆菌,培养基组成,胆盐水解酶,响应面实验
随着人们生活水平的提高,高血压、冠心病等心血管疾病的发病率逐年上升,医学研究表明[1],人体内胆固醇含量过高是心血管疾病发生的重要原因之一。目前,国内外对于乳酸菌降胆固醇的研究越来越多,乳酸菌在生长代谢的过程中会产生胆盐水解酶[2](bile salt hydrolase,BSH),它是一种胞内酶,能将体内的结合胆盐降解成游离胆酸和氨基酸,游离胆酸能与血清中的胆固醇发生共沉淀,随粪便一同排出体外,因此降低了胆固醇水平[3-4]。所以提高细菌中胆盐水解酶的含量,对降低胆固醇水平具有很重要的意义[5-7]。国内方面利用响应面实验优化BSH的培养基成分报道比较少,为了提高胆盐水解酶活力,本实验选择了植物乳杆菌KLDS1.0386,该菌具有很好的益生特性,而且体外降胆固醇能力达到55.71%,在单因素实验的基础上进行了Plackett-Burman实验,筛选出影响BSH比酶活的3个显著性因素,并进行最陡爬坡实验确定出实验因素的中心点,设计Box-Behnken实验,最终进行响应面分析,建立培养基成分与胆盐水解酶比酶活之间的回归方程模型,以期为以后高产胆盐水解酶乳酸菌发酵制品的开发和研制提供依据。
1 材料与方法
1.1材料与仪器
植物乳杆菌KLDS1.0386分离自内蒙古传统发酵乳制品,由东北农业大学教育部重点实验室工业微生物菌种保藏中心(KLDS-DICC)提供;茚三酮上海惠世生化试剂有限公司;95%乙醇天津市富宇精细化工有限公司;MRS液体培养基天津基准化学试剂有限公司;考马斯亮蓝,牛血清白蛋白,溶菌酶。
GL-21M型离心机上海市离心机研究所;VD-1320型洁净工作台北京东联哈尔仪器制造有限公司;DHP-9272型电热恒温培养箱上海一恒科技有限公司;YH-2S型远红外恒温干燥箱天津市中环实验电炉有限公司;XK96-A型快速混匀器姜堰市新康医疗器械有限公司;DU800型紫外分光光度计美国Beckman公司。
1.2实验方法
1.2.1植物乳杆菌KLDS1.0386的生长曲线挑取平板上的植物乳杆菌单菌落,接种到MRS液体培养基中,传代培养2次后,以2%的接种量接种于MRS液体培养基中,于37℃恒温培养箱中培养。每隔2 h于紫外分光光度计上测一次OD620,直到24 h,记录菌的生长情况,绘制生长曲线。
1.2.2BSH比酶活测定将植物乳杆菌KLDS1.0386传代培养2次后,接种到MRS液体培养基中,培养至稳定初期,离心(10000×g,4℃,10 min)留菌体,用磷酸缓冲液清洗两次后,加入VC磷酸缓冲液和溶菌酶溶液,37℃水浴30 min后,在冰浴条件下进行细胞超声破碎(600 W,15 min),离心后留上清,即为粗酶液。
采用茚三酮显色法来测定BSH酶活[8],取0.1 mL的粗酶液,加入0.1 mL的50 mmol/L牛磺脱氧胆盐溶液、0.8 mL的pH6.0的磷酸钠缓冲液,振荡混匀后37℃水浴30 min,之后冷却终止反应,加入0.5 mL的三氯乙酸(15%,w/v)沉淀蛋白质,3 min后离心(10000×g,4℃,10 min),留上清液,并加入1.5 mL的茚三酮显色液,混匀后沸水浴15 min,冰浴至室温,在紫外分光光度计上测得在570 nm处的最大吸收值。蛋白质浓度的测定参照文献[9],比酶活定义为每毫克蛋白质所含的胆汁盐水解酶的单位(U)数。
1.2.3单因素实验以普通MRS培养基为基础,分别以可溶性淀粉、果糖、蔗糖、葡萄糖、麦芽糖、乳糖作为碳源,添加量为20 g/L,进行比酶活测定,从而确定最佳碳源。
在最佳碳源的基础上,将氮源分别替换成蛋白胨、胰蛋白胨、酵母粉、硫酸铵、大豆蛋白胨、牛肉膏,添加量为25 g/L,进行比酶活测定,确定最佳氮源。
在最佳碳源和氮源基础上,进行复合氮源的优化,参考相关文献[10]后共设计4组实验,1号:蛋白胨5 g/L、酵母粉20 g/L,2号:蛋白胨10 g/L、酵母粉15 g/L,3号:蛋白胨15 g/L、酵母粉10 g/L,4号:蛋白胨20 g/L、酵母粉5 g/L,筛选出胆盐水解酶产量最高的氮源组合。1.2.4Plackett-Burman实验根据单因素实验结果,葡萄糖、蛋白胨和酵母粉对胆盐水解酶产量有很重要的影响,并且参考相关文献[10-11]后可知,乙酸钠、磷酸氢二钾、柠檬酸氢二铵、硫酸锰、硫酸镁都会有重要影响,所以此8种成分,被选为Plackett-Burman实验的影响因素,胆盐水解酶比酶活作为响应值。利用软件Design Expert进行Plackett-Burman实验的设计,每一因素设置高(+1)、低(-1)两个水平,高水平为低水平的1.5倍,总共进行12组实验,进而筛选出对胆盐水解酶比酶活影响最显著的因素。
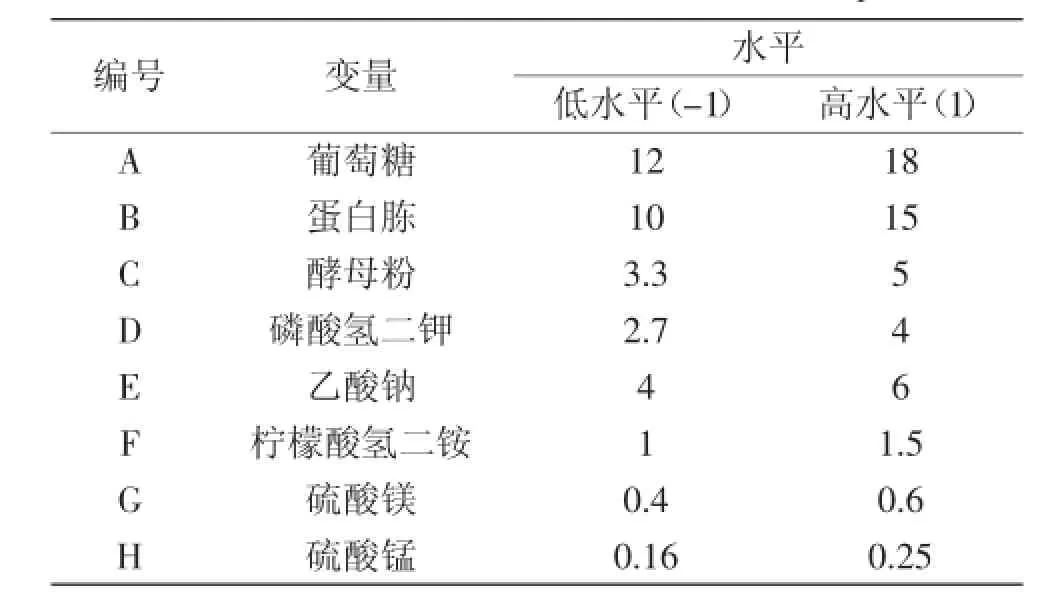
表1 Plackett-Burman实验因素及水平表Table 1 Factors and levels of Plackett-Burman experiment
1.2.5最陡爬坡实验根据Plackett-Burman实验的显著性结果,设计最陡爬坡实验,筛选出胆盐水解酶比酶活最高时显著性因素的浓度梯度。
1.2.6Box-Behnken实验根据Plackett-Burman实验和最陡爬坡实验的结果,利用Design Expert软件进行Box-Behnken实验设计,3个影响因素,3个水平,共形成15组实验,实验设计如表2所示。实验结果用Design-Expet软件进行回归分析,确定优化后的最佳培养基。

表2 Box-Behnken实验因素及水平表Table 2 Factors and levels table of Box-Behnken experiment
1.3数据统计方法
利用SPSS 19分析软件对数据进行方差分析,离散度通过标准差来表示,结果数据用平均值±标准差来表示。
2 结果与讨论
2.1植物乳杆菌KLDS1.0386的生长曲线
植物乳杆菌KLDS1.0386的生长曲线如图1所示,该菌生长情况稳定,8 h时就进入了对数期,当培养到15 h时达到稳定期初期,可用于酶活的测定。
2.2单因素实验
2.2.1最佳碳源的筛选在微生物的生长代谢过程中,碳源是必要的营养物质[12],选用最佳碳源,可以让微生物的生长达到最佳状态。如图2所示,几种碳源对植物乳杆菌KLDS1.0386产胆盐水解酶的影响不同,其中葡萄糖对胆盐水解酶比酶活影响最大,可达0.96 U/mg,可溶性淀粉的影响最小,比酶活为0.28 U/mg,因此最佳碳源确定为葡萄糖。
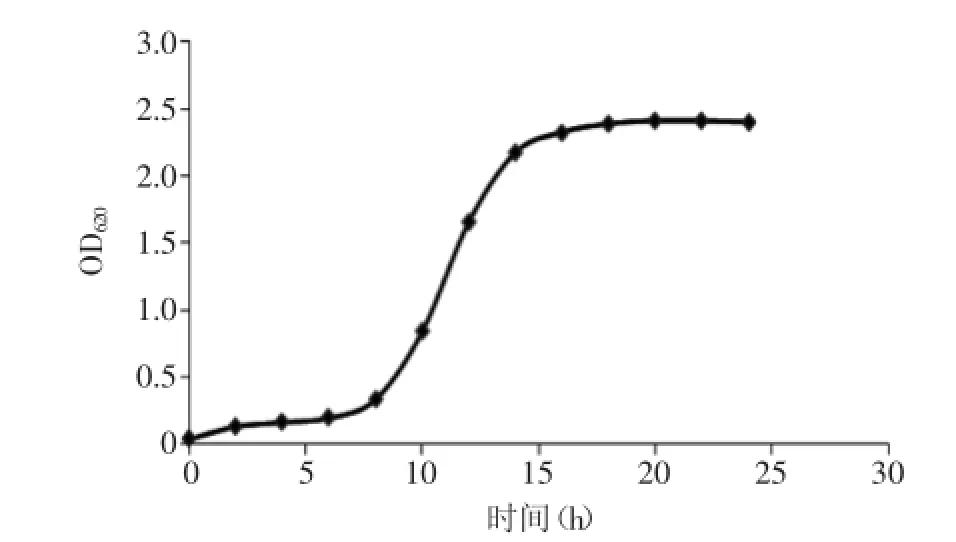
图1 植物乳杆菌KLDS1.0386的生长曲线Fig.1 The grow curve of Lactobacillus plantarum KLDS1.0386
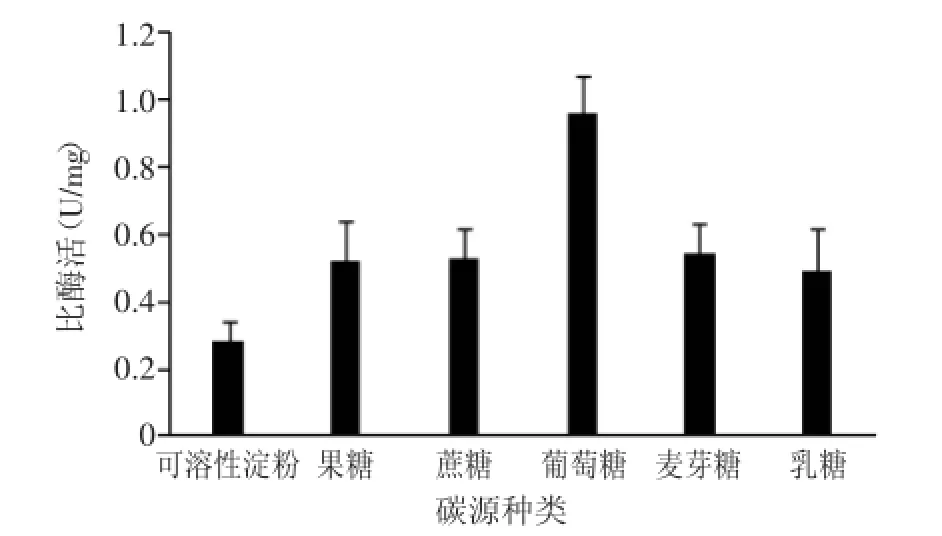
图2 不同碳源对胆盐水解酶比酶活的影响Fig.2 Effect of different carbon sources on BSH production
2.2.2最佳氮源的筛选以葡萄糖为碳源,分别添加25 g/L的蛋白胨、胰蛋白胨、牛肉膏、大豆蛋白胨、硫酸铵、酵母粉作为氮源,研究不同氮源对胆盐水解酶活性的影响。结果如图3所示,氮源不同,胆盐水解酶的产量也不同,其中蛋白胨和酵母粉对胆盐水解酶产量有很大的促进作用,比酶活分别为0.9 U/mg、0.85 U/mg,因此被选出进行复合氮源优化。
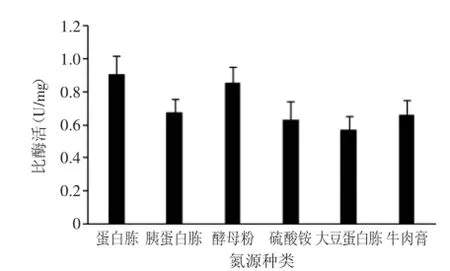
图3 不同氮源对胆盐水解酶比酶活的影响Fig.3 Effect of different nitrogen sources on BSH production
2.2.3最佳组合氮源的筛选从四种组合中筛选出最佳的氮源组合,由图4可知,2号和4号对胆盐水解酶产量影响较大,其中4号的胆盐水解酶比酶活达到1.49 U/mL,酵母粉能够为菌的生长提供生长因子等营养物质,但由于高含量的酵母粉可能会抑制该菌的生长,少量即能达到最佳生长状态。
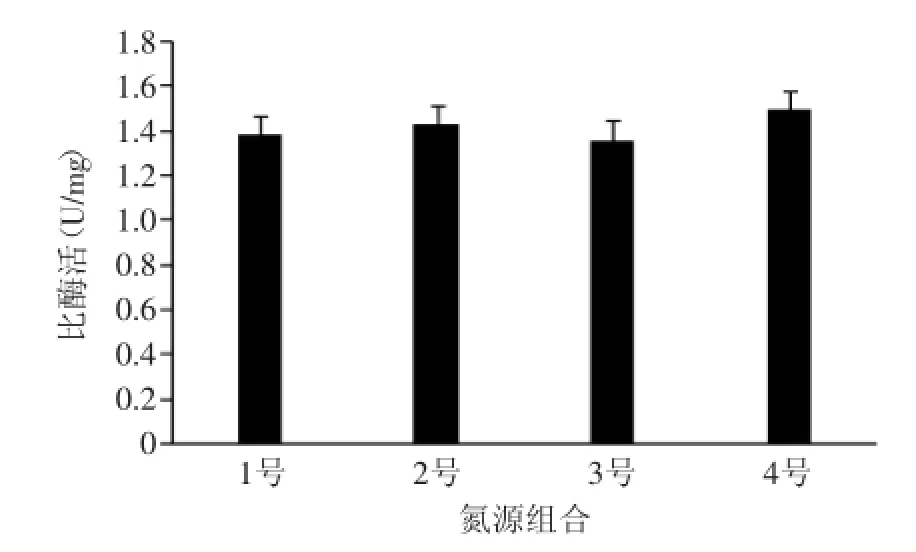
图4 不同氮源组合对胆盐水解酶产量的影响Fig.4 Effect of different mixed nitrogen sources on BSH production
2.3Plackett-Burman实验结果
Plackett-Burman实验的回归分析如表4所示,当Prob>F值小于0.05时,说明该因素对胆盐水解酶的产量有显著影响,而且F值越大,该因素对胆盐水解酶的比酶活影响越大。对胆盐水解酶产量影响显著的依次是:A、B、E,且可信度在95%置信区间内,回归方程为:Y=1.78+0.15A+0.058B+0.042C+8.333E-003D-0.052E-0.032F+0.025G-0.018H,R2=0.9933,说明方程拟合很好,而其他因素对胆盐水解酶产量影响很小。因此选择A、B、E 3个因素进行最陡爬坡实验,筛选出显著性因素的产BSH最佳浓度梯度。

表3 Plackett-Burman实验结果Table 3 The results of Plackett-Burman experimental design
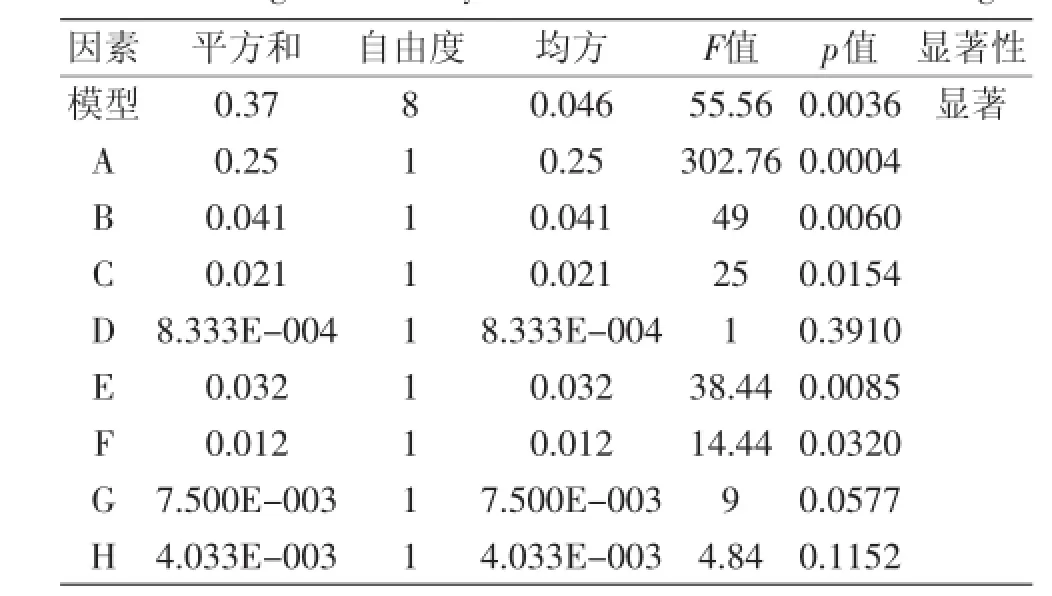
表4 Plackett-Burman实验的回归分析表Table 4 Regression analysis table of Plackett-Burman design
2.4最陡爬坡实验
最陡爬坡实验以葡萄糖、蛋白胨和乙酸钠作为影响因素,步长为1 g/L,结果如表5所示,当葡萄糖为18 g/L、蛋白胨为15 g/L、乙酸钠为3 g/L时,植物乳杆菌KLDS1.0386所产胆盐水解酶含量最高,因此,该组合被定为Box-Behnken实验设计的中心点,进行响应面分析。
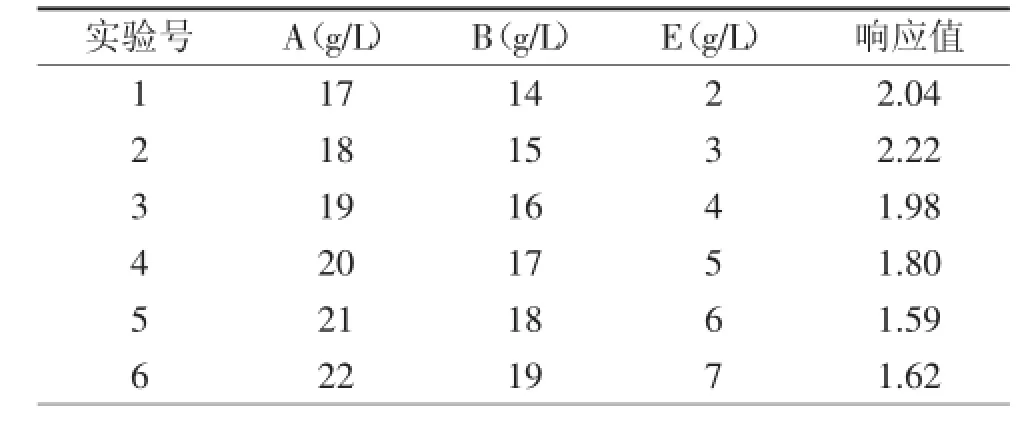
表5 最陡爬坡实验结果Table 5 Experimental results of the steepest ascent path
2.5Box-Behnken实验优化结果
根据2.4最陡爬坡实验结果设计Box-Behnken实验,各因素编码及结果如表6所示。以胆盐水解酶比酶活为响应值(Y),进行3因素,15次的Box-Behnken实验进行优化,并利用Design-Expet软件对数据进行回归分析,得到二次多项式方程:Y=3.24+0.13A+ 0.015B+0.05E+0.01AB-0.04BE-0.34A2-0.2B2-0.2E2,决定系数R2=0.9648。由表7可知,模型p=0.0040<0.05,说明方程拟合度较好;p失拟项为0.5659>0.05,说明失拟不显著;校正性决定系数R2Adj=0.9015,表明该模型可信度较高,可用于实验结果的计算。
2.6模型验证实验
根据以上模型预测,当显著性因素葡萄糖为18.20 g/L、蛋白胨为15.03 g/L、乙酸钠为3.13 g/L时,模型预测值为3.256 U/mg,在上述条件下进行三次模型验证实验,测得的胆盐水解酶比酶活为(3.37± 0.21)U/mg,与误差在允许范围内,因此该模型具有一定的实践价值,可以很好地预测该菌产胆盐水解酶实际发酵情况。
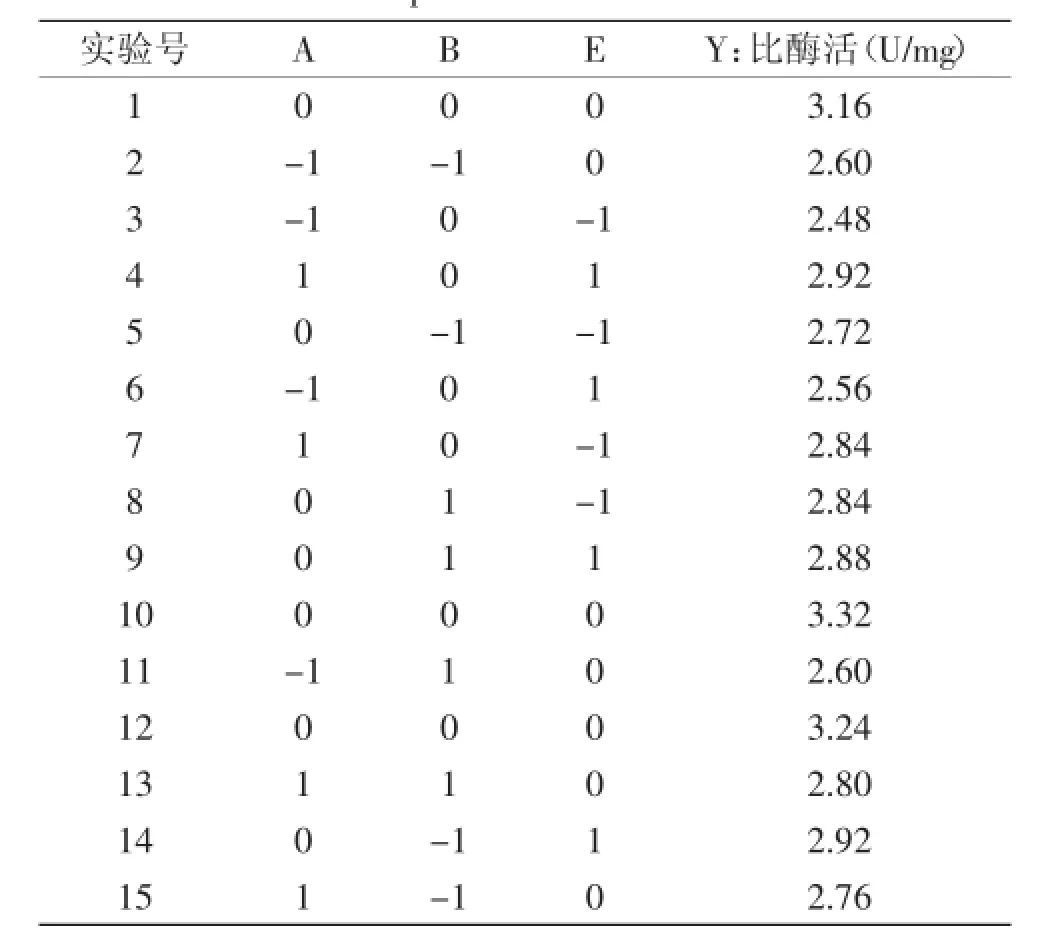
表6 响应面设计及结果Table 6 Response surface central composite design and experimental results
3 结论
本实验首先通过单因素实验筛选出适合植物乳杆菌产胆盐水解酶的最佳碳源和组合氮源,然后采用Plackett-Burman实验法对初始培养基的主要成分进行了筛选,最终选出葡萄糖、蛋白胨和乙酸钠为影响植物乳杆菌KLDS1.0386产胆盐水解酶的显著因素。利用最陡爬坡实验确定了显著因素的最佳浓度值,并以此为中心点进行了Box-Behnken实验设计,
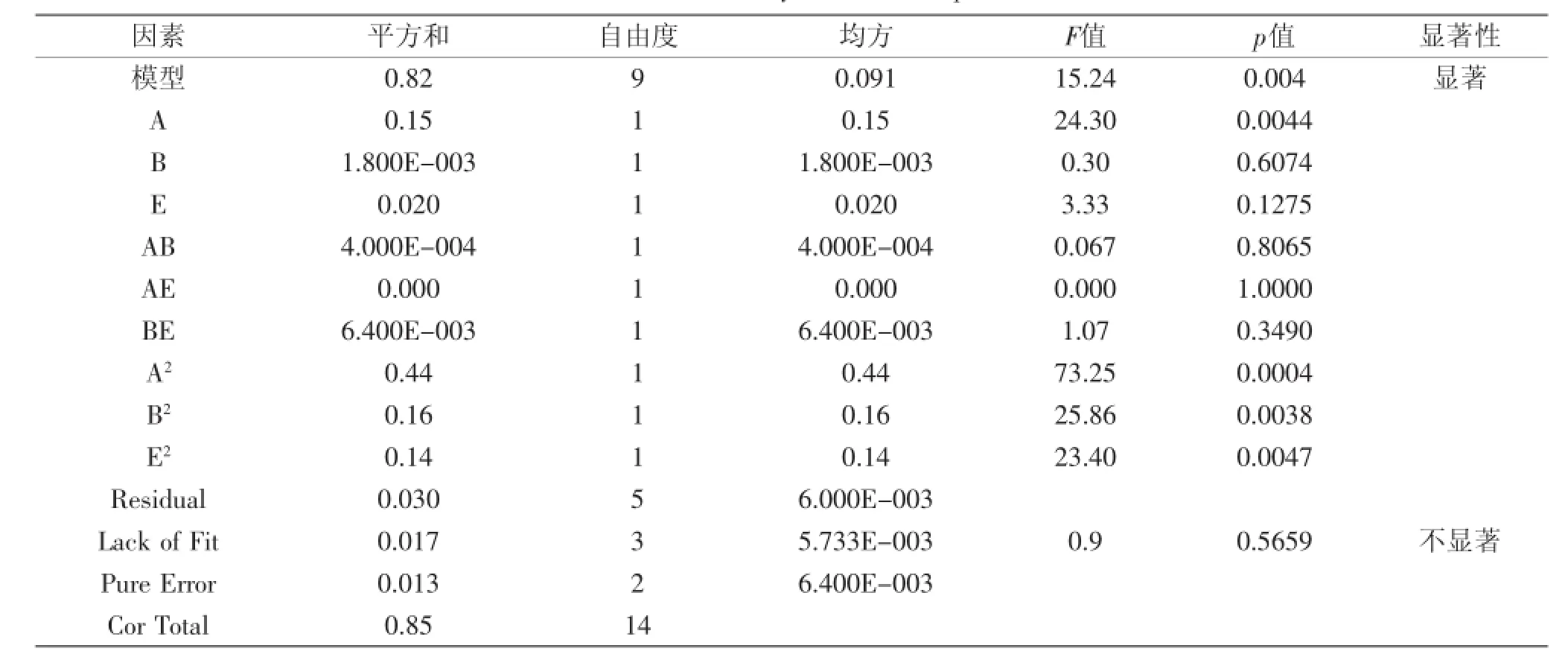
表7 模型方差分析表Table 7 Anova analysis of model equations
最终确定了植物乳杆菌KLDS1.0386产胆盐水解酶的最佳培养基成分为:葡萄糖18.2 g/L、蛋白胨15.03 g/L、酵母粉9.97 g/L、乙酸钠3.13 g/L、柠檬酸氢二铵2.00 g/L、磷酸氢二钾2.00 g/L、硫酸锰0.25 g/L、硫酸镁0.58 g/L。优化前植物乳杆菌KLDS1.0386产胆盐水解酶的量为1.04 U/mg,经过培养基的优化后,胆盐水解酶的比酶活为3.37 U/mg,比优化前提高了3.24倍。
[1]H Kimoto S,Ohmomo T,Okamoto.Cholesterol removal from media by Lactococci[J].American Dairy Science Association,2002,85(12):3182-3188.
[2]De Smet I,L Van Hoorde,et al.Significance of bile salt hydrolytic activities of lactobacilli[J].Appl Bacteriol,1995,79:292-301.
[3]Liong M T.Bile salt deconjugation ability,bile salt hydrolase activity and cholesterol coprecipitation ability of lactobacilli strains[J].International Dairy Journal,2005,15(4):391-398.
[4]LI G J.Intestinal probiotics:Interactions with bile salts and reduction of cholesterol[J].Procedia Environmental Sciences,2012,12:1180-1186.
[5]Ma’ire Begley,Colin Hill.Bile Salt Hydrolase Activity in Probiotics[J].Applied and Environmental Micribiology,2006,72 (3):1729-1738.
[6]Bateup,J M,M A McConnell.et al.Tannock.Comparison of Lactobacillus strains with respect to bile salt hydrolase activity,colonization of the gastrointestinal tract,and growth rate of the murine host[J].Appl Environ Microbiol,1995,61:1147-1149.
[7]Corzo G,S E Gilliland.Measurement of bile salt hydrolase activity from Lactobacillus acidophilus based on disappearance of conjugated bile salts[J].J Dairy Sci,1999,82:466-471.
[8]Liong M T.Bile salt deconjugation ability,bile salt hydrolase activity and cholesterol co-precipitation ability of lactobacilli strains[J].International Dairy Journal,2005,15(4):391-398.
[9]姜金康.乳杆菌属胆汁盐水解酶的活性多样性、底物特异性及相关基因研究[D].上海:上海交通大学,2008:19-20.
[10]李秀凉,王继超.响应面法优化植物乳杆菌发酵产胆盐水解酶的培养基成分[J].中国酿造,2013,32(5):47-51.
[11]惠明,刘勇,张红星,等.产胆盐水解酶BSH乳酸菌的鉴定及发酵条件优化[J].中国食品学报,2011,11(1):214-221.
[12]刘慧,熊丽霞.藏灵菇源干酪乳杆菌KL1高产胆盐水解酶发酵条件的优化研究[J].食品科学,2008,24(12):114-118.
Optimization of fermentation medium of Lactobacillus plantarum KLDS1.0386 for bile salt hydrolase production
TANG Ya-ru1,YU Shang-fu1,GUO Li-dong1,2,WANG Na-na1,HUO Gui-cheng1,*
(1.Key Laboratory of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China;2.Heilongjiang University of Traditional Chinese Medicine,College of Pharmacy,Harbin 150030,China)
In order to improve the bile salt hydrolase production of Lactobacillus plantarum KLDS1.0386,the response surface method was used to optimize the medium composition.The optimal values of the culture medium were as follows(g/L):glucose 18.2 g/L,peptone 15.03 g/L,yeast extract 9.97 g/L,sodium acetate 3.13 g/L,diammonium hydrogen citrate 2.00 g/L,K2HPO42.00 g/L,MnSO40.25 g/L,MgSO40.58 g/L.Before optimizing,the activity of bile salt hydrolase was 1.04 U/mg,Under the optimal conditions,specific enzyme activity of bile salt hydrolase was 3.37 U/mg,increasing 3.24 times than before.The experimental result was consistent with the value predicted by the mathematical model.which showed the model can be put into use.
Lactobacillus plantarum;medium composition;bile salt hydrolase;response surface method
TS201.1
A
1002-0306(2016)04-0232-05
10.13386/j.issn1002-0306.2016.04.038
2015-07-17
唐雅茹(1990-),女,硕士研究生,研究方向:食品科学,E-mail:yarutang@126.com。
霍贵成(1958-),男,博士,教授,研究方向:食品微生物与生物技术,E-mail:gchuo58@126.com。
国家自然科学基金;国家863项目(2011AA100902)。
