超声波预处理棉籽壳酶法制备低聚木糖的工艺研究
2016-09-14支佳佳李应彪蒋彩虹李飞亚叶家鑫石河子大学食品学院新疆石河子832000
支佳佳,李应彪,蒋彩虹,李飞亚,叶家鑫(石河子大学食品学院,新疆石河子832000)
超声波预处理棉籽壳酶法制备低聚木糖的工艺研究
支佳佳,李应彪*,蒋彩虹,李飞亚,叶家鑫(石河子大学食品学院,新疆石河子832000)
本文以棉籽壳为原料制备低聚木糖。以超声温度、超声时间,料液比和NaOH浓度为单因素,采用正交实验设计确定了超声波预处理提取木聚糖的最优条件,即超声温度60℃,超声时间30 min,料液比为1∶15,NaOH浓度为8%,此时木聚糖得率为33.66%。在单因素料液比、加酶量、酶解时间、酶解温度的实验基础上,根据Box-Benhnken中心组合实验设计原理,采用4因素3水平的响应面分析法,以低聚木糖含量为响应值建立数学模型,确定了最佳酶解工艺条件:料液比1∶20,加酶量4%,酶解时间3.5 h,酶解温度64℃,此时低聚木糖含量为3.35 mg/mL。
棉籽壳,超声,木聚糖,酶解,低聚木糖
我国是世界棉花生产大国,棉籽壳资源丰富。但目前我国棉籽壳的利用途径比较单一,生物利用率极低[1]。寻找棉籽壳新的利用途径及提高棉籽壳加工附加值是需要解决的问题。棉子壳中半纤维素含量约为34.55%、纤维素为24.85%、木质素为31.68%[2],其中半纤维素的主要成分是木聚糖,木聚糖降解可生成低聚木糖。低聚木糖系是由2~7个木糖分子以α-1,4糖苷键结合而成,以木二糖、木三糖为主要成分的混合物[3]。低聚木糖是一种功能性低聚糖,是目前发现的促进肠内双歧杆菌的增殖有效用量最小的低聚糖。其理化性质稳定,耐酸、耐热,并有很强增殖肠道益生菌、改善肠道微生态环境等功能[4-5]。
目前,制备木聚糖最常用的方法是碱浸提,碱提具有操作简便、对设备要求低、易投入生产等特点,但化学试剂的引入也对后序的分离提纯增加了困难。半纤维素的还原末端带有各种糖基和支链,在碱性条件下发生水解,得到木聚糖或可溶性木聚糖片段[6]。超声波提取法是一种优良新型的提取技术,具有提取效率高,提取时间短,不损坏提取物结构,提取工艺运行成本低,操作简单易行等优点[7]。其原理是利用超声振动能量产生的强大剪切力和高温,使木质纤维素生物质因振动而破碎,扩大孔隙、增加可及度、保水性和比表面积,从而释放可降解的多糖[8]。水酶法是生产低聚木糖的主要方法,它是利用内切型木聚糖酶定向酶解木聚糖,副产物较少,有利于后续工艺中低聚木糖的分离和纯化[9]。碱法提取木聚糖操作简便,但是提取率不高。超声辅助提取的引入,可以提高提取率。酶法生产中由于原料和酶制剂的不同导致工艺参数不同,本文结合超声波预处理,通过响应面分析法对酶法水解木聚糖制备低聚木糖进行工艺优化,探讨一套适合从棉籽壳中提取低聚木糖的方法,为棉籽壳资源的有效利用提供基础数据。
1 材料与方法
1.1材料与仪器
棉籽壳市售,粉碎细度80目;木聚糖酶Ruibio公司,酶活力≥60000 U/mg;D-木糖标准品,天津市光复化工研究所;氢氧化钠、浓硫酸、3,5-二硝基水杨酸、无水乙醇均为国产分析纯,天津市盛奥化学试剂有限公司。
多功能粉碎机诸暨市海道机械有限公司;KQ-200VDE型双频数控超声波清洗器昆山市超声仪器有限公司;Neofuge 15R型冷冻离心机力康发展有限公司;722可见分光光度计上海精密科学仪器有限公司。
1.2实验方法
棉籽壳→粉碎(粉碎粒度80目)→超声辅助浸提(超声功率100 W)→离心过滤→醇沉(无水乙醇)→烘干得木聚糖(80℃烘干2 h)→酶解→低聚木糖。
1.2.1超声预处理各因素的确定
1.2.1.1超声温度对木聚糖得率的影响选择温度为55、60、65、70、75℃,将棉籽壳按料液比1∶15(g/mL),加入8%NaOH溶液,超声处理30 min,研究超声温度对木聚糖得率的影响。
1.2.1.2超声时间对木聚糖得率的影响选择时间为20、25、30、35、40 min,将棉籽壳按料液比1∶15(g/mL),加入8%NaOH溶液,超声温度60℃进行超声预处理,研究超声时间对木聚糖得率的影响。
1.2.1.3料液比对木聚糖得率的影响选择料液比1∶10、1∶15、1∶20、1∶25、1∶30(g/mL),将棉籽壳加入8% NaOH溶液后,按超声温度60℃,预处理30 min,研究料液比对木聚糖得率的影响。
1.2.1.4NaOH浓度对木聚糖得率的影响选择溶剂NaOH溶液浓度为2%、4%、6%、8%、10%,将棉籽壳按超声温度60℃,料液比1∶15(g/mL),预处理30 min,研究NaOH浓度对木聚糖得率的影响。
1.2.2正交实验设计优化木聚糖提取工艺根据单因素的实验结果,选择合适的因素水平设计实验(见表1),以正交实验确定木聚糖的最优提取条件。
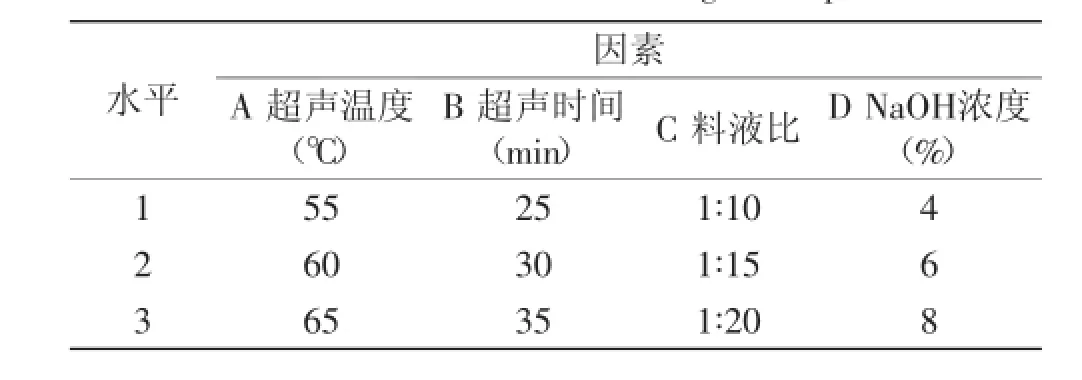
表1 正交实验的因素水平Table 1 Factors and levels of orthogonal experiment
1.2.3酶解参数的选择按照1.2.2实验所得最佳超声预处理条件预处理后,料液在6000 r/min离心10 min取上清液,加入3~4倍体积的乙醇静置8 h,真空抽滤取滤渣,用蒸馏水洗至滤渣无乙醇味,烘干得粗木聚糖。称取一定量的木聚糖于250 mL锥形瓶中,加入蒸馏水后用磷酸氢二钠-柠檬酸缓冲液调节pH至7.0。
1.2.3.1料液比对低聚木糖含量的影响设定酶解时间4 h,酶解温度60℃,加酶量4%,研究不同料液比(1∶10、1∶15、1∶20、1∶25、1∶30)对低聚木糖含量的影响。
1.2.3.2酶添加量对低聚木糖含量的影响设定料液比1∶20,酶解时间4 h,酶解温度60℃,在不同的加酶量(1%、2%、3%、4%、5%)条件下对酶解液中低聚木糖含量的影响。
1.2.3.3酶解时间对低聚木糖含量的影响设定料液比1∶20,加酶量4%,酶解温度60℃,研究不同酶解时间(1、2、4、6、8 h)对低聚木糖含量的影响。
1.2.3.4酶解温度对低聚木糖含量的影响设定料液比1∶20,酶添加量4%,酶解时间4 h,研究不同酶解温度(45、50、55、60、65℃)对酶解液中低聚木糖含量的影响。
1.2.4响应面设计优化工艺根据单因素的实验结果,选择合适的因素水平,采用响应面分析,以Box-Benhnken中心组合设计实验(表2),确定最佳的酶解工艺。
1.2.5测定方法
1.2.5.1木糖标准曲线的绘制准确称取25 mg分析纯的木糖(预先在105℃干燥至恒重),定容于250 mL容量瓶。分别吸取该溶液0、5、l0、15、20、25 mL均定容于50 mL,分别取1 mL木糖溶液置于25 mL试管中,再加入1 mL 3,5-二硝基水杨酸,在沸水浴中沸煮5 min,立即冷却,用去离子水定容至25 mL,以没加木糖溶液的液体作空白,用比色皿于550 nm处测吸光度值,以木糖浓度为横坐标,吸光度值为纵坐标绘制木糖标准曲线,并得出标准方程Y=0.2425X+0.0014。
1.2.5.2还原糖的测定还原糖测定用3,5-二硝基水杨酸(DNS)法[10]:取1 mL样品加水量稀释0.5~3.5 g/L 于25 mL比色管中,再加入去离子水1 mL和DNS试剂1 mL,沸水浴5 min,立即冷却后定容至25 mL,于550 nm下测定吸光度值(A550)。利用1.2.5.1中标准方程即可求出其还原糖,以还原糖含量代表酶解后的低聚木糖含量。
1.2.5.3总糖测定取提取液1 mL,加入1 mL 72%硫酸溶液,沸水中保温1 h,使提取液中木聚糖充分水解为木糖,冷却至室温用40%氢氧化钠溶液中和至中性,定容至25 mL,从中再取1 mL按照1.2.5.1步骤测定吸光度值,并对照木糖标准曲线计算总糖含量。
木聚糖提取得率(%)=[(提取液中总糖量-提取液中还原糖量)×0.88]/绝干原料中的木聚糖×100
其中,0.88—为木聚糖聚合因数;绝干原料中的木聚糖=棉籽壳量×34.55%。
1.3数据处理
用SPSS Statistics17软件分析正交实验结果的数据。用Design-Expert 8.0对响应面实验数据进行处理分析。
2 结果与分析
2.1超声预处理各因素的确定
2.1.1超声温度对木聚糖得率的影响由图1可知,随着温度的升高,处理后的棉籽壳木聚糖得率也逐渐提高,当温度升至60℃时得率达到最大。这可能是因为温度升高加快了分子运动,提高反应速度,但温度过高可能会破坏糖链结构,不利于提取。因此,超声预处理温度选择60℃。
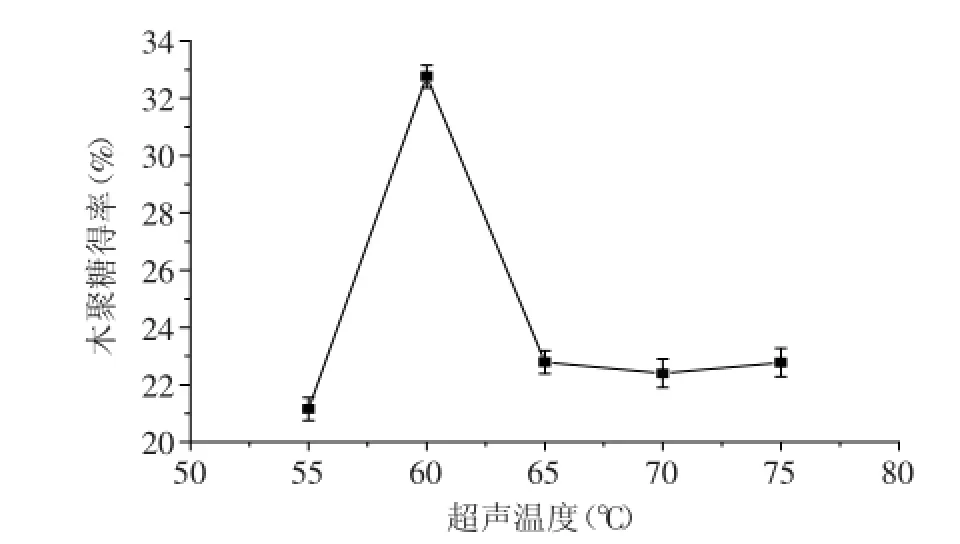
图1 超声温度对木聚糖得率的影响Fig.1 Effect of ultrasonic temperature on extraction rate of xylane
2.1.2超声时间对木聚糖得率的影响由图2可知,随着提取时间的延长木聚糖得率逐渐增大,当超声时间为30 min时,木聚糖得率达到最大值;超声时间大于30 min时,木聚糖得率随着时间的增大而降低。这可能是因为时间过长,导致其有效成分分解。因此,最佳超声时间选择30 min。
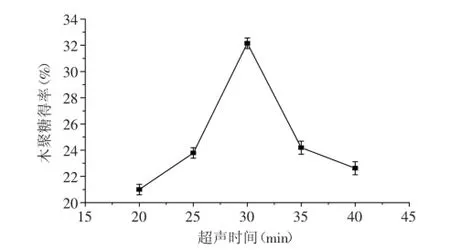
图2 超声时间对木聚糖得率的影响Fig.2 Effect of ultrasonic time on extraction rate of xylane
2.1.3料液比对木聚糖得率的影响由图3可知,当料液比小于1∶15时,木聚糖得率随着料液比的升高而逐渐升高;当料液比大于1∶15时,木聚糖得率升高不显著。这可能是因为料液比升高,溶液黏度降低,不利于木聚糖的溶出。因此,选择料液比1∶15为最佳预处理条件。

图3 料液比对木聚糖得率的影响Fig.3 Effect of the ratio of solid to liquid on extraction rate of xylane
2.1.4NaOH浓度对木聚糖得率的影响由图4可知,随着NaOH浓度的升高,木聚糖得率逐渐增大,但当NaOH浓度从8%到10%时,木聚糖得率虽有所增加却没有6%到8%增加明显,可能是因为原料中的木聚糖已经完全溶出,而且高浓度的NaOH消耗量更大,考虑到经济原因,因此,选择NaOH浓度8%作为最佳预处理条件。
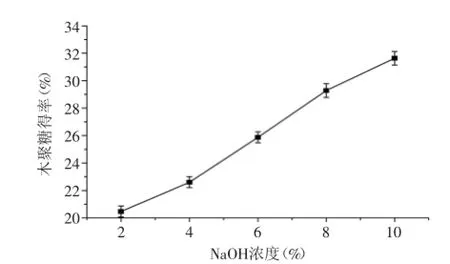
图4 NaOH溶液浓度对木聚糖得率的影响Fig.4 Effect of NaOH concentration on extraction rate of xylane
2.2正交分析及工艺优化
2.2.1正交实验设计及结果由表3中木聚糖得率的R值可知,影响得率的因素排序为C>A>D>B。综合各因素K值和直观比较,得出理论上最佳得率工艺条件为A2B2C2D3。由正交实验结果分析最佳提取工艺,在超声温度60℃,超声时间30 min,料液比为1∶15,NaOH浓度为8%的条件下做验证实验,得出木聚糖得率为33.66%。
2.3预处理后酶解条件的研究
2.3.1料液比对低聚木糖含量的影响由图5可知,随着料液比的增加,酶解液中低聚木糖的含量逐渐增加,当料液比大于1∶20时,低聚木糖含量增加不明显。这可能是因为酶反应速度与底物浓度呈线性关系,当底物浓度达到酶促反应最大速度的一半时,反应速度增幅缓慢[11]。所以从生产角度来考虑,选择底物的料液比为1∶20。
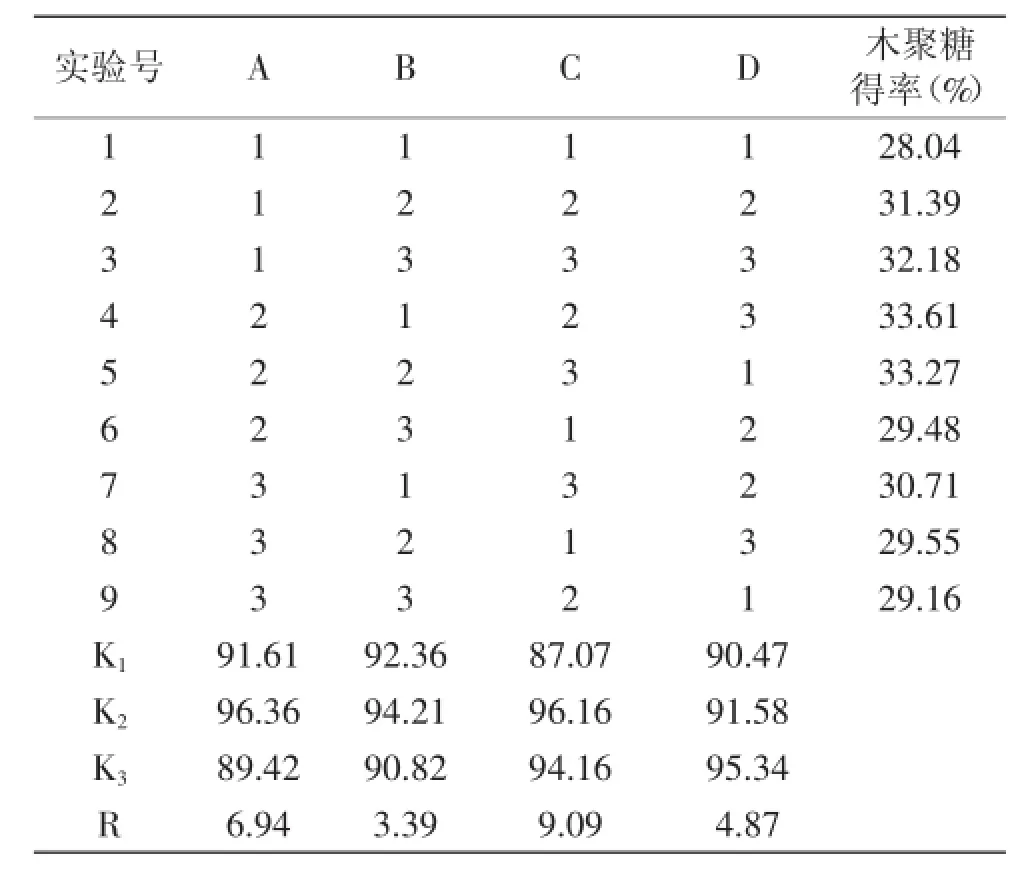
表3 正交实验结果Table 3 The results of orthogonal experiment

图5 料液比对低聚木糖含量的影响Fig.5 Effect of the ratio of solid to liquid on oligosaccharide content
2.3.2酶添加量对低聚木糖含量的影响由图6可知,随着加酶量的增加,酶解液中低聚木糖的含量逐渐增加,当加酶量小于4%时,低聚木糖含量增加幅度较大,当加酶量大于4%时,低聚木糖含量增加幅度变小并趋于平缓。在酶浓度较低时,酶结合的底物少,随着酶量的增加,酶结合的底物越来越多,但是由于底物量有限,进一步增加酶添加量也不能提高低聚木糖的量[12]。因此选择酶添加量为4%。
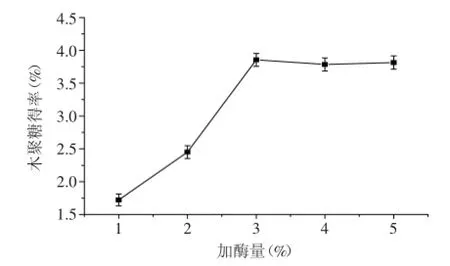
图6 加酶量对低聚木糖含量的影响Fig.6 Effect of volume of enzyme on oligosaccharide content
2.3.3酶解时间对低聚木糖含量的影响由图7可知,随着酶解时间的延长,酶解液中低聚木糖的含量先增大后缓慢下降。这可能是因为随着酶解产物的积累,生成的产物占领了酶分子上的特殊位点,使酶不能结合底物,产生竞争性抑制。为了使低聚木糖含量最高,选择4 h为最适酶解时间。

图7 酶解时间对低聚木糖含量的影响Fig.7 Effect of zymolytic time on oligosaccharide content
2.3.4酶解温度对低聚木糖含量的影响由图8可知,随着酶解温度的升高,酶解液中的低聚木糖含量先增加后减少,在60℃达到最高值。这可能是因为温度低时酶活性较低,但当温度过高会导致酶的变性,降低酶活性。因此,选择酶解最适温度为60℃。
图8 酶解温度对低聚木糖含量的影响Fig.8 Effect of zymolytic temperature on oligosaccharide content
2.4响应面分析及工艺优化
2.4.1响应面实验设计及结果由Design-Expert 8.06统计分析软件的实验设计功能可知,4因素3水平的中心组合设计包括29个实验方案,具体的实验方案及实验结果如表4所示。
利用Design-Expert 8.06统计软件,通过回归分析对表4实验数据进行回归拟合,得到料液比(A′)、加酶量(B′)、酶解时间(C′)和酶解温度(D′)4个因素对低聚木糖含量(Y)的二次回归方程为:
Y=3.69+0.097A′+0.16C′+0.15D′+0.17A′D′-0.13B′C′-0.26C′D′-0.36A′2-0.29B′2-0.14C′2-0.17D′2。
对该回归模型及其系数进行显著性检验,结果见表5。由表5的方差分析可知:模型的p<0.0001,说明该模型是极显著的,一次项C′、D′均极显著,说明酶解时间、酶解温度对低聚木糖含量影响极显著。交互项C′D′的偏回归系数达到极显著水平,A′D′、B′C′的偏回归系数达到显著水平,表明各影响因素对低聚木糖含量的影响不是简单的线性关系。失拟项p值为0.515>0.05,不显著。模型决定校正系数R2Adj= 0.8471,说明模型能解释84.71%的响应值变化;模型的复相关系数为R2=0.9017,说明拟合度良好,该模型可以用于实验工艺条件的预测。
表4 响应面实验设计及结果Table 4 Experimental design and results for MSA
2.4.2最佳条件的响应面优化拟合的响应面比较直观的反映了各因素间的交互作用,其交互因素影响显著的响应面图如图9~图11所示。
如图9所示,当料液比和酶解温度处于较低水平时,随着料液比和酶解温度的增大,低聚木糖含量逐渐上升后缓慢降低;当料液比处于较高水平时,随着酶解温度的升高低聚木糖含量明显上升后趋于平稳,当酶解温度处于较高水平时,随着料液比的增加,低聚木糖含量先缓慢上升后缓慢下降。结果表明,料液比和酶解温度之间的交互影响显著。
如图10所示,当加酶量处于较低水平时,随着酶解时间的增大,低聚木糖含量明显上升后趋于平稳,当加酶量处于较高水平时,随着酶解时间的增大,低聚木糖含量变化幅度不大;在酶解过程中随着加酶量的增大,低聚木糖含量逐渐升高后缓慢降低。结果表明,酶添加量与酶解时间之间的交互影响显著。
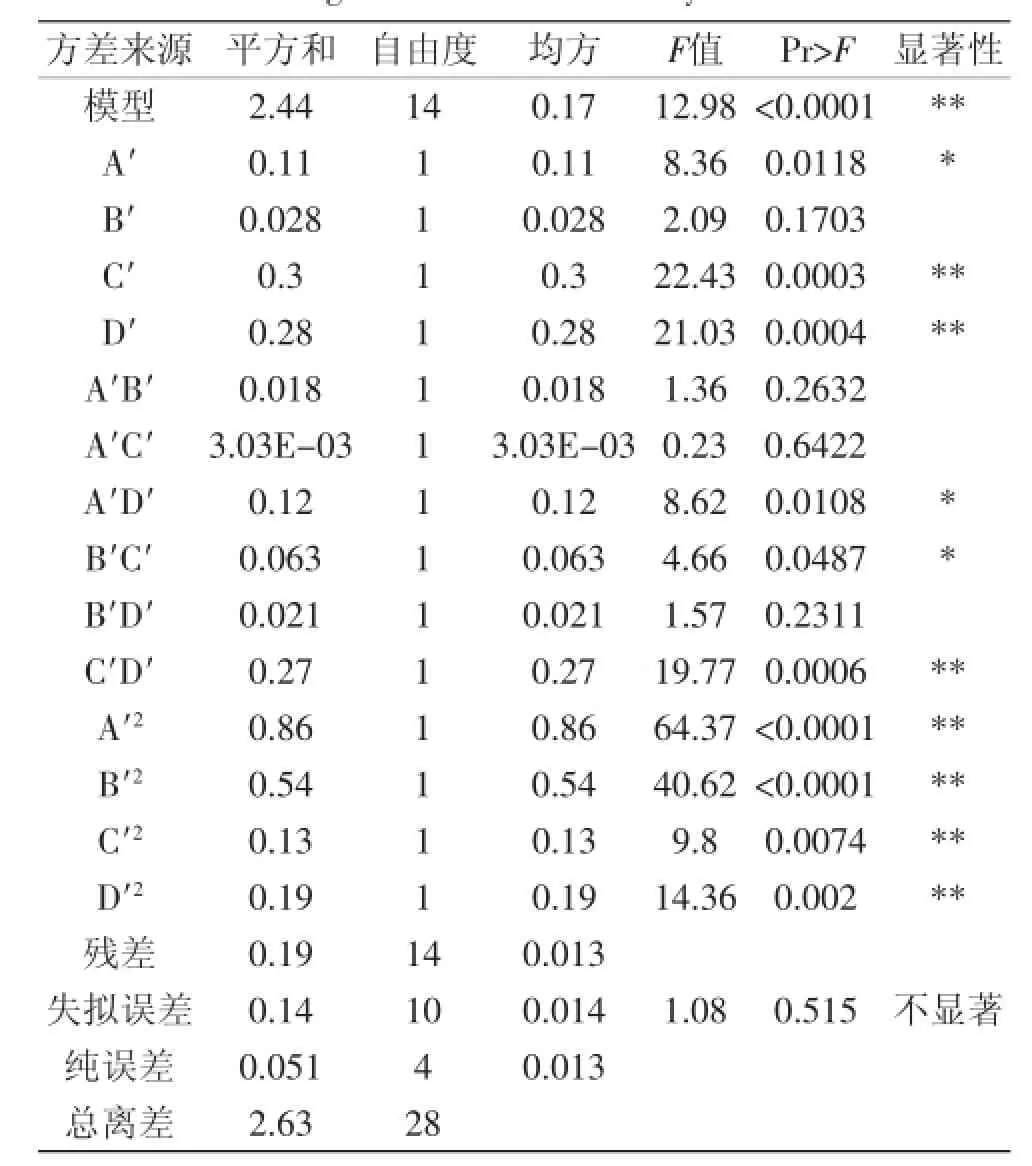
表5 回归模型及方差分析结果Table 5 Regression model and analysis of variance
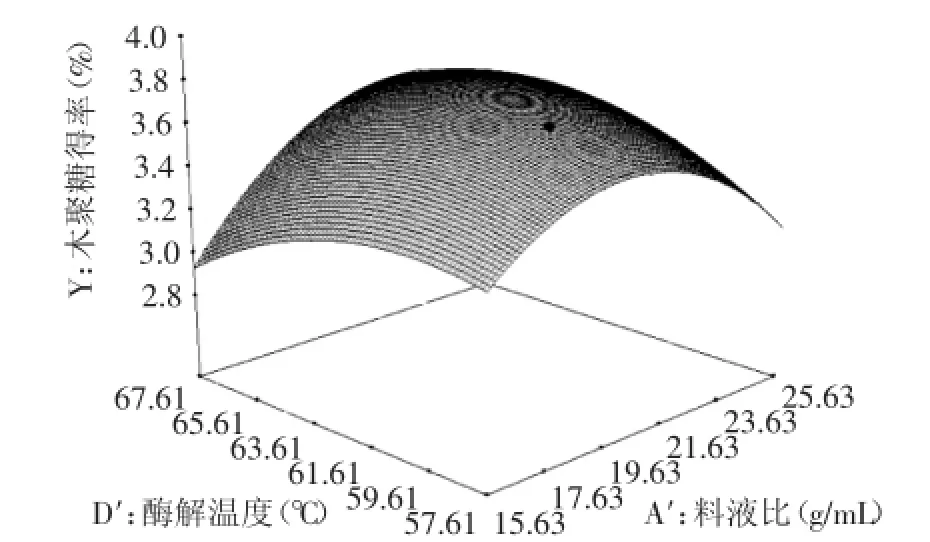
图9 料液比和酶解温度对低聚木糖含量交互影响的响应面图Fig.9 Response surface of effects of the ratio of solid to liquid and zymolytic temperature

图10 酶解时间和加酶量的交互影响的响应面Fig.10 Response surface of effects of zymolytic time and volume of enzyme
如图11所示,当酶解时间和酶解温度处于较低水平时,随着酶解时间和酶解温度的升高,低聚木糖含量逐渐升高;当酶解时间和酶解温度处于较高水平时,对低聚木糖含量的影响不大。结果表明,酶解时间和酶解温度的交互性影响极显著。
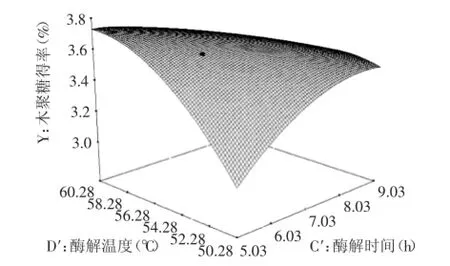
图11 酶解温度和酶解时间的交互作用的响应面Fig.11 Response surface of effects of zymolytic temperature and time
Box-Behnken模型响应面优化结果为:料液比1∶21.46,加酶量4.2%,酶解时间3.56 h,酶解温度63.98℃,此时低聚木糖含量为3.75 mg/mL。各因素对低聚木糖含量的影响大小依次为:酶解时间、酶解温度、料液比、加酶量。考虑实际操作条件,调整为料液比1∶20,加酶量4%,酶解时间3.5 h,酶解温度64℃。采用修正后的条件参数,进行3次平行验证实验,结果测得低聚木糖含量为3.35 mg/mL,与预测值3.75 mg/mL相比的RSD为0.3%,两者较接近。
3 结论
超声预处理的最佳条件为:超声温度60℃,超声时间30 min,料液比1∶15,NaOH浓度8%。在此条件下预处理得到的棉籽壳中木聚糖得率为33.66%。利用Design-Expert 8.06统计软件,选用Box-Behnken模型对酶解实验条件进行优化,结合实际情况得到最优酶解工艺条件为料液比1∶20,加酶量4%,酶解时间3.5 h,酶解温度64℃,此时低聚木糖含量为3.35 mg/mL,与理论预测值3.75 mg/mL接近,说明模型可靠性较高,能很好的预测实验结果。
[1]丁长河,张洪宾,周迎春,等.棉籽壳酶法制备低聚木糖工艺条件优化[J].食品科学,2015(4):29-33.
[2]田维亮,葛振红,李继兴,等.棉子壳中半纤维素、纤维素和木质素含量的测定[J].中国棉花,2013,40(7):24-25.
[3]Kyoji Y,Naoki H,Kunimasa K,et al.Inhibitory effects of acidic xylooligisaccaride on stree-induced gastric inflammation in mice[J].Food Hyg Soc Japan,2006,47(6):284-287.
[4]杨瑞金,许时婴,王璋,等.低聚木糖的功能性质与酶法生产[J].中国食品添加剂,2000,2:89-93.
[5]Makelainen H,Juntunen M,Hasselwander O.Prebiotic Potential of Xylo-Oligosaccharides[J].Prebiotics and Probiotics Science and Technology,2009,12(1):245-258.
[6]武秋颖,陈复生,时冬梅,等.响应面优化超声辅助碱法提取花生壳木聚糖的工艺研究[J].食品工业科技,2012,33(2):307-310.
[7]胡爱军,郑捷.食品工业中的超声提取技术[J].食品与机械,2004,20(4):56-60.
[8]张明霞,庞建光,呼秀智,等.超声波处理玉米芯制备低聚木糖的条件优化[J].食品工业,2015,36(4):62-66.
[9]冉玉梅,晁正,潘智,等.响应面法优化酶法制备麦麸低聚木糖工艺研究[J].食品工业科技,2013,34(18):159-164.
[10]朱凯杰,陆国权,张迟,等.响应面法优化水杨酸比色测定还原糖的研究[J].中国粮油学报,2013,28(8):107-113.
[11]李丽,施展,钱春香,等.酶动力学模块软件求解米氏常数和最大反应速率的实验研究[J].洛阳理工学院学报:自然科学版,2009,19(4):1-4.
[12]施伟梅,张赛男,陈建福,等.响应面法优化酶法辅助提取熟地黄多糖的工艺研究[J].河南工业大学学报:自然科学版,2014,35(5):23-27.
Study on xylan extraction from cottonseed husk enhanced
by ultrasonication and enzymatic hydrolysis of xylan to xylooligosaccharides
ZHI Jia-jia,LI Ying-biao*,JIANG Cai-hong,LI Fei-ya,YE Jia-xin (Food College of Shihezi University,Shihezi 832000,China)
The preparation of xylooligosaccharide from cottonseed husk was studied in this paper.Orthogonal experimental design was used to select optimal conditions of ultrasonic extraction of xylan.When the ultrasonic temperature was 60℃,the ultrasonic time was 30 min,the ratio of material to liquid was 1∶15,the concentration of NaOH was 8%,the extraction rate of xylan was 33.66%.Based on the experimental results of single factor:ratio of material to liquid,the amount of enzyme,the time of enzyme hydrolysis and the temperature of the enzyme hydrolysis,using four factors and three levels of response surface methodology to analyse the influence of each single factor and interaction.The reducing sugar content in response to the value of establishing mathematical model,the optimum conditions were as follows:the ratio of solid to liquid was 1∶20,the accession of the xylanase was 4%,zymohydrolysis time was 3.5 h,zymohydrolysis temperature was 64℃.Under this condition,3.35 mg/mL oligosaccharide content was produced.
cottonseed husk;ultrasonic wave;xylan;enzymatic hydrolysis;xylooligosaccharides
TS201.3
A
1002-0306(2016)04-0217-06
10.13386/j.issn1002-0306.2016.04.035
2015-08-17
支佳佳(1989-),女,在读硕士研究生,主要从事农产品加工方面的研究,E-mail:zjj3366@163.com。
李应彪(1964-),男,教授,研究方向:农畜产品加工,E-mail:lybfood@sohu.com。
“:十二五”农村领域国家科技计划课题(2011BAD23B03)。
