新型中国被毛孢胞内多糖HSIPS2链构象及抗氧化活性研究
2016-09-14邵双双韦朝阳李卫旗浙江大学生命科学学院浙江杭州30058浙江省林业科学研究院生物技术所浙江杭州3003
邵双双,贺 亮,韦朝阳,李卫旗,*(.浙江大学生命科学学院,浙江杭州30058;.浙江省林业科学研究院生物技术所,浙江杭州3003)
新型中国被毛孢胞内多糖HSIPS2链构象及抗氧化活性研究
邵双双1,贺亮2,韦朝阳1,李卫旗1,*
(1.浙江大学生命科学学院,浙江杭州310058;2.浙江省林业科学研究院生物技术所,浙江杭州310023)
以发酵得到的中国被毛孢菌丝体为原料进行热水浸提,经过醇沉、脱蛋白、脱色素以及DEAE-Sepharose Fast Flow离子交换柱色谱和Sephacryl S-100凝胶柱色谱得到均一性多糖组分(HSIPS2),并对该组分进行链构象及抗氧化活性分析。结果表明:HSIPS2的单糖组成及摩尔比例为葡萄糖∶半乳糖∶甘露糖∶核糖=48.52∶6.58∶5.17∶1.0,其绝对分子量为1.46×104g/mol,纯度为99.82%;该多糖在0.1 mol/L的NaNO3溶液中呈柔顺链构象,流体力学半径Rh=2.3 nm,ML=334.05 nm-1,q=0.70 nm,d=0.69 nm;同时,HSIPS2清除羟自由基的IC50为0.749 mg/mL,氧自由基吸收能力(ORAC值)为872.80 μmol TE/g,说明HSIPS2具有较高的抗氧化能力。
中国被毛孢,多糖,链构象,氧自由基吸收能力
天然虫草自然资源短缺,价格昂贵,人工培养的虫草易于得到,其有效成分及药理活性与天然虫草非常接近。中国被毛孢(Hirsutella sinensis)是从天然虫草中分离得到的虫草菌之一,被确认为冬虫夏草真正的无性型[1-3]。
越来越多的研究表明,多糖是除了蛋白质和核酸之外另一种重要的生命物质,具有多方面、复杂的生物活性及功能[4]。虫草多糖是冬虫夏草的主要活性成分之一,具有很好的药理活性,如抗氧化、调节血糖、免疫调节、抗肿瘤等多方面均有报道[5],在医药、食品和保健品研发上具有诱人的应用前景。结构决定其生物活性,不同的高级构象表现出不同的生物功能,因此,开展多糖等大分子高级构象的研究具有非常重要的意义。
近年来,有关中国被毛孢多糖的提取分离以及初级结构的研究比较多[6-7],但是对其胞内多糖分子链构象的研究目前还没有涉及。本实验首次对发酵得到的中国被毛孢胞内多糖进行分子链构象分析,并对其抗氧化活性进行研究,为其多糖类物质的开发利用奠定理论基础。
1 材料与方法
1.1材料与仪器
中国被毛孢菌株(HS001) 由浙江省林业科学研究院提供;葡萄糖(Glc)、岩藻糖(Fuc)、木糖(Xyl)、甘露糖(Man)、半乳糖(Gal)、鼠李糖(Rham)、葡萄糖醛酸(GlcUA)、半乳糖醛酸(GalUA)、阿拉伯糖(Ara)以及核糖(Rib) Sigma公司;无水乙醇、氯仿等试剂均为分析纯,国药集团化学试剂有限公司。
CL31R型多功能高速离心机美国Thermo公司;R-210型旋转蒸发仪瑞士BUCHI公司;冷冻干燥机美国LABCONCO公司;U-1900型可见分光光度计日本HITACHI公司;Spectra Max M2多功能酶标仪美国分子仪器公司;AKTA purifier层析系统美国GE医疗集团;戴安U-3000型高效液相色谱仪美国Dionex公司;DAWN-II多角度激光光散射仪美国Wyatt Technology Co;RID-10A示差折光仪日本SHIMADZU公司。
1.2实验方法
1.2.1菌株及其发酵培养[8]孢菌株(HS001)在斜面培养基(马铃薯200 g、葡萄糖20 g、麦麸10 g、蚕蛹粉10 g、琼脂20 g、去离子水1000 mL,自然pH)中4℃保存,然后接种到平板培养基(配方同斜面培养基),18℃条件下培养40 d后,接种到发酵培养基(葡萄糖20 g、蛋白胨5 g、蚕蛹粉10 g、KH2PO41 g、MgSO4·7H2O 0.5 g、去离子水1000 mL)26℃振荡培养30 d。
1.2.2多糖的提取及分离纯化参考王蕾等的方法[9],并做了适当修改。将发酵液经8层纱布过滤,得到的菌丝体再用蒸馏水冲洗3次,冻干。将干燥后的菌丝体粉碎后过60目筛,按料液比为1∶20加去离子水,90℃浸提2 h,8000 r/min离心15 min,收集上清液,滤渣重复提取1次,合并2次提取液。50℃下减压浓缩,冻干得粗多糖。粗多糖溶于水,Sevage法脱蛋白后,采用双氧水法进行脱色素,浓缩,透析(3500 u)。将脱完蛋白色素的多糖样品,过DEAE-Sepharose Fast Flow离子交换柱(2.0 cm×35 cm),用蒸馏水、0.1、0.3、0.5和0.7 mol/L的NaCl溶液进行梯度洗脱,洗脱用量依次为28、28、28、28、48 mL流速为1.0 mL/min,每管收集4 mL,采用苯酚-硫酸法检测分布,分别从每管吸取0.2 mL收集液,加入0.8 mL去离子水,1.0 mL 5%的苯酚,再加5 mL浓硫酸,充分振荡,室温反应1 h,490 nm测吸光值。分别收集不同洗脱峰的洗脱液,合并同一洗脱峰的洗脱液,经浓缩、透析、冻干,即可得到几个不同的多糖组分。用Sephacryl S-100凝胶柱色谱(1.6 cm×60 cm)对主峰多糖组分进一步纯化,蒸馏水做洗脱液,流速为0.5 mL/min,每管收集3 mL,分别从每管吸取0.2 mL收集液,加入0.8 mL去离子水,1.0 mL 5%的苯酚,再加5 mL浓硫酸,充分振荡,室温反应1 h,490 nm测吸光值,检测糖分布。可得到纯化后的中国被毛孢胞内多糖HSIPS2。
1.2.3单糖组成单糖成分测定参考Dai等[10]的方法,并做了适当的修改。10种单糖(5 mol/L),分别取150 μL,加入150 μL 0.6 mol/L NaOH溶液,混合均匀后,加入300 μL 0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮甲醇液,混匀,70℃水浴100 min,冷却至室温后,加入300 μL 0.3 mol/L HCl中和,然后加入等体积氯仿,充分振荡、离心(4000 r/min,15min),收集水相,重复5次,过0.45 μm膜,待HPLC测定。
取纯化后的多糖3 mg,加入1 mL 4 mol/L三氟乙酸溶液,121℃水解6 h后,加入200 μL甲醇,60℃减压浓缩蒸干,去除残留的三氟乙酸,反复3次,最后加入150 μL去离子水溶解,衍生化方法与上述单糖衍生化制备一致。
RP-HPLC测定条件:检测波长为245 nm,流速为1.0 mL/min,柱温:25℃,柱子:HYPERSIL APS-2 (4.6 mm×250 mm,5 μm,Agilent,USA),进样体积为20 μL,流动相A(乙腈):流动相B(0.05 mol/L PBS缓冲液,pH6.9)为15∶85。
1.2.4多糖分子量及链构象研究采用静态光散射和动态光散射系统(SEC-MALLS)与在线差动式粘度计(ViscoStarTM II,Wyatt Technology,USA)联用进行测定,可以精确获得多糖的分子量(Mw)、均方根旋转半径(<S2>z1/2)、流体力学半径(Rh)和特性粘度([η])等构象参数[11],进而构建模型获知多糖链构象。
配制0.1 mol/L NaNO3溶液(含有0.02%NaN3)作为流动相,过0.22 μm膜,超声脱气30 min。称取3 mg样品溶解于1 mL 0.1 mol/L NaNO3溶液中,磁力搅拌溶解4 h,过0.22 μm膜备用。
参考Rau等[12]的方法,折光率增量dn/dc为0.135 mL/g。进样量为200~300 μL,流速为1.0 mL/min,柱温为室温。采用ASTRA version软件(Wyatt Technology)进行数据收集和计算。
1.2.5抗氧化活性
1.2.5.1羟自由基清除率参考Mao等[13]的测定方法并稍作修改,具体方法为:2.0 mL FeSO4溶液(6 mmol/L)分别与2.0 mL 0.2、0.4、0.6、0.8、1.0 mg/mL的样品混匀,加入2 mL H2O2(6 mmol/L),摇匀,室温静置10 min后,加入2.0 mL水杨酸(6 mmol/L),混匀,室温静置10 min,于510 nm处测定吸光值,VC作为阳性对照,对羟自由基的清除能力按照下面公式进行计算:
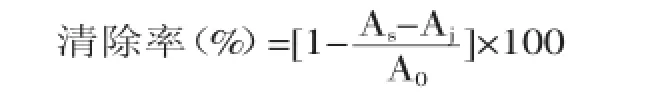
其中,A0为空白样品吸光值,As加样后的吸光值,Aj为以蒸馏水代替H2O2的吸光值。
1.2.5.2氧自由基吸收能力(ORAC)使用荧光素作为氧化底物,偶氮二异丁脒盐酸盐(AAPH)为自由基产生剂,并使用Trolox抗氧化剂作为定量样品抗氧化能力的标准。ORAC测定参考Hua等[14]的方法并稍作了修改,在96孔板的微孔中加入20 μL荧光素(35 nmol/L)、40 μL待测样品液和140 μL AAPH (12.8 mmol/L)。该反应在75 mmol/L磷酸盐缓冲液(pH7.4)体系中进行,检测温度为37℃,激发波长为485 nm,发射波长为528 nm,每隔2 min测定一次吸光强度,持续98 min。ORAC实验需要设定两种对照,即没有添加自由基的荧光素的自然衰减对照(-AAPH)和没有抗氧化剂存在时的自由基作用对照(+AAPH)。各个微孔不同时间点的绝对荧光强度与其初始时间的荧光强度之比,得到相对荧光强度,以相对荧光强度采用近似积分法计算荧光衰退曲线下面积(AUC)。Net AUC=AUCsample-AUCblank,AUCblank为没有添加自由基的荧光素的自然衰减,Net AUC与抗氧化物的浓度呈正相关。ORAC值=[AUCsample-AUCblank](Trolox摩尔浓度/样品摩尔浓度),即Trolox当量(TE),以μmol TE/g表示。
1.3数据分析
采用Microsoft Excel 2010和Origin 9.0软件对相关数据进行统计分析。
2 结果与分析
2.1多糖的提取及分离纯化
由图1可知,多糖脱蛋白脱色素后,经过DEAESepharose Fast Flow色谱柱分离,由0.1 mol/L NaCl溶液洗脱得到组分HSIPS1(17.07%),由0.3 mol/L NaCl溶液洗脱得到组分HSIPS2(82.93%),组分HSIPS1的得率与HSIPS2相比较低,所以收集主要组分HSIPS2 过Sephacryl S-100凝胶柱进一步纯化,得到单一对称的洗脱峰,见图2。
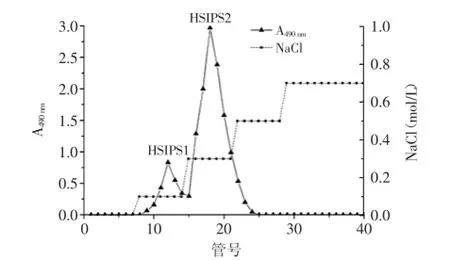
图1 中国被毛孢胞内多糖的DEAE-Sepharose Fast Flow洗脱曲线Fig.1 Elution profile of polysaccharide from Hirsutella Sinensis on DEAE-Sepharose Fast Flow column
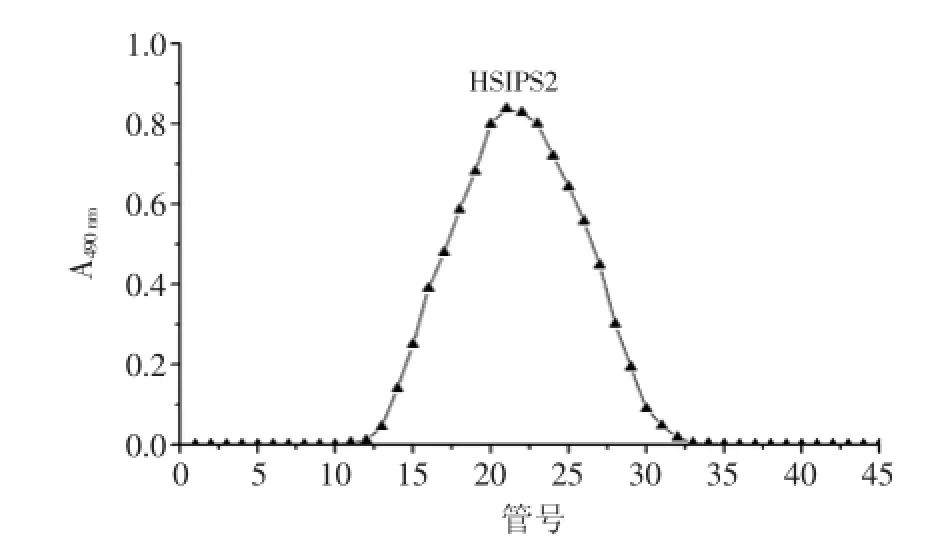
图2 HSIPS2的Sephacryl S-100柱层析洗脱曲线Fig.2 Chromatography of HSIPS2 by gel filtration on Sephacryl S-100
2.2HSIPS2的单糖组成
根据10种单糖标准品的液相色谱图(图3)和HSIPS2单糖组成的HPLC色谱图(图4)可知,HSIPS2的单糖组成及摩尔比例为:葡萄糖∶半乳糖∶甘露糖∶核糖=48.52∶6.58∶5.17∶1.0,说明HSIPS2主要由葡萄糖、半乳糖和甘露糖组成,这与刘金花等[15]从中国被毛孢发酵虫草菌丝体得到的HSP-1单糖组成类似(葡萄糖∶半乳糖∶甘露糖=4.522∶1∶1.378),但是检测到HSIPS2中含有核糖(1.63%),目前其他文献还没有报道,说明发酵后得到的HSIPS2是一种新型的多糖。
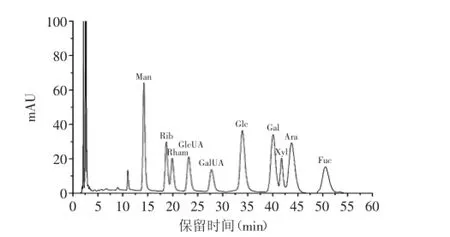
图3 10种单糖标准品的HPLC色谱图Fig.3 High-performance liquid chromatography of 10 standard monosaccharides
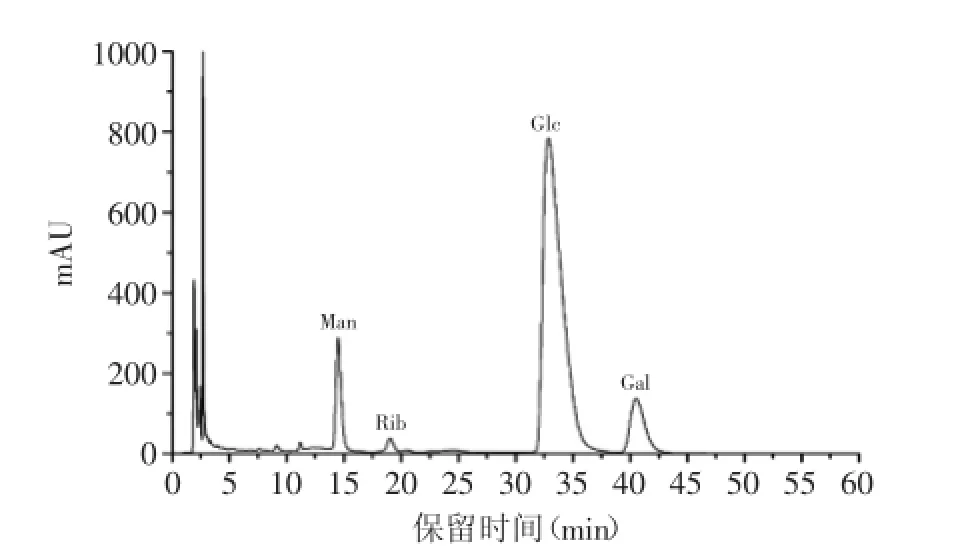
图4 HSIPS2的HPLC色谱图Fig.4 High-performance liquid chromatography of HSIPS2
2.3HSIPS2的分子量及链构象
如图5所示,样品峰出现在12~18 min之间,90°光散射和示差检测器RI所产生的峰形具有相似大小和形状,几乎完全重叠。并且显示多糖呈现单一对称峰,HSIPS2为均一性的纯多糖,而LS信号主峰前的小峰可能是由多糖部分团聚而引起,测得第二维利系数A2=1.0×10-4mol·mL/g2,A2>0,说明溶剂为良性溶剂[16]。同时,测得HSIPS2多糖纯度达到99.82%。此外,Mw/Mn表示样品的分散度,分子量分布越宽,分散度就越大[17]。仪器检测给出Mw/Mn的值为1.017,比较接近1,表明HSIPS2是一个低分散度的多糖,其分子量Mw= 1.463×104g/mol。均方旋转半径<S2>z1/2测得为0.5 nm,由于仪器无法测定<10 nm的粒子半径,所以给出的<S2>z1/2值不准确,需要以该分子的流体力学半径Rh= 2.3 nm来表征。
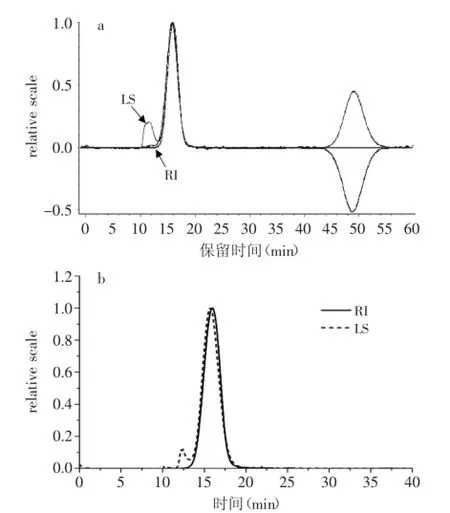
图5 HSIPS2的SEC-MALLS尺寸排阻色谱图Fig.5 SEC chromatogram of HSIPS2 detected by SEC-MALLS
Mark-Houwink方程([η]=KMwα)可以表示高分子在溶液中的特性粘度[η]与分子量Mw之间的关系[18]。由图6可知,以lg[η]对lgMw作图得到一条线性关系较好的直线,R2为0.9512,依据直线的斜率和截距求得K=9.67×10-3,α=0.67,从而建立HSIPS2多糖的Mark-Houwink方程[η]=9.67×10-3Mw0.67,根据参数α可推断出HSIPS2多糖在0.1 mol/L NaNO3溶液中的构象为柔顺链[19]。流体力学半径Rh与分子量Mw的关系Rh=KMwv可用于进一步推断多糖在溶液中的链形态[20]。由图7可知,以lgRh对lgMw作图得到一条线性直线,R2为0.9919,依据直线的斜率和截距求得K=1.16×10-2,ν值为0.56,根据参数ν同样推断出HSIPS2多糖在0.1 mol/L NaNO3溶液中的构象为柔顺链[19]。
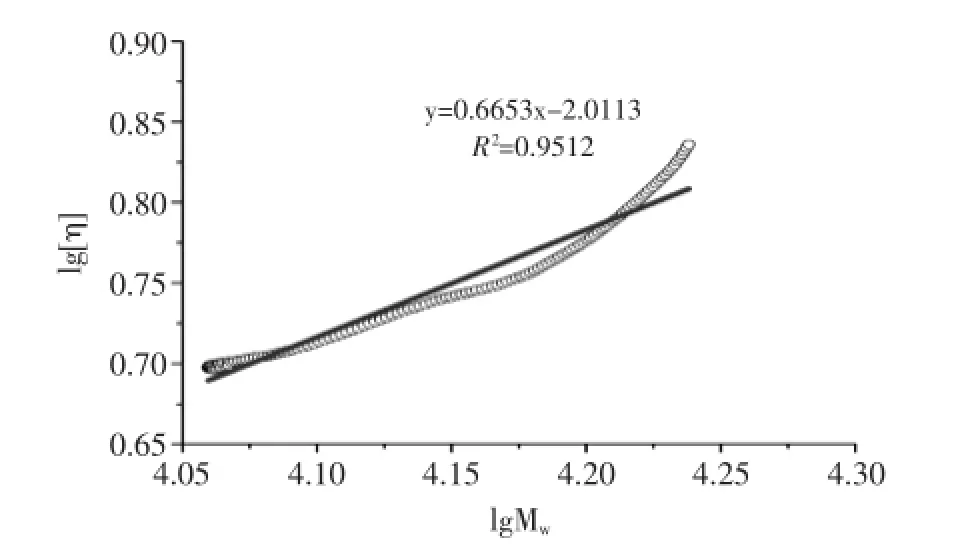
图6 lg[η]对lgMw的对数图Fig.6 Logarithmic plot of Mwvs[η]
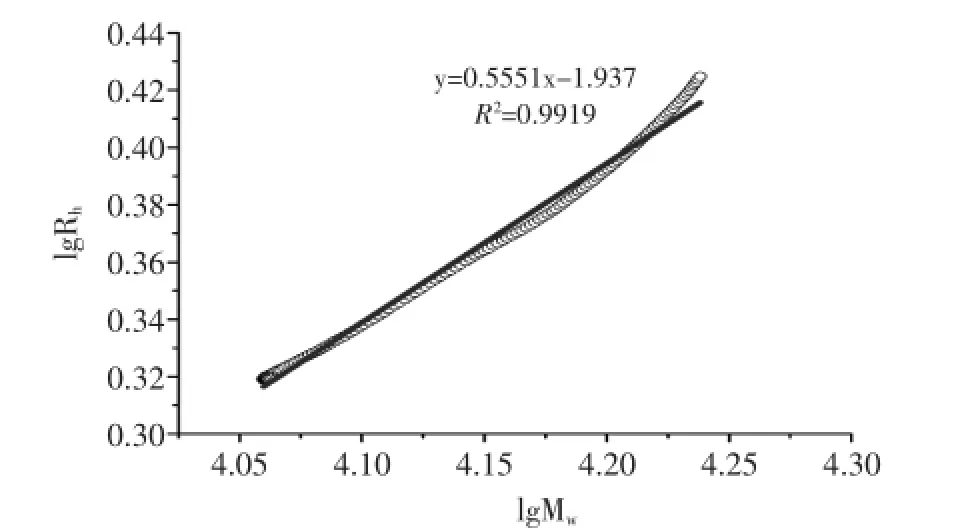
图7 lgRh对lgMw的对数图Fig.7 Logarithmic plot of Mwvs Rh
Yamakawa-Fujii-Yoshizaki(YFY)蠕虫链模型可用于计算分子链的刚性参数,参考Yang等[21]的方法,YFY模型关系可近似表达为:

B0为近似为常数,取值为1.05,A0可按下列公式计算:
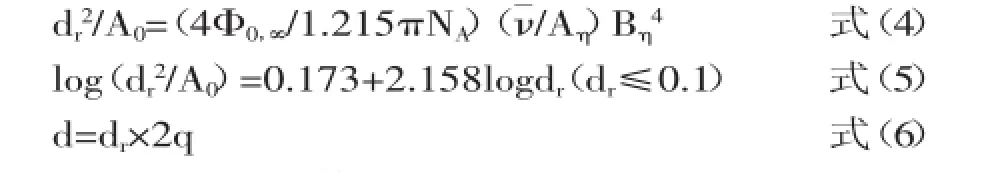
Φ∞,0为Flory常数,dr≤0.1时,Φ∞,0=2.86×1023,ν为偏微分比容0.68 cm3/g。
由图8可知,以(Mw2/[η])1/3对Mw1/2作一条关系曲线,得到Bohdanecký图。根据Bohdanecký图中的线性关系方程以及上述式(1)~式(6)公式可以计算得到刚性参数:ML=334.05 nm-1,q=0.70 nm,d=0.69 nm。ML值越大链的刚性越强,刚性链通常在500~2000 nm-1之间,因此,HSIPS2在0.1 mol/L NaNO3溶液中的构象为柔顺链,q=0.70 nm表明HSIPS2为无规则线团高分子链(0.5~1.0 nm),d=0.69 nm表明HSIPS2分子链为单链(<1 nm)[22]。
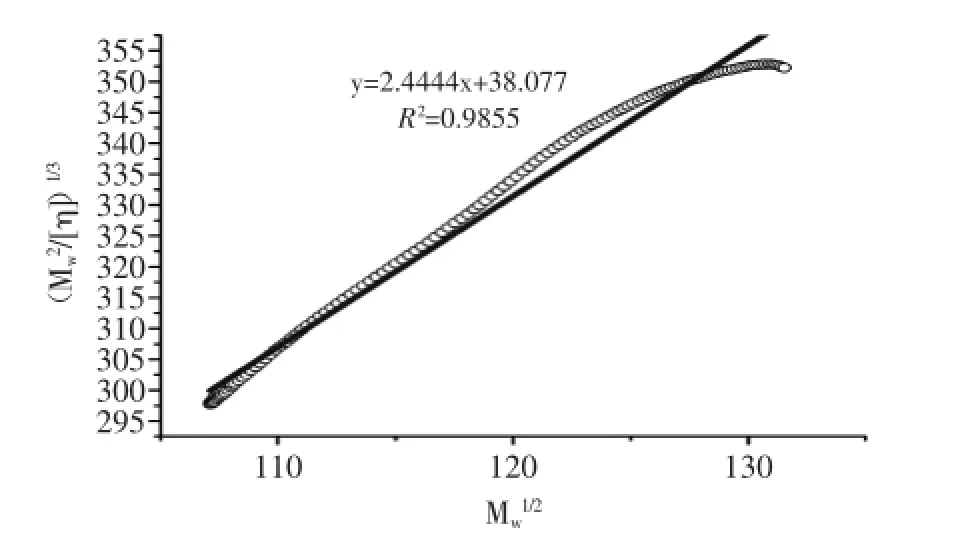
图8 HSIPS2的Bohdanecký图Fig.8 The Bohdanecký plot of HSIPS2
2.4抗氧化活性

图9 VC和HSIPS2对羟自由基的清除率Fig.9 Hydroxyl radical scavenging activity of VCand HSIPS2
2.4.1羟自由基清除率如图9所示,在0.2~1.0 mg/mL浓度范围内,随着浓度的增大,VC和HSIPS2对羟自由基的清除能力越强;当浓度为1.0 mg/mL时,VC和HSIPS2对羟自由基清除力大小分别为99.01%和74.68%,VC和HSIPS2清除羟自由基的IC50分别为0.291 mg/mL和0.749 mg/mL,HSIPS2对羟自由基的清除能力要比VC弱,但是与Liu等[23]从中国被毛孢发酵菌丝体中分离纯化得到的多糖HSP-1相比较,HSIPS2对羟自由基的清除能力要稍高于HSP-1(IC50为0.834 mg/mL)。
2.4.2氧自由基吸收能力(ORAC)图10为标准品Trolox在不同浓度下的相对荧光强度衰退曲线,图11 为HSIPS2在15 μg/mL时的相对荧光强度衰退曲线。Trolox系列标准液标准曲线线性方程为:y=1.0581x+ 4.0779,R2=0.9991。根据标准曲线线性方程计算得到,HSIPS2的ORAC值为872.80μmolTE/g,高于Wojcikowski等[24]测得虫草ORAC值(117.28 μmol TE/g)。
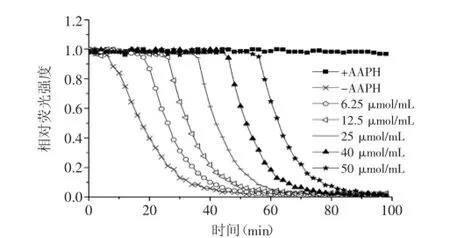
图10 不同浓度Trolox标准品荧光衰退曲线Fig.10 Fluorescence decay curve affected by different concentration of Trolox
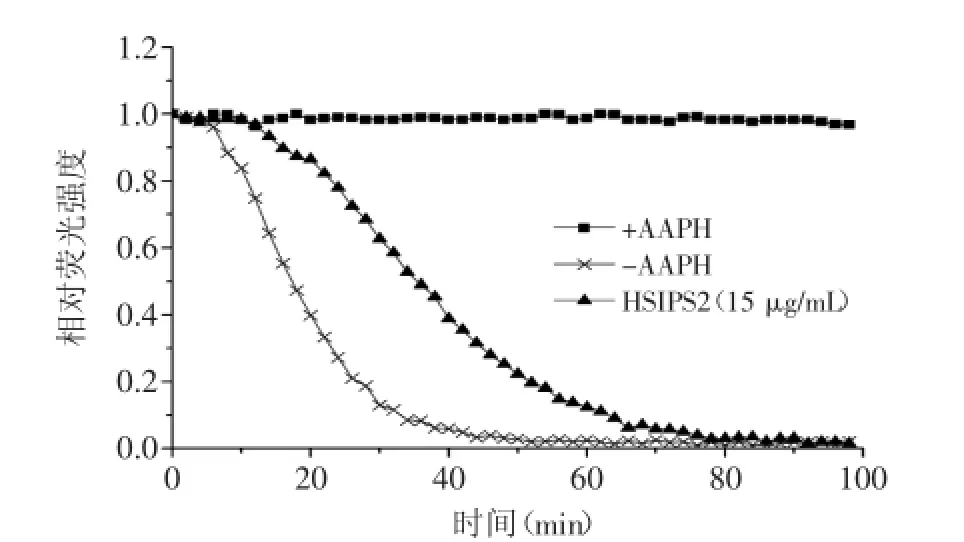
图11 HSIPS2多糖的荧光衰退曲线Fig.11 Fluorescence decay curve effected by HSIPS2
3 结论
发酵得到的中国被毛孢菌丝体经过提取分离及纯化后,得到新型多糖组分HSIPS2。HPLC测得HSIPS2单糖组成及摩尔比例为葡萄糖∶半乳糖∶甘露糖∶核糖=48.52∶6.58∶5.17∶1.0;采用静态光散射和动态光散射系统(SEC-MALLS)与在线差动式粘度计(ViscoStarTM II,Wyatt Technology,USA)联用,进行检测分析得知:HSIPS2分子量为1.463×104g/mol,纯度为99.82%,是一个低分散度,分子量较为均一的多糖;HSIPS2在0.1 mol/L的NaNO3溶液中呈柔顺链构象,构象参数:Rh=2.3 nm,ML=334.05 nm-1,q=0.70 nm,d=0.69 nm;同时,HSIPS2清除羟自由基的IC50为0.749 mg/mL,ORAC值为872.80 μmol TE/g,说明HSIPS2具有较高的体外抗氧化能力,多糖HSIPS2的高效活性可能受到其较低分子量、单糖组成和链构象的影响,但其机理尚未清楚。总之,HSIPS2可以开发为一种新的抗氧化添加剂应用到食品、化妆品和药品等行业。
[1]赵锦,李泰辉.冬虫夏草无性型的分子鉴别[J].中山大学学报:自然科学版,1999,38(1):121-123.
[2]李增智,黄勃,李春如,等.确证冬虫夏草无性型的分子生物学证据1.中国被毛孢与冬虫夏草之间的关系[J].菌物系统,2000,19(1):60-64.
[3]蒋毅,姚一建.冬虫夏草无性型研究概况[J].菌物系统,2003,22(1):161-176.
[4]谢明勇,聂少平.天然产物活性多糖结构与功能研究进展[J].中国食品学报,2010,10(2):1-11.
[5]Yan J K,Wang W Q,Wu J Y.Recent advances in Cordyceps sinensispolysaccharides:Mycelialfermentation,isolation,structure,and bioactivities:A review[J].Journal of Functional Foods,2014,6:33-47.
[6]刘金花,李富奎,贾得儒,等.中国被毛孢发酵虫草菌丝体多糖的提取,纯化及其理化性质[J].食品与发酵工业,2014,40 (3):222-226.
[7]丁婷,邵颖,樊美珍.中国被毛孢发酵液中一种镇静催眠活性物质的分离纯化和结构鉴定[J].菌物学报,2008,27(6):956-963.
[8]He L,Cheng J W,Wang Y B,et al.Statistics-based optimization of extracellular polysaccharide production from Hirsutella sinensis using a fermentation process and in vitro immunomodulatory activity[J].Food Science and Biotechnology,2014,23(2):451-457.
[9]王蕾,于荣敏,张辉,等.人工培养蛹虫草多糖的分离纯化及其结构的初步研究[J].中国生化药物杂志,2003,24(1):23-25.
[10]Dai J,Wu Y,Chen S,et al.Sugar compositional determination of polysaccharides from Dunaliella salina by modified RP-HPLC method of precolumn derivatization with 1-phenyl-3-methyl-5-pyrazolone[J].Carbohydrate Polymers,2010,82(3):629-635.
[11]Wu D T,Meng L Z,Wang L Y,et al.Chain conformation and immunomodulatory activity of a hyperbranched polysaccharide from Cordyceps sinensis[J].Carbohydrate Polymers,2014,110:405-414.
[12]Rau U,Müller R J,Cordes K,et al.Process and molecular data of branched 1,3-β-D-glucans in comparison with Xanthan [J].Bioprocess Engineering,1990,5(2):89-93.
[13]Mao G,Zou Y,Feng W,et al.Extraction,preliminary characterization and antioxidant activity of Se-enriched Maitake polysaccharide[J].CarbohydradePolymer,2014,101(30):213-219.
[14]Hua Y,Yang B,Tang J,et al.Structural analysis of watersoluble polysaccharides in the fruiting body of Dictyophora indusiata and their in vivo antioxidant activities[J].Carbohydrate Polymers,2012,87(1):343-347.
[15]刘金花,李富奎,贾得儒,等.中国被毛孢发酵虫草菌丝体多糖的提取,纯化及其理化性质[J].食品与发酵工业,2014,40 (3):222-226.
[16]季志超.基于临界胶束浓度控制的“假高稀法”高效合成环状嵌段共聚物及其性能研究[D].苏州:苏州大学,2014.
[17]伊芳,郭丽,杜先锋.SEC-MALLS-RI体系测定魔芋胶分子结构特性的研究[J].安徽农业科学,2011,39(36):22585-22588.
[18]Chen C,Wu W,Xu X,et al.Chain conformation and antitumor activity of derivatives of polysaccharide from Rhizoma Panacis Japonici[J].Carbohydrate Polymers,2014,105:308-316.
[19]Wei C,Li W,Shao S,et al.Structure and chain conformation of a neutral intracellular heteropolysaccharide from mycelium of Paecilomyces cicadae[J].Carbohydrate Polymers,2016,136:728-737.
[20]许淑琴.黑木耳刚性链葡聚糖结构,链构象转变及自组装行为[D].武汉:武汉大学,2013.
[21]Yang L,Zhang L M.Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources[J].Carbohydrate Polymers,2009,76
[22]邵丽.产胞外多糖乳杆菌的筛选及其多糖的分离,结构和生物活性研究[D].无锡:江南大学,2015.
[23]Liu J H,Wang Z J,Wang Y,et al.Structural Elucidation and Antioxidant Activity of a Polysaccharide from Mycelia Fermentation of Hirsutella sinensis Isolated from Ophiocordyceps sinensis[J].Journal of Bioprocessing&Biotechniques,2014,4 (7):1.
[24]Wojcikowski K,Stevenson L,Leach D,et al.Antioxidant capacity of 55 medicinal herbs traditionally used to treat the urinary system:a comparison using a sequential three-solvent extractionprocess[J].TheJournalofAlternative and Complementary Medicine,2007,13(1):103-110.
Chain conformation and antioxidant activity of a novel intracellular polysaccharide HSIPS2 from Hirsutella sinensis
SHAO Shuang-shuang1,HE Liang2,WEI Chao-yang1,LI Wei-qi1,*
(1.College of Life Sciences,Zhejiang University,Hangzhou 310058,China;2.Institute of Biological Technology,Zhejiang Forestry Academy,Hangzhou 310023,China)
A novel intracellular polysaccharide,named HSIPS2,from Hirsutella sinensis was obtained by hot water extraction and alcohol precipitation,and then purified using DEAE-Sepharose Fast Flow chromatography and Sephacryl S-100 gel column chromatography.Its chain conformation and antioxidant activity were determined. The result showed that HSIPS2 was composed of glucose,galactose,mannose,and ribose with a molar ratio of 48.52∶6.58∶5.17∶1.0.It was proved to be a novel lower dispersion polysaccharide with uniform molecular of 1.463×104g/mol,and the purity was 99.82%.In 0.1 mol/L NaNO3aqueous solution,HSIPS2 existed as flexible chain conformation.The parameters of Rh,ML,q and d were 2.3 nm,334.05 nm-1,0.70 nm,and 0.69 nm respectively. Moreover,the IC50of its hydroxyl radical scavenging activity was identified to be 0.749 mg/mL and the value of ORAC was calculated to be 872.80 μmol TE/g.Hence,it was undoubtedly demonstrated that HSIPS2 exhibited potent antioxidant activity.
Hirsutella sinensis;polysaccharide;chain conformation;ORAC
TS201.2
A
1002-0306(2016)04-0200-06
10.13386/j.issn1002-0306.2016.04.032
2015-08-24
邵双双(1990-),女,硕士研究生,研究方向:微生物学,E-mail:shaoshuanger@sina.com。
李卫旗(1964-),男,博士,副教授,研究方向:天然产物加工,E-mail:liweiqi2014@sina.com。
浙江省科技攻关项目(2012C12004-4);浙江省科技计划项目(2014C32085)。
