响应面法优化蛹虫草菌丝液体发酵产虫草素培养基
2016-09-14赵玉卉韩融冰路等学甘肃省科学院生物研究所甘肃兰州730000
秦 鹏,王 龙,赵玉卉,韩融冰,路等学(甘肃省科学院,生物研究所,甘肃兰州730000)
响应面法优化蛹虫草菌丝液体发酵产虫草素培养基
秦 鹏,王 龙,赵玉卉,韩融冰,路等学*
(甘肃省科学院,生物研究所,甘肃兰州730000)
探究利用响应面法优化蛹虫草液体发酵产虫草素的条件,以提高虫草素积累量。以虫草素积累量为指标,同时测定对应的菌丝体产率,利用Plackett-Burman实验筛选影响虫草素积累量的关键因素,再以最陡爬坡实验逼近最大虫草素积累量响应区域,最后应用Box-Behnken方法优化培养基;对虫草素积累量和对应的菌丝体产率数据进行相关性分析。结果表明:在25℃,无光照,160 r/min,pH自然,5 mL/100 mL接种量,优化培养基为:KNO30.04 g/100 mL,酵母浸膏1.50 g/100 mL,FeSO4·7H2O 0.03 g/100 mL,KH2PO40.2 g/100 mL,葡萄糖3.82 g/100 mL,ZnSO4·7H2O 0.06 g/100 mL,MgSO4·7H2O 0.13 g/100 mL,维生素B10.08 g/100 m,虫草素积累量达到852.621 μg/mL;在同等条件下,利用优化培养基发酵8 d+静置10 d后,虫草素积累量达到936.225 μg/mL。在本实验多组分的条件下,菌丝体产率小于0.857 g/100 mL时,虫草素生成的效率较高,而菌丝体产率大于1.703 g/100 mL时,虫草素积累量开始下降;发酵第8 d虫草素积累量和菌丝体产率存在极显著相关关系。
响应面,蛹虫草,液体发酵,虫草素,菌丝体
虫草素(cordycepin)即3’-脱氧腺苷(3’-deoxyadenosine),属嘌呤类生物碱,有抗肿瘤[1-2]、抑菌抗炎和提高免疫力等功效[3-4],疗效显著,但化学合成难度大,使其国际市场上的价格很高。虫草素主要
通过蛹虫草培养物中获得,而天然冬虫夏草子实体不含虫草素,其菌丝体发酵液中含极少量的虫草素[5]。蛹虫草菌丝体将90%以上的虫草素分泌到培养基中[6],液体发酵产虫草素具有周期短、发酵过程易控制等优点,液体发酵培养基对提高虫草素产率至关重要,雷坤等用优化培养基进行液体发酵产虫草素的研究,产率比优化前提高124%[7],蔡水淋等用响应面法优化液体培养基,虫草素产率较优化前提高108.3%[8];研究报道遮光[9]、摇床+静置两段培养[10]能显著提高虫草素积累量,本研究采用遮光培养方式,实验亦证实摇床+静置培养方式能提高虫草素积累量。虽然虫草素的研究有很多进展,但虫草素的产率和生产成本一直都是虫草素工业化生产的瓶颈。因此,本实验对蛹虫草液体发酵产虫草素培养基进行优化并进一步实验明确发酵第8 d虫草素积累量和菌丝体产率之间的关系,为提高虫草素产率、降低生产成本提供新的研究思路和实验依据。
1 材料与方法
1.1 材料与仪器
蛹虫草菌 购自中科院微生物研究所菌种保藏中心;虫草素标准品 中国药品生物制品检定所;甲醇 色谱纯,德国默克公司;KNO3、酵母浸膏、ZnSO4· 7H2O、KH2PO4、MgSO4·7H2O、FeSO4·7H2O、葡萄糖、维生素B1市售分析纯;水 市售纯净水。
SPJ-150生化培养箱 上海君竺仪器制造有限公司;HZQ-QX卧式空气恒温摇床 北京东联哈尔仪器制造有限公司;Waters 1525高效液相色谱仪,配二极管阵列检测器(2998 PDA)和在线脱气机 美国Waters公司;0.22 μm有机相过滤器 上海密粒膜分离技术有限公司;ELGA MK2超纯水器 北京格瑞恩科技发展有限公司;微波炉 美的集团。
1.2 实验方法
1.2.1 培养基与培养方法 斜面培养基、平皿培养基:营养琼脂。种子培养基:市售纯净水。初始培养基:葡萄糖2.5 g/100 mL,酵母浸膏1 g/100 mL,市售纯净水。液体发酵培养基:市售纯净水。培养基初始pH均为自然,121℃灭菌30 min。
斜面菌种活化三次后转接到平皿培养基,20℃黑暗条件下培养9 d,用打孔器取同一半径上相同大小(约3 mm)的6个菌块,分别转接到平皿培养基中,置于5、10、15、20、25、30℃下黑暗培养9 d。
斜面菌种活化三次后转接到装种子培养基的100 mL/250 mL三角瓶中,置摇床160 r/min,25℃黑暗培养3 d制成种子悬液,以5 mL/100 mL接种量将种子悬液接入液体发酵培养基,于160 r/min、25℃黑暗条件下置摇床培养8 d。
1.2.2 虫草素的提取与菌丝体产率的测定 微波提取方法:将发酵菌悬液用微波提取(700 W,1 min)后于三层纱布过滤,收集滤液,用于胞内与胞外总虫草素的测定,该方法经实验后确定。
HPLC法测定虫草素条件:Zorbax SB C18柱(4.6 mm×250 mm,5 μm),流动相为甲醇/水(15∶85);流速1 mL/min;柱温35℃;进样量20 μL;检测波长260 nm,该方法由参考文献[11]并实验后确定;同时,将过滤得到的菌丝体置于烘箱中,于80℃下烘干至恒重,用于菌丝体产率的测定。
1.2.3 培养温度的确定 对每个温度下的菌落直径测量三次,测量的夹角为60度,取均值作为温度对菌株影响的指标,每个温度实验重复3次。
1.2.4 Plackett-Burman实验设计 通过参考相关研究[12-16]并进行了单因素实验,确定了Plackett-Burman实验设计因素的水平,因素水平见表1。采用n=12的Plackett-Burman实验设计对影响虫草素积累量的8个因素进行研究,同时测定对应的菌丝体产率,实验重复3次。

表1 Plackett-Burman实验设计因素水平Table1 Levels of factors for Plackett-Burman design
1.2.5 最陡爬坡实验 Plackett-Burman实验设计筛选出3个关键因素,利用最陡爬坡实验逼近虫草素积累量最大值响应区域,明确95%置信水平下的关键因素的设计中心点,关键因素质量浓度依效应值大小确定,爬坡方向为虫草素积累量增加的方向,同时测定了对应的菌丝体产率。其他5个因素依正效应的取高水平质量浓度,负效应的取低水平质量浓度,最陡爬坡实验设计水平见表2。

表2 最陡爬坡实验设计Table2 Experimental design of steepest ascent method
1.2.6 Box-Behnken实验设计 依据Box-Behnken实验设计原理,设计3因素3水平响应面实验,以最大虫草素积累量为响应目标,3因素水平见表3,同时测定
了对应的菌丝体产率。
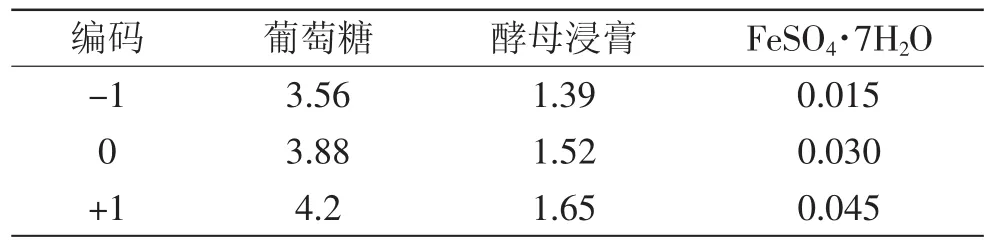
表3 Box-Behnken实验设计因素水平Table3 Levels and factors of Box-Behnken design
1.2.7 发酵第8 d虫草素积累量和菌丝体产率相关性分析 对以上实验得到的32对虫草素积累量与菌丝体产率进行相关性分析。将32个虫草素积累量、菌丝体产率从大到小排序,探求两者的相关性。
1.3 数据处理
温度对菌株影响的实验结果用均值±标准差表示,绘图软件采用Oringin,数据处理软件采用SPSS的LSD多重检验法;Plackett-Burman实验设计软件采用Minitab,Box-Behnken响应面设计软件采用Design-Expert;相关性分析实验的排序、绘图和相关性检验软件采用SPSS。
2 结果与讨论
2.1 适宜培养温度
图1反映了菌株在不同温度下的生长情况。25℃为适宜温度,优于其他组(p<0.01),随温度增加,菌落直径先增长达到最大值后急剧下降,30℃为菌株的致死温度。

图1 温度对菌株的影响Fig.1 The effect of temperature on strain
2.2 培养基优化
2.2.1 Plackett-Burman实验 每个因素分别取高(+1)低(-1)两个水平,根据本研究前期Plackett-Burman实验的结论,高低水平浓度比约为1.25倍时只筛选出一个因素,故将比值增至1.5倍,结果显示1.5倍为适宜的高低水平比,Plackett-Burman实验设计水平见表1,实验结果及分析见表4。拟合模型的p= 0.029,R2为0.9723,故用该模型模拟实验是可靠可信的。结果显示:对因素予以高低水平处理筛选出3个关键因素,依次为X7>X2>X6,以虫草素积累量增加为目标,高水平比低水平质量浓度对虫草素积累量影响更大的因素依次为X7>X2>X4>X5>X3,而低水平质量浓度有较大影响的因素依次为:X6>X8>X1。
2.2.2 最陡爬坡实验 最陡爬坡实验和响应面设计优化参数是实验设计中非常实用的技术[17]。最陡爬坡实验设计见表2,X7、X2、X4、X5、X3分别取高水平质量浓度,X6、X8、X1分别取低水平质量浓度,缩小X7、X2、X6高低水平质量浓度差后再确定适宜的步长,进行最陡爬坡实验,爬坡方向为虫草素积累量的增长方向。1~5组的虫草素积累量分别为为:552.235、566.857、626.025、835.679、685.101 μg/mL,对应的菌丝体产率依次为:0.183、0.189、0.945、1.801、1.112 g/100 mL,虫草素积累量在第4组达到极大值,故以第4组为响应面设计的中心点。
2.2.3 响应面法实验 采用N=15的Box-Behnken方法设计实验,其中12个析因点,其他3个中心点用于估计误差,因素水平见表3,实验设计及结果见表5,编码的回归模型如下所示。Y=835.12-7.78X7-3.03X2-11.28X6+3.62X7X2+2.32X7X6+2.67X2X6-22.05X-15.29X-23.48X
以表5误差和实验值的比率作统计,误差比率均在0.1%以下,证实该模型预测的可靠性。方差分析见表6。结果显示:回归模型R2为0.9996,说明模型可以真实反映99.96%的实验数据,矫正决定系数R2Adj为0.9989,说明在消除自由度影响的前提下,仅有0.11%的变异不能被该模型解释。模型失拟项p=0.9307大于0.05,说明在三个中心点实验中,虫草素积累量的均值和X7、X2、X6存在线性关系,可将误差平方和、失拟平方和合并为残差平方和以便检验模型显著性。模型p值小于0.01,接受回归系数不全为零的备择假设,回归模型拟合较好。因此,在本实验条件下,该模型是可信的,可以很好的预测和分析虫草素积累量的变化。

表4 Plackett-Burman实验设计及结果分析Table4 Design and results of analysis of Plackett-Burman design

表5 Box-Behnken实验设计及结果Table5 Results of Box-Behnken design

表6 响应面回归分析Table6 Analysis of variance for response surface design
图2~图4是固定回归模型中X2、X6、X7其中一个因素值后,Y(虫草素积累量)关于另外两个因素的回归模型而绘制的3D曲面图。在X7、X2、X6的取值区间内,虫草素积累量存在极大值点,固定值分别为3.88、1.52、0.03 g/100 mL。从图上的等高线图可以看出,最陡爬坡实验确定的响应面设计中心点已经比较接近最大响应值区域,曲面的陡峭程度反映了因素间交互作用的大小,图2曲面较其他陡峭,X2、X7交互作用明显于其他。

图2 Y=f(X2,X7)的响应面Fig.2 Response surface plot of Y=f(X2,X7)

图3 Y=f(X6,X7)的响应面Fig.3 Response surface plot of Y=f(X6,X7)
2.2.4 优化培养基及模型验证 分别对X7、X2、X6求一阶偏导,联立方程可求得虫草素积累量最大时X7、X2、X6的质量浓度:葡萄糖3.82%,酵母浸膏1.50%,七水合硫酸亚铁0.03%,模型预测值为837.580 μg/mL,验证值为852.621 μg/mL,与预测值的误差为1.79%。在25℃、无光照、160 r/min,初始培养基中发酵8 d作为对照组,对照组虫草素产率为457.906 μg/mL,优化
培养基的虫草素积累量比对照提高86.2%。

图4 Y=f(X6,X2)的响应面Fig.4 Response surface plot of Y=f(X6,X2)
利用优化培养基再进行摇床培养8 d+静置培养10 d,虫草素产率达到936.225 μg/mL,比对照组和优化培养基的虫草素积累量分别提高了104.5%和9.8%。优化培养基组分为:葡萄糖3.82%,酵母粉1.50%,七水合硫酸亚铁0.03%,KH2PO40.2%,KNO30.04%,ZnSO4· 7H2O 0.06%,MgSO4·7H2O 0.13%,维生素B10.08%。
2.3 虫草素积累量与菌丝体产率相关性实验
按菌丝体产率升序排列后(见图5),虫草素积累量亦呈上升趋势,相对于菌丝体产率,虫草素积累量的增速较为缓和;菌丝体产率小于0.857 g/100 mL时,菌丝体促进虫草素的效率较高,菌丝体产率高于1.703 g/100mL时,虫草素积累量开始降低。因此,在复杂组分的实验条件下,低菌丝体产率的培养基促进虫草素的效率较高。

图5 发酵第8 d的虫草素积累量与菌丝体产率变化Fig.5 Changes of cordycepin and mycelium by cordyceps militaris at 8th day
经分析,原因可能为较多的菌丝体产率在发酵前期对底物消耗更多,而虫草素的大量合成在发酵第6 d,在虫草素大量合成期,营养组分已经消耗殆尽,虫草素的合成受到影响;此外,另一个原因可能是菌丝体产率越高,对液体培养基中水分的消耗越大,培养基中菌丝体胞外水份越少,菌丝体产生虫草素后直接分泌到胞外,而虫草素不再被吸收,胞外虫草素质量浓度达到饱和,抑制了菌丝体合成和分泌虫草素。
经SPSS相关性检验:发酵第8 d虫草素积累量和菌丝体产率在0.01显著性水平下存在相关关系,说明在本实验条件下,利用菌丝体产率可以间接地预测虫草素积累量的变化趋势,有利于减少生产成本。
2.4 讨论
虫草素分子由一个腺嘌呤基团和一个3’脱氧五碳糖基团构成,虫草素的分子结构、腺嘌呤核苷、脱氧腺嘌呤核苷和ATP类似,腺嘌呤核苷酸的合成代谢途径为从头合成和补救合成,从头合成为主要的途径,虫草素的合成机理尚不明确,其合成途径是否与腺嘌呤核苷酸的相似或者虫草素只是腺嘌呤核苷酸合成的副产物,目前,文献报道证实腺嘌呤、腺苷为虫草素合成的前体物质。此外,虫草素对于蛹虫草菌的意义方面的研究很少,文献报道真菌激发子可以提高虫草素产率[18],是否因为其他真菌的加入激活了某些免疫反应而促进虫草素合成和分泌,这方面的研究将对虫草素积累量的提高产生较好的意义。
对于蛹虫草液体发酵产虫草素,研究报道胞外的虫草素积累量占总量的70%以上,菌丝体含量很少[19]。而不同液体培养方式对虫草素积累量的影响也很大[20-21],静置培养较摇床培养产虫草素效率高,本实验较低菌丝体产率有利于虫草素的积累结果亦间接支持了上述结论;对于培养基组分,虫草素的合成前体[22-23]、激发子等能较大程度的促进虫草素的合成,NH4+离子亦能显著地促进虫草素的合成[24],硫酸亚铁能调节基因转录水平,从而提高虫草素合成,而本实验结果显示FeSO4·7H2O低浓度对虫草素积累量的影响较大,Fan等的实验的亚铁离子的添加量与本实验相近[25],但本实验所用组分中的硫酸根离子质量浓度较高,据此推测,高质量浓度的硫酸根离子抑制了虫草素生成。此外,国内液体发酵产虫草素的产量较低,不同菌株液体发酵产虫草素的产量不同,但一般在1 g/L以下[26],利用本实验优化的培养基生产得到虫草素积累量接近1 g/L,且8种培养基组分价格低,而且,在本实验多组分培养基条件下,虫草素积累量和菌丝体产率呈极显著相关关系,故可用菌丝体产率作为间接指标预测虫草素积累量变化趋势,有利于生产成本的控制。
3 结论
本实验的条件为:25℃,无光照,160 r/min,pH自然,液体发酵培养8 d;经Plackett-Burman实验筛选出三个关键因素,葡萄糖、酵母浸膏和FeSO4·7H2O,前两个组分的高质量浓度对虫草素积累量的影响较大,FeSO4·7H2O低质量浓度影响较大;经优化后的培养基为:葡萄糖3.82%,酵母浸膏1.50%,七水合硫酸亚铁0.03%,KH2PO40.2%,KNO30.04%,ZnSO4·7H2O 0.06%,MgSO4·7H2O 0.13%,维生素B10.08%,经摇床发酵8 d+静置培养10 d后,虫草素积累量达到936.225 μg/mL。在本实验复杂组分的条件下,菌丝体产率小于0.857 g/100mL时,菌丝体促进虫草素的效率较高,菌丝体产率高于1.703 g/100mL时,虫草素积累量开始降低,因此,较低菌丝体产率促进虫草素分泌,较高菌丝体产率抑制虫草素的分泌。
[1]Lin Y W,Chiang B H.Anti-tumor activity of the fermentation broth of Cordyceps militaris cultured in the medium of Radix
astragali[J].Process Biochemistry,2008,43(3):244-250.
[2]Chen Y,Yang S H,Hueng D Y,et al.Cordycepin induces apoptosis of C6 glioma cells through the adenosine 2A receptorp53-caspase-7-PARP pathway[J].Chemico-Biological Interactions,2014,216(5):17-25.
[3]Lee J H,Hong S M,Yun J Y,et al.Anti-cancer effects of cordycepin on oral squamous cell carcinoma proliferation and apoptosisinvitro[J].Journal of Cancer Therapy,2011,(2):224-234.
[4]Ren Z H,Cui J H,Huo Z R,et al.Cordycepin suppresses TNF-α-induced NF-κB activation by reducing p65 transcriptional activity,inhibiting IκBα phosphorylation,and blocking IKKγ ubiquitination[J].International Immunopharmacology,2012,14 (4):698-703.
[5]DONG Caihong,YAO Yijian.Comparison of some metabolites among cultured mycelium of medicinal fungus Ophiocordyceps sinensis(Ascomycetes)from different geographical regions[J].International Journal of Medicinal Mushrooms,2010,12(3):287-297.
[6]Masuda M,Urabe E,Sakurai A,et al.Production of cordycepin by surface culture using the medicinal mushroom Cordyceps militaris [J].Enzyme and Microbial Technology,2006,39(4):641-646.
[7]雷坤,柯轶,毛宁.蛹虫草Fjnu-01高产虫草素的液体培养基优化[J].药物生物技术,2011,18(6):504-508.
[8]蔡水淋,郑永标,王明兹,等.响应面法优化蛹虫草深层培养产菌丝及虫草素的发酵工艺[J].农产品加工(学刊),2013,(6):13-18,21.
[9]温鲁.提高蛹虫草培养物中虫草素含量的研究[J].江苏农业科学,2005(6):118-120.
[10]Shih I L,Tsai K L,Hsieh C.Effects of culture conditions on the myceliuml growth and bioactive metabolite production in submerged culture of Cordyceps militaris[J].Biochemical Engineering Journal,2007,33(3):193-201.
[11]钟思敏,杜梅,陈往滨,等.蛹虫草菌丝产虫草素液体培养条件的研究[J].菌物学报,2011,30(2):229-234.
[12]岳翠翠,沈健增,蔡宇杰,等.蛹虫草Cordyceps militaris JN168产虫草素液态发酵条件的优化[J].食品与生物技术学报,2013,32(2):135-141.
[13]汤佳鹏,柳依婷.蛹虫草静置发酵产虫草素的优化[J].食品工业科技,2013,34(20):225-229,245.
[14]阮元,马进川,薛元,等.维生素B_1、B_6和生长激素2,4-D对蛹虫草液体发酵虫草素产量的影响[J].菌物学报,2014,33 (2):477-482.
[15]Das S K,Masuda M,Hatashita M,et al.A new approach for improving cordycepin productivity in surface liquid culture of Cordyceps military is using high-energy ion beam irradiation[J].Letters in Applied Microbiology,2008,47(6):534-538.
[16]Das S K,Masuda M,Hatashita M,et al.Optimization of culture medium for cordycepin production using Cordyceps militaris mutant obtained by ion beam irradiation[J].Process Biochemistry,2010,(45):129-132.
[17]Joyce A P,Leung S S.Use of response surface methods and path of steepest ascent to optimize ligand-binding assay sensitivity [J].Journal of Immunological Methods,2013,392(1-2):23-23.
[18]步岚,朱振元,梁宗琦,等.真菌激发子对提高蛹虫草虫草菌素的作用[J].菌物系统,2002,21(2):252-256.
[19]王蕾,罗巍,胡瑕,等.虫草素高产菌株的筛选及不同添加物对虫草素产量的影响研究[J].菌物学报,2012,31(3):382-388.
[20]Hung L T,Keawsompong S,Hanh V T,et al.Effect of temperature on cordycepin production in Cordyceps militaris[J].Thai Journal of Agricultural Science,2009,42(4):219-225.
[21]Shih I L,Tsai K L,Hsieh C Y.Effects of culture conditions on the myceliuml growth and bioactive metabolite production in submerged culture of Cordyceps militaris[J].Biochemical Engineering Journal,2007(33):193-201.
[22]康超,文庭池,康冀川,等.不同培养条件和前体对蛹虫草液体发酵产虫草素的影响[J].菌物学报,2012,31(3):389-397.
[23]文庭池,康冀川,雷帮星,等.前体及营养物提高蛹虫草虫草菌素产量的研究[J].食品科学,2010,31(5):175-179.
[24]MAO Xianbing,ZHONG Jianjiang.Significant effect of NH4+on cordycepin production by submerged cultivation of medicinal mushroom Cordyceps militaris[J].Enzyme and Microbial Technology,2006,38(3-4):343-350.
[25]FAN Dandan,WANG Wei,ZHONG Jianjiang.Enhancement of cordycepin production in submerged cultures of Cordyceps militaris by addition of ferrous sulfate[J].Biochemical Engineering Journal,2012,60:30-35.
[26]刘艳芳,唐庆九,顾俊杰,等.北冬虫夏草深层发酵高产虫草素工艺的优化[J].上海农业学报,2010,26(3):26-30.
Liquid fermentation media for promoting cordycepin production by Cordyceps militaris mycelium using response surface methodology
QIN Peng,WANG Long,ZHAO Yu-hui,HAN Rong-bing,LU Deng-xue*
(Institute of Biology,Gansu Academy of Sciences,Lanzhou 730000,China)
Liquid fermentation media was optimized for promoting the yield of cordycepin by cordyceps militaris mycelium using response surface methodology and the corresponding yield of mycelium were measured.Firstly,factors playing important roles in the cordycepin production were selected based on Plackett-Burman design.Then the path of steepest ascent was undertaken to approach the optimal region of the cordycepin production.Finally,the optimal levels of those main factors were further optimized by using Box-Behnken design.All above experiments were repeated to analize the correlation between cordycepin and mycelium production.Fermentation conditions were temperature 25℃,dark,rotation speed 160 r/min,natural pH,inoculating amount 5 mL/100 mL.Optimal media was KNO30.04 g/100 mL,yeast extract 1.50 g/100 mL,FeSO4·7H2O 0.03 g/100 mL,KH2PO40.2 g/100 mL,Glucose 3.82 g/100 mL,ZnSO4·7H2O 0.06 g/100 mL,MgSO4·7H2O 0.13 g/100 mL,Vitamin B10.08 g/100 mL.Cordycepin production reached 852.621 μg/mL.Then,using the optimal media on the same conditions,cordycepin production was optimized with 8 days'shaking-flask and 10 days'static culture and reached 936.225 μg/mL.The results of relationship between the yield of cordycepin and mycelium showed that when the yield of mycelium was less than 0.857 g/100 mL,it was more efficient that mycelium produced cordycepin.When the yield of mycelium was more than 1.708 g/100mL,the yield of cordycepin started descending.Production of cordycepin and mycelium at 8th day had significant correlations.
response surface method;cordyceps militaris;liquid fermentation;cordycepin;mycelium
TS201.3
A
1002-0306(2016)08-0185-06
10.13386/j.issn1002-0306.2016.08.030
2015-07-24
秦鹏(1984-),男,硕士,助理研究员,研究方向:食(药)用蕈菌学,E-mail:kingkerberos@163.com。
*通讯作者:路等学(1962-),男,硕士,高级工程师,研究方向:食用蕈菌学,E-mail:ludengxue@126.com。
甘肃省科学院青年科技创新基金项目(2014QN-07);甘肃省科学院与中科院合作项目(2012HZ-02)。
