蛋白橘皮果胶胶体制备、表征及对红景天苷体外释放研究
2016-09-14彭海龙胡振瀛宁方建余宁翔朱雯婷刘文强南昌大学食品科学与技术国家重点实验室江西南昌330047南昌大学化学工程系江西南昌33003
陈 莎,彭海龙,2,*,胡振瀛,宁方建,余宁翔,朱雯婷,刘文强,熊 华(.南昌大学食品科学与技术国家重点实验室,江西南昌330047;2.南昌大学化学工程系,江西南昌33003)
蛋白橘皮果胶胶体制备、表征及对红景天苷体外释放研究
陈 莎1,彭海龙1,2,*,胡振瀛1,宁方建1,余宁翔1,朱雯婷1,刘文强1,熊 华1
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047;2.南昌大学化学工程系,江西南昌330031)
以牛血清蛋白与橘皮果胶为原料,采用安全无毒的自组装技术制备缓释水凝胶,并以制备过程中两种原料配比、蛋白浓度与pH进行三因素三水平对凝胶粒径影响的响应面分析。在此基础上,重点研究显著因子添加橘皮果胶比例对蛋白成胶的影响,并结合利用流变、圆二、扫描电镜对其进行表征。以红景天苷为模型检测其包封效果和体外释放,结果表明:橘皮果胶和牛血清蛋白比例为0.5和pH为4.5时加热粒径达到最小259.5 nm,尺寸分布较窄(PDI<0.06),形成良好稳定的三维网络结构水凝胶;红景天苷包封率达到49.88%,在模拟胃肠溶液中具有缓释效果。本研究的水凝胶可作为红景天苷以及其他功能性食品的潜在输送载体。
牛血清蛋白,橘皮果胶,自组装,水凝胶,缓释
水凝胶因独特的三维网状结构,具备良好的渗透性,能够有效提高载药量和生物半周期和稳定性等,在药物释放领域受到极大关注[1-2]。蛋白质富含形成具生物活性水凝胶时非常重要的β-折叠结构,被广泛用作凝胶制备的材料[2]。而蛋白的功能性质极大地受到外界条件如pH、离子强度与温度的影响,容易引起加热聚集或等电点沉淀[3]。近年来,许多医药领域研究人员对多糖和蛋白质自组装制备了具有绿色无毒,高负荷,高稳定和可控制释放的水凝胶[4-6]。
红景天苷在医药中可用于抗炎症、抗疲劳、抗衰老、抗抑郁性、抗病毒性、肝保护性和心血管神经保护性等,同时,在抑制白血病、胃腺癌、腮腺癌、结肠癌等方面也有一定作用,但存在生物半周期较短和口服生物利用度不高的问题[7-9]。有研究报导利用脂
质体和微粒包裹红景天苷,但是这些有机载体存在体内体外不稳定、可控性释放较低、包裹药物易泄漏、安全性等缺陷[10-12]。
牛血清蛋白(BSA)是食品领域常用的一种模型蛋白,含有583个氨基酸残基,分子量为66.5,等电点为4.7;在人体内能够很好地被消化吸收,具备低抗原性、低过敏性和高生物降解性[13-14]。橘皮果胶(CPP)是一种从橘皮中提取出来的由α-(1-4)-脱水半乳糖醛酸残基组成的线性多糖,目前,因为应用有限造成大量浪费,成为了许多工厂面临的巨大问题[15-16]。因此,本文利用BSA和CPP制备一种新型的以天然食品级材料为基础的传递系统,以红景天苷为模型,考察模拟体外的释放行为,以提高红景天苷的生物利用效率。
1 材料与方法
1.1 材料与仪器
牛血清蛋白 含量>98%,上海西格玛有限公司;橘皮果胶 酯化度50%,杂质<10%,上海西格玛有限公司;胃蛋白酶 酶活力≥250 U/mg,上海西格玛有限公司;胰蛋白酶 酶活力≥250 U/mg,上海西格玛有限公司;乙酸钠、乙酸和氢氧化钠等试剂 分析纯。
JB-3型磁力搅拌器 上海雷磁新径仪器有限公司;BS 224S型电子天平 北京赛多利斯科学仪器有限公司;NICOMP 380/ZLS型激光纳米粒度仪 美国粒度仪公司;T6型紫外可见分光光度计 北京普析通用仪器有限公司;THZ-82型恒温振荡器 常州国华电器有限公司;Anke LXJ-IIB型离心机 上海安亭科学仪器厂;MOS-450 AF/CD型圆二 法国BioLogic公司;TA DHR-2 type型流变仪 美国TA公司;Quanta 200F型环境扫描电子显微镜 美国FEI公司。
1.2 实验方法
1.2.1 凝胶的制备方法及实验设计 凝胶制备方法[5]:BSA溶解于去离子水,配制10 mg/mL的牛血清蛋白水溶液。加入质量比MR分别为0.2、0.5和0.8的CPP混匀,混匀过程维持溶液的pH为中性,过夜充分保证水合然后冷冻干燥。用去离子水分别配制蛋白浓度c为3.33、6.66、10 mg/mL的牛血清蛋白果胶混合物(BSACPP),分别调节牛血清蛋白果胶pH至5.5、5.0和4.5,平衡之后将溶液置于90℃的水浴中加热20 min,冷却后即可得到牛血清蛋白果胶纳米凝胶(BSA and CPP hydrogel,BCH)。
利用Design Expect 8.0(Statease公司)选取牛血清蛋白橘皮果胶质量比、蛋白浓度和pH为3个影响因子,以粒径和分散系数为指标,在分别进行单因素实验之后,选取上述3个水平展开,实验的设计总共包括17个安排,该实验的顺序完全随机。实验针对牛血清蛋白橘皮果胶混合体系(BSA-CPP)和凝胶体系(BCH),总共给出34个样品,并进行方程拟合和响应分析,方差分析用软件自带ANOVA来检验牛血清蛋白橘皮果胶比例、蛋白浓度和pH变化对粒径大小的影响是否显著性差异(p<0.05)。本文重点研究蛋白浓度3.33 mg/mL和pH为4.5条件下,显著因子果胶添加比例对凝胶形成的影响。
凝胶平均粒径及分布的测定采用动态光散射的方法,采用纳米粒度仪测定样品的平均粒径(Dh)及多分散系数(Polydispersity index,PDI),每个样品平行测定三次以上,粒径数据由仪器自带软件NICOMP 1.0进行Gaussion分布和Nicomp分布分析。
1.2.2 流变性质的测定 利用流变仪来测试不同果胶添加比例制备凝胶样品的静态流变行为。测定条件[17]:温度25℃,采用直径为40 mm、锥度为1%的不锈钢板,间隙为1 mm,固定频率为1 Hz,剪切频率先由0.1 s-1上升到600 s-1(上行曲线),然后由600 s-1递减到0.1 s-1(下行曲线),来回各持续10 min,得到样品的粘度和压力随剪切速率来回的变化曲线。
1.2.3 二级结构的测定 对添加不同果胶比例的BSA、BSA-CPP和BCH样品进行稀释(蛋白浓度为0.3 mg/mL),使用路径长度为0.1 mm的石英比色皿进行在190~250 nm下的圆二图谱测定,同时去离子水作空白对照[18]。图谱转化为包括α-螺旋、β-折叠、β-转角和无规则卷曲四种二级结构,计算在以下网址获得:http://dichroweb.cryst.bbk.ac.uk/html/process.shtml.
1.2.4 凝胶微观结构的观察 利用扫描电镜(SEM)观察凝胶的表面形貌[19]。将冷冻干燥的凝胶样品,少许撒在贴了双面胶的样品台上,吹去多余粘附物,放置于扫描电子显微镜(SEM)10 kV加速电压低真空模式观察放大倍数为6000的样品结构。
1.2.5 离子、pH稳定性 利用动态光衍射法测定制备凝胶稳定性[5]。将制备果胶凝胶pH分别调至2.0、4.0、6.0、8.0、10.0、12.0测定其粒径及分散系数。之后另取制备凝胶分别加入0.05、0.10、0.15、0.20、0.25 mol/L NaCl溶液测定其粒径及分散系数,之后在调至pH2.0~12.0的凝胶中加入0.15 mol/L NaCl溶液测定其粒径及分散系数。
1.2.6 红景天苷的包封率测定及模拟胃肠道释放 红景天苷标准曲线的绘制:称取0.05 g红景天苷粉末,溶解于磷酸盐缓冲液中,定容至50 mL容量瓶中,依次配制为梯度浓度的溶液,分别编号1、2、3、4、5测定红景天苷标准曲线,得到方程为y=4.35226x-0.01325。
采用离心法[20]测定红景天苷吸附含量。离心法直接混合5 mL(25 mg)制备凝胶和5 mL配制红景天苷(总红景天苷m(Sa)5 mg),摇床适速振荡48 h,之后离心紫外测定悬浮液红景天苷含量m’(Sa)。透析袋法则量取5 mL红景天苷溶液于试管中,加入装有5 mL制备凝胶的透析袋,之后同上操作,进而按下式计算出其包封率(EE):

参照文献方法[21]采用紫外透析测定红景天苷从牛血清蛋白果胶凝胶的模拟胃肠道体外释放。将吸附红景天苷牛血清蛋白果胶凝胶以透析袋形式加入SGF(模拟胃液,pH1.2,含1%胃蛋白酶)2 h和SIF(模拟肠液,pH6.8,含1%胰酶)媒介4 h,整个体系保持在37℃水浴温和搅拌。按照一定时间间隔从体系中取出5 mL用紫外进行测定,并重新填充5 mL释放媒介
确保溶液浓度一定。同时单独红景天苷放入透析袋中相同操作做空白对照。
1.3 数据分析
本文中所有实验均重复3次,采用Origin 8.6 (OriginLab公司)和SPSS 16.0(SPSS公司)对实验数据进行统计分析,样品平均值之间的差异性通过Duncan法比较(p<0.05)。
2 结果与分析
2.1 凝胶的粒径分布分析
经Design Expert软件可以得到牛血清蛋白BSA和橘皮果胶CPP混合物体系BSA-CPP响应方程:粒径=-26772.42325-1396.93858MR-410.28182c+10887.74362pH+312.74446MR×c-19.16667MR×pH+107.89055c×pH+530.70370MR2-17.39617c2-1081.17333pH2,并且MR、pH、c、MR×pH、pH×c、pH2、c2是显著影响因子,又以MR、pH影响最为显著,所以给出质量比和pH的交互作用响应曲面图(图1)。pH影响机制主要是调节pH至蛋白等电点4.7之下,蛋白会发生阴性至阳性的转变,进而与阴性果胶产生同种电荷到异种电荷的增强的静电作用,粒径大幅减小[22]。本文重点研究pH4.5时蛋白果胶带异种电荷时MR的影响;凝胶响应面无法找到合适方程,原因将进一步研究。
由图1(A)中可以看到,随着橘皮果胶比例0.2~0.8,体系粒径先减小后增大,可以推测是蛋白与果胶复合能力的饱和,多余果胶只能在体系中形成架桥絮凝,进而造成体系粒径的增大[23];图1(B)中凝胶体系在MR为0.5和0.8时,粒径随着pH降低呈现下降趋势,推测是由于蛋白加热疏水作用交换二硫键冷
却导致的网络结构的生成[5],但在添加果胶比例为0.2时,体系粒径随着pH的减少先减少后增大,推测比例为0.2的果胶不足以维持蛋白在近等电点下的平衡发生聚集。
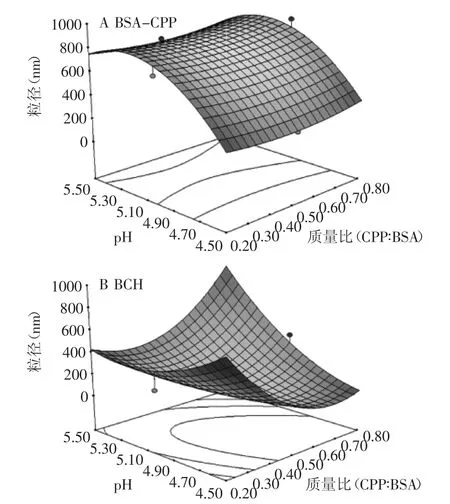
图1 BSA-CPP(R2=0.95)(A)和BCH(R2=0.80)(B)pH与质量比的粒径响应图Fig.1 Diameter-responsibility influenced by pH and mass ratio (MR)of BSA BSA-CPP(R2=0.95)(A)and BCH(R2=0.80)(B)

图2 不同CPP添加比例凝胶的流变性质研究(a:0.2,b:0.5,c:0.8)Fig.2 Rheological properties of different mass ratio(MR)of CPP∶BSA(a:0.2,b:0.5,c:0.8)
2.2 橘皮果胶添加对凝胶流变性质的影响
由图2(A)可以看出,制备凝胶粘度随剪切速率非线性减小,并且减小速率随剪切速率的增大而减少,即呈现假塑性流体的流体行为。并且可以发现体系的剪切上行与剪切下行并不重叠,而是存在着在同一剪切速率下下行粘度小于上行粘度,即剪切滞后的触变现象,二条线围成了一定大小的触变环。这一现象通常由体系中一些静电作用、空间位阻作用等形成,可以抵抗外界一定强度的机械压力[17]。图A(a)显示,在CPP添加比为0.2时,加热成胶的BCH相比未加热的蛋白果胶混合物粘度有所下降,甚至不足以抵抗外界的剪切,触变环无法闭合。而图A(b)和(c)显示在添加CPP比例为0.5和0.8时,BCH凝胶比未加热的蛋白果胶混合物粘度有所增大。
由图2(B)可以看出,混合物体系和凝胶体系只有在外界压力达到一定的值才会开始流动,这是屈服-假塑性流体的典型流变行为,通常形成了一定的网络结构才有此现象。比较图2B(c)与A(c)可以发现,添加比例为0.8时,混合物体系压力随剪切速率变化的滞后圈为顺时针,而粘度随剪切速率变化的滞后圈为逆时针的现象,即负触变现象。这种现象出现于高分子对固体粒子吸附不够强的情况,有絮凝体存在但不沉淀,进一步证实了果胶的过量与架桥絮凝现象的存在[24]。
2.3 橘皮果胶添加对凝胶构象的影响
表1揭示了不同橘皮果胶浓度对于蛋白二级结构的影响:混合体系CPP的添加相比单独蛋白带来二级结构主要变化是α-螺旋大幅度转变为β-折叠和β-转角,并伴随无规则卷曲的轻微变化。添加比例为0.2和0.8时,主要发生的变化是β-折叠的增加;而添加比例为0.5时β-折叠的增加显著性变化更小,相对而言β-转角的增加更为显著;无规则卷曲随着CPP添加比例的增加呈现减少,无显著变化,增加三种变化。凝胶构象性质是凝胶的重要参数之一,尤其是蛋白的二级结构,β-折叠是蛋白组装形成三维网络凝胶的重要结构,而β-转角也被认为是蛋白高度有序的产物[25]。推测添加比例0.2和0.8时β-折叠显著增加原因时果胶的不足或果胶过量会引起蛋白的自组装或蛋白与果胶的多重组装促进了β-折叠的生成[26]。
而在加热成胶之后,添加果胶质量比0.2时,α-螺旋继续下降,β-折叠、β-转角变化不大,无规则卷曲显著提高,推测这是果胶浓度过低不足以维持蛋白接近等电点的加热变性聚集造成的。而在CPP添加比例为0.5时,混合体系至凝胶体系过程由α-螺旋转变为β-折叠的变化在疏水作用力下增大,无规则卷曲含量显著减少,伴随β-转角略微降低。而当CPP添加比例达到0.8时,β-折叠和β-转角在混合体系基础上继续增加,但同时无规则卷曲含量也在升高,推测是多重吸附的凝胶增强了体系的有序性,但同时可能存在多种复合物的生成。
2.4 凝胶的粒径分析和形貌观察
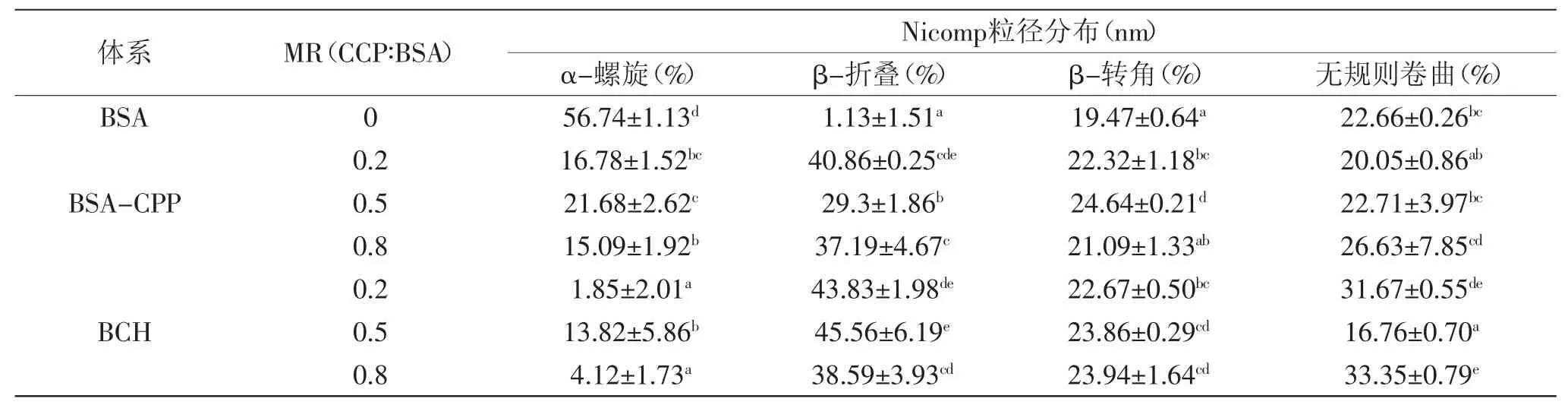
表1 圆二牛血清蛋白、不同含量橘皮果胶蛋白果胶混合物和复合胶的二级结构Table1 Second structure of BSA,BSA-CPP and BCH with different mass ratio(MR)of CPP∶BSA from CD

表2 不同橘皮果胶添加比例的蛋白果胶混合体系和凝胶体系的峰值分布Table2 Peak distribution of BSA-CPP and BCH system with different mass ratio(MR)of CPP∶BSA
表2是凝胶添加不同橘皮果胶比例加热前和加热后的粒径分布峰值表。其中比例为0.5时呈现单分散体系Gussian分布,具备较小粒径分布系数(PDI<0.06),呈现良好单分散性;而果胶比例为0.2和0.8时呈现出多分散体系Nicomp分布,进一步证实了果胶不足与过量引起的除复合体系之外蛋白自组装及二重复合体系的生成[22]。可发现在添加果胶比例为0.2
和0.5的体系都呈现单峰分布,而添加果胶比例0.8时出现双峰,推测小峰是蛋白果胶复合物峰,而大峰是多余果胶自缠绕形成[17]。
图3中A、B、C图分别为加入CPP比例0.2、0.5和0.8制备凝胶的扫描电镜图,可以看到在图A中凝胶结构确实有所破坏,证实了加入果胶比例0.2不足以维持蛋白在接近等电点的加热;而加入CPP比例0.5时形成良好三维网状凝胶结构体系;当体系加入多大蛋白质量比为0.8时,凝胶明显发生了多层吸附现象。

图3 不同橘皮果胶质量添加比制备凝胶的扫描电镜图Fig.3 SEM of BCH with with different mass ratio(MR)of CPP∶BSA
2.5 凝胶的离子及pH稳定性
凝胶实际应用易受pH和离子强度的影响而限制其使用。蛋白果胶凝胶随着盐浓度粒径变化与PDI变化如图4(A)所示,凝胶在添加0~0.25 mol/L的盐溶液粒径变化不大,而且保持着小于0.2的良好PDI指数,说明凝胶在此离子强度范围内可保持稳定。
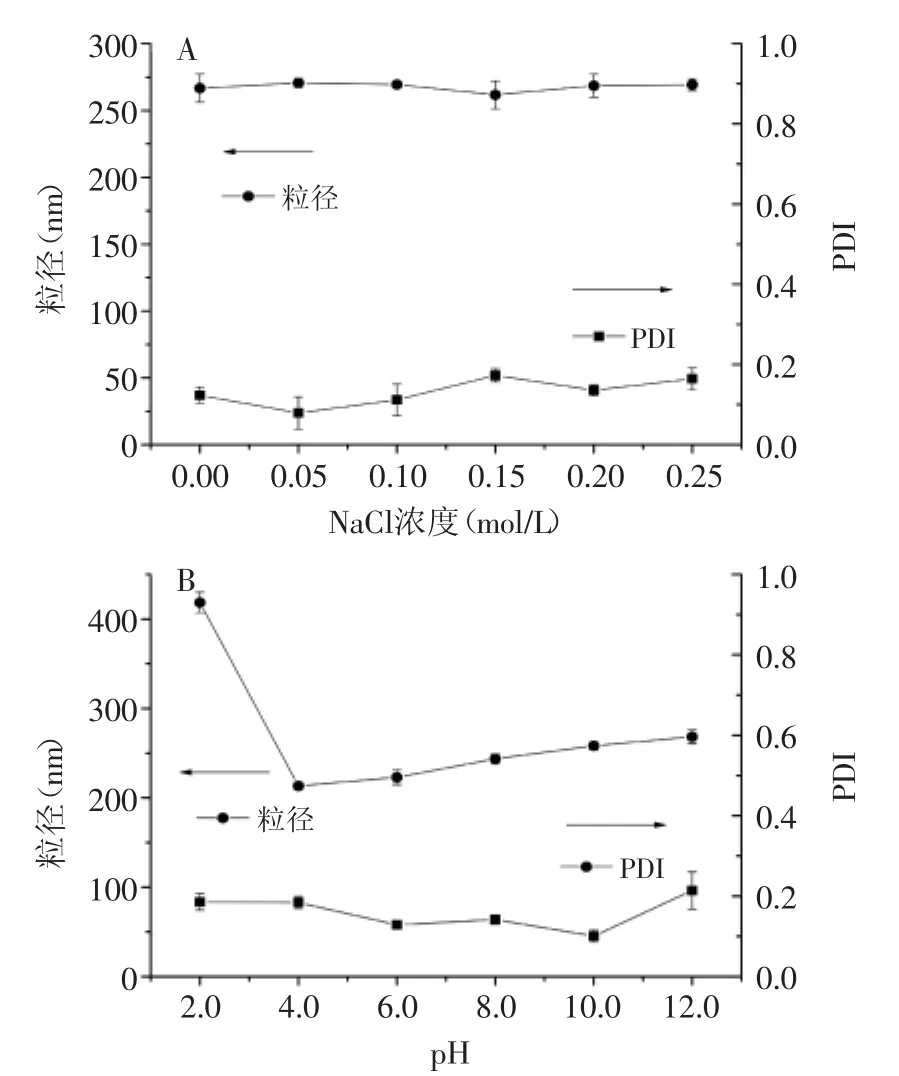
图4 BCH凝胶粒径与分布系数的离子强度依赖性(A)和pH依赖性(B)Fig.4 The iconic strength(A)and pH dependence(B)of Dh and PDI of BCH
图4(B)是制备凝胶在pH2.0~12.0的粒径值和分散系数,可以发现,凝胶在pH2.0~12.0保持较小且稳定的分散系数;而凝胶粒径值在pH2.0强酸性条件下较大,推测是果胶微水解的原因[20],在pH4.0~12.0会随着pH逐渐增大发生轻微的增加,结合文献判断这是随着碱性的增强果胶羧基充分质子化溶胀造成[27]。相对单独蛋白体系和蛋白果胶混合体系,制备凝胶取得了一定稳定性的提高,这要归功于蛋白质加热过程中的疏水作用和二硫键交换,促进了其分子间交联的不可逆性和形成稳定交联三维网络结构[5]。
2.6 牛血清蛋白果胶凝胶包裹红景天苷的包测封率定及释放
通过离心法测得凝胶包裹红景天苷的包封率(EE)为49.88%±0.59%。就红景天苷从凝胶中的释放,本文模拟胃肠道进行了释放研究,研究结果见图5,同时红景天苷单独释放作为对照。可以发现,单独红景天苷在模拟胃肠道中释放迅速,并且基本呈现零级释放,并且在3.5 h达到近100%的释放。而红景天苷从制备凝胶中,前2 h在胃消化液的释放明显较缓慢,而后在模拟肠液中速度有所增大,6 h后达到了80.24%的最大释放。
释放的阶段性,推测原因为果胶在胃液中果胶有所水解,但分子量达上千道尔顿的蛋白及其网状结构还是足以阻挡红景天苷的释放;而在肠道中,凝胶在经历了果胶的水解和脱离后蛋白消化迅速,红景天苷大量从中释放。结果表明凝胶可以有效延长活性成分的生物半周期,提高特别是靶向肠道的作用效率。

图5 红景天苷从制备凝胶及空白在模拟胃消化液(前2 h)与肠消化液(后4 h)的累积释放Fig.5 Accumulated release of salidroside from BCH and control in SGF(first 2 h)and SIF(later 4 h)
3 结论
研究了不同橘皮果胶浓度对牛血清蛋白成胶的影响,并且利用安全无毒自组装方法制备了一种肠道靶向控制释放载体凝胶。结果表明:蛋白与橘皮果胶质量比为0.5时,能够制得粒径小、流变性质和结构构象稳定的果胶嵌入型三维结构蛋白凝胶;而在添加比例为0.2或0.8时,体系易因果胶不足或过量发生蛋白自组装或果胶蛋白的多重吸附现象,成为多分散体系。制备凝胶应用于功能性食品红景天苷的载药包封率达到49.88%,模拟体外释放具备胃肠道缓释功能,并且具备一定的pH与离子稳定性,在食品及其他领域具潜在价值。
[1]Mavuso S,Marimuthu T,Choonara Y E,et al.A Review of Polymeric Colloidal Nanogels in Transdermal Drug Delivery[J].Current Pharmaceutical Design,2015,21(20):2801-2813.
[2]Yan H,Saiani A,Gough J E,et al.Thermoreversible protein hydrogel as cell scaffold[J].Biomacromolecules,2006,7:2776-2782.
[3]Bryant C M,Mcclements D J.Influence of xanthan gum on physical characteristics of heat-denatured whey protein solutions and gels[J].Food Hydrocolloids,2000,14(4):383-390.
[4]María Julia Spotti,Perduca M J,Piagentini A,et al.Does dextran molecular weight affect the mechanical properties of whey protein/dextran conjugate gels?[J].Food Hydrocolloids,2013,32(1):204-210.
[5]Shaoyong Yu,Jinhua Hu,Xiaoyun Pan,et al.Stable and pH-sensitive nanogels prepared by self-assembly of chitosan and ovalbumin[J].Langmuir the Acs Journal of Surfaces&Colloids,2006,22(6):2754-2759.
[6]Juan Li,Shaoyong Yu,Ping Yao,et al.Lysozyme-dextran core-shell nanogels prepared via a green process[J].Langmuir,2008,24(7):3486-3492.
[7]Zhang L,Yu H,Sun Y,et al.Protective effects of salidroside on hydrogen peroxide-induced apoptosis in SH-SY5Y human neuroblastoma cells[J].European Journal of Pharmacology,2007,564(1-3):18-25.
[8]Hu X L,Zhang X Q,Qiu S F,et al.Salidroside induces cellcycle arrest and apoptosis in human breast cancer cells[J].Biochem Biophys Res Commun,2010,398:62-67.
[9]Fan M H,Xu S Y,Xia S Q,et al.Effect of different preparation methods on physicochemical properties of salidroside liposomes[J].Agric Food Chem,2007,55:3089-3095.
[10]Slowing I I,Trewyn B G,Giri S,et al.Mesoporous silica nanoparticlesfor drug delivery and biosensing applications[J].Adv Funct Mater,2007,17:1225-1236.
[11]Slowing I I,Vivero-Escoto J L,Wu C W,et al.Mesoporous silica nanoparticles as controlled release drug delivery and gene transfection carriers[J].Adv Drug Deliv Rev,2008,60:1278-1288.
[12]Fathi M,Mozafari M R,Mohebbi M,et al.Nanoencapsulation of food ingredients using lipid based delivery systems[J].Trends Food Sci Technol,2012,23:13-27.
[13]Jung S H,Kim S J C J.Molecular characteristics of bovine serum albumin-dextran conjugates[J].Bioscience Biotechnology &Biochemistry,2006,70(9):2064-2070.
[14]Baier S,Mcclements D J.Impact of preferential interactions on thermal stability and gelation of bovine serum albumin in aqueous sucrose solutions[J].Journal of Agricultural&Food Chemistry,2001,49(5):2600-2608.
[15]Kim Y M,Lee H W,Kim S,et al.Non-Isothermal Pyrolysis of Citrus Unshiu Peel[J].Bioenergy Research,2014,8:1-9.
[16]Mamma D,Christakopoulos P.Biotransformation of Citrus By-Products into Value Added Products[J].Waste&Biomass Valorization,2014,5(4):529-549.
[17]胡陵.酸变性酪蛋白与高酯果胶作用机理的研究[D].杭州:浙江工商大学,2013.
[18]Chen L,Jie W,Jing S,et al.Encapsulation of tomato oleoresin using soy protein isolate-gum aracia conjugates as emulsifier and coating materials[J].Food Hydrocolloids,2015,45:301-308.
[19]Yang C,Wang Y,Vasanthan T,et al.Impacts of pH and heating temperature on formation mechanisms and properties of thermally induced canola protein gels[J].Food Hydrocolloids,2014,40(10):225-236.
[20]Luo Y,Pan K,Zhong Q.Casein/pectin nanocomplexes as potential oral delivery vehicles[J].International Journal of Pharmaceutics,2015,486(1-2):59-68.
[21]Luo Y,Zhang B,Cheng W H,et al.Preparation,characterization and evaluation of selenite-loaded chitosan/TPP nanoparticles with or without zein coating[J].Carbohydrate Polymers,2010,82 (3):942-951.
[22]Hattori T,Hallberg R,Dubin P.The roles of electrostatic interaction and polymer structure in the binding of β-lactoglobulin to anionic polyelectrolytes:measurement of binding constants by frontal analysis continuous capillary electrophoresis[J].Langmuir,2000,16,9738-9743.
[23]Grinberg V Y,Tolstoguzov V B.Thermodynamic incompatibility of proteins and polysacchrides in solutions[J].Food Hydrocolloids,1997,11(2):145-152.
[24]陈宗淇,石林,伍士英,等.负触变性现象[J].化学通报,1991,2:31-34.
[25]Carbonaro M,Nucara A.Secondary structure of food proteins by Fourier transform spectroscopy in the mid-infrared region[J].Amino Acids,2010,38(3):679-690.
[26]Alina K,Katharina A P,Jochen W,et al.Environmental response of pectin-stabilized whey protein aggregates[J].Food Hydrocolloids,2014,35:332-340.
[27]季兴敏.环境敏感水凝胶的溶胀动力学理论及药物释放动力学研究[D].武汉:武汉理工大学,2007.
Research on preparation,characterization of bovine serum albumin and citrus peel pectin hydrogel and release for salidroside in vitro
CHEN Sha1,PENG Hai-long1,2,*,HU Zhen-ying1,NING Fang-jian1,YU Ning-xiang1,ZHU Wen-ting1,LIU Wen-qiang1,XIONG Hua1
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China;2.Department of Chemical Engineering,Nanchang University,Nanchang 330031,China)
A novel slow release hydrogel was prepared by bovine serum albumin(BSA)and citrus peel pectin via self-assembly.The significant influence on the diameter of hydrogel was found and discussed by three factors Mass ratio(MR)of pectin and BSA,protein concentration,and pH at three level in the preparation of the hydrogel.Combined with the characterization of rheology,CD and SEM,the paper further focused on investigating the effective factor MR of CPP and BSA.The results showed that mixture of pectin and BSA reached the smallest particle size 259.5 nm with a narrow size distribution(PDI<0.06)and formed a good and stable hydrogel with three-dimensional network structure when heated with mass ratio(MR)of CPP:BSA 0.5 at pH4.5.The result indicated that the hydrogels(BCH)had a high encapsulation efficiency(EE,49.88%)and slow release under simulated gastric and intestinal fluid condition when salidroside was used as a model molecule,which showed that this novel hydrogel might be a potential deliver carrier for salidroside or other functional food agents.
bovine serum albumin;citrus peel pectin;self-assembly;hydrogels;slow release
TS218
A
1002-0306(2016)08-0139-06
10.13386/j.issn1002-0306.2016.08.020
2015-09-29
陈莎(1992-),女,硕士研究生,研究方向:食品科学,E-mail:251761607@qq.com。
*通讯作者:彭海龙(1979-),男,博士,讲师,主要从事新剂型和功能食品方面的研究,E-mail:peng_hailong@aliyun.com。
国家自然科学基金(21201098);江西省自然科学基金(20151BAB203029)。
