红酵母红素对氧化应激细胞PC12细胞的保护机制
2016-09-14桑卫国宁波大学海洋学院浙江宁波315211
张 丹,桑卫国(宁波大学海洋学院,浙江宁波315211)
红酵母红素对氧化应激细胞PC12细胞的保护机制
张 丹,桑卫国*
(宁波大学海洋学院,浙江宁波315211)
探究红酵母红素对氧化应激细胞的保护机制。PC12细胞(大鼠肾上腺嗜铬细胞瘤细胞)分为对照组、模型组(200 μmol/L H2O2)、番茄红素组(20 μmol/L番茄红素+200 μmol/L H2O2,阳性对照组)和红酵母红素组(1 μmol/L红酵母红素+200 μmol/L H2O2、2 μmol/L红酵母红素+200 μmol/L H2O2和3 μmol/L红酵母红素+200 μmol/L H2O2),分别观察PC12细胞的形态变化,检测细胞凋亡率、半胱氨酸蛋白酶Caspase-3的活性及细胞中促凋亡蛋白Bax和抗凋亡蛋白Bcl-2的表达含量。结果表明,与模型组相比,3 μmol/L的红酵母红素能维持细胞原有形态,降低了11.6%的细胞凋亡率(p<0.05),抑制了62.92%的Caspase-3活性(p<0.01),进一步研究发现红酵母红素能够下调Bax的表达(p<0.01),上调Bcl-2的表达(p<0.01),从而阻止了凋亡链反应。综上所述,红酵母红素可能通过抑制Caspase-3活性,调节Bax和Bcl-2的表达来发挥对氧化应激细胞的保护作用,且其作用存在剂量依赖性。
红酵母红素,氧化应激,保护机制,PC12细胞,凋亡
当受到氧化剂的刺激时,机体会产生过多的活性氧(ROS),会与细胞膜上的各种不饱和脂肪酸和胆固醇反应,导致自由基连锁反应,抗氧化体系失调,引起不同程度的细胞毒性,同时细胞内的信号传导途径发生改变,最终导致细胞的凋亡[1]。生物体内存在的各种自由基通过多种途径可导致细胞凋亡,包括:氧自由基直接损伤细胞核;激活半胱氨酸蛋白酶Caspase-3;调控肿瘤坏死因子等[2-4]。
红酵母红素(结构式见图1)具有和番茄红素(结构式见图2)相似的化学结构。目前,红酵母红素的研究主要集中在其生物上游优化发酵提高色素产量方面,对关于其功能活性研究较少。但从化学结构的角度来看,Babin A等[5]以及Lee等[6]报道了红酵母红素在体外具有转化为维生素A的能力,这可能与其具有
满足生成维生素A的结构—无取代基的β-芷香环和侧面具有11个碳原子的聚合链有关,所以其可能有β-胡萝卜素所特有的维生素A前体功能。番茄红素在一定条件下可发生顺反异构化和氧化降解并且番茄红素对氧化反应比较敏感,其溶液经日光照射12 h后,其中的番茄红素基本上损失殆尽。然而,红酵母红素具有14个共轭双键,目前认为共轭双键的数目和抗氧化活性之间是有联系的,所以红酵母红素可能具有清除自由基的作用。研究新型类胡萝卜素对氧化应激的抑制具有一定的科研和应用价值,为类胡萝卜素的广泛开发利用提供理论基础。目前为止,发酵法生产番茄红素还未能进行工业化生产,如果可进行发酵工业化生产的红酵母红素具有和番茄红素相比拟的功能活性,那么其应用前景是非常乐观的。

图1 红酵母红素结构式Fig.1 Structural formula of torularhodin

图2 番茄红素结构式Fig.2 Structural formula of lycopene
PC12细胞(大鼠肾上腺嗜铬细胞瘤细胞)广泛用于神经系统疾病的体外研究,也是在机体内最容易受到氧化应激损伤的细胞之一,所以本实验以其为模型细胞。与此同时,H2O2常常作为模拟氧化应激的诱导剂。本实验中采用PC12细胞和H2O2来建立氧化应激细胞模型,通过研究细胞的凋亡水平,可以进一步地了解红酵母红素对氧化应激的保护机制。
1 材料与方法
1.1 材料与仪器
PC12细胞(小鼠肾上腺嗜铬细胞瘤细胞株) 上海细胞所;红酵母红素(纯度≥95%) 江南大学生物工程学院;番茄红素(纯度≥95%) 美国Sigma公司;DMEM培养基、胰蛋白酶、胎牛血清 美国Gibco公司;碘化丙啶(PI,纯度≥94%)、Hoechst33342(纯度≥98%) 南京建成生物工程研究所;AnnexinVFITC细胞凋亡检测试剂盒、Caspase-3试剂盒 碧云天生物技术研究所;兔抗鼠β-actin抗体、Bax抗体、Bcl-2抗体 美国Cell sinaling公司;其他试剂 均为分析纯试剂。
BX51型倒置相差显微镜、TH4-200荧光显微镜 日本Olympus公司;FACSCalibur流式细胞仪 美国BectonDickinson公司;SpectraMax M5/M5e酶标仪 美国Molecular Devices公司;FluorChem FC3化学发光成像分析系统 美国ProteinSimple公司。
1.2 实验方法
1.2.1 红酵母红素溶液的制备 将经0.22 μm滤膜过滤除杂除菌,高度纯化的红酵母红素溶于细胞培养液中,分别配成1、2和3 μmol/L的红酵母红素溶液。
1.2.2 实验分组及处理 采用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基在37℃下培养PC12细胞,并用质量分数为0.25%胰蛋白酶溶液进行消化传代[7]。待PC12细胞在细胞培养皿中培养24 h后,吸出培养液,随机分为六组:对照组、模型组、番茄红素组和三组红酵母红素的实验组。对照组:加入细胞培养液连续培养26 h;模型组:先加入细胞培养液培养24 h后,再加200 μmol/L H2O2溶液继续培养2 h;番茄红素组:加20 μmol/L番茄红素培养细胞24 h,加200 μmol/L H2O2溶液继续培养2 h,作为阳性对照;三组红酵母红素的实验组:分别加1、2和3 μmol/L红酵母红素溶液培养细胞24 h,加200 μmol/L H2O2溶液继续培养2 h。
1.2.3 细胞形态的观察 PC12细胞在细胞培养皿中按上述方法1.2.2培养后,在倒置相差显微镜下观察细胞形态。
1.2.4 Annexin V-FITC/PI双染法检测细胞凋亡率
收集各组细胞,先1000×g离心5 min,吸走上清,加入200 μL Annexin V-FITC结合液吹打重悬细胞,在25℃避光孵育10 min,然后按上述同样方法离心,吸走上清,再加入190 μL Annexin V-FITC结合液吹打重悬细胞,最后加入10 μL PI染色液,小心混匀,冰浴避光保存。随即进入流式细胞仪以525 nm绿色荧光和620 nm红色荧光检测细胞凋亡率。
1.2.5 Caspase-3活性的检测 采用碧云天试剂盒检测Caspase-3活性。Casepase-3的底物催化产物对硝基苯胺(pNA)在405 nm附近有强吸收,从而可以通过测定吸光度来检测Caspase-3的活性。
1.2.6 Western-blot检测细胞内相关蛋白表达水平
将各组细胞提取蛋白,并用二喹啉甲酸(BCA)法测定其浓度。按每孔10 μL点样,用12.5%的SDS-聚丙烯酰胺(PAGE)进行凝胶电泳,等蛋白完全分离后,采用半干法将蛋白转至PVDF膜。接着,放入含5%牛血清蛋白的洗膜缓冲液中,在室温条件下封闭1 h。根据分子量大小剪下目的条带分别加入一抗:β-actin抗体(1∶1000)、Bax抗体(1∶1000)和Bcl-2抗体(1∶1000),4℃孵育过夜。取出条带,洗涤后放入二抗,室温孵育1 h,最后洗膜并用3,3-二氨基联苯胺(DAB)显色,成像,使用电泳图像分析系统进行分析。
1.2.7 数据处理与统计方法 数据为至少三次的平行数据结果,以平均数±标准差表示,用SPSS 17.0统计软件进行t检测,p值是接受两均值存在差异这个假设可能犯错的概率。p<0.05代表差异具有显著性,p<0.01代表差异具有高度显著性。
2 结果与分析
2.1 红酵母红素对PC12细胞形态的影响
图3为倒置相差显微镜下观察的PC12细胞形态。从图3-A可以看出,正常的PC12细胞自由伸展、呈现纤维状,细胞形态清晰分明;而图3-B中模型组的PC12细胞不再自由伸展,皱缩成球形,不少细胞漂浮而死。在红酵母红素预孵育的情况下,细胞一定程度上受到了保护,即使后续加入H2O2,细胞形态也没有
太大的异常,如图3-D、图3-E、图3-F,细胞边界清晰,大部分仍成自由伸展状态,其中3 μmol/L的红酵母红素保护的细胞形态最好,依旧大部分呈现角状梭状,正常生长。
H2O2作用于细胞时,会导致脂质、蛋白质和DNA的结构发生改变。一旦组成细胞膜的蛋白质和脂质结构发生改变,细胞膜的流动性就会下降,稳定性随之崩溃,细胞形态发生变化[8]。在本实验中,得到不同浓度的红酵母红素在一定程度上保持了细胞膜的完整性,维持了PC12细胞的正常形态,从而对氧化应激细胞有保护作用。

图3 红酵母红素对PC12细胞形态的影响Fig.3 Effect of torularhodin on the morphology of PC12 cell
2.2 红酵母红素对PC12细胞凋亡率的影响
处于凋亡早期的细胞会把磷酯酰丝氨酸外翻到细胞膜外侧,磷酯酰丝氨酸暴露到细胞表面后会促进凝血和炎症反应,而Annexin V和外翻到细胞表面的磷酯酰丝氨酸结合后可以减弱磷酯酰丝氨酸的促凝血和促炎症反应活性。在Annexin V-FITC和PI染色后,使用流式细胞仪,正常的活细胞不被Annexin V-FITC和PI染色(流式图的左下角区域);凋亡早期的细胞仅被Annexin V-FITC染色(流式图的右下角区域);坏死细胞和凋亡晚期的细胞可以同时被Annexin V-FITC和PI染色(流式图的右上角区域)。凋亡早期、坏死细胞和凋亡晚期的细胞所占比例的总和为细胞凋亡率。
见图4,对照组细胞大部分出现在左下角区域,说明细胞处于正常状态;当经过H2O2处理后,发现凋亡细胞明显增加,凋亡早期和坏死细胞、凋亡晚期的细胞比例均有所升高,其细胞凋亡率为12.7%,比对照组高了12%;在经过红酵母红素的保护之后,细胞凋亡率显著下降,分别从12.7%下降到5.7%、3.9%和1.1%,呈剂量依赖性,且与对照组相比3 μmol/L的红酵母红素组细胞凋亡率具有显著性差异(p<0.05)。
有研究通过Annexin V/PI双染法测定细胞凋亡率发现氧化受损细胞的凋亡早期、坏死和凋亡晚期细胞比例明显增加[9]。Qiang等[10]发现,相比模型组,三七总皂苷保护组的凋亡早期、坏死细胞和凋亡晚期细胞比例均有所减小,即三七总皂苷具有抗凋亡活性;与上述文献报道结果相一致,本实验结果证实红酵母红素
对H2O2诱导的细胞凋亡具有一定程度的改善作用,尤其对于凋亡早期的细胞具有特别显著的保护作用。

图4 红酵母红素对PC12细胞凋亡率的影响Fig.4 Effect of torularhodin on the apoptosis rate of PC12 cell
2.3 红酵母红素对PC12细胞Caspase-3活性的影响
Caspase-3正常以酶原(32KD)的形式存在于胞浆中,没有活性,在凋亡的早期阶段会被激活[11],对染色体固缩等过程起到了重要的作用[12-13],并可以直接特异性剪切DNA修复酶PARP,脱氧核糖核苷酸酶等。
从图5中可以看出,模型组的Caspase-3活性提高到175.23%(p<0.01),表明H2O2激发了细胞内Caspase-3的活化。同时,在不同浓度的红酵母红素对细胞保护培养后,Caspase-3活性都有一定程度的降低,其中3 μmol/L红酵母红素组的Caspase-3活性高度显著降低到112.31%(p<0.01),其保护效果最好。
Caspase-3在氧化应激介导的凋亡通路中起到了关键的作用[14]。实验结果表明,H2O2激发了Caspase-3的活化,进行PARP的剪切,促使细胞凋亡,而不同浓度的红酵母红素抑制了这种促发机制,且存在一定的剂量依赖性,这与多篇报道对于氧化应激的作用机制研究结果是相类似的[15-16]。其中,3 μmol/L红酵母红素组具有高度显著的调控作用。
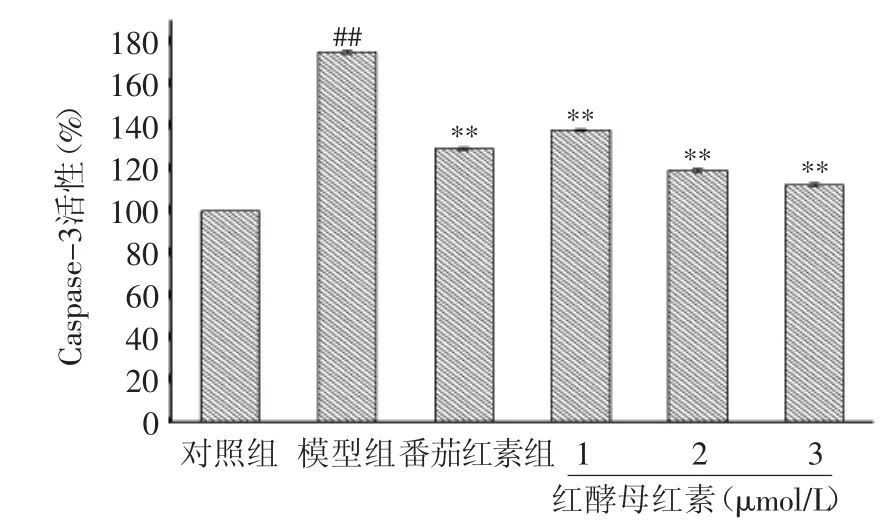
图5 红酵母红素对PC12细胞Caspase-3活性的影响Fig.5 Effect of torularhodin on the Caspase-3 activity of PC12 cell
2.4 红酵母红素对PC12细胞内相关蛋白表达水平的影响
在凋亡研究中促进和抑制细胞凋亡的蛋白有着关键作用,其中Bax蛋白为典型的促凋亡蛋白,而Bcl-2蛋白为抗凋亡蛋白[17]。当细胞受到氧化应激时,促凋亡蛋白Bax表达量增加,促发凋亡链反应[18]。而抗凋亡蛋白Bcl-2可以通过抑制线粒体通透性转换孔的开放,阻止细胞色素的释放,从而阻止一系列凋亡链反应[19]。
图6是Bax和Bcl-2的表达情况,从图7柱状图数据中可以看出,与对照组相比,模型组的Bax蛋白表达量明显上调,增加幅度达到38.24%(p<0.01),而Bcl-2的表达量降低了22.08%(p<0.01)。但是通过加入番茄红素或是不同浓度的红酵母红素对细胞进行保护后,与模型组相比,Bax蛋白的表达量呈现不同程度的下降,Bcl-2蛋白表达量也得到一定程度的恢复。其中3 μmol/L红酵母红素组的Bax蛋白表达量比模型组降低了37.46%(p<0.05),其Bcl-2蛋白表达量上升18.89%(p<0.01)。
从凋亡相关蛋白表达量的实验结果来看,H2O2导致氧化应激相关蛋白的表达量发生变化,促使凋亡的发生,而不同浓度的红酵母红素对细胞进行保护后,下调促凋亡蛋白Bax表达,上调抗凋亡蛋白Bcl-2表达,从而阻止了凋亡链反应的发生,保护细胞免受氧化应激的损伤。
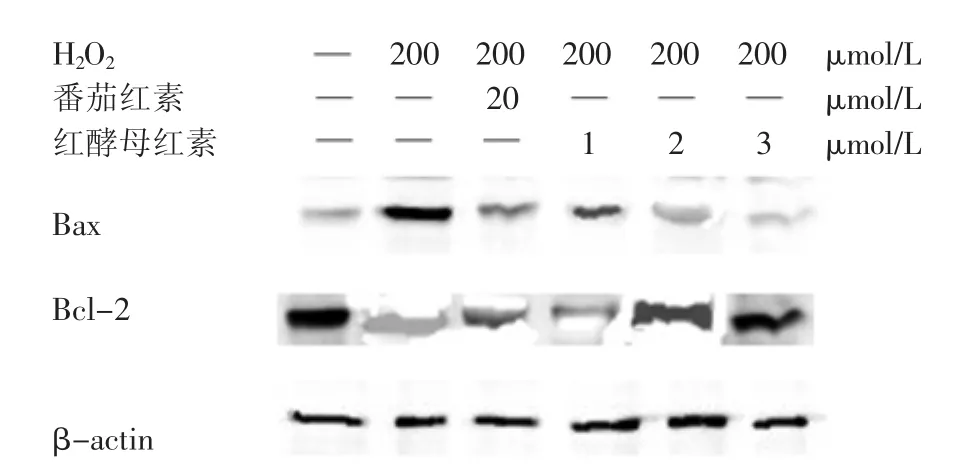
图6 Western-blot检测细胞内相关蛋白表达情况Fig.6 Testing related protein expression in cells by Western-blot

图7 红酵母红素对PC12细胞的Bax、Bcl-2蛋白表达量的影响Fig.7 Effect of torularhodin on the Bax,Bcl-2 protein expression of PC12 cell
3 结论
在PC12细胞的氧化应激模型中,H2O2对PC12细胞进行氧化损伤,而不同浓度的红酵母红素均对氧化受损的细胞进行调控和保护,且调控能力呈现剂量依赖性,其中3 μmol/L红酵母红素具有较好的调控能力。红酵母红素能通过保护细胞膜,抑制Caspase-3的活性,有效调控Bax和Bcl-2蛋白的表达量,从而发挥抗凋亡活性,对氧化应激细胞产生保护作用。
[1]卢静,王丽,左丽丽,等.荞麦蜂花粉的氧化应激防护及其活性成分分析[J].食品工业科技,2014,3(1):130-135.
[2]Vaisanen EE,Annikal,Smeds Al,et al.Coniferyl alcohol hinders the growth of tobacco BY-2 cells and Nicotiana benthamiana seedlings[J].Planta,2015,242(3):747-760.
[3]Fujiwara N,Nakano M,Kato S,et al.Oxidative modification to cysteine sulfonic acid of Cys111 in human copper-zinc superoxide dismutase[J].Journal of Biological Chemistry,2007,282(49):35933-35944.
[4]Paulech J,Liddy KA,Enqholm,et al.Global analysis of myocardial peptides containing cysteines with irreversible sulfinic and sulfonic Acid post-translational modifications[J].Mol Cell Proteomics,2015,14(3):609-620.
[5]Babin A,Saciat C,Teixeira M,et al.Limiting immunopathology:Interaction between carotenoids and enzymatic antioxidant defences[J].Dev Comp Immunol,2015,49(2):278-281.
[6]Lee da H,Nam YJ,Lee CS.Quercetin-3-O-(2″-galloyl)-α-L-rhamnopyranoside attenuates cholesterol oxidation productinduced apoptosis by suppressing NF-κB-mediated cell death process in differentiated PC12 cells[J].Naunyn Schmiedeberqs Arch Pharmacol,2015,388(8):869-881.
[7]Benedí J,Arroyo R,Romero C,et al.Antioxidant properties and protective effects of a standardized extract of Hypericum perforatum on hydrogen peroxide-induced oxidative damage in PC12 cells[J].Life Sciences,2004,75(10):1263-1276.
[8]Li S P,Zhao K J,Ji Z N,et al.A polysaccharide isolated from Cordyceps sinensis,a traditional Chinese medicine,protects PC12 cells against hydrogen peroxide-induced injury[J].Life Sciences,2003,73(19):2503-2513.
[9]Raza H,John A,Benedict S,et al.Acetylsalicylic acidinduced oxidative stress,cell cycle arrest,apoptosis and mitochondrial dysfunction in human hepatoma HepG2 cells[J].European Journal of Pharmacology,2011,558(2):15-24.
[10]Qiang H,Gao P G,Zhang C,et al.Effects of Panax notoginseng saponins on apoptosis induced by hydrogen peroxide in cultured rabbit bone marrow stromal cells via altering the oxidative stress level and down-regulating Caspase-3[J].Journal of Nanjing Medical University,2009,23(6):373-379.
[11]Rahman MA,Amin AR,Wang D,et al.RRM2 regulatis Bxl-2 in head and neck and lung cancers:a potential target for cancer therapy[J].Clin Cancer Res,2013,19(13):3416-3428.
[12]Zhou F,Xin S,Liang HW,et al.Carbon nanofibers decorated with molybdenum disulfide nanosheets:synergistic lithium storage and enhanced electrochemical performance[J].Angew Chem Int Ed Engl,2014,53(43):11552-11556.
[13]Braun F,De Carne,Trecesson S,et al.Protect and serve:Bcl-2 proteins as quardians and rulers of cancer cell survival[J].Cell Cycle,2013,18(12):2937-2947.
[14]Jiang L,Wang H,Shi C,et al.ZNF667/Mipu1 is a novel anti-apoptotic factor that directly regulates the expression of the rat Bax gene in H9C2 cells[J].Plos One,2014,11(9):38-49.
[15]Zhao YR,Qu W,Liu WY,et al.YGS40,an active fraction of Yi-Gan San,reduces hydrogen peroxide-induxed apoptosis in PC12 cells[J].Chin J Nat Med,2015,13(6):438-444.
[16]Kim H J,Lee K W,Kim M S,et al.Piceatannol attenuates hydrogen-peroxide-and peroxynitrite-induced apoptosis of PC12 cells by blocking down-regulation of Bcl-2 and activation of JNK[J].Journal of Nutrtion Biochemistry,2008,19(6):459-466.
[17]Sherhod R,Gillet VJ,Judson PN,et al.Automating knowledge discovery for toxicity prediction using jumping emerging pattern mining[J].J Chem Inf Model,2012,52(11):3074-3087.
[18]Cho E S,Lee K W,Lee H J.Cocoa procyanidins protect PC12 cells from hydrogen-peroxide-induced apoptosis by inhibiting activation of p38 MAPK and JNK[J].Mutation Research,2008,640(28):123-130.
[19]Barber S C,Higginbottom A,Mead R J,et al.An in vitro screening cascade to identify neuroprotective antioxidants in ALS [J].Free Radical Biology and Medicine,2009,46(8):1127-1138.
Cytoprotective mechanism of torularhodin against oxidative stress
ZHANG Dan,SANG Wei-guo*
(School of Marine Sciences,Ningbo University,Ningbo 315211,China)
This study aims to investigate the cytoprotective mechanism of torularhodin against oxidative stress.PC12 cells were randomly divided into control group and model group(200 μmol/L H2O2),lycopene group (20 μmol/L lycopene+200 μmol/L H2O2,positive control group)and torularhodin groups(1 μmol/L torularhodin+200 μmol/L H2O2,2 μmol/L torularhodin+200 μmol/L H2O2and 3 μmol/L torularhodin+200 μmol/L H2O2).The changes of PC12 cell morphology were observed,while the apoptosis rate of cell,the activity of Caspase-3 and expressions of pro-apoptotic protein Bax and anti-apoptotic protein Bcl-2 were also detected.Results showed that 3 μmol/L torularhodin could maintain the original shape of cell,reduce 11.6% apoptosis rate(p<0.05)and inhibit 62.92% Caspase-3 activity(p<0.01),comparing with the model group.Further study demonstrated that torularhodin could down-regulate the expression of Bax(p<0.01)and up-regulate the expression of Bcl-2 (p<0.01),which thereby prevented chain reaction of apoptosis and protected cells from oxidative stress.In a word,torularhodin could effectively protect cells against oxidative stress,by mechanisms which probably involves the inhibition of Caspase-3 activity and adjustment of Bax,Bcl-2 expression in dose-dependent manner.
torularhodin;oxidative stress;protect mechanism;PC12 cells;apoptosis
TS264.4
A
1002-0306(2016)08-0120-05
10.13386/j.issn1002-0306.2016.08.016
2015-09-08
张丹(1987-),女,硕士,研究方向:生物技术及功能性食品,E-mail:1030453360@qq.com。
*通讯作者:桑卫国(1954-),男,副教授,研究方向:生物技术、食品研发和海洋生物分子育种,E-mail:282324079@qq.com。
