稗草生防菌BC-1的分离及生物学特性研究
2016-09-14李健李美高兴祥房锋董连红
李健,李美,高兴祥,房锋,董连红
(山东省农业科学院植物保护研究所,山东省植物病毒学重点实验室,山东 济南250100)
稗草生防菌BC-1的分离及生物学特性研究
李健,李美*,高兴祥,房锋,董连红
(山东省农业科学院植物保护研究所,山东省植物病毒学重点实验室,山东 济南250100)
为了能够获得低毒且高效的生物除草剂,本研究以苹果园感病稗草为材料,从中分离得到菌株BC-1,形态学观察和16S rDNA序列比对分析后,确认该菌株为露湿漆斑菌(Myrotheciumroridum)。菌株BC-1最适生长培养基为PDA和PSA培养基,最适生长温度为25~28 ℃。最适生长pH值为6~7;光照强度对菌丝生长有一定抑制作用;菌丝生长最佳碳源为麦芽糖,最佳氮源为硝酸铵。室内生防试验表明,该菌株分生孢子悬浮液对稗草生防效果最佳,接菌21 d后稗草发病率为100%,鲜重防效达93.7%;对马唐、狗尾草、播娘蒿和反枝苋的生防效果相对较差,鲜重抑制率仅为33.7%,28.3%,-3.2%,16.8%。作物安全性试验表明,该菌株的分生孢子液对玉米、小麦、水稻等作物安全。综上所述,菌株BC-1有开发成商品化生物除草剂的潜力。
稗草;生物学特性;露湿漆斑菌;生物防治
农田杂草是危害农业生产安全的重要因素之一。据统计,我国每年因杂草危害造成的农作物产量损失达9.7%[1]。稗草(Echinochloacrusgalli)生态适应性强,在我国分布广泛,是我国严重危害作物产量安全的18种恶性杂草之一[2]。稗草生育期与相应作物生育期高度一致,且根系发达,吸收水分和养分能力强,易与田间农作物争夺水分、养分、光照和空间等条件,是我国水稻(Oryzasativa)、玉米(Zeamays)和小麦(Triticumaestivum)等粮食作物上危害最严重的杂草之一[3]。目前,对稗草的防除主要通过化学防除方法,该方法简单易行,经济有效。但是,化学除草剂的长期使用不仅造成环境污染,更会引起高抗性杂草的产生,从而使得化学药剂的使用陷入单纯剂量逐渐增加的恶性循环[4-5]。例如,早在1993年,黄炳球等[6]就已报道稗草对丁草胺和禾草丹产生了明显的抗药性;而随着近年来二氯喹啉酸在我国的大规模推广使用,我国各主要水稻产区的稗草对二氯喹啉酸已经产生了不同程度的抗药性[7]。
杂草生物防治菌株多采集于自然界,毒性低,具有长效防治的特点,是减少化学药品大量使用的有效手段[5]。利用生物防除杂草已有200多年历史,我国是应用生物防除杂草较早的国家之一,如20世纪60年代中期研制并推广的“鲁保一号”菌剂,为我国在生物除草剂研究应用方面打下良好的基础[8]。近年来在诸多科研人员的重视下,我国在杂草生物防治上也取得了一定成果。初步建立起了以稗草-新月弯孢(Culvularialunata)[9]、稗草-尖角突脐孢(Exserohilummonoceras)[10],马唐(Digitariasanguinalis)-画眉草弯孢(Curvulariaeragrostidis)[11]和空心莲子草(Alternantheraphiloxeroides)-假隔链格孢菌(Nimbyaalternantherae)[12]等生物除草剂研究的技术体系,但是我国生物除草剂产品尚处于初期阶段,需要进一步研究并开发成为可替代化学除草剂的新型生物除草剂。
生物除草剂具有对目标杂草选择性高、环境负效应小、对作物安全性高等优点[13],符合可持续农业的发展要求,已受到世界各国的高度重视,纷纷致力于该领域的开发与研究。本实验室于2013年对山东省主要杂草病原真菌进行调查和分离,并从山东齐河的感病稗草叶片上分离得到1株具有强致病力的菌株BC-1,并对其进行了形态学和分子生物学鉴定、生物学特性、生防效果和作物安全性评估等的研究,以期为进一步研究和下一步的应用提供理论依据。
1 材料与方法
1.1材料
供试植物:稗草、马唐、狗尾草(Setariaviridis)、反枝苋(Amaranthusretroflexus)和播娘蒿(Descuminiasophia)等杂草种子均为本实验室采集并保存。玉米、小麦和水稻种子均购自种子公司。玉米品种为鲁单981,小麦品种为济麦22,水稻品种为郑旱6号。
本研究所用培养基马铃薯葡萄糖培养基(potato dextrose agar, PDA)、马铃薯蔗糖培养基(potato sucrose agar, PSA)、葡萄糖蛋白胨培养基(peptone dextrose agar, SDA)、真菌培养基(fungi medium, ZJ)、水琼脂培养基(water)和稗草汁液培养基(baicao juice medium, BC)等基本配方参考李健等[14]和方中达[15]的方法。碳源基础培养基和氮源基础培养基的配方参考李健等[14]的方法配制。
1.2病原菌的分离纯化
参照康慧颖等[16]和Han等[17]的方法对病原菌进行分离纯化。自然感病的稗草叶片从山东省齐河县果园中采集,放于信封内于4 ℃保存,用于病原菌分离。首先将感病的稗草叶片用无菌水冲洗2次,剪下病叶的病健结合部位,用5%(v/v)次氯酸钠溶液和70% (v/v)酒精分别进行表面消毒2和1 min,最后用无菌水漂洗2~3次后将组织转移至新的灭菌培养皿内,超净台内吹干。以上步骤均在超净工作台中进行操作。将吹干后的叶片组织铺于PDA培养基表面,置于28 ℃培养箱培养,待长出菌落后挑取菌丝至新的PDA培养皿内,培养至产孢并经过单孢子分离、纯化得到纯培养菌菌株,并编号为BC-1。
1.3菌株的鉴定
1.3.1形态鉴定将菌株BC-1在PDA平板上培养10 d,期间观察并记录其菌落形态。同时用无菌水将培养基表面的分生孢子洗下,制成分生孢子悬浮液,调节浓度至1×104个孢子/mL左右。显微镜下观察菌株BC-1的分生孢子形态;对照魏景超[18]编著的《真菌鉴定手册》,对菌株BC-1进行形态学鉴定。
1.3.2分子鉴定用CTAB法提取菌株BC-1的基因组DNA[19],采用引物ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)和ITS5 (5′-GGAAGTAAAAGTCGTAACAAGG-3′)进行PCR扩增,将PCR产物回收后送至上海生物工程有限公司进行PCR产物测序。将测得序列提交到NCBI(National Center for Biotechnology information,美国生物信息中心,http://www.ncbi.nlm.nih.gov)的GeneBank进行BLAST分析,利用MEGA 6.0软件构建系统发育树。
1.4影响菌株BC-1菌丝生长的因子的测定
1.4.1培养基对菌株BC-1菌丝生长的影响PDA培养基活化保存的菌株,5 d后,在菌落的边缘打取直径为5 mm的菌饼,接种到各供试培养基上,10 d后测量菌落直径;并收集菌丝,80 ℃烘箱烘烤2 h后称量菌丝干重(下同)。
1.4.2温度对菌株BC-1菌丝生长的影响以PDA培养基为基础培养基,接菌后将温度条件设置为19,22,25,28,31和34 ℃测定温度条件对菌株生长的影响,接菌10 d后,测量菌落直径及菌丝重量。
1.4.3光照时间对菌株BC-1菌丝生长的影响以PDA培养基为基础培养基,接菌后光照条件设置为连续黑暗、光照/黑暗(8 h/16 h、12 h/12 h、16 h/8 h)交替和持续光照5个处理测定光照条件对菌株生长的影响,接菌10 d后,测量菌落直径及菌丝重量。
1.4.4pH值对菌株BC-1菌丝生长的影响将PDA培养基灭菌后调制成不同pH值,设置的pH值为4,5,6,7,8,9,参照1.2.1的方法,25 ℃,黑暗条件下培养10 d后,统计菌落直径和菌丝重量。
1.4.5碳氮源对菌株BC-1菌丝生长的影响在碳源基础培养基上分别添加相应量(20 g/L)葡萄糖、麦芽糖、蔗糖、可溶性淀粉、乳糖,观察并统计菌落生长情况;在氮源基础培养基上分别添加相应量(1 g/L)硝酸钠、硝酸钾、硝酸钙、硝酸铵、硫酸铵5种氮源,25 ℃,黑暗条件下培养10 d,观察并统计菌落生长情况。
以上各试验均于2015年进行,均设置3次重复。
1.5寄主范围测定
将BC-1接种于PDA平板培养基,25 ℃、黑暗培养14 d后,收集孢子并配制成浓度为1×108个/mL的孢子悬浮液(含0.05%的吐温80)。将孢子悬浮液喷施2叶期稗草、马唐和狗尾草等杂草植株上,28 ℃、黑暗保湿培养2 d后,持续光照培养。观察菌株的致病特性。以喷施0.05%吐温80的植株为对照,每个处理设置3次重复。
1.6作物安全性测定
将浓度为1×108个/mL 的孢子悬浮液[20](含0.05%的吐温80)喷施2~3叶期玉米、小麦和水稻植株,培养方法同1.4。接种7 d后,观察菌株对供试玉米、小麦和水稻的安全性。21 d后收集作物地上部分,称量鲜重,并统计鲜重抑制率。
1.7数据分析
鲜重抑制率(fresh weight inhibition rate,FWIR)的计算公式:FWIR(%)=[(对照平均鲜重-处理平均鲜重)/对照平均鲜重]×100。利用SPSS统计软件ANOVA和GLM分析不同处理间的差异显著性。
2 结果与分析

图1 生防菌BC-1菌落与分生孢子Fig.1 Colony and conidia of BC-1 strain A:BC-1菌落Colony of BC-1 strain;B:分生孢子Conidia of BC-1 strain.
2.1病原菌的分离与鉴定
BC-1菌株在PDA培养基上培养10 d后,菌落直径约8 cm,白色,菌落产生漆黑色粘孢子团(图1A)。显微观察显示(图1B),BC-1菌株分生孢子梭形,无色。表型分析和系统发育树(图2)结果表明,BC-1菌株为露湿漆斑菌(Myrotheciumroridum),属半知菌亚门,壳霉目,杯霉科[21]。
2.2菌株BC-1在不同培养基内生长情况
菌株BC-1在6种不同成分培养基生长情况见表1,在PDA和PSA培养基上长势最好,生长速率较高,培养10 d后菌落直径分别为5.5和5.6 cm,但PSA培养基中的气生菌丝量明显高于PDA培养基(表1),为6种培养基中菌丝重量最高。由稗草汁液配制的BC培养基虽然菌落直径较其他培养基没有较大差别,但是气生菌丝量较少。综上结合产孢量分析,PDA和PSA培养基为最适合BC-1菌株生长和产孢培养基。

图2 BC-1 系统发育树分析Fig.2 Phylogenesis analysis of BC-1 strain

表1 菌株BC-1在不同培养基上的生长速率
注:表中数值为平均值±标准误(n=3),同行数据后的不同字母表示在 0.05 水平上差异显著,下同。
Note: The values in the Table are the average value±the standard error (n=3), and the different letters within the same row indicate that the differences are significant at the 0.05 level. The same below.
2.3温度对BC-1菌株生长的影响
以PDA培养基为基础培养基,研究温度对菌株BC-1生长的影响。由表2可以看出,在22,25和28 ℃培养条件下,菌株BC-1在菌落直径、菌丝产量上没有显著差异,而在22 ℃条件下产孢量显著降低。而当温度低于22 ℃或高于28 ℃时,菌株BC-1在菌落直径、菌丝产量和产孢量上均显著下降。

表2 温度对菌株BC-1生长的影响
2.4光照时长对BC-1菌株生长的影响
以PDA培养基为基础培养基,研究光照时间长短对菌株BC-1生长的影响。由表3可以看出,连续黑暗条件下,菌株BC-1生长情况最好,菌丝产量最高。根据菌株BC-1在不同光照时长下的生长情况,显示光照对菌株BC-1的生长有一定抑制作用,且随着光照时间的增长,抑制作用更为明显。
2.5pH值对菌株BC-1生长的影响
由表4可以看出,菌株BC-1在pH值为4~9的培养基上的生长趋势为,菌落直径和菌丝重量均表现为先增加后减少的趋势。菌株BC-1在pH值为6~7时生长最好,当培养基pH值<6和pH>7时生长速率和气生菌丝产生量均开始受到抑制,并且当培养基pH值<5和pH>8都受到明显抑制。
2.6碳氮源对菌株BC-1生长的影响
在以葡萄糖、麦芽糖、蔗糖、淀粉和乳糖为碳源的培养基上对菌株BC-1进行培养时,各培养基的菌落直径均在5.0~6.0 cm,并没有明显差异。但菌丝重量却表现出明显差异,从图3可以看出,菌丝重量从高到低依次为麦芽糖>蔗糖>乳糖>葡萄糖>淀粉。分别以硝酸钠、硝酸钾、硝酸钙、硝酸铵和硫酸铵为氮源进行试验,结果发现,菌株BC-1在以硫酸铵为氮源的培养基上,菌落直径较其他培养基明显减小。菌丝重量从高到低依次为硝酸铵>硫酸铵>硝酸钾>硝酸钠>硝酸钙。综上,菌株BC-1的最佳碳源为麦芽糖;最佳氮源为硝酸铵,其对铵态氮源的利用好于硝态氮源(图3)。

表3 光照时长对菌株BC-1生长的影响
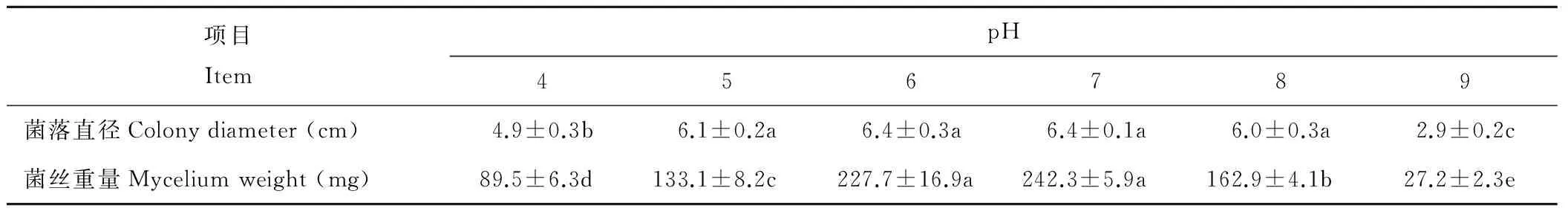
表4 pH值对菌株BC-1生长的影响

图3 菌株BC-1在含不同碳氮源培养基上的生长速率Fig.3 Growth rate of the strain BC-1 in different carbon and nitrogen sources G:葡萄糖Glucose;M:麦芽糖Maltose;S:蔗糖Sucrose;St:淀粉Starch;L:乳糖Lactin.
2.7接种时期对致病力的影响
菌株BC-1对稗草的致病力受接种时期的影响。本研究分别对2~3叶期和4~5叶期的稗草进行接种,结果显示,在相同的接种温度下,2~3叶期的稗草致死率达58.5%,鲜重防效达91.8%,而对4~5叶期的稗草致死率则只有17.2%,鲜重防效也低于2~3叶期(表5)。综上,菌株BC-1对2~3叶期的稗草在致死率和鲜重防效均优于4~5叶期稗草。

表5 接种时期对菌株BC-1致病力的影响
2.8菌株BC-1对不同杂草防效分析
杂草生防实验结果表明,BC-1菌株孢子液对稗草生防效果最佳,接菌21d后稗草发病率为100%,致死率达57.2%,鲜重抑制率达到93.7%;对马唐、狗尾草和反枝苋的生防效果较差,鲜重抑制率仅为33.7%,28.3%,16.8%;反枝苋虽然发病,但是却不致死;而播娘蒿几乎不感病,BC-1对其生长几乎没影响(表6)。
2.9作物安全性分析
作物安全性试验结果(表7)表明,在喷雾7d后,玉米(鲁单981)、小麦(济麦22)和水稻(郑旱6号)叶片没有明显病斑;接菌21d后,玉米、小麦和水稻等作物鲜重没有明显的抑制,表现为安全。
3 结论与讨论
农田杂草与作物竞争光照、生存空间和土壤肥力,造成作物产量损失,化学除草剂的发现与使用在一定程度上释放了劳动力,降低了农业成本,为保障全球粮食安全做出了重要贡献。迄今,化学除草剂已经是使用量最大的农药类别,仅仅草甘膦的使用量就已经占据全球农药市场的近20%[22]。但是随着化学除草剂的大规模持续使用,其带来的负面影响也越来越受到关注,尤其是近些年随着抗性杂草的广泛出现,导致了除草剂倍量使用现象的发生,进一步加剧了除草剂残留等环境危害[23-25]。因此,研制高效、持续且无残留的新型生物除草剂已经显得十分迫切。在我国,随着经济的发展以及在农业上实施的“食品安全”战略,给生物除草剂在我国的研究和发展提供了机遇,使生物除草剂逐渐成为当前研制和开发的热点之一[26]。生物除草剂的筛选主要依据两方面:有效性(对目标杂草防治效果好)和专一性(对目标杂草外的作物安全)[27]。
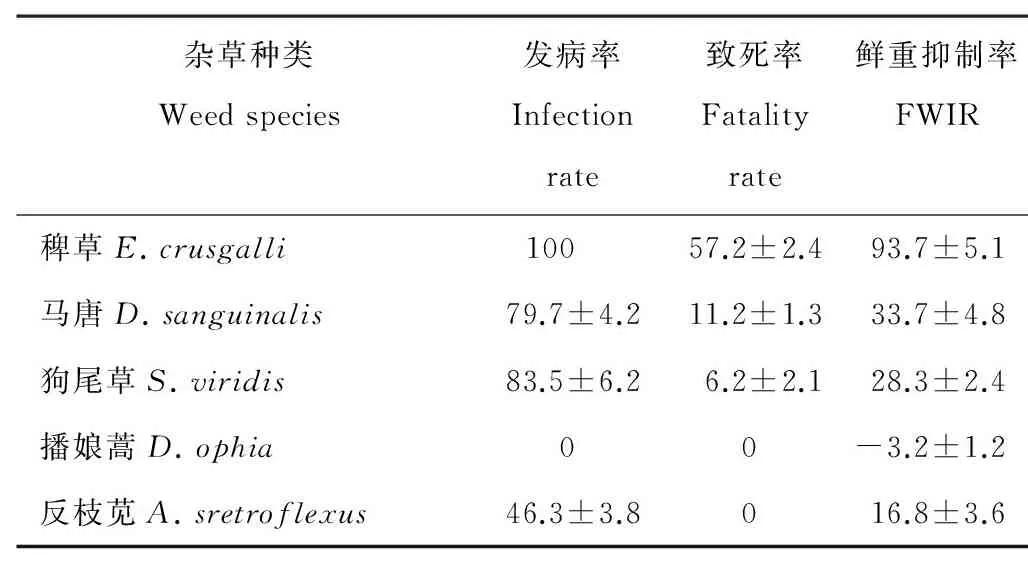
表6 BC-1菌株孢子液对不同杂草生物防效的比较
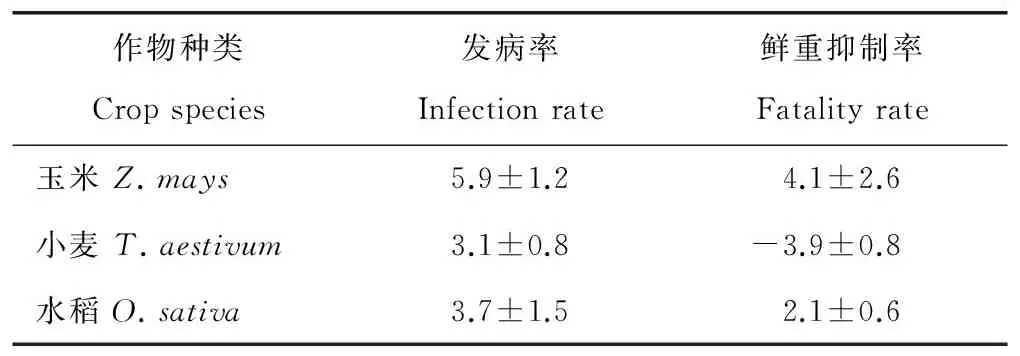
表7 BC-1菌株孢子液对不同作物安全性比较
能够高效地防治目标杂草是生防菌是否有研究价值的基础。BC-1菌株分离自感病的稗草植株,通过室内防效实验,发现菌株BC-1对稗草具有良好的生物防效,具备进一步开发的潜力。该菌株对其他类杂草,例如对马唐、狗尾草、反枝苋等杂草的防治效果则一般;同时BC-1菌株对玉米、小麦和水稻等作物安全性较高。真菌除草剂的大规模使用会在短期内人为地增加使用环境中的该病原菌数量,并因此对环境中的其他作物构成潜在威胁,因此所筛选病原菌对作物安全性也是杂草生防菌研究中的重要问题[28]。生防菌株在对目标杂草具有良好防效的基础上,同时对其他常见作物安全,这就为该菌株的进一步利用扫清了障碍,避免了因生防菌株大规模引入、应用而造成对作物安全的人为危害。
近20年来,美国专利局公布的关于生物除草剂的专利已经达到了90个左右,而加拿大和日本等国家的相关专利申请也分别为17和8个,但是截至目前全球范围内仅有20多个生物除草剂产品登记[29]。这是因为在具备了高效性和专一性后,杂草生防菌初步具备了被开发为生防制剂的潜力,但是否具备开发价值,并进一步开发为除草剂登记产品,还取决于该菌的一系列生物特性,例如培养的难易程度,对培养基和培养条件的要求和生防因子的制备难易等影响[30]。本试验中获得的BC-1菌株易于培养,产孢量高,且未经任何基因修饰,因此将它释放到自然界中不会造成生态环境的安全隐患,是相对安全的生物防治介体。综上所述,菌株BC-1兼备有效性和安全性,显示出该菌具有开发成商品化生物除草剂的巨大潜力。2015年3月,农业部发布了《到2020 年农药使用量零增长行动方案》,就如何提高农药利用效率,减少农药总使用量,改善我国土壤环境问题等方面提出了具体要求,而鉴于微生物源农药的诸多优点,因此微生物源农药的开发显得十分迫切。
References:
[1]Cui A J. Study on the Investigate and Chemistry Controlling of Malignant Weed in Seed Product Field ofAgropyronmongolicumKeng[D]. Hohhot: Inner Mongolia Agricultural University, 2009.
[2]Schroeder D, Mueller S H, Stinson C A S. European weed survey in 10 major crop systems to identify targets for biological control. Weed Research, 1993, 33: 449-458.
[3]Rao A N, Johson D E, Sivaprasad B,etal. Weed management in direct-seeded rice. Advances in Agronomy, 2007, 93(2): 153-255.
[4]Zhang C X, Ni H W, Wei S H,etal. Current advances in research on herbicide resistance. Scientia Agricultura Sinica, 2009, 42(4): 1274-1289.
[5]Qiang S, Chen S G. Current status of bioherbicide research and development and its opportunities and challenges. Weed Science, 2011, 29(1): 1-6.
[6]Huang B Q, Xiao Z Y, Lin S X. The present situation of resistance of the Barnyardgrass to butachlor in the rice planting areas in China. Pesticide Science and Administration, 1993, 14(1): 18-21.
[7]Li Y B, Wu Z H, Chen X,etal. Determination of resistance ofEchinochloacrusgallito quinclorac in the rice planting areas of south China. Chinese Journal of Pesticide Science, 2003, 5(4): 88-92.
[8]Gao Z Y, Gan J E. Biological control of dodder a review on research progress of the bioherbicide “LU BAO No.1”. Chinese Journal of Biological Control, 1992, 8(4): 173-175.
[9]Wei T, Li J, Ni H W. The biological characteristics ofEchinochloacrusgallipathogenCulvularialunatastrain J15. Chinese Journal of Biological Control, 2009, 25(1): 54-59.
[10]Chen Y, Ni H W. Pathogenicity of indigenous fungi toEchinochloacrusgalliand rice. Chinese Journal of Biological Control, 1999, 15(2): 73-76.
[11]Zhu Y Z, Qiang S. Isolation, pathogenicity and pafety ofCurvulariaeragrostidisisolate QZ-2000 as a bioherbicide agent for large crabgrass (Digitariasanguinalis). Biocontrol Science and Technology, 2004, 14: 769-782.
[12]Nie Y F, Chen Z Y, Liu Y F,etal. Conidial production ofNimbyaalternantheraeSF-193 and its pathogenicity toAlternantheraphiloxeroides. Chinese Journal of Biological Control, 2009, 25(3): 260-266.
[13]Liu H L, Liu Y X, Liu X L,etal. Current advances in microbial herbicides research and prospect in China. Journal of Tianjin Agricultural College, 2000, 7(4): 36-39.
[14]Li J, Li Y, Gao X X,etal. The biological characteristics ofDigitariasanguinalispathogenFusariumchlamydosporumstrain ZC201301. Acta Prataculturae Sinica, 2016, 25(3): 234-239.
[15]Fang Z D. Plant Pathology Research Method[M]. Beijing: China Agriculture Press, 2001.
[16]Kang H Y, Wang W, Liu J L,etal. Isolation and identification of two plant-growth promoting endophytes from alfalfa. Microbiology China, 2015, 42(2): 280-288.
[17]Han J, Xia D, Li L,etal. Diversity of culturable bacteria isolated from root domains of moso bamboo (Phyllostachysedulis). Microbial Ecology, 2009, 58(2): 363-373.
[18]Wei J C. Handbook of Fungal Identification[M]. Shanghai: Shanghai Science and Technology Press, 1979.
[19]Zhang Y H, Wei D S, Xing L J,etal. A modified method for isolating DNA from fungus. Microbiology China, 2008, 35(3): 466-469.
[20]Wang X Y, Zhang D D, Gui Y J,etal. Construction of a rapid screening system of pathogenicity-related mutants inVerticilliumdahlia. Scientia Agricultura Sinica, 2015, 48(14): 2747-2756.
[21]Dai F L. Chinese Fungi Confluence[M]. Beijing: Science Press, 1979.
[22]Prado J R, Segers G, Voelker T,etal. Genetically engineered crops: from idea to product. Annual Review of Plant Biology, 2014, 65: 769-790.
[23]Heap I. International survey of herbicide resistant weeds. www.Weedscience.com, 2016-02-21.
[24]Green J M. Current state of herbicides in herbicide-resistant crops. Pesticide Management Science, 2014, 70(9): 1351-1357.
[25]Czaja K, Góralczyk K, Struciński P,etal. Biopesticides-towards increased consumer safety in the European Union. Pesticide Management Science, 2015, 71(1): 3-6.
[26]Zhao H, Zhou Y J, Liu X C,etal. Advances in bioherbicide formulation. Plant Protection, 2005, 31(5): 5-8.
[27]Liu Z S, Liao X L, Ren X G,etal. Study progress on bioherbicide preventing and controlling farmland weeds. Agrochemicals Research and Applicaton, 2007, 11(3): 6-10.
[28]Chen S G, Qiang S. The status and future directions of bioherbicide study and development. Chinese Journal of Biological Control, 2015, 31(5): 770-779.
[29]Qiang S, Song X L, Dai W M. The opportunity and challenge faced by transgenic herbicide-resistant crops and their development strategy. Journal of Agricultural Biotechnology, 2010, 18(1): 114-125.
[30]Li X, Xie M, Tan W Z,etal. Research progress on fungi as weed biological control agents. Chinese Journal of Biological Control, 2009, 25(1): 83-88.
[1]崔爱娇. 蒙农1号蒙古冰草种子田杂草调查与化学防除研究[D]. 呼和浩特: 内蒙古农业大学, 2009.
[4]张朝贤, 倪汉文, 魏守辉, 等. 杂草抗药性研究进展. 中国农业科学, 2009, 42(4): 1274-1289.
[5]强胜, 陈世国. 生物除草剂研发现状及其面临的机遇与挑战. 杂草科学, 2011, 29(1): 1-6.
[6]黄炳球, 肖整玉, 林韶湘. 我国稻区稗草对禾草丹的抗性研究. 农药科学与管理, 1993, 14(1): 18-21.
[7]李拥兵, 吴志华, 陈萱, 等. 我国南方稻区稗草对二氯喹啉酸的抗药性测定. 农药学学报, 2003, 5(4): 88-92.
[8]高昭远, 干静娥. 菟丝子的生物防除—“鲁保一号”的研究进展. 生物防治通报, 1992, 8(4): 173-175.
[9]韦韬, 李静, 倪汉文. 稗草生防菌新月弯孢菌株J15(2)的生物学特性. 中国生物防治, 2009, 25(1): 54-59.
[10]陈勇, 倪汉文. 中国稗草病原真菌对稗草及水稻的致病性. 中国生物防治, 1999, 15(2): 73-76.
[12]聂亚锋, 陈志谊, 刘永锋, 等. 假隔链格孢SF-193的产孢特性及其分生孢子对空心莲子草的致病力. 中国生物防治, 2009, 25(3): 260-266.
[13]刘焕禄, 刘亦学, 刘晓琳, 等. 微生物除草剂研究与建议. 天津农学院学报, 2000, 7(4): 36-39.
[14]李健, 李岩, 高兴祥, 等. 马唐生防菌厚垣孢镰刀菌ZC201301的生物学特性研究. 草业学报, 2016, 25(3): 234-239.
[15]方中达. 植病研究法[M]. 北京: 中国农业出版社, 2001.
[16]康慧颖, 王伟, 刘佳莉, 等. 两株具促生作用的苜蓿内生菌的分离纯化与鉴定. 微生物学通报, 2015, 42(2): 280-288.
[18]魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979.
[19]张颖慧, 魏东盛, 邢来君, 等. 一种改进的丝状真菌DNA提取方法. 微生物学通报, 2008, 35(3): 466-469.
[20]王新艳, 张丹丹, 桂月晶, 等. 大丽轮枝菌致病性相关突变体快速筛选体系的建立. 中国农业科学, 2015, 48(14): 2747-2756.
[21]戴芳澜. 中国真菌总汇[M]. 北京: 科学出版社, 1979.
[26]赵航, 周勇军, 刘小川, 等. 生物除草剂剂型研究进展. 植物保护, 2005, 31(5): 5-8.
[27]刘占山, 廖晓兰, 任新国, 等. 生物除草剂防治研究进展. 农药研究与应用, 2007, 11(3): 6-10.
[28]陈世国, 强胜. 生物除草剂研究与开发的现状及未来的发展趋势.中国生物防治学报, 2015, 31(5): 770-779.
[29]强胜, 宋小玲, 戴伟民. 抗除草剂转基因作物面临的机遇与挑战及其发展策略. 农业生物技术学报, 2010, 18(1): 114-125.
[30]李新, 谢明, 谭万忠, 等. 杂草生防真菌的研究进展.中国生物防治, 2009, 25(1): 83-88.
Isolation and biological characteristics of the biological control fungi BC-1 forEchinochloacrusgalli
LI Jian, LI Mei*, GAO Xing-Xiang, FANG Feng, DONG Lian-Hong
InstituteofPlantProtection,ShandongAcademyofAgriculturalScience,ShandongKeyLaboratoryofPlantVirology,Jinan250100,China
There has been increasing effort in the research and development of biological herbicides because of their low toxicity.Myrotheciumroridum, strain BC-1 was isolated from diseasedEchinochloacrusgallileaves in order to obtain a low toxicity and effective biological herbicide. The BC-1 strain was identified using its culture characters and 16S rDNA sequence analysis. The optimal mycelium growth media were PDA and PSA medium. The optimal culture temperature is 25-28 ℃, and optimal initial pH of culture media was 6-7. Darkness was beneficial for mycelium growth. The optimal mycelium growth carbon source is maltose, and the best nitrogen source was NH4NO3. Additionally, biocontrol testing showed that theE.crusgalliwere all infested with BC-1 21 days after innoculation, and fresh weight inhibition was 93.7%. However, the fresh weight inhibition effects of BC-1 onDigitariasanguinalis,Setariaviridis,DescuminiasophiaandAmaranthusretroflexuswere only 33.7%, 28.3%, -3.2% and 16.8% respectively. Crop safety analysis showed that the strain BC-1 was safe toZeamays,TriticumaestivumandOryzasativa. This study suggests that strain BC-1 has potential to be developed into an effective microbial herbicide with economic and social benefits.
Echinochloacrusgalli; biological characteristics;Myrotheciumroridum; biological control
10.11686/cyxb2015583http://cyxb.lzu.edu.cn
李健, 李美, 高兴祥, 房锋, 董连红. 稗草生防菌BC-1的分离及生物学特性研究. 草业学报, 2016, 25(8): 164-171.
LI Jian, LI Mei, GAO Xing-Xiang, FANG Feng, DONG Lian-Hong. Isolation and biological characteristics of the biological control fungi BC-1 forEchinochloacrusgalli. Acta Prataculturae Sinica, 2016, 25(8): 164-171.
2015-12-31;改回日期:2016-03-25
山东省自然科学基金(ZR2015CQ014)和国家863计划项目(2011AA10206)资助。
Corresponding author. E-mail: limei9909@163.com
