扁蓿豆SK2型脱水素基因MrDHN3的异源表达提高大肠杆菌对盐和高温胁迫的抗性
2016-09-14沈迎芳马超吴小培张业猛王海庆
沈迎芳,马超,吴小培,张业猛,王海庆*
(1.中国科学院西北高原生物研究所,高原适应与进化重点实验室,青海 西宁 810008;2.中国科学院大学,北京 100049)
扁蓿豆SK2型脱水素基因MrDHN3的异源表达提高大肠杆菌对盐和高温胁迫的抗性
沈迎芳1,2,马超1,吴小培1,2,张业猛1,2,王海庆1*
(1.中国科学院西北高原生物研究所,高原适应与进化重点实验室,青海 西宁 810008;2.中国科学院大学,北京 100049)
扁蓿豆为高原高寒地区优质豆科牧草,具有极强的抗旱、耐寒、抗盐碱的能力。脱水素(DHNs)是参与植物逆境应答的一类蛋白。根据前期RNA-seq的结果,从扁蓿豆幼苗中克隆到一个编码脱水素的基因MrDHN3。序列分析显示该基因含666 bp的开放阅读框,编码221个氨基酸,为一个SK2型酸性脱水蛋白。氨基酸序列比对结果表明,MrDHN3与豆科植物白三叶和蒺藜苜蓿相似性最高,达83%。实时荧光定量PCR结果显示,MrDHN3基因受脱水、低温、高盐和脱落酸处理诱导表达,表明MrDHN3参与了扁蓿豆的非生物胁迫响应。通过构建原核表达载体,在大肠杆菌中过表达MrDHN3蛋白,检测重组菌在盐和高温胁迫处理下的生长存活情况。结果发现,在0.5 mol/L NaCl和0.5 mol/L KCl高盐胁迫条件下,重组大肠杆菌的存活率明显高于对照菌株;在55 ℃高温胁迫条件下, 转化大肠杆菌的生长状态明显优于对照。表明MrDHN3对盐和高温引起的细胞损伤具有保护作用。为今后作物抗逆性遗传改良的研究提供了有用信息。
脱水素基因;非生物胁迫;异源表达;扁蓿豆
高盐、低温和干旱等环境胁迫是影响植物生长发育和产量的主要因素,植物作为固着的生物,在长期的进化过程中逐渐演化出了一系列应答机制[1]。其中,脱水蛋白作为一类重要的响应蛋白,在高盐、低温、干旱等脱水的环境胁迫信号刺激及外源ABA处理下积累表达[2]。脱水蛋白属于晚期胚胎发育丰富蛋白(late embryogenesis abundant protein)LEAII家族,为天然无序蛋白,富含甘氨酸,呈高度的亲水性和热稳定性[3],广泛分布于高等植物、藻类、酵母、线虫以及蓝细菌中[4]。脱水蛋白含有至少一个保守的富含赖氨酸的基序K片段(EKKGIMDKIKEKLPG 或其衍生物),它们常形成双亲性螺旋结构。部分脱水蛋白还包含Y片段和S片段,Y片段通常以1~3个重复形式(T/VDEYGNP)出现在脱水蛋白的N-端,S片段由一系列丝氨酸(Ser)残基组成。基于Y,S,K片段出现的类型和数量可将脱水蛋白分为5个亚家族:YnSKn, SKn, Kn,YnKn和KnS型[5-6]。体内和体外实验证明,脱水蛋白对植物抵御环境胁迫发挥重要作用[7]。
扁蓿豆(Medicagoruthenica)为多年生豆科植物,广泛分布于西伯利亚、蒙古利亚和我国北方地区,多生长于山坡草地处[8-9]。Campbell 等[10]指出,扁蓿豆是唯一可适应干旱、高原严寒及贫瘠土壤的豆科苜蓿属植物。鉴于其具有优于苜蓿的抗低温性,扁蓿豆被认为是高原高寒地区优质的豆科牧草[11],也被认为是提高苜蓿作物胁迫耐受性的优异种质资源。近年来国内学者聚焦于牧草高产、优质、抗逆育种的研究,注重与苜蓿产业发展相结合,而对分子遗传基础等机理性研究尚显不足[12]。尽管脱水蛋白基因已从很多物种中克隆出[13],包括豆科植物苜蓿(Medicagotruncatula)、豌豆(Pisumsativum)、大豆(Glycinemax)等[14],但其在扁蓿豆内的分子特性鲜有报道。本研究以扁蓿豆为材料,从中克隆脱水素基因(dehydrin),异源表达到大肠杆菌中,来探讨其在逆境胁迫下可能发挥的作用,以期为牧草抗逆育种提供参考依据。
1 材料与方法
1.1植物材料与处理
扁蓿豆种子承蒙中国农业科学院草原研究所孙启忠研究员惠赠。2013年6月将种子用浓硫酸处理10 min,用无菌水冲洗数次去除残余硫酸。上述经过处理的种子置于铺有湿滤纸的培养皿内,在21 ℃、16 h/8 h光照条件下萌发。3 d后将发芽的幼苗移栽于蛭石∶营养土(3∶1)的混合基质中培养,每周用含1/2 MS营养液浇灌1次。生长3周后对幼苗进行非生物胁迫和脱落酸处理。NaCl胁迫处理:用150 mmol/L NaCl水溶液从花盆底部浇灌至培养基质饱和,处理0,0.5,1,3,6,24 h;脱水胁迫处理:将幼苗洗去砂石后,室温自然脱水0,0.5,1,3,6,12 h;ABA脱落酸处理:将整株幼苗洗净砂石后,转移至铺有多层吸水纸的培养皿中,用含0.05% Tween 20(V/V)的100 μmol/L脱落酸溶液(ABA)喷雾,封盖以防植株脱水,处理0,0.5,1,3,6,12 h;低温胁迫处理:将培养的幼苗转移到4 ℃光照培养箱进行低温处理0,1,4,8,12,24 h。每组处理设3次生物学重复,取样后液氮速冻,-80 ℃冰箱保存备用。
1.2MrDHN3基因的cDNA克隆及序列分析
总RNA的提取采用TRIZOL®试剂(Invitrogen,USA),参照说明书用Recombinant DNase I(RNase-free)(TaKaRa,大连)去除基因组DNA。cDNA 第一链按PrimeScript®RT reagent Kit(Perfect Real Time)(TaKaRa,大连)的操作说明合成。
根据本实验室已有的扁蓿豆转录组测序结果(未发表)设计正向引物MrDHN3F(5′-CGTGTCATTATGTGTAGTAGTGAAG-3′)和反向引物MrDHN3R(5′-TAAACAAAGCACCCTCCA-3′),以低温4 ℃处理24 h的cDNA样为模板,用PyrobestTMDNA聚合酶(TaKaRa,大连)进行PCR扩增。扩增产物胶回收后,用Ex Taq®DNA聚合酶(TaKaRa,大连)进行加尾,然后克隆到pGEM®-T Easy载体(Promega, USA)进行测序。
用DNAMAN软件(Lynnon Biosoft, Vaudreuil-Dorion, Quebec, Canada)分析核酸序列、编码的氨基酸序列以及开放阅读框ORF;用ExPASy 网站上的Protparam(http://au.expasy.org/tools/protparam.htm)软件预测理论等电点(pI)和相对分子量(Mw);用NCBI网站(http://www.ncbi.nlm.nih.gov/)的BlastN、BlastP软件进行核苷酸及蛋白序列相似性检索;用MEGA 6软件[15]构建系统进化树。
1.3MrDHN3基因表达的实时荧光定量PCR分析
将上述不同胁迫处理样品合成的cDNA稀释至50~150 ng/μL为模板,用SYBR®Premix Ex TaqTMII (Perfect Real Time)试剂盒(TaKaRa,大连)进行qRT-PCR,反应体系20 μL,用ViiATM7实时荧光定量PCR系统(Applied Biosystems, Foster City, CA)扩增。反应按两步法PCR标准程序95 ℃ 30 s预变性,95 ℃ 5 s,60 ℃ 30 s,40个循环进行,荧光信号采集在每一循环的第2步:60 ℃ 30 s。目的基因MrDHN3和内参基因Mr18S的qRT-PCR引物用PrimerPrimer 5.0(PREMIER Biosoft International, Silicon Valley, USA)设计。基因的上游和下游引物分别为MrDHN3-qF(5′-GGATGTAACAACTCAACCGCCTG-3′)和MrDHN3-qR(5′-GCAGTCT-TAGGGTGATAACCAGGAA-3′),Mrt18SF(5′-CGCTCCTACCGATTGAAT-3′)和Mrt18SR(5′-GTTACGACT-TCTCCTTCCT-3′)。
用2-ΔΔCt法[16]计算MrDHN3在各非生物胁迫及ABA处理下的相对表达量。每个处理设3次重复,相对定量结果以平均数±标准误表示。
1.4MrDHN3原核表达载体构建
根据已测序的MrDHN3 cDNA序列设计含BamHΙ位点的正向引物MrDHN3-F1(5′-GCGGATCCATGGCTGATCAGGAGAATCAGAAC-3′)和含SacI位点的反向引物MrDHN3-R1(5′-CGCGAGCTCTCAATGAGTAGTAGTCTCATCCTT-3′),扩增MrDHN3基因编码区。扩增的片段测序确认后,用BamHI和SacI双酶切,将酶切后的片段插入到经BamHI/SacI双酶切的pET-30a(Novagen, Madison, WI, USA)原核表达载体内,转化DH5ɑ大肠杆菌菌株,挑选阳性克隆提取质粒,酶切鉴定后,获得重组的原核表达载体pET30a-MrDHN3。
1.5MrDHN3融合蛋白的表达及热稳定性和溶解性分析
按照说明书将重组质粒pET30a-MrDHN3转化到大肠杆菌BL21(DE3)表达菌株内,含pET30a-MrDHN3质粒的BL21(DE3)命名为BL/MrDHN3,只含pET30a的BL21(DE3)为对照,命名为BL/pET30a。在含有50 mg/L卡那霉素(kanamycin, Kan)的LB平板上挑取阳性克隆接种于含50 mg/L卡那霉素的LB液体培养基内,37 ℃振荡培养。约12 h后,按1∶100(V/V)转接到LB培养基内培养2~3 h至OD600达到0.6~0.8后,取1 mL菌液为诱导前样。其余菌液中加入异丙基硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside, IPTG)至终浓度为0.5 mmol/L。诱导3 h后,取1 mL菌液为诱导后样。
离心收集菌体,PB缓冲液重悬,超声5 min完全破碎诱导后菌体细胞,12000 r/min离心15 min。收集上清,将其分成2份,1份于100 ℃ 沸水浴中处理10 min;另1份直接用于电泳分析。收集的4份样品中加入等体积样品缓冲液,100 ℃煮沸10 min,冷却至室温,12000 r/min离心10 min,取10 μL上清液,12% SDS-PAGE进行电泳分析。
1.6异源表达转化子抗逆性实验
1.6.1定性分析大肠杆菌转化和IPTG诱导条件如1.5所述。分别将BL/MrDHN3和对照BL/pET30a进行液体培养,诱导后的菌液OD600至0.9时,用含50 mg/L卡那霉素和0.5 mmol/L IPTG的新鲜液体LB培养基将培养菌液稀释10倍。取原液和稀释菌液进行胁迫处理,用含终浓度为50 mg/L卡那霉素和0.5 mmol/L IPTG的LB固体培养基为非胁迫对照。盐胁迫实验中,以分别添加有0.5 mol/L NaCl和0.5 mol/L KCl的LB固体培养基为盐胁迫处理;热胁迫实验中,将原菌液和稀释菌液在55 ℃水浴中温育30 min为热胁迫处理。取10 μL菌液滴加到上述平板上,37 ℃倒置培养16 h(热胁迫处理)、3 d(盐胁迫处理)后观察菌体生长情况。
1.6.2定量分析大肠杆菌培养、IPTG诱导及胁迫处理条件同1.6.1定性分析。稀释10倍的菌液,取100 μL均匀涂布于上述非胁迫和胁迫处理的平板上,37 ℃倒置培养16 h(热胁迫处理)、3 d(盐胁迫处理)后菌落计数,按如下公式分析菌落形成率。

2 结果与分析
2.1MrDHN3基因克隆与序列分析
根据已有的扁蓿豆转录组数据设计引物,采用RT-PCR方法从低温处理24 h的扁蓿豆幼苗中扩增得到约900 bp的特异片段(图1A),将其命名为MrDHN3。该片段经胶回收,进行载体连接,并测序。测序结果显示该cDNA长890 bp,含有666 bp的开放阅读框,编码221个氨基酸。ProtParam预测该基因编码蛋白的分子量(Mw)为24.84 kD,理论等电点(pI)为5.56,为酸性蛋白。总平均疏水性指数(grand average of hydropathicity,GRAVY)为-1.444,表明具有较高的亲水性。MrDHN3蛋白含有1个S片段和2个富含赖氨酸的K片段,为典型的SK2型脱水蛋白(图1B)。
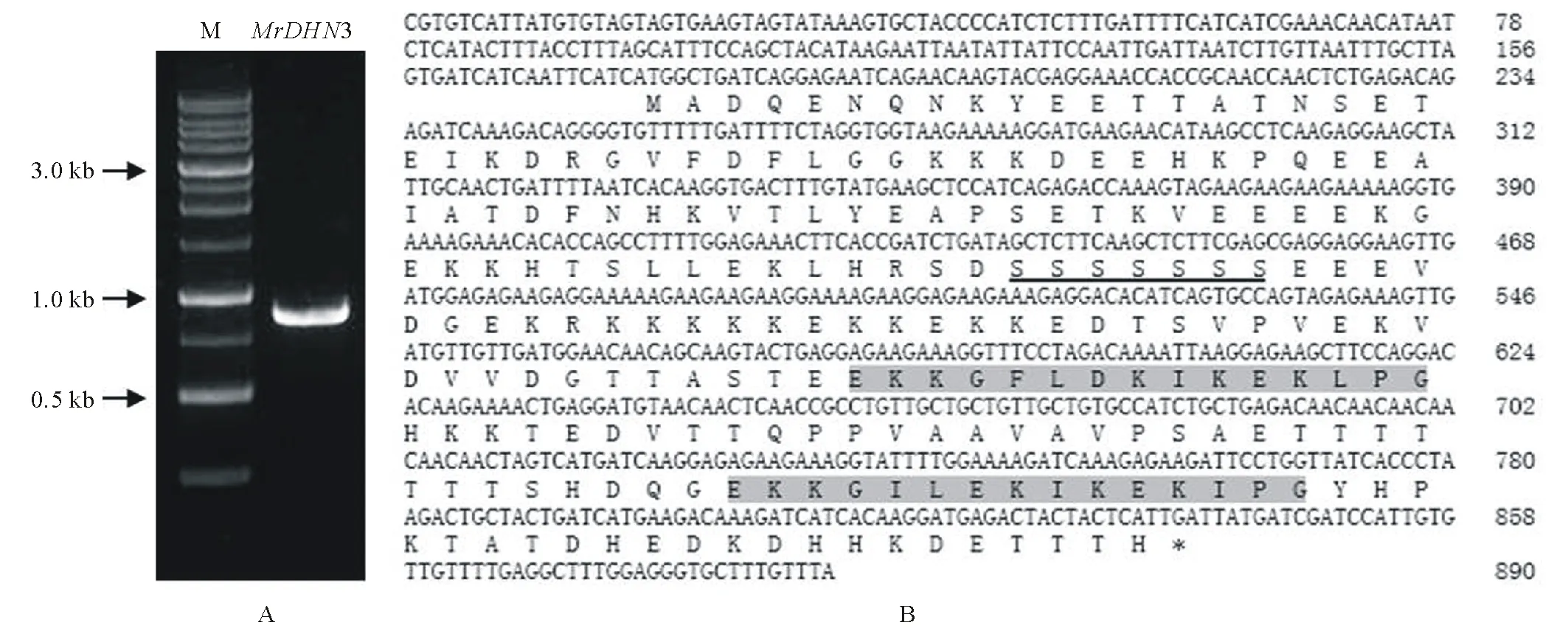
图1 扁蓿豆MrDHN3基因的cDNA克隆(A)及序列分析(B)Fig.1 Cloning and sequence analysis of cDNA for MrDHN3 gene from M. ruthenica A:扁蓿豆MrDHN3基因RT-PCR产物扩增;M:1 kb DNA Ladder;B:扁蓿豆MrDHN3的cDNA序列及其编码的氨基酸序列,脱水蛋白预测的S片段用下划线标出,3个保守的K片段用阴影标出。A: RT-PCR products of MrDHN3 from M. ruthenica; M: 1 kb DNA Ladder; B: Nucleotide sequence of the MrDHN3 cDNA and its deduced amino acids, the DHN deduced S-segment is underlined and the conserved three K-segments are marked as shadow edge.
编码MrDHN3的氨基酸序列经NCBI数据库中的BlastP分析,发现其与白三叶(Trifoliumrepens)、蒺藜苜蓿(Medicagotruncatula)、豌豆(Pisumsativum)、鹰嘴豆(Cicerarietinum)等豆科植物DHN蛋白家族成员具有高度一致性,相似性达77%,其中与白三叶和蒺藜苜蓿中DHN蛋白的一致性最高,达83%。在GenBank中选取部分DHN蛋白,进一步用 DNAMAN 软件进行氨基酸序列比对(图2),结果显示比对的DHN蛋白均含有保守结构域S片段和2个K片段,为SK2型脱水蛋白。
用MEGA6对NCBI下载的6个物种SKn型脱水蛋白氨基酸序列构建系统进化树(图3),分析结果显示,MrDHN3与豆科植物豌豆SK2蛋白的亲缘关系最近。而与禾本科的小麦(Triticumaestivum)、粳稻(OryzasativaJaponica Group),芭蕉科大蕉(MusaABB Group)的亲缘关系较远。豆科不同物种聚为一组,禾本科不同物种聚为一组,其他科植物为另一组,说明DHN蛋白具有种属特性。

图2 MrDHN3脱水蛋白与其他物种SKn类DHN脱水蛋白的氨基酸序列比对Fig.2 Alignment of amino acid sequences of MrDHN3 and other SKn-type dehydrin proteins 实线方框示DHN脱水蛋白的保守结构区段S片段;虚线方框示DHN脱水蛋白的保守结构区段K片段;The conserved S-segment and K-segment of MrDHN3 and other SKn-type dehydrin proteins are boxed;TrDHN3:白三叶T. repens (ADD09573.1);MtDHN3:蒺藜苜蓿M. truncatula (XP_003603987.1); PsDHN3:豌豆P. sativum (CAA78515.1); CaDHN3:鹰嘴豆C. arietinum (XP_004500781.1).
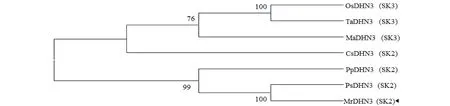
图3 MrDHN3脱水蛋白与其他物种SKn类脱水蛋白构建的系统进化树Fig.3 Phylogenetic tree between MrDHN3 and other SKn-type dehydrin proteins OsDHN3:粳稻O. sativa Japonica Group (ABS44866.1);TaDHN3:小麦T. aestivum (AAB18202.1);MaDHN3:大蕉Musa ABB Group (AEI54683.1);CsDHN3:茶Camellia sinensis (ACT10283.1);PpDHN3:桃Amygdalus persica (AAZ83586.1); PsDHN3:豌豆P. sativum (AAL50315.1).
2.2MrDHN3基因在非生物胁迫下表达特性
为分析MrDHN3是否受非生物胁迫和ABA处理诱导表达,以组成型表达的基因Mr18S为内参,利用实时荧光定量PCR定量检测MrDHN3基因在各非生物胁迫,低温、高盐、室温脱水以及外源ABA处理下的相对表达量(图4)。结果显示,MrDHN3基因在不同处理条件下的表达特性是有差异的。在低温(图4A)和脱水胁迫(图4C)处理下,MrDHN3的表达量呈逐步上升的趋势,在胁迫处理24和12 h时相对表达量达到最高,分别约为对照的2.7和6.9倍;不同于低温和脱水胁迫,MrDHN3的相对表达量在NaCl胁迫(图4B)1 h时快速积累达到对照的4.8倍,在ABA处理(图4D)3 h时达到对照的6倍,之后逐渐降低到与对照相当的表达水平。由此可见,MrDHN3基因的表达受各种非生物胁迫和ABA的诱导。表明MrDHN3基因参与了ABA及干旱、低温、盐等非生物胁迫应答反应。
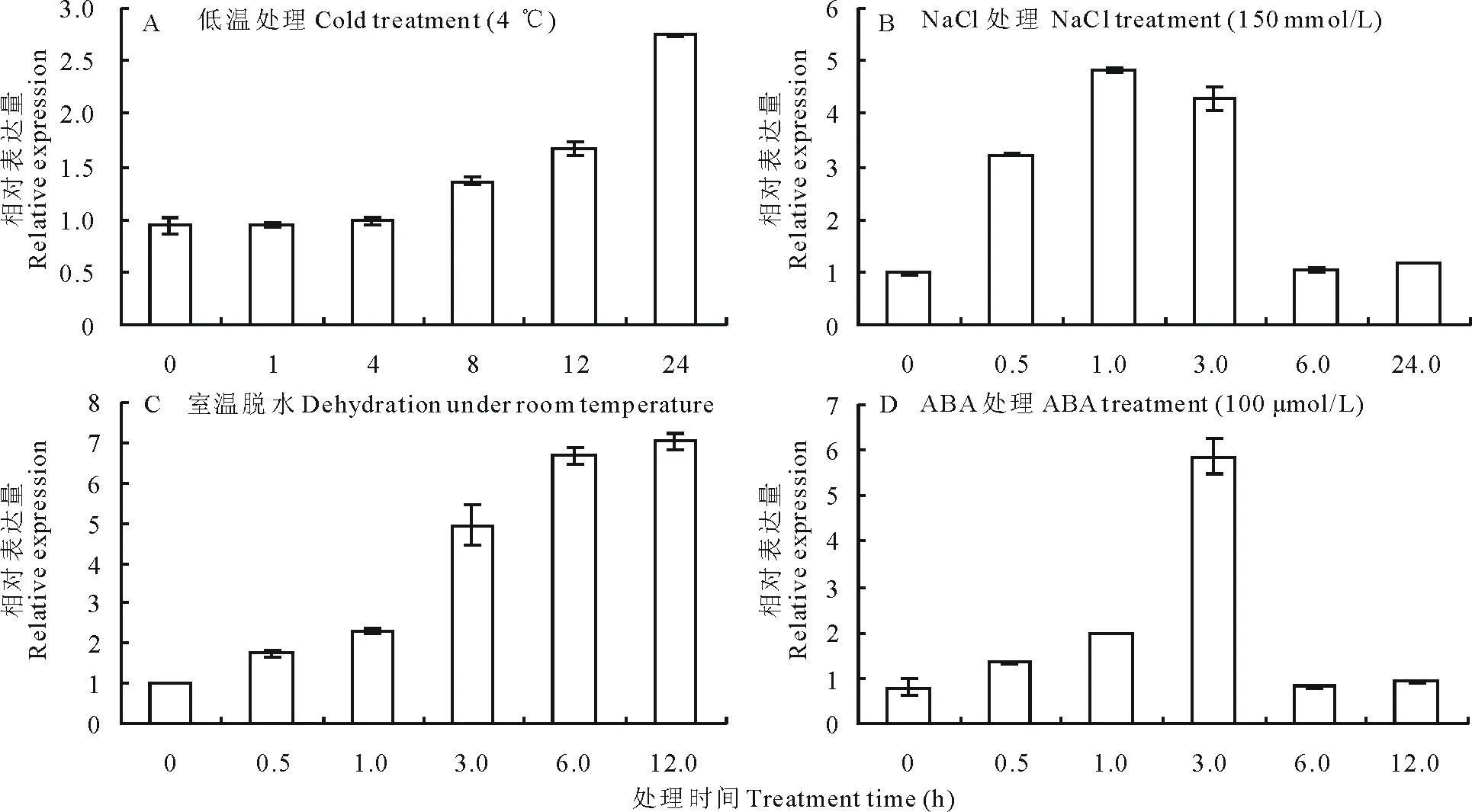
图4 扁蓿豆MrDHN3基因在不同非生物胁迫及ABA处理下的实时荧光定量PCR分析Fig.4 Relative expression patterns of MrDHN3 gene in M. ruthenica under various abiotic stresses and ABA treatment
2.3MrDHN3原核表达载体的构建及蛋白的表达特性分析
为了解MrDHN3在体外非生物胁迫下可能的功能,将MrDHN3基因的编码区经BamHI和SacI双酶切后,重组到pET30a表达载体内,得到重组质粒pET30a-MrDHN3。构建的表达载体pET30a-MrDHN3经酶切鉴定(图5A)后,以pET30a为对照,转入大肠杆菌表达菌株BL21(DE3)。
含重组质粒的菌体经IPTG诱导培养2 h,用SDS-PAGE电泳分析蛋白表达(图5B)。与诱导前的样相比(图5B-1),图5B-2显示1条约28 kD蛋白出现在诱导表达的BL/MrDHN3中,表明重组蛋白成功表达。但表达的蛋白比融合蛋白的理论分子量略大,推测可能是MrDHN3含有大量亲水结构域并且重组蛋白N-端含有碱性残基的His-标签序列,阻滞了重组蛋白在SDS-PAGE中的泳动,导致表观分子量变大。
诱导表达的菌体破碎后离心,表达的大部分蛋白出现在上清液中(图5B-3)。另外,经沸水浴处理后,上清液中仍有目标蛋白存在(图5B-4),这些结果表明目标蛋白MrDHN3在大肠杆菌中具有一定的亲水性和热稳定性。
2.4过表达MrDHN3对大肠杆菌的逆境胁迫保护
为检测不同逆境胁迫条件下过表达MrDHN3对重组大肠杆菌的作用,将BL/pET30a和BL/MrDHN3菌体滴加到含不同胁迫因子的LB培养基上,观察菌落形成情况(图6A)。结果显示,BL/MrDHN3和对照BL/pET30a之间在克隆形成数和生长速率方面没有明显的差别;当LB培养基上添加了0.5 mol/L NaCl后,重组菌的数量明显高于对照BL/pET30a,添加0.5 mol/L KCl的结果与之相同。以上结果表明过表达MrDHN3能显著增强大肠杆菌对盐的耐受性。在热胁迫下,经55 ℃胁迫处理30 min后大部分BL/pET30a菌死亡。而同样条件下,BL/MrDHN3的菌体存活率高于对照。该结果表明,过表达MrDHN3能显著增强大肠杆菌对高温胁迫的抗性。
菌落计数结果(图6B)显示,在0.5 mol/L NaCl和KCl高盐胁迫下,BL/MrDHN3的菌落形成率分别为16.71%和20.80%,对照BL/pET30a的菌落形成率仅为3.55%和4.29%;55 ℃高温处理后,BL/MrDHN3的菌落形成率为11.22%,对照BL/pET30a的菌落形成率为2.40%。胁迫条件下,BL/MrDHN3的菌落形成率是BL/pET30a的4~5倍,表明MrDHN3能显著增强宿主菌对盐和热的抗性,与菌落定性分析结果一致。
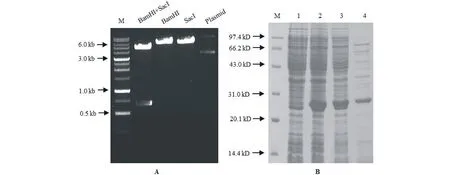
图5 MrDHN3原核表达载体的鉴定(A)及原核表达产物的SDS-PAGE分析(B)Fig.5 Identification of pET30a-MrDHN3 by enzymatic digestion (A) and analysis of prokaryotic expression products by SDS-PAGE (B) M:1 kb DNA Ladder(A),低分子量标准蛋白(B);1:IPTG诱导前的BL/MrDHN3表达产物;2:IPTG诱导后的BL/MrDHN3表达产物;3:上清液中诱导表达的BL/MrDHN3;4:上清液100 ℃处理10 min后的表达产物。M: 1 kb DNA Ladder (A), LMW Markers Proteins (B); Lane 1: Total protein fraction from non-induced BL/MrDHN3 cells; Lane 2: Total protein fraction from IPTG-induced BL/MrDHN3 cells; Lane 3: Soluble supernatant protein fraction from IPTG-induced BL/MrDHN3 cells; Lane 4: Protein fraction from soluble supernatant, which boiled at 100 ℃ for 10 min.

图6 MrDHN3蛋白过表达对大肠杆菌在逆境胁迫下的保护效果Fig.6 Effects of MrDHN3 over-expression on protection of E. coli against injury under abiotic stresses A:菌液滴板试验;B:菌落形成率测定;BL/pET30a:含有pET30a(+)质粒的BL21(DE3)大肠杆菌;BL/MrDHN3:含有pET30a-MrDHN3质粒的BL21(DE3)大肠杆菌;LB:Luria-Bertani (LB)固体培养基添加有0.5 mmol/L IPTG;LB+0.5 mol/L NaCl:LB固体培养基添加0.5 mmol/L IPTG和0.5 mol/L NaCl;LB+0.5 mol/L KCl:LB固体培养基添加0.5 mmol/L IPTG和0.5 mol/L KCl; LB(55 ℃,30 min):55 ℃热处理30 min。A: Spotting assays; B: Colony forming efficiency assays; BL/pET30a: pET-30a(+) plasmid harboring BL21(DE3) strain; BL/MrDHN3: pET30a-MrDHN3 plasmid harboring BL21(DE3) strain; LB: Luria-Bertani (LB) solid medium with 0.5 mmol/L IPTG; LB+0.5 mol/L NaCl: LB solid medium with 0.5 mmol/L IPTG and 0.5 mol/L NaCl; LB+0.5 mol/L KCl: LB solid medium with 0.5 mmol/L IPTG and 0.5 mol/L KCl; LB (55 ℃,30 min): Incubation at 55 ℃ for 30 min.
3 讨论
脱水素(dehydrin)为LEA 蛋白DII家族成员。本研究所克隆的MrDHN3基因含1个S片段和2个K片段,为SK2 类脱水蛋白。SKn类脱水蛋白是一类酸性蛋白,受低温、高盐、干旱、机械损伤及脱落酸信号的调节[17]。小麦wzy1-2基因编码一个SK3类脱水蛋白,其mRNA的表达量在低温、渗透胁迫及ABA诱导下上调[18]。紫花针茅(Stipapurpurea)SK3型脱水蛋白基因SpDHN1在干旱胁迫时表达[19]。本研究中扁蓿豆SK2型脱水蛋白基因MrDHN3在低温、干旱、盐及ABA处理下表达都有上调,由此推测MrDHN3的表达与积累和扁蓿豆抗逆性之间存在正相关关系。
众多研究为异源表达dehydrins(DHNs)基因能增强植物和细菌的非生物胁迫抗性提供了直接的证据。Ochoa-Alfaro等[20]发现转扭刺仙人掌(Opuntiastreptacantha)SK3型脱水蛋白基因OpsDHN1的拟南芥(Arabidopsisthaliana)抗冻能力提高。Lakshmi等[21]研究发现,超表达高粱(Sorghumbicolor)SK2型脱水蛋白基因SbDHN1到烟草(Nicotianatabacum)中可以增强其对干旱和盐胁迫的抗性。目前,关于原核表达植物脱水蛋白基因提高大肠杆菌抗性的研究也有很多。原核表达大豆(Glycinemax)KS型脱水基因SLT1629可提高大肠杆菌抗盐能力[22]。过表达沙冬青(Ammopiptanthusmongolicus)KS类脱水蛋白AmCIP到大肠杆菌可增强宿主菌对低温胁迫的耐受性[23]。本研究将MrDHN3编码区连接到pET30a表达载体上,异源表达MrDHN3到大肠杆菌中,发现MrDHN3与维持大肠杆菌在盐和高温胁迫条件下的存活有密切联系,说明植物基因可以提高宿主菌的抗胁迫能力。基于以上研究,可以推测原核和真核生物在胁迫条件下可能具有相似的保护机制。
高盐和极端温度胁迫会引起胞内脱水,也可导致蛋白及细胞膜的损伤[24]。本研究显示,重组的大肠杆菌细胞对盐和高温胁迫的抗性增强,表明过表达扁蓿豆MrDHN3基因可以使宿主菌的蛋白、细胞膜、细胞免受损伤。本研究预测扁蓿豆MrDHN3基因编码一个酸性蛋白,总平均疏水性指数为-1.444,具有较高的亲水性。在大肠杆菌BL21(DE3)中表达的MrDHN3呈水溶性和热稳定性。有报道指出,脱水蛋白含有高比例的亲水性氨基酸残基,在水溶液中呈高度无序的柔性状态[25]。当处于脱水环境下,其构象会发生改变,K片段可形成双亲性a-螺旋结构[26],可与其他蛋白部分脱水的表面及生物膜表面相互作用,进而保护该蛋白免受更进一步脱水导致的不可逆的蛋白变性[27]。S片段可以被酪蛋白激酶磷酸化[28],从而具有Ca2+结合活性[29]。此外DHNs中的组氨酸也可与Cu2+、Zn2+、Mn2+和Fe2+等金属离子结合[30]。因此可以推测,在逆境胁迫条件下,MrDHN3中的K片段可维持膜系统的稳定性,防止其在高温下的聚集;酸性的SKn蛋白可作为离子缓冲液或伴侣分子稳定受胁迫细胞的蛋白、核酸和膜结构,减少细胞脱水过程中盐分沉淀和结晶,从而减轻高盐胁迫对重组菌的毒害,提高转化子的存活率。
本研究中,虽然MrDHN3蛋白可明显提高大肠杆菌的耐盐和耐高温能力,但对低温胁迫及山梨醇和甘露醇模拟的渗透胁迫未表现出明显的抗性,其可能的原因是MrDHN3对不同胁迫保护存在机制上的差异性。这与Zhang等[31]和Lan 等[32]的研究结果类似,他们发现不同组的LEA基因在渗透胁迫中的保护机制不同。
总之本研究克隆并分析了扁蓿豆MrDHN3基因,结果表明,MrDHN3为SK2类LEAII蛋白,MrDHN3基因受脱水等非生物胁迫及外源激素ABA诱导表达,异源表达MrDHN3蛋白到大肠杆菌中能显著增强宿主菌对盐和高温的胁迫耐受性。推测超表达MrDHN3在提高植物的逆境胁迫耐受性方面有一定的作用,以后可用于作物抗逆基因工程改良研究中。未来,对于过表达MrDHN3到植物体中是否能提高作物的抗胁迫能力还有待进一步研究。
References:
[1]Hanin M, Brini F, Ebel C,etal. Plant dehydrins and stress tolerance: versatile proteins for complex mechanisms. Plant Signaling & Behavior, 2011, 6(10): 1503-1509.
[2]Tunnacliffe A, Wise M J. The continuing conundrum of the LEA proteins. Naturwissenschaften, 2007, 94(10): 791-812.
[3]Allagulova C R, Gimalov F R, Shakirova F M,etal. The plant dehydrins: structure and putative functions. Biochemistry (Moscow), 2003, 68(9): 945-951.
[4]Close T J. Dehydrins: a commonalty in the response of plant to dehydration and low temperature. Physiologia Plantarum, 1997, 100(2): 291-296.
[5]Close T J, Bray E A. Plant Responses to Cellular Dehydration during Environmental Stress[C]. Riverside Symposium in Plant Physiology 1993: University of California, Riverside. American Society of Plant Physiologists, 1993.
[6]Campbell S A, Close T J. Dehydrins: genes, proteins, and associations with phenotypic traits. New Phytologist, 1997, 137: 61-74.
[7]Hara M. The multifunctionality of dehydrins: an overview. Plant Signaling & Behavior, 2010, 5(5): 503-508.
[8]Small E, Jomphe M. A synopsis of the genusMedicago(Leguminosae). Canadian Journal of Botany, 1989, 67(11): 3260-3294.
[9]Hao J H, Shi F L. Study on drought resistance ofMedicagoruthenicaaccessions. Chinese Journal of Grassland, 2006, 28: 39-42.
[10]Campbell T A, Bao G, Xia Z L. Completion of the agronomic evaluations ofMedicagoruthenica[(L.) Ledebour] germplasm collected in Inner Mongolia. Genetic Resources and Crop Evolution, 1999, 46(5): 477-484.
[11]Yang J Y, Zheng W, Tian Y,etal. Effects of various mixed salt-alkaline stresses on growth, photosynthesis, and photosynthetic pigment concentrations ofMedicagoruthenicaseedlings. Photosynthetica, 2011, 49(2): 275-284.
[12]Liu Z Y, Li X L, Qi X,etal. Alfalfa science research by Chinese scholars science 1950: history and main topics. Acta Prataculturae Sinica, 2015, 24(10): 58-69.
[13]Rorat T. Plant dehydrins-tissue location, structure and function. Cellular & Molecular Biology Letters, 2006, 11(4): 536-556.
[14]Battaglia M, Covarrubias A A. Late Embryogenesis Abundant (LEA) proteins in legumes. Frontiers in Plant Science, 2013, 4: 190.
[15]Tamura K, Stecher G, Peterson D,etal. MEGA6: molecular evolutionary genetics analysis version 6.0. Molecular Biology and Evolution, 2013, 30(12): 2725-2729.
[16]Schmittgen T D, Livak K J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols, 2008, 3(6): 1101-1108.
[17]Kalemba E M, Bagniewska-Zadworna A, Ratajczak E. Multiple subcellular localizations of dehydrin-like proteins in the embryonic axes of common beech (FagussylvaticaL.) seeds during maturation and dry storage. Journal of Plant Growth Regulation, 2015, 34(1): 137-149.
[18]Zhu W, Zhang D, Lu X,etal. Characterisation of an SKn-type dehydrin promoter from wheat and its responsiveness to various abiotic and biotic stresses. Plant Molecular Biology Reporter, 2014, 32(3): 664-678.
[19]Yang Y, Sun X, Yang S,etal. Molecular cloning and characterization of a novel SK3-type dehydrin gene fromStipapurpurea. Biochemical and Biophysical Research Communications, 2014, 448(2): 145-150.
[20]Ochoa-Alfaro A E, Rodríguez-Kessler M, Pérez-Morales M B,etal. Functional characterization of an acidic SK3 dehydrin isolated from anOpuntiastreptacanthacDNA library. Planta, 2012, 235(3): 565-578.
[21]Lakshmi T V, Varalaxmi Y, Yadav S K,etal. Metabolic engineering of SK2-type of dehydrin1 (DHN1) gene isolated fromSorghumbicolorenhances tolerance to water-deficit and NaCl stresses in transgenic tobacco. Plant Omics, 2015, 8(6): 556.
[22]Chung E S, Cho C W, Kim K M,etal. Ectopic expression of soybean KS-type dehydrin, SLTI66 and SLTI629 conferred tolerance against osmotic and metal stresses ofEscherichiacoliandArabidopsis. Journal of Plant Biotechnology, 2009, 36(1): 38-44.
[23]Shi J, Liu M, Chen Y,etal. Heterologous expression of the dehydrin-like protein gene AmCIP fromAmmopiptanthusmongolicusenhances viability ofEscherichiacoliand tobacco under cold stress. Plant Growth Regulation, 2015, 79(1): 1-10.
[24]Wang W, Vinocur B, Altman A. Plant responses to drought, salinity and extreme temperatures: towards genetic engineering for stress tolerance. Planta, 2003, 218: 1-14.
[25]Mouillon J, Eriksson S K, Harryson P. Mimicking the plant cell interior under water stress by macromolecular crowding: disordered dehydrin proteins are highly resistant to structural collapse. Plant Physiology, 2008, 148: 1925-1937.
[26]Graether S P, Boddington K F. Disorder and function: a review of the dehydrin protein family. Frontiers in Plant Science, 2014, 5: 576.
[27]Rahman L N, Chen L, Nazim S,etal. Interactions of intrinsically disorderedThellungiellasalsugineadehydrins TsDHN-1 and TsDHN-2 with membranes-synergistic effects of lipid composition and temperature on secondary structure. Biochemistry and Cell Biology, 2010, 88(5): 791-807.
[28]Kosová K, Vítámvás P, Prášil I T. Wheat and barley dehydrins under cold, drought, and salinity-what can LEA-II proteins tell us about plant stress response. Frontiers in Plant Science, 2014, 5: 343.
[29]Alsheikh M K, Svensson J T, Randall S K. Phosphorylation regulated ion-binding is a property shared by the acidic subclass dehydrins. Plant, Cell & Environment, 2005, 28(9): 1114-1122.
[30]Hara M, Fujinaga M, Kuboi T. Metal binding by citrus dehydrin with histidine-rich domains. Journal of Experimental Botany, 2005, 56: 2695-2703.
[31]Zhang L, Ohta A, Takagi M,etal. Expression of plant group 2 and group 3 lea genes inSaccharomycescerevisiaerevealed functional divergence among LEA proteins. Journal of Biochemistry, 2000, 127(4): 611-616.
[32]Lan Y, Cai D, Zheng Y Z. Expression of three different group soybean lea genes enhanced stress tolerance inEscherichiacoli. Journal of Integrative Plant Biology, 2005, 42(5): 613-621.
[9]郝建辉, 石凤翎. 不同扁蓿豆材料抗旱性比较研究. 中国草地学报, 2006, 28(3): 39-42.
[12]刘志英, 李西良, 齐晓, 等. 1950年以来中国学者对苜蓿属的研究: 历史脉络与启示. 草业学报, 2015, 24(10): 58-69.
Heterologous expression of an SK2-type dehydrin gene (MrDHN3) fromMedicagoruthenicaenhancesEscherichiacolitolerance under salt and high temperature stress
SHEN Ying-Fang1,2, MA Chao1, WU Xiao-Pei1,2, ZHANG Ye-Meng1,2, WANG Hai-Qing1*
1.KeyLaboratoryofAdaptationandEvolutionofPlateauBiota,NorthwestInstituteofPlateauBiology,ChineseAcademyofSciences,Xining810008,China; 2.UniversityofChineseAcademyofSciences,Beijing100049,China
Medicagoruthenica, is an excellent legume in highland and cold regions, and is highly resistant to drought, cold and high salinity. Dehydrins (DHNs) are stress proteins involved in plant protective reactions against environmental stress. According to our previous RNA-sequence data, a DHN gene,MrDHN3, was cloned from young seedlings ofM.ruthenica. Sequence analyses showed that theMrDHN3 gene contained a 666 bp open reading frame, putatively translated to 221 amino acids, and was an SK2-type acidic DHN. Amino acid sequence alignment showed that MrDHN3 shared the highest similarity (83%) with TrDHN3 and MtDHN3. Quantitative RT-PCR analysis showed that the expression ofMrDHN3 was induced by dehydration, cold, high salinity stress and abscisic acid (ABA), which suggests thatMrDHN3 is involved in abiotic stress responses. A prokaryotic expression vector was constructed and transferred toEscherichiacoliso as to induce MrDHN3 over expression inE.coli. The survival and growth of the recombinantE.coliunder salinity and high temperature stress conditions were determined. It was found that survival rates of recombinantE.coliafter exposure to high salinity (0.5 mol/L NaCl, 0.5 mol/L KCl) and high temperature (55 ℃) stress were obviously higher than those of the control group. This suggests that MrDHN3 plays an important role in cell response to damage caused by salinity and high temperature stress. This research indicates a potential methodology for the genetic improvement of crops to improve stress tolerance.
dehydrins; abiotic stress; heterologous expression;Medicagoruthenica
10.11686/cyxb2015510http://cyxb.lzu.edu.cn
沈迎芳, 马超, 吴小培, 张业猛, 王海庆. 扁蓿豆SK2型脱水素基因MrDHN3的异源表达提高大肠杆菌对盐和高温胁迫的抗性. 草业学报, 2016, 25(8): 118-127.
SHEN Ying-Fang, MA Chao,WU Xiao-Pei, ZHANG Ye-Meng, WANG Hai-Qing. Heterologous expression of an SK2-type dehydrin gene (MrDHN3) fromMedicagoruthenicaenhancesEscherichiacolitolerance under salt and high temperature stress. Acta Prataculturae Sinica, 2016, 25(8): 118-127.
2015-11-10;改回日期:2016-02-17
青海省应用基础研究计划(2014-ZJ-764),中科院“西部之光”联合学者项目和中科院科技服务网络计划(KFJ-SW-STS-177)资助。
沈迎芳(1987-),女,青海西宁人,在读博士。E-mail:syfnc@126.com
Corresponding author. E-mail: wanghq@nwipb.cas.cn
