红细胞参数判断慢性重型肝炎患者预后的价值及其影响因素分析*
2016-09-14杨彦麟赵正斌朱陇东毛小荣
高 鹏,肖 萍,杨彦麟△,石 磊,赵正斌,朱陇东,毛小荣,陈 琳,岳 伟
(1.兰州大学第一医院传染病研究室,兰州 730000;2.兰州大学第二医院检验科,兰州 730000;3.兰州大学第一医院传染科,兰州 730000)
·临床研究·
红细胞参数判断慢性重型肝炎患者预后的价值及其影响因素分析*
高鹏1,肖萍1,杨彦麟1△,石磊2,赵正斌3,朱陇东3,毛小荣3,陈琳3,岳伟3
(1.兰州大学第一医院传染病研究室,兰州 730000;2.兰州大学第二医院检验科,兰州 730000;3.兰州大学第一医院传染科,兰州 730000)
目的分析探讨红细胞参数变化对判断重型肝炎患者预后的价值。方法回顾性分析171例兰州大学第一医院住院的慢性重型肝炎患者的红细胞参数,比较分析预后良好组与预后不良组红细胞参数的差异,采用相关性分析影响红细胞参数变化的因素。结果红细胞参数红细胞计数(RBC)、血红蛋白(HGB)、血细胞比容(HCT)水平预后良好组明显高于预后不良组,差异有统计学意义(P<0.05)。红细胞平均体积(MCV)、红细胞体积分布宽度(RDW)水平预后良好组明显低于预后不良组,差异有统计学意义(P<0.05)。相关性分析显示肝功能指标和病毒载量均显著影响着红细胞参数。结论机体的肝功能状况和病理性免疫反应直接影响着红细胞参数,动态观察红细胞参数对重型肝炎患者的预后有预示价值。
重型肝炎;红细胞参数;预后
重型肝炎是以大量肝细胞坏死为主要病理特点的一种严重肝脏疾病,可引起肝衰竭甚至危及生命,是肝病患者死亡的主要原因之一[1]。目前有很多指标用来判断重型肝炎患者的预后,并取得了很大的进展,但是很少有文献观察红细胞参数变化与重型肝炎预后的关系,本文就此加以分析探讨,借此来揭示红细胞参数作为判断慢性重型肝炎患者预后指标的价值。
1 资料与方法
1.1一般资料回顾性分析2007年1月至2011年4月在兰州大学第一医院住院的因乙型肝炎病毒(HBV)感染后,确诊为慢性重型肝炎的患者171例,其中男139例、女32例,年龄17~71岁、平均(42.1±5.6)岁。诊断均符合2010年《慢性乙型肝炎防治指南》标准[2],同时排除甲、丙、丁、戊型肝炎,药物性肝炎,自身免疫性肝炎,妊娠期妇女,有过抗病毒治疗的患者,脾功能亢进的患者以及其他心血管、肾脏等重大脏器病变患者。本研究将171例慢性重型肝炎患者按预后分为预后良好组(治愈或好转出院)84例,预后不良组(死亡)87例。
1.2仪器XE2100型全自动血细胞计数仪为日本Sysmex公司产品。ACL9000型全自动血凝仪为美国Beckman-Coulter公司产品,AU900型全自动生化分析仪为日本Olympus公司产品,荧光定量PCR分析仪为德国LightCycler Roche Corporation产品。
1.3方法采用普通干燥管抽取被测者清晨空腹血,37 ℃水浴箱温浴0.5 h后离心,取上清液用于检测。肝功能指标直接用全自动生化分析仪检测,病毒载量检测直接用荧光定量PCR分析仪检测,血常规检测标本采用乙二胺四乙酸(EDTA)抗凝后用全自动血细胞分析仪检测,凝血检测标本用枸橼酸钠抗凝后用全自动血凝分析仪检测,所有检测均在抽血后2 h内完成。分别观察预后良好组与预后不良组红细胞参数的差异,并对171例慢性重型肝炎患者的凝血指标、肝功能及病毒载量与红细胞各项参数之间进行两两之间的相关性分析。
2 结 果
2.1预后良好组与预后不良组之间红细胞参数水平的比较红细胞计数(RBC)、血红蛋白(HGB)、血细胞比容(HCT)水平预后良好组明显高于预后不良组,差异有统计学意义(P<0.05);红细胞平均体积(MCV)、红细胞体积分布宽度(RDW)水平预后良好组明显低于预后不良组,差异有统计学意义(P<0.05)。见表1。

表1 预后良好组与预后不良组之间红细胞参数水平的比较±s)
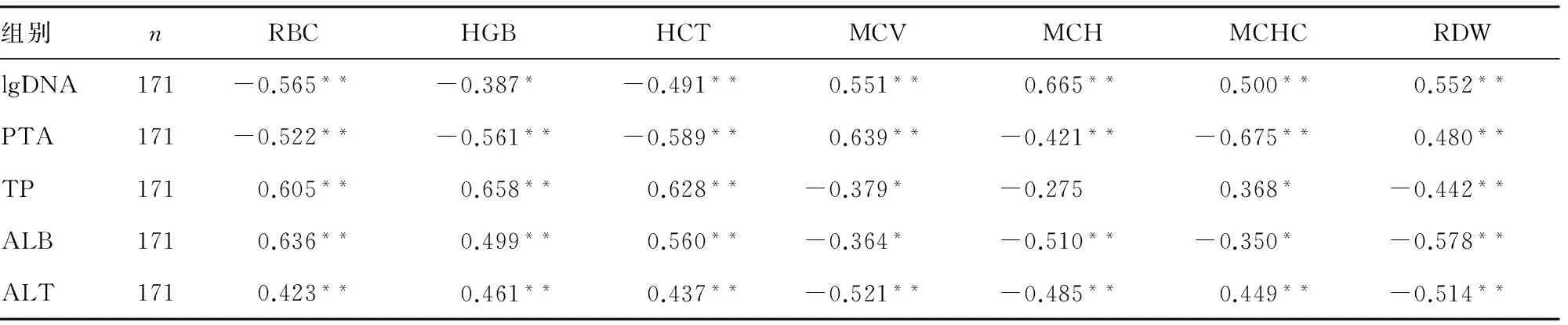
表2 慢性重型肝炎患者肝功能及病毒载量与红细胞参数之间的相关性分析(相关系数r)
注:*P<0.05,**P<0.01。
2.2慢性重型肝炎患者肝功能及病毒载量与红细胞参数之间的相关性分析由表2可见在慢性重型肝炎患者中,红细胞参数既与反映肝脏功能的指标凝血酶原活动度(PTA)、总蛋白(TP)、清蛋白(ALB)、丙氨酸氨基转移酶(ALT)密切相关,又与病毒载量大小(lgDNA)密切相关。见表2。
3 讨 论
目前有包括肝功能在内的许多指标可以作为判断重型肝炎预后的指标。红细胞参数就是近年来发现的一类新指标[3]。本文研究显示预后良好组与预后不良组之间红细胞参数差别较大,同时相关性分析显示有两类因素影响红细胞参数:(1)肝功能指标(TP、ALB、PTA等)。肝功能指标(TP、ALB、PTA等)是目前普遍认为决定重型肝炎预后的指标,肝功能越差,患者的病死率越高[4]。PTA、ALB等是反映肝脏功能的主要指标[5],当TP、ALB、PTA下降时,肝脏合成和储备能力下降,维生素B12、叶酸、铁等营养物质的摄入不足、吸收不良和利用障碍,从而引起红细胞数量和形态的异常[6]。同时肝脏合成和储备能力下降可引起凝血-抗凝物质代谢紊乱,从而造成红细胞过早破坏,也可影响到红细胞的数量和形态[7]。(2)病毒载量lgDNA。目前普遍认为重型肝炎时,机体免疫功能紊乱。病毒载量越高,机体病理性免疫反应愈强烈,患者病死率越高。本文中显示随着病毒载量的增高,RBC、HCT下降,MCV、MCH、MCHC、RDW增高,其原因为当病毒载量越大时,肝细胞受损越严重,释放出更多的细胞因子和炎性介质以及内毒素[8],大量内毒素、细胞因子和炎性介质的释放可以改变红细胞膜的结构,使红细胞的渗透脆性增大,从而使得红细胞更容易被巨噬细胞吞噬以及发生内源性溶血。同时大量内毒素、细胞因子和炎性介质的释放可以干扰骨髓造血功能及骨髓的微环境,使红细胞生长发育受到影响,从而导致红细胞的数量和形态均发生变化[9]。故而在重型肝炎时,病毒载量越大,机体免疫反应愈强烈,红细胞受到的损伤愈厉害,红细胞的数量形态变化愈大。
综上所述,肝功能和病毒载量是影响慢性重型肝炎预后的指标,它们也明显影响着红细胞参数,观察慢性重型肝炎患者红细胞参数的变化可以帮助了解掌握患者机体的肝功能和免疫状况。因此慢性重型肝炎患者红细胞系统参数可以作为判断慢性重型肝炎患者预后的指标。
[1]Bernstein D,Tripodi J.Fulminant hepatic failure[J].Crit Care Clin,1998 ,14(2):181-197.
[2]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南:2010年版[J].中华传染病杂志,2011,29(2):65-80.
[3]Lou YF,Wang MY,Mao WL.Clinical usefulness of measuring red blood cell distribution width in patients with hepatitis B[J].PLoS One,2012,7(5):141-150.
[4]Gu XB,Yang XJ,Lu ZH,et al.Alteration in cellular immunity after chronic hepatitis B deteriorated into severe hepatitis and its significance[J].Hepat Mon,2011,11(10):810-815.
[5]Valsamakis A.Molecular testing in the diagnosis and management of chronic hepatitis B[J].Clin Microbiol Rev,2007,20(3):426-439.
[6]Higgins JM,Mahadevan L.Physiological and pathological population dynamics of circulating human red blood cells[J].Proc Natl Acad Sci U S A,2010,107(47):20587-20592.
[7]Amitrano L,Guardascione MA,Brancaccio V,et al.Coagulation disorders in liver disease[J].Semin Liver Dis,2002,22(1):83-96.
[8]Leifeld L,Cheng S,Ramakers J,et al.Imbalanced intrahepatic expression of interleukin 12,interferon gamma,and interleukin 10 in fulminanthepatitis B[J].Hepatology,2002,36(4 Pt 1):1001-1008.
[9]Gonzalez-Casas R,Garcia-Buey L,Jones EA,et al.Systematic review:hepatitis-associated aplastic anaemia--a syndrome associated with abnormal immunological function[J].Aliment Pharmacol Ther,2009,30(5):436-443.
兰州大学第一医院院内基金资助项目(ldyyyn2014-14)。
,E-mail:yanlin6611@sina.com。
10.3969/j.issn.1673-4130.2016.16.035
A
1673-4130(2016)16-2295-02
2016-01-28
2016-06-07)
