病毒灭活血浆残余亚甲蓝对人外周血单个核细胞免疫功能影响的体外研究*
2016-09-14陈志忠李结敏陈尚良梁洁贞卢少芬陈超红陆倩文
陈志忠,李结敏,陈尚良,梁洁贞,卢少芬,陈超红,陆倩文,张 绮
(广东省肇庆市中心血站 526020)
·论著·
病毒灭活血浆残余亚甲蓝对人外周血单个核细胞免疫功能影响的体外研究*
陈志忠,李结敏,陈尚良△,梁洁贞,卢少芬,陈超红,陆倩文,张绮
(广东省肇庆市中心血站526020)
目的利用人外周血单个核细胞(PBMC)研究用于血浆病毒灭活后残余的亚甲蓝是否对人体免疫细胞功能产生影响。方法采用Ficoll-Hypaque密度梯度离心法分离PBMC,在T细胞特异性刺激因子Anti-CD3/CD28存在的条件下,加或者不加不同浓度的亚甲蓝共培养,培养至72 h,收集培养上清液,采用酶联免疫吸附试验(ELISA)检测细胞因子分泌情况;培养66 h后,加入CCK-8染料继续培养4~6 h,于A450处测定细胞增殖情况。结果高浓度剂量亚甲蓝(1.25、2.5、5 μmol/L组)对Anti-CD3/28刺激PBMC的增殖均有明显抑制作用(P<0.01),其OD值由0.897±0.385分别降至0.632±0.334、0.524±0.254、0.445±0.287,呈一定的剂量依赖效应。高浓度亚甲蓝(1.25、2.5、5 μmol/L组)可下调Anti-CD3/28诱导PBMC分泌细胞因子白细胞介素(IL)-17a、IL-10、γ-干扰素(IFN)-γ,且呈剂量依赖效应。1.25、2.5、5 μmol/L的亚甲蓝影响PBMC分泌IL-17a,IL-17a水平由(406±57)pg/mL分别降至(276±38)、(192±31)、(134±24)pg/mL;影响PBMC分泌IL-10,IL-10水平由(184±15)pg/mL分别降至(132±13)、(110±12)、(42±8)pg/mL;影响PBMC分泌IFN-γ, IFN-γ水平由(4 512±187)pg/mL分别降至(2 876±143)、(2 234±153)、(1 988±112)pg/mL。结论高浓度亚甲蓝(≥1.25 μmol/L)对人PBMC的增殖以及分泌细胞因子功能有显著抑制作用,换而言之,血浆病毒灭活后残余浓度(≤0.33 μmol/L)的亚甲蓝对PBMC免疫功能无明显影响,但该浓度的亚甲蓝对人纯T细胞免疫功能是否有影响需要进一步评估研究。
病毒灭活血浆;亚甲蓝;人外周血单个核细胞; T淋巴细胞;免疫功能
亚甲蓝光化学法灭活血浆中病毒的效果已被证实,输注病毒灭活血浆成为国内外预防输注血浆制品传播疾病的有效措施[1-3]。亚甲蓝光化学法灭活病毒最终血浆制剂中亚甲蓝残余浓度≤0.30 μmol/L[4],即≤0.096 mg/L,与临床的使用剂量(1~2)mg/kg体质量相比,浓度是非常低的。但考虑到大量输注血浆的患者多为危重病,如多发性创伤、心脏手术、多器官衰竭、凝血功能紊乱等患者,本身功能较衰弱,同时大量输血本身也存在输血后免疫抑制的风险[5],故有必要考虑亚甲蓝对人体免疫功能的影响。亚甲蓝毒理实验证明其安全[6-7],但体内、外基因毒性实验结果尚不一致[8-9]。目前,亚甲蓝一定程度的致突变性和其他不良反应已被体外实验所证明[10],然而其对人免疫细胞的影响尚未明确。为保障输血安全,笔者对亚甲蓝影响人外周血单个核细胞(PBMC)增殖以及分泌细胞因子功能进行了研究,现报道如下。
1 资料与方法
1.1一般资料新鲜人静脉血(枸橼酸钠抗凝)由肇庆市中心血站提供;淋巴细胞分离液购自天津灏阳生物科技有限公司;CCK-8试剂盒(Cell Counting Kit-8)购自日本株式会社同仁化学研究所;酶联免疫吸附试验(ELISA)检测试剂盒购自Ebioscience公司;Anti-CD3、Anti-CD28购自Sigma公司;RPMI-1640培养基、胎牛血清(FBS)购自Gibco公司。
1.2方法
1.2.1Ficoll-Hypaque密度梯度离心法分离人PBMC在离心管中加入20 mL淋巴细胞分离液;取枸橼酸钠抗凝静脉血与等量RPMI-1640液充分混匀,用滴管沿管壁缓慢叠加于分层液面上,注意保持清楚的界面;水平离心,2 000 r/min,20 min;用滴管吸出白色云雾层细胞,加入5倍体积的无菌PBS,1 500 r/min离心10 min,洗涤细胞2次;末次洗涤时进行计数,将细胞用RPMI-1640重悬,调整细胞密度为2×106个/mL。
1.2.2亚甲蓝溶液的配制分析天平准确称取分析纯亚甲蓝试剂0.032 g,溶于10 mL RPMI-1640液,充分溶解后,溶液经0.22 μm过滤器滤过除菌,即为亚甲蓝溶液保存液(1 mmol/L),-20 ℃保存备用,根据实验需要取保存液使用RPMI-1640液进行稀释使用。
1.2.3PBMC的培养96孔培养板加入Anti-CD3(1 μg/mL)、Anti-CD28(5 μg/mL),每孔200 μL,4 ℃过夜;吸走包被上清液,每孔加入PBMC细胞悬浮液100 μL;加入不同浓度亚甲蓝工作液(20、10、5、2.5、1.25、0.63、0.31、0.16、0.08、0 μmol/L)100 mL,最终培养体积为每孔200 mL,终浓度分别10、5、2.5、1.25、0.63、0.31、0.16、0.08、0.04、0 μmol/L,每组设4个复孔,置于37 ℃、5% CO2培养,72 h后收集细胞或者上清液进行后续实验。
1.2.4ELISA检测细胞因子细胞培养第3天收集各组细胞上清液,以ELISA检测γ-干扰素(IFN-γ)、白细胞介素(IL)-17a和IL-10分泌情况。按照试剂盒说明,将捕获抗体用包被缓冲液稀释250倍,加入酶联板,每孔100 μL,4 ℃包被过夜。次日PBS-T洗涤5次。加入检测缓冲液,每孔200 μL,于室温封闭1 h,PBS-T洗涤5次;分别加入待测细胞培养上清液和倍比稀释的标准品(按1∶2 000稀释),每孔100 μL,室温反应1 h,PBS-T洗板5次。加入已稀释的检测抗体,每孔100 μL。于室温反应 1 h,PBS-T洗板5次。加入Avidin-HRP(按1∶250稀释),每孔100 μL。于室温反应30 min。PBS-T洗涤7次。加入TMB底物缓冲液,每孔100 μL。显色5~10 min。最后用2 mol/L H2SO4显色终止液终止反应。于酶标仪测450 nm处光密度(OD)值。根据标准曲线,计算样品中细胞因子浓度。
1.2.5CCK-8法检测MBL对PBMC增殖的调节作用按照1.2.3细胞培养66 h后,加入20 μL CCK-8,继续培养4~6 h,测450 nm处OD值。

2 结 果
2.1亚甲蓝抑制PBMC的增殖CCK-8法显示高浓度剂量的亚甲蓝对PBMC增殖有明显的抑制作用,且呈剂量依赖效应,见图1。与对照组相比,亚甲蓝浓度1.25、2.5、5 μmol/L组对Anti-CD3/28刺激PBMC的增殖均有明显抑制作用(P<0.01),其OD值由0.897±0.385分别降至0.632±0.334、0.524±0.254、0.445±0.287。
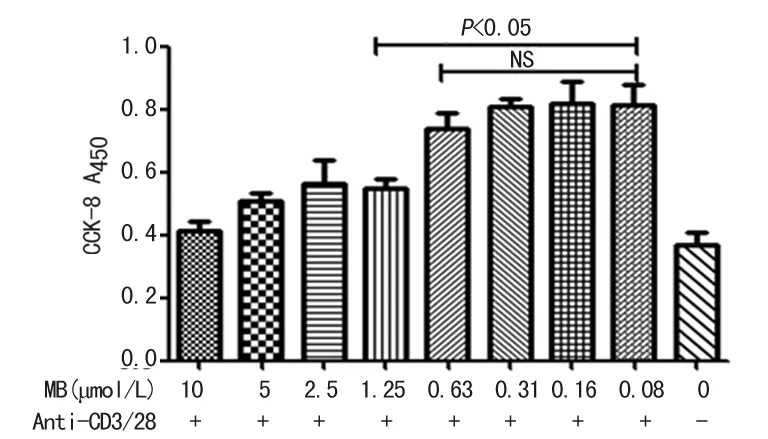
注:横坐标均表示亚甲蓝浓度分组;+表示Anti-CD3/28刺激条件,-则表示无Anti-CD3/28。
2.2亚甲蓝抑制特异性刺激因子(Anti-CD3/CD28)诱导PBMC分泌细胞因子在亚甲蓝与Anti-CD3/28共处理PBMC细胞组,高浓度亚甲蓝组(1.25、2.5、5 μmol/L组)可下调Anti-CD3/28所诱导PBMC分泌细胞因子IL-17a、IL-10、IFN-γ的分泌,且呈一定剂量依赖效应。亚甲蓝浓度1.25、2.5、5 μmol/L组影响PBMC分泌IL-17a,IL-17a水平由(406±57)pg/mL分别降至(276±38)、(192±31)、(134±24)pg/mL(图2A);影响PBMC分泌IL-10,IL-10水平由(184±15)pg/mL分别降至(132±13)、(110±12)、(42±8)pg/mL(图2B);影响PBMC分泌IFN-γ,IFN-γ水平由(4 512±187)pg/mL分别降至(2 876±143)、(2 234±153)、(1 988±112)pg/mL(图2C)。

注:横坐标均表示亚甲蓝浓度分组;+表示Anti-CD3/28刺激条件,-则表示无Anti-CD3/28。
3 讨 论
近年有学者研究认为,亚甲蓝能在动物模型中增加诱发胰腺癌的概率[8-9],随后有学者对其可能发生的机制进一步研究后认为,可能是亚甲蓝介导的DNA损伤增加了肿瘤的发生概率[10]。2011年,日本学者报道了2例输注亚甲蓝病毒灭活血浆发生过敏性反应从而致死的案例[11],但其机制至今未明[12]。最近,国内学者研究认为病毒灭活残余亚甲蓝对人CIK细胞的体外杀伤功能以及增殖未见明显影响[13],国外学者研究发现亚甲蓝可影响PBMC细胞跨越内皮的迁徙能力,并且呈剂量效应[14-16]。但亚甲蓝对PBMC免疫功能的影响,目前少见报道。
本研究通过分离健康志愿者PBMC与亚甲蓝共培养,研究评估其对人T淋巴细胞免疫功能的影响。本研究发现高浓度的亚甲蓝(≥1.25 μmol/L)对Anti-CD3/28所诱导PBMC细胞增殖以及细胞因子IL-17a、IL-10、IFN-γ的分泌量有显著的抑制作用。IL-17a主要由Th17分泌,属于Th17细胞因子,亚甲蓝对PBMC分泌IL-17a有抑制作用,将影响Treg/Th17的平衡;IL-10主要由单核巨噬细胞和Th细胞分泌,属于Th2细胞因子,主要生物效应是刺激B淋巴细胞的分化增殖,产生抗体,亚甲蓝对PBMC分泌IL-10有抑制作用,可能将加大大量输血本身也存在输血后免疫抑制的风险。IFN-γ主要由活化的Th1细胞和NK细胞分泌,属于Th1细胞因子,主要的生物学功能是刺激CTL细胞的分化增殖,实现细胞毒效应。在本研究中发现,亚甲蓝浓度低于1.25 μmol/L组对PBMC的增殖以及分泌细胞因子的功能无明显影响。目前,国家标准中对病毒灭活血浆亚甲蓝残余浓度要求为≤0.33 μmol/L,仅为1.25 μmol/L的1/4浓度,且血浆输入人体后,会被体内血容量稀释,故体内实际浓度将更加低,由此可见,输注亚甲蓝病毒灭活血浆不会因残余的亚甲蓝对人体PBMC细胞免疫功能产生影响。
PBMC是从人外周血中分离得到,其主要由淋巴细胞构成,而且T淋巴细胞占其主要部分。本研究中使用了特异性T淋巴细胞刺激因子为共培养的PBMC提供共刺激信号,一般认为只有CD3+T细胞会被活化增殖,执行相应的生物学功能。T淋巴细胞是获得性免疫系统中最重要的细胞,不仅影响免疫应答强度,而且影响机体免疫应答的类型,阐明亚甲蓝对人T细胞免疫功能的影响具有重要意义。T淋巴细胞是获得性免疫应答中最重要的细胞,不仅参与细胞免疫,而且辅助体液免疫;不仅激活免疫应答,而且诱导免疫耐受。一方面初始T细胞通过其抗原识别受体(TCR)/CD3复合物识别抗原提呈细胞(APC)提呈的抗原肽后,活化并分化为效应T细胞,进而发挥效应和(或)调节功能。另一方面,T细胞通过Th1/Th2亚群分化的影响,调节免疫应答的类型。故本研究实际上间接评估了亚甲蓝对T淋巴细胞免疫功能的影响。
但鉴于PBMC除T细胞外,还有B细胞、NK细胞、单核细胞等,因此亚甲蓝上述的抑制作用不一定是其对T细胞的作用。因此在后续的研究中,将采用免疫磁珠负选法,分离获得纯化的T细胞,进一步明确亚甲蓝对T淋巴细胞免疫功能的影响。
[1]Seghatchian J,De Sousa G.Pathogen-reduction systems for blood components:the current position and future trends[J].Transfus Apher Sci,2006,35(3):189-196.
[2]Chunhui Y,Guohui B,Hong Y,et al.Quantitative evaluation of plasma after methylene blue and white light treatment in four Chinese blood centers[J].Transfus Apher Sci,2013,49(3):631-639.
[3]Elikaei A,Hosseini SM,Sharifi Z,et al.Methylene blue based device for pathogen reduction in human plasma[J].Iranian journal of pediatric hematology and oncology,2013,3(3):97-102.
[4]中华人民共和国卫生部.全血及成分血质量要求:GB-18469[S].北京:中华人民共和国卫生部,2012.
[5]Pandey S,Vyas GN.Adverse effects of plasma transfusion[J].Transfusion,2012,52(Suppl 1):65S-79S.
[6]Sturmey RG,Wild CP,Hardie LJ.Removal of red light minimizes methylene blue-stimulated DNA damage in oesophageal cells:implications for chromoendoscopy[J].Mutagenesis,2009,24(3):253-258.
[7]Masannat YA,Hanby A,Horgan K,et al.DNA damaging effects of the dyes used in sentinel node biopsy:possible implications for clinical practice[J].J Surg Res,2009,154(2):234-238.
[8]National Toxicology Program.Toxicology and carcinogenesis studies of methylene blue trihydrate (Cas No.7220-79-3) in F344/N rats andB6C3F1 mice (gavage studies)[J].Natl Toxicol Program Tech Rep Ser,2008(540):1-224.
[9]Auerbach SS,Bristol DW,Peckham JC,et al.Toxicity and carcinogenicity studies of methylene blue trihydrate in F344N rats and B6C3F1 mice[J].Food Chem Toxicol,2010,48(1):169-177.
[10]Hiraku Y,Goto H,Kohno M,et al.Metal-mediated oxidative DNA damage induced by methylene blue[J].Biochim Biophys Acta,2014,1840(9):2776-2782.
[11]Nubret K,Delhoume M,Orsel I,et al.Anaphylactic shock to fresh-frozen plasma inactivated with methylene blue[J].Transfusion,2011,51(1):125-128.
[12]Politis C,Kavallierou L,Hantziara S,et al.Haemovigilance data on the use of methylene blue virally inactivated fresh frozen plasma with the Theraflex MB-Plasma System in comparison to quarantine plasma:11 years′ experience[J].Transfus Med,2014,24(5):316-320.
[13]姚仁南,陈玲,刘军权,等.病毒灭活血浆对人CIK细胞功能影响的体外实验研究[J].中国输血杂志,2012,25(8):741-744.
[15]Werner I,Guo F,Bogert NV,et al.Methylene blue modulates transendothelial migration of peripheral blood cells[J].PLoS One,2013,8(12):e82214.
[16]Werner I,Guo F,Stock UA,et al.Methylene blue modulates adhesion molecule expression on microvascular endothelial cells[J].Inflamm Res,2014,63(8):649-656.
In vitro study on influence of residual methylene blue after virus inactivation plasma on immune function of human PBMC cells*
CHENZhizhong,LIJiemin,CHENShangliang△,LIANGJiezhen,LUShaofen,CHENChaohong,LUQianwen,ZHANGQi
(ZhaoqingMunicipalBloodCenter,Zhaoqing,Guangdong526020,China)
ObjectiveTo study the influence of residual methylene blue after plasma viral inactivation on the human immune cell function by using the peripheral blood mononuclear cell(PBMC).MethodsPBMC were isolated by adopting the Ficoll-Hypaque density gradient centrifugation method and co-cultured for 72 h in presence of specific T cell stimulating factors(Anti-CD3/28 and Anti-CD28),with or without different concentration of methylene blue.The culture supernatant was collected and detected the cytokines secretion situation by ELISA.After 66 h culture,CCK-8 dye was added and continueously cultured for 4-6 h,the proliferation was determined at A450.ResultsThe high-concentration doses of methylene blue (1.25,2.5,5 μmol/L groups) had significantly inhibiting effect on the proliferation of PBMC stimulated by Anti-CD3/28(P<0.01),its OD value was decreased from 0.897±0.385 to 0.632±0.334,0.524±0.254 and 0.445±0.287 respectively,showing certain dose dependent effect.The high concentrations of methylene blue (1.25,2.5,5 μmol/L groups) could down-regulate interleukin(IL)-17a,IL-10 and interferon(IFN)-γ secreted by anti-CD28 induced PBMC,moreover showing a dose dependent effect.1.25,2.5,5 μmol/L methylene blue affected the IL-17a level secreted by PBMC from (406±57)pg/mL descending to (276±38),(192±31),(134±24)pg/mL respectively;affected PBMC to secrete IL-10,its level was reduced from (184±15) pg/mL to (132±13),(110±12),(42±8)pg/mL;affected PBMC to secrete IFN-γ,its level was deduced from (4 512±187)pg/mL to (2 876±143),(2 234±153),(1 988±112)pg/mL respectively.ConclusionHigh concentrations of methylene blue (≥1.25 μmol/L) has the significant inhibiting effect on the proliferation and cytokine secretion functions of PBMC.In other words,the residual methylene blue concentration in viral inactivation plasma (≤0.33 μmol/L) has no obvious effect on the immune function of PBMC,but whether this concentration of methylene blue having the effect on human pure T cell immune function needs to be further evaluated and studied.
virus inactivation plasma;methylene blue;the peripheral blood mononuclear cell;T lymphocyte;immune function
广东省医学科研基金资助项目(A2015238)。
陈志忠,男,副主任技师,主要从事采供血管理和血液安全研究。△
,E-mail:fimmu2000@163.com。
10.3969/j.issn.1673-4130.2016.16.001
A
1673-4130(2016)16-2205-03
2016-03-10
2016-06-20)
