碱性β-葡萄糖苷酶产生菌株的筛选、鉴定及部分酶学性质研究
2016-09-14范李龙崔凤杰赵鹏翔安徽工程大学生物与化学工程学院安徽芜湖4000江苏大学食品与生物工程学院江苏镇江0国网节能服务有限公司北京生物质能源技术中心北京0005
李 松,杨 倩,范李龙,崔凤杰,赵鹏翔(.安徽工程大学生物与化学工程学院,安徽芜湖4000;.江苏大学食品与生物工程学院,江苏镇江0;.国网节能服务有限公司北京生物质能源技术中心,北京0005)
碱性β-葡萄糖苷酶产生菌株的筛选、鉴定及部分酶学性质研究
李 松1,杨 倩1,范李龙1,崔凤杰2,赵鹏翔3
(1.安徽工程大学生物与化学工程学院,安徽芜湖241000;2.江苏大学食品与生物工程学院,江苏镇江212013;3.国网节能服务有限公司北京生物质能源技术中心,北京100053)
为开发新型碱性微生物来源的β-葡萄糖苷酶资源,本文采用七叶苷平板显色筛选法在碱性条件下从多个土壤样本和印染洗涤废水中筛选得到一株β-葡萄糖苷酶产生菌株,并对该菌株进行了分子生物学鉴定、发酵特性及部分酶学性质研究。结果表明:筛选菌株为Bacillus sp.,其最适生长和产酶温度为35~37℃,最适生长和产酶pH分别为9.5和9.0;该菌株所产β-葡萄糖苷酶最适作用温度和pH分别为50℃和9.5;在50℃以下和pH9.0~10.0内比较稳定;Cu2+、Fe2+、Ca2+和Mn2+对该酶表现出一定抑制作用,而Mg2+、Zn2+和Co2+对该酶催化活性没有明显影响。研究结果对产碱性β-葡萄糖苷酶的微生物资源获取和信息整理具有一定的借鉴意义。
碱性β-葡萄糖苷酶,筛选,酶学性质
β-葡萄糖苷酶(EC 3.2.1.21,BG),又称β-D-1,4-葡萄糖苷水解酶,常与内切葡聚糖酶(EC 3.2.1.4,EG)和纤维二糖水解酶(EC 3.2.191,CBHs)共同构成一组可对纤维素进行高效协同作用的纤维素酶系[1-3]。β-葡萄糖苷酶可将纤维二糖彻底水解并释放葡萄糖,同时该酶常因微生物自然分泌量的不足而成为整个纤维素酶系水解过程中的主要限速酶[4]。β-葡萄糖苷酶对纤维二糖的水解活性最强,但由于β-葡萄糖苷酶对底物(糖基)部分结构的专一性较差,使得β-葡萄糖苷酶不仅能够使C-O、C-S、C-N和C-F等键断裂,还可以水解β-半乳糖苷键,甚至由于对糖分子结构中C6位的专一性不高而能够水解木糖[5],这使得β-葡萄糖苷酶除了可以与其他纤维素酶组分协同水解纤维素外,还可以在糖苷转移或水解[6-7]、制茶[8]以及食品增香[9-10]等多个领域使用。
碱性酶制剂在洗涤用酶中占有非常重要的地位,如碱性脂肪酶、碱性淀粉酶、碱性蛋白酶和碱性纤维素酶等[11]。其中,碱性酶制剂的研究及其品种的更新和应用拓展,在很大程度上得益于对嗜碱菌资源的深度开发和利用。目前使用的碱性纤维素酶主要是由一类耐碱或嗜碱芽孢杆菌属或链霉菌属微生物产生,因为该类碱性芽孢杆菌往往仅具有纤维素酶单一组分(内切葡聚糖酶)的生成能力,因此碱性纤维素酶又可专指碱性内切葡聚糖酶[12-13]。关于碱性β-葡萄糖苷酶的研究报道非常少,使得对该酶资源的获取和利用进展缓慢,同时也限制了该酶的工业应用。因此,研究和开发碱性β-葡萄糖苷酶对该酶应用领域的拓展和实际使用均具有一定的现实意义。本文以获取碱性β-葡萄糖苷酶资源并研究其催化性质多样性为目的,从土壤以及印染厂洗涤废水中筛选得到一株碱性β-葡萄糖苷酶的产生菌株,通过16S rDNA序列比对和生理生化特性研究对该菌株进行了鉴定,同时对碱性β-葡萄糖苷酶的部分酶学性质进行分析。
1 材料与方法
1.1 材料与仪器
分离样本 采集于芜湖市神山公园、芜湖市周边农田等地表下5~10 cm土壤以及印染厂洗涤废水(各处理工段总废水);初筛培养基(酵母膏0.5%,蛋白胨1%,NaCl 0.5%,KH2PO40.1%,琼脂2.0%)、复筛培养基(七叶苷1.0%,(NH4)2SO40.3%,KH2PO40.1%,MgSO40.05%,柠檬酸高铁铵0.025%,琼脂2.0%)、种子培养基(葡萄糖2.0%,蛋白胨0.5%,酵母粉0.3%,NaCl 0.5%,KH2PO40.1%,MgSO40.05%)和发酵培养基(乳糖2%,NaCl 0.1%,NaNO30.3%,蛋白胨0.5%,酵母粉0.3%,MgSO40.05%) 均使用Na2CO3调节pH 至9.5;PCR产物回收、纯化和质粒提取试剂盒 购自大连生物工程(大连)有限公司;七叶苷(CAS#66778-17-4) 购自上海绿叶生物科技有限公司;其他分析纯或化学纯生化试剂 购自国药集团化学试剂有限公司;细菌16S rDNA通用引物27F(5′-AGAGTTTGA TCCTGGCTCAG-3′)和1429R(5′-GGTTACCTTGTTA CGACTT-3′) 购自苏州金唯智生物科技有限公司。
灭菌锅LDZX-50KBS 上海申安医疗器械厂;高速冷冻离心机Allg642 美国贝克曼公司;振荡培养箱GHZ-123B 太仓市华美生化仪器厂;超净工作台SW-CJ-2FD 苏净集团苏州安泰空气技术有限公司;PCR仪TC312 美国伯乐公司;紫外可见光分光光度计L5 上海精科仪器有限公司;生物显微镜XSP-2C 上海光学仪器厂;扫描电子显微镜S4800日本日立公司。
1.2 实验方法
1.2.1 菌株筛选 将采集的34个土壤样本和1个印染废水样本在无菌环境中使用无菌水进行溶解或稀释并梯度稀释至10-1、10-2和10-3。分别取200 μL各样本梯度稀释液涂布于初筛培养基,在37℃条件下恒温培养24 h至出现易挑取的单菌落。分别用灭菌处理的牙签从每个样本的分离平板中优先挑取2~3个菌落形态或颜色有差异的单菌落,点种复筛培养基并于37℃条件下恒温培养24 h。挑取在复筛培养基中出现深褐色显色圈的菌落,使用复筛培养基做进一步划线分离,并对该分离菌进行后续研究。
1.2.2 菌株形态学观察 将分离菌株划线初筛培养基并在37℃条件下恒温培养24 h,观察菌落形态,同时挑取单菌落于0.2 mL无菌水中并振荡混匀,吸取10 μL菌悬液制片并进行革兰氏染色或扫描电镜观察。
1.2.3 菌株生理生化实验 筛选菌株的革兰氏染色及其对大分子物质的水解及产酸等实验参照《微生物学实验》[14]所述方法和步骤进行。
1.2.4 菌株的分子生物学鉴定 分离菌株染色体DNA的提取、质粒DNA的小量制备及DNA的酶切、连接、转化等操作参见文献[15]进行。其中,以该菌株染色体DNA为模板,使用细菌16S rDNA通用引物在54℃退火温度下进行扩增,得到的PCR产物经纯化后连接入T-载体并使用扩增引物进行序列测定,序列测定委托苏州金唯智生物科技有限公司完成。通过在线数据库Blast/blastp(http://www.ncbi.nlm.nih.gov/Blast)对测定序列进行比对,选择同源性较高的序列利用BioEdit软件进行ClustalW多重比对(重复计算1000次),并进一步使用MEGA 5.0软件对其结果通过Neighbor-Joining(NJ)法构建系统发育树。
1.2.5 摇瓶发酵 挑取单菌落接入种子培养基30 mL/ 250 mL,在37℃、200 r/min条件下培养16 h后按10%比例接入发酵培养基50 mL/250 mL并在37℃、200 r/min条件下进行发酵。微生物生长前期为菌种快速增殖期,然后进入平稳期,因此在0~24 h期间内每隔2 h取样,在24~54 h期间内每隔6 h取样,进行菌体密度和酶活力测定。
在上述培养过程中,分别将温度设定在25、30、35、40、45℃条件下进行发酵,以研究温度对菌株生长和产酶的影响;分别将发酵液初始pH调整为7.0、7.5、8.0、8.5、9.0、9.5和10.0条件下进行发酵,以研究发酵液初始pH对菌株生长和产酶的影响。
1.2.6 酶学性质研究 分别在40、45、50、55、60、65、70℃等温度下测定酶活力,以测定的最高酶活力为100%计算相对酶活力,以研究酶的最适作用温度;将酶液分别在40、50、60、70℃温度条件下保温1 h后测定残余酶活力,以未经保温处理的酶液活力为对照(计为100%)计算相对酶活力,以研究酶液在不同温度下的稳定性;分别在pH8.0、8.5、9.0、9.5、10.0、10.5和11.0条件下测定酶活力,以测定的最高酶活力为100%计算相对酶活力,以研究酶的最适作用pH;将酶液分别使用pH为8.0、9.0、10.0和11.0的缓冲液稀释2倍后于30℃下保温1 h后测定残余酶活力,以经保温处理但未加缓冲液的酶液活力为对照(计为100%)计算相对酶活力,以研究酶液在不同pH条件下的稳定性。其中,pH8.0~8.5使用Tris-盐酸缓冲液(0.05 mol/L),pH9.0~10.5使用甘氨酸-氢氧化钠缓冲液(0.05 mol/L),pH11.0使用磷酸氢二钠-氢氧化钠缓冲液(0.05 mol/L)。在反应体系中分别加入金属离子Mg2+、Zn2+、Cu2+、Fe2+、Mn2、Ca2+和Co2+至终浓度分别为1 mmol/L和5 mmol/L,以未加入金属离子的酶液活力为对照(计为100%)计算相对酶活力,以研究金属离子对酶催化性质的影响。
1.2.7 菌体密度测定 发酵液样品经适当稀释后于600 nm处测定吸光值(OD600)并按公式(1)计算菌体密度,同时对β-葡萄糖苷酶活力进行测定。

式(1)中,ODM为发酵液中菌体密度;A1为发酵液稀释样品在600 nm处的吸光值;A0为未接种培养基在600 nm处的吸光值;N为稀释倍数;测定中均采用1 cm玻璃比色杯。
1.2.8 β-葡萄糖苷酶活力测定 取1 mL发酵液于10,000 r/min离心5 min,取上清并使用甘氨酸-氢氧化钠缓冲液(0.05 mol/L,pH9.5)适当稀释。取0.5 mL适当稀释的粗酶液加入1 mL 1%水杨苷(溶于0.05 mol/L,pH9.5甘氨酸-氢氧化钠缓冲液)及0.5 mL 0.05 mol/L,pH9.5甘氨酸-氢氧化钠缓冲液,50℃保温30 min,加入3 mL 3,5-二硝基水杨酸(DNS)试剂[16]沸水浴10 min,冷却后加水稀释至25 mL,使用分光光度计测定在540 nm处测定吸光值(OD520)。
酶活力单位定义:在上述反应条件下,每分钟水解七叶苷生成1 μmol还原糖(以葡萄糖计)所需的酶量定义为1个β-葡萄糖苷酶活力单位(U)。其中,以煮沸灭活的酶液作为对照。测定结束后样品中β-葡萄糖苷酶活力按式(2)进行计算。
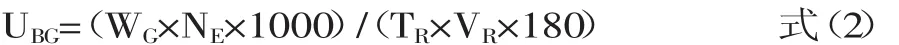
式(2)中,UBG为单位体积样品中β-葡萄糖苷酶活力(U/mL);WG为从葡萄糖标准曲线中查得的葡萄糖的质量浓度(mg/mL);NE为酶液稀释倍数;TR为反应时间(min);VR为反应体系中加入的酶液的体积(mL)。
1.3 数据处理
所有实验项均做3个平行,3个平行数据的平均值和标准差计算以及数据作图均采用OriginLab Origin V7.5(Northampton,MA,USA)软件进行,数据以平均值±标准差形式表示。
2 结果与分析
2.1 菌株筛选
实验结果经统计发现,在所选择的34个土壤样本中,平均每克样本中含有可在pH9.5条件下生长的耐碱细菌数量约30 cfu,最多约120 cfu,最少3~4 cfu;在所选择的一个印染洗涤废水样品中含耐碱细菌数量约1200~1500 cfu/mL,平均含量要远远高于正常土壤中耐碱细菌的数量,可能是洗涤废水的碱性环境(pH11.0~11.5)对碱性微生物存在的富集作用所致。根据菌落形态、颜色的差异,共计挑选97个单菌落点种复筛平板,同时进行大分子水解实验,如表1所示。结果显示,在碱性条件下具有木聚糖酶产生能力的菌株最多,约占所分离菌株总数的37%,其中有部分菌株(约5%)同时具有3种以上大分子物质水解能力,但是仅有一株分离自印染废水样本的细菌(编号为AB46)具有β-葡萄糖苷酶活力,使筛选平板在培养过程中出现深棕色,如图1(a)所示。挑取菌株AB46划线初筛培养基,培养16 h后显示AB46菌落呈乳白色,表面圆润、整齐、有光泽,不产粘性物质,如图1 (b)所示。革兰氏染色及显微形态观察结果显示AB46为革兰氏阳性细菌,细胞为长杆状,长约3~5 μm,直径约0.3~0.6 μm,如图1(c)和图1(d)所示。

表1 耐碱细菌大分子水解平板检测Table1 Macromolecule hydrolysis assay of alkaline bacteria
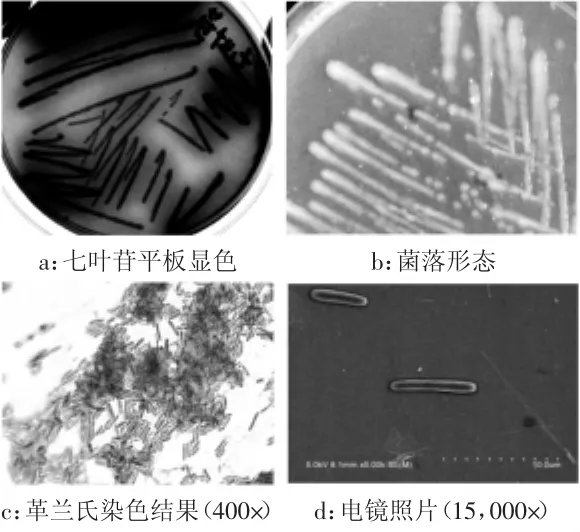
图1 菌株AB46菌落及显微形态观察Fig.1 The colony and microscope morphology of strain AB46
2.2 菌株鉴定
生理生化实验结果(表2)表明菌株AB46不能在45℃及以上温度生长,表明该菌为中温菌;该菌除了具有β-葡萄糖苷酶分泌能力外,还可以分泌淀粉和纤维素水解酶系;该菌可以利用常见的六碳糖进行成长(如葡萄糖),但不能利用五碳糖(如木糖)。

表2 菌株AB46生理生化特性Table2 The physiological and biochemical characteristics of strain AB46
菌株AB46 16S rDNA序列经测序后提交GenBank并获得登陆号为:KP115895.1,选择与较为相似的序列构建系统发育树,如图2所示。结果显示,虽然在已鉴定到种的芽孢杆菌属中,AB46与Bacillus cohnii(科氏芽孢杆菌)同源性最高,但AB46在同源进化分类上却与Bacillus sp.(GenBank:EF672045.1)聚为一类。因此,结合形态学观察(图1)和生理生化实验结果(表2)将菌株AB46鉴定为Bacillus sp.,并命名为Bacillus sp.AB46。
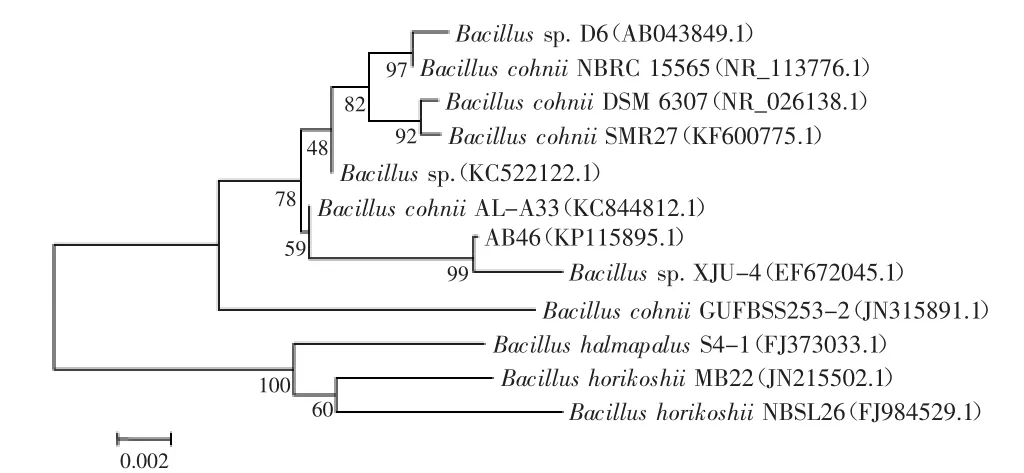
图2 菌株AB46 16S rDNA序列系统发育树Fig.2 Phylogenetic tree of strain AB46 based on the 16S rDNA sequence alignment
2.3 菌株生长与产酶过程
将菌株AB46在37℃、pH9.5条件下进行培养,每隔一定取样并进行菌体密度和β-葡萄糖苷酶活力测定,结果如图3所示,菌株AB46经历一个典型的对数生长期后在16 h左右开始进入对数生长期的拐点(生长速率开始下降),并在24 h左右达到最大菌体密度,发酵至30 h左右菌体密度开始明显下降,菌体细胞进入衰亡期。发酵至42 h时β-葡萄糖苷酶活力达到最大值,约0.9 U/mL,随后开始下降。
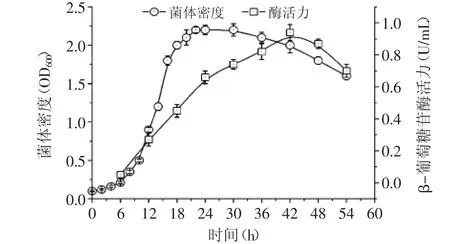
图3 菌株AB46摇瓶发酵过程中生长及产酶变化趋势Fig.3 Growth and enzyme production curves of strain AB46 in shaking flask fermentation
2.4 发酵条件对细胞生长和产酶的影响
2.4.1 初始pH对生长和产酶的影响 在不同pH条件下发酵获得的最大菌体密度和酶活力结果如图4所示。结果表明AB46最适生长pH为9.5,在pH9.0~10.0范围内生长良好,当pH低于7.5时该菌株几乎停止生长,显示该菌株是一种专性嗜碱菌;β-葡萄糖苷酶活力变化趋势表明AB46最适产酶pH为9.0,当pH高于9.5或低于8.5时产酶量明显下降,最适产酶pH范围较窄。在整体变化趋势上,除了最适产酶pH比最适生长pH低0.5之外,两者随pH变化的趋势均较为接近。
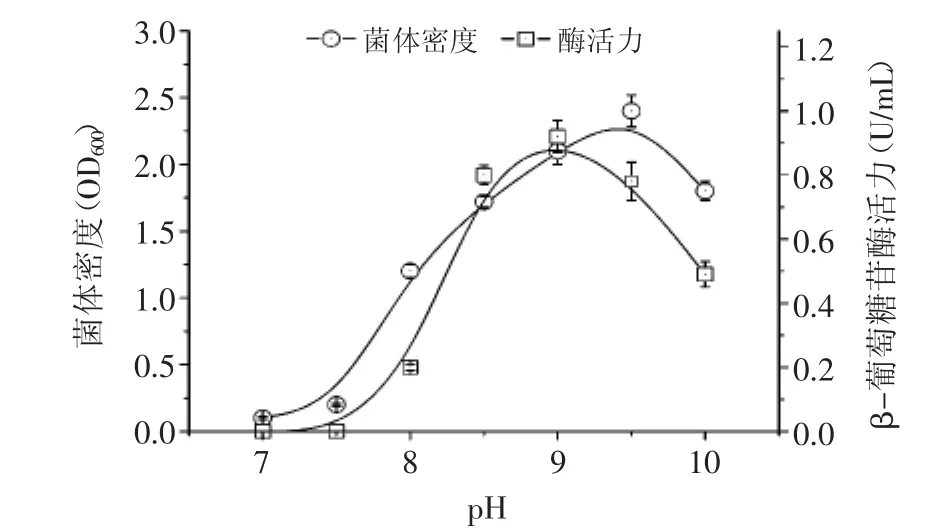
图4 初始pH对菌株AB46发酵生长及产酶的影响Fig.4 Effect of initial pH value on growth and enzyme production of strain AB46 in shaking flask fermentation
2.4.2 温度对生长和产酶的影响 在不同温度条件下发酵获得的最大菌体密度和酶活力结果如图5所示。结果表明AB46最适生长温度范围为35~37℃,同时在25~40℃范围内亦可快速生长,当温度上升至45℃时菌体细胞几乎停止生长,表明该菌株并不是耐热细菌;在不同温度条件下,该菌株产β-葡萄糖苷酶趋势与菌体生长趋势较为接近,即菌株的最适生长温度与最适产酶温度相同。

图5 温度对菌株AB46发酵生长及产酶的影响Fig.5 Effect of temperature on growth and enzyme production of strain AB46 in shaking flask fermentation
2.5 酶学性质研究
2.5.1 温度和pH对酶催化活力的影响 在不同温度和pH下分别测定β-葡萄糖苷酶的催化活力,结果表明:该酶最适作用温度为50℃,在45~50℃范围内催化活力较高,如图6(a)所示;该酶最适作用pH为9.5,在pH8.0~11.0之间均具有最高催化活力的60%以上,如图6(b)所示。
2.5.2 温度和pH对酶稳定性的影响 热稳定性研究显示该酶40℃下保温1 h后残余酶活力81%,在60℃下保温1 h后酶活力全部丧失,如图7(a)所示,表明该酶的耐热性一般,即使在60℃能够发挥最大催化效率的70%左右,但在高温(大于50℃)条件下的长时间处理过程中,该酶的应用性能可能会受到一定的限制。pH稳定性研究显示该酶在pH8.0~9.0之间非常稳定,当pH上升至10.0时,酶的稳定性随着pH的升高而出现大幅下降,如图7(b)所示。综合其最适反应pH条件可以判断该酶属于碱性β-葡萄糖苷酶,在弱碱性环境中(pH9.0~10.0)具有较好的稳定性和催化效率。
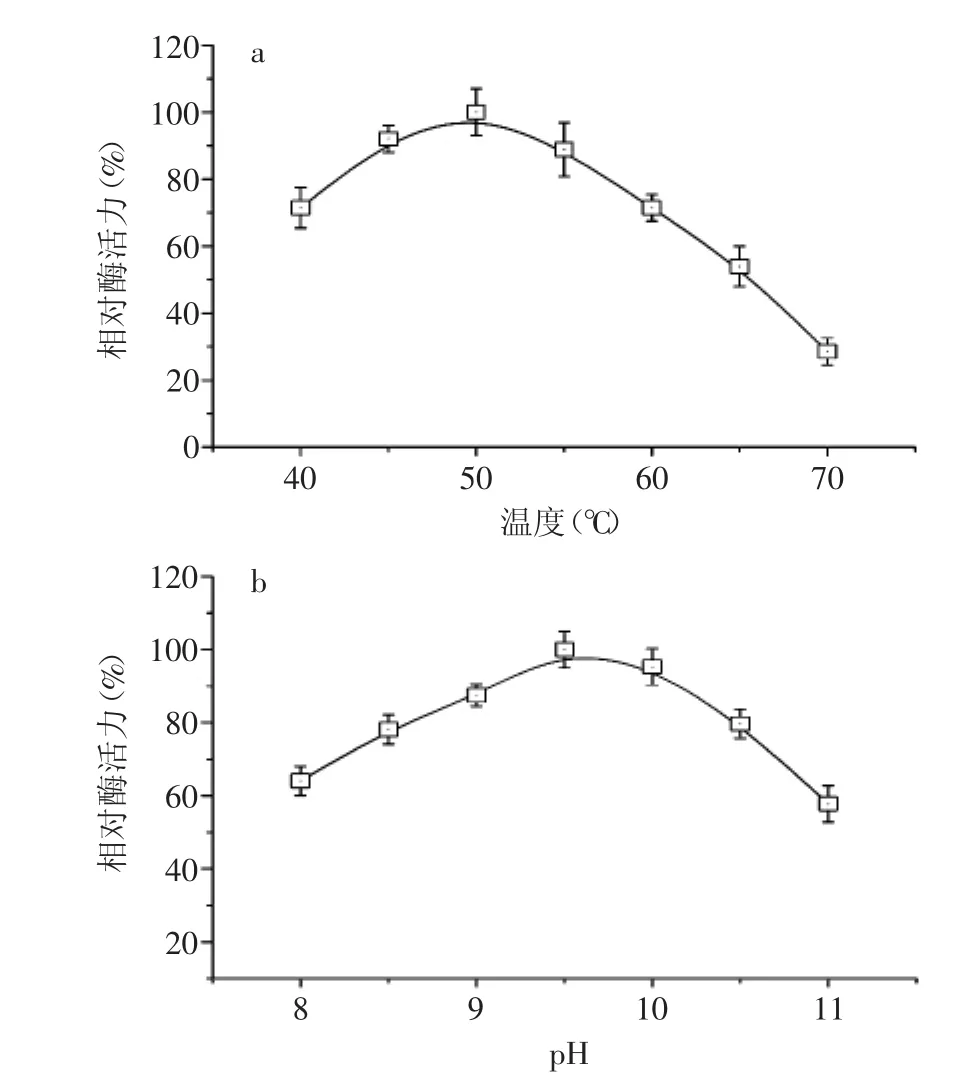
图6 温度(a)和pH(b)对酶催化活力的影响Fig.6 Effect of temperature(a)and pH(b)on catalytic activity of the enzyme

图7 温度(a)和pH(b)对酶稳定性的影响Fig.7 Effect of temperature(a)and pH(b)on stability of the enzyme
2.5.3 金属离子对酶催化活力的影响 研究结果如图8所示,表明高浓度(5 mmol/L)的Cu2+、Fe2+、Ca2+和Mn2+对该酶表现出一定抑制作用,而Mg2+、Zn2+和Co2+对该酶催化活性没有明显影响。

图8 金属离子对酶催化活力的影响Fig.8 Effect of mental ions on catalytic activity of the enzyme
3 结论与讨论
目前关于碱性β-葡萄糖苷酶的研究报道非常少,仅有的少量报道显示不同来源的碱性β-葡萄糖苷酶碱性作用条件较为相似,如马振刚等[17]通过基因枪方法从兔盲肠细菌宏基因组中克隆到一种碱性β-葡萄糖苷酶编码基因,在大肠杆菌中异源表达量后其碱性β-葡萄糖苷酶最适作用pH为10.0,在pH4.0~11.0范围内保持较高酶活力;苏迪等[18]报道一种克雷伯氏杆菌所产碱性β-葡萄糖苷酶最适作用pH为10.0,在pH7.0~11.0范围内具有较高催化活力。本文采用七叶苷筛选平板显色法快速从多个样本中筛选出产β-葡萄糖苷酶菌株并鉴定为Bacillus sp.,研究结果显示该菌株在pH9.0~10.0范围内生长良好,是一种专性嗜碱菌。该菌株所产β-葡萄糖苷酶最适作用温度为50℃,最适作用pH为9.5并在pH8.0~11.0范围内可发挥较高催化活力;该酶在弱碱环境中(pH9.0~10.0)非常稳定,但在高温(大于60℃)条件下容易失活。综上,研究中使用七叶苷平板显色法快速筛选得到β-葡萄糖苷酶产生菌株,虽然所获得的菌株产酶水平比较低,但所获菌株的生长和产酶特性及酶作用条件等研究结果可为产碱性β-葡萄糖苷酶的微生物资源研究及后期碱性β-葡萄糖苷酶基因的克隆和异源表达等工作奠定一定基础。
[1]Juturu V,Wu J C.Microbial cellulases:Engineering,production and applications[J].Renewable and Sustainable Energy Reviews,2014,33:188-203.
[2]Karmakar M,Ray R R.Current trends in research and application of microbial cellulases[J].Research Journal of Microbiology,2011(6):41-53.
[3]Bhatia L,Johri S,Ahmad R.An economic and ecological perspective of ethanol production from renewable agro waste:a review[J].AMB Express,2012,2(1):65.
[4]Lee W H,Nan H,Kim H J,et al.Simultaneous saccharification and fermentation by engineered Saccharomyces cerevisiae without supplementing extracellular β-glucosidase[J].Journal of Biotechnology,2013,167(3):316-322.
[5]邵金辉,韩金祥,朱有名,等.葡萄糖苷酶在工农医领域的应用[J].生命的化学,2005,25(1):22-24.
[6]Shin K C,Lee H J,Oh D K.Substrate specificity of βglucosidase from Gordonia terrae for ginsenosides and its application in the production of ginsenosides Rg3,Rg2,and Rh1from ginseng root extract[J].Journal of Bioscience and Bioengineering,2015,119(5):497-504.
[7]张丹,刘耀平,鱼红闪,等.人参皂苷β-葡萄糖苷酶的分离纯化及其酶学特性[J].应用与环境生物学报,2003,9(3):259-262.
[8]王斌,江和源,张建勇,等.酶工程技术在茶叶深加工中的应用及展望[J].茶叶科学,2010,30(1):521-526.
[9]Chandra M,Kalra A,Sangwan N S,et al.Biochemical and proteomic characterization of a novel extracellular β-glucosidase from Trichoderma citrinoviride[J].Molecular Biotechnology,2013,53:289-299.
[10]Guo Y,Yan Q,Yang Y,et al.Expression and characterization of a novel β-glucosidase,with transglycosylation and exo-β-1,3-glucanase activities,from Rhizomucor miehei[J].Food Chemistry,2015,175:431-438.
[11]Sarethy I P,Saxena Y,Kapoor A,et al.Alkaliphilic bacteria: applications in industrial biotechnology[J].Journal of Industrial Microbiology&Biotechnology,2011,38(7):769-790.
[12]Annamalai N,Rajeswari M V,Elayaraja S,et al.Thermostable,haloalkaline cellulase from Bacillus halodurans CAS 1 by conversion of lignocellulosic wastes[J].Carbohydrate Polymers,2013,94(1):409-415.
[13]刘刚,余少文,孔舒,等.碱性纤维素酶及其应用的研究进展[J].生物加工过程,2005,3(2):9-14.
[14]沈萍,陈向东.微生物学实验[M].第4版.北京:高等教育出版社,2007.
[15]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].第三版.北京:科学出版社,2002.
[16]MillerG L.Use of dinitrosalicylic acid reagent for determination of reduce sugar[J].Analytical Chemistry,1959,31 (3):426-428.
[17]马振刚,唐婧,马淑华,等.新型碱性低分子量β-葡萄糖苷酶基因的分离与酶学性质研究[J].食品工业科技,2012,4:108-113.
[18]苏迪,徐小蓉,唐婧.高产碱性β-葡萄糖苷酶的产纤维素酶菌株的筛选[J].贵州农业科学,2012,40(2):87-89.
Screening and identification of alkaline β-glucosidase producing-strain and partial enzyme characterization
LI Song1,YANG Qian1,FAN Li-long1,CUI Feng-jie2,ZHAO Peng-xiang3
(1.School of Biological and Chemical Engineering,Anhui Polytechnic University,Wuhu 241000,China;2.School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013,China;3.Beijing Biomass Energy Technology Center,State Grid Energy Conservation Service Ltd.,Beijing 100053,China)
One β-glucosidase producing strain was selected from various soil samples and dyeing wastewater by using esculin agar plate screening method with the aim to study and develop alkaline microbial origin βglucosidase resources,and the microbiology identification,fermentation properties and enzyme characterization of the isolated strain were further studied.The isolated strain was identified as Bacillus sp.,and the optimum growth and enzyme production temperatures was between 35~37℃,and the optimum growth and enzyme production pH were at 9.5 and 9.0,respectively.The optimum temperature and pH of the produced enzyme was 50℃and 9.5,respectively,and the enzyme was stable at temperatures below 50℃and in a pH range of 9.0~10.0.Mental ions,such as Cu2+,Fe2+,Ca2+and Mn2+showed some inhibition to the enzyme,Mg2+,Zn2+and Co2+have no significantly effect on the catalytic activity of the enzyme.The results obtained in the study were meaningful for microbial resources and information consolidation of alkaline β-glucosidase producing strain.
alkaline β-glucosidase;screening;enzyme characterization
TS201.1
A
1002-0306(2016)02-0180-06
10.13386/j.issn1002-0306.2016.02.028
2015-05-11
李松(1980-),男,博士,研究方向:发酵工程、工业微生物遗传育种,E-mail:lisong821123@126.com。
安徽省自然科学青年基金资助项目(1408085QC61);安徽工程大学引进人才科研启动基金(2013YQQ003);国家电网公司科技项目资助(合同号:SGECS56-2014)。
