三种低氟南极磷虾肽的ACE抑制作用及抗氧化活性研究
2016-09-14王彦超常耀光李兆杰薛长湖中国海洋大学食品科学与工程学院山东青岛266003
高 颖,王彦超,常耀光,薛 勇,李兆杰,薛长湖(中国海洋大学食品科学与工程学院,山东青岛266003)
三种低氟南极磷虾肽的ACE抑制作用及抗氧化活性研究
高 颖,王彦超,常耀光,薛 勇,李兆杰,薛长湖*
(中国海洋大学食品科学与工程学院,山东青岛266003)
以高效回收脱脂磷虾粉中的蛋白质为出发点,以低氟南极磷虾肽的制备为切入点,旨在通过探究不同磷虾肽的基本性质及体外功能活性,为磷虾肽的应用奠定理论基础。研究以脱脂南极磷虾粉为原料,以三种蛋白酶为水解酶,经酶解、脱氟、脱盐、干燥制备得到三种低氟磷虾肽。通过对三种磷虾肽的得率、基本组成、分子量分布及红外光谱进行分析,评估三种磷虾肽制备工艺的可行性及产物的基本性质。通过对三种产物的体外ACE抑制作用及抗氧化活性进行测定,比较三种磷虾肽的体外功能活性。结果表明,三种磷虾肽的回收率高、蛋白质含量高、分子量集中分布在200~2000 u范围内;中性蛋白酶水解肽和碱性蛋白酶水解肽的ACE抑制作用显著优于胰蛋白酶水解肽(p<0.05),胰蛋白酶水解肽的抗氧化活性显著高于中性蛋白酶水解肽和碱性蛋白酶水解肽(p<0.05);磷虾肽的体外活性与其氨基酸组成、分子量分布和二级结构相关。
南极磷虾,肽,ACE抑制作用,抗氧化活性
南极磷虾生物储量大、蛋白质含量高,是一种新兴的蛋白质资源。磷虾蛋白质的氨基酸组成合理、生物价高,具有潜在的生理活性和应用价值。近年来,南极磷虾(E.superba)被广泛研究,已经被列为南极海域主要的渔业捕捞品种。据估计,南极磷虾的生物量约为400~1550百万公吨[1],约相当于其他所有可捕捞海洋水产品生物量的总和。南极磷虾约含有77.9% ~83.1%水分、0.4%~3.6%脂质、11.9%~15.4%蛋白质和2%甲壳质[2]。磷虾蛋白的氨基酸组成合理、生物价高,是一种优质的蛋白质来源[3]。磷虾油具有降血脂、调节脂代谢等生理功能[4],已被作为营养食品在市场上销售。南极磷虾粉经有机溶剂萃取后,得到主产物磷虾油和副产物脱脂磷虾粉。脱脂磷虾粉中含有65%~75%蛋白质,是回收蛋白质的良好原料。因此,建立一种从脱脂虾粉中回收蛋白质的工艺路线是实现磷虾高值化利用的有效途径之一。
蛋白酶水解法是从食品原料中回收蛋白质的有效手段之一。通过向食品原料中添加外源酶制剂可以使蛋白质降解为可溶于水的多肽或氨基酸,使蛋白质得到回收。蛋白酶的种类决定了肽键断裂的类型,从而影响到蛋白质的回收率及产物多肽的理化性质和功能活性[5]。研究表明,食源性多肽除可提供氮源和氨基酸,还具有免疫调节、降血压、抗氧化等多种潜在的生理功能[6-8]。
本文以脱脂南极磷虾粉为原料,采用三种蛋白酶为水解酶,制备得到三种低氟磷虾肽。通过分析三种产物的得率、基本组成、分子量分布及红外光谱,评估三条磷虾肽的制备工艺及基本性质。通过测定三种磷虾肽的ACE抑制作用活性和抗氧化活性,确定三种磷虾肽的最适功能活性。本文的创新点在于,建立了脱脂磷虾粉中高效回收低氟蛋白质的工艺,并在此基础上比较研究了不同蛋白酶水解所得磷虾肽的体外功能活性。
1 材料与方法
1.1 材料与仪器
南极磷虾粉(E.superba) 辽宁省大连海洋渔业集团公司提供,于-20℃贮存;胰蛋白酶(4.0×103U/g,最适反应pH为8.0,最适温度为50℃) 购于无锡市雪梅生物工程有限公司;碱性蛋白酶(1.5×105U/g,最适反应pH为8.0,最适温度为50℃)及中性蛋白酶(1.5×105U/g,最适反应pH为7.5,最适温度为45℃) 均购于广西市庞博生物工程有限公司;马尿基-L-组氨酰-L-亮氨酸(HHL,MW 429 u)、血管紧张素转化酶(ACE,0.25 U)、马尿酸(HA)、1,1-二苯基-2-三硝基苯肼(DPPH)、啡啰嗪(Ferrozine)、二丁基羟基甲苯(BHT) 购于美国Sigma-Aldrich公司;其他试剂 均为国产分析纯试剂。
FLOM-UNR-D2-1812卷式膜超滤系统 青岛富勒姆科技有限公司;IFS 55红外光谱仪 德国Bruker公司;722可见分光光度计 尤尼柯仪器有限公司;Biochrom 30 Ltd氨基酸自动分析仪 英国Biochrom公司;Alpha 1-4LD冷冻干燥机 德国Christ公司;安捷伦1200 HPLC液相色谱仪 美国安捷伦公司;PF-1氟选择电极、232甘汞参比电极 上海雷磁精密仪器有限公司;精密电动搅拌器 常州国华电器有限公司。
1.2 实验方法
1.2.1 低氟磷虾肽的制备工艺 南极磷虾粉→脱脂→酶解→灭酶→离心→取上清→脱氟→脱盐→冷冻干燥→低氟磷虾肽。
脱脂:向南极磷虾粉中加入95%乙醇(1∶10,w/v)混合,采用电动搅拌器于室温下搅拌,搅拌速度为1500 r/min,反应6 h后,过滤,取滤渣,50℃ 烘干,备用。
酶解:向脱脂南极磷虾粉中加入蒸馏水(1∶10,w/v),重复三组,分别调节三组混合液至最适pH,分别向三组混合液中加入胰蛋白酶、中性蛋白酶和碱性蛋白酶,酶底比为2%(w/w,酶/虾粉),于最适温度下保温6 h,将酶解液于100℃加热5 min,终止酶解反应,待酶解液冷却至室温后,于5000×g常温离心20 min,收集上清液,即得磷虾肽酶解液。
脱氟:采用氯化钙法脱除酶解液中的氟化物[9],即得低氟酶解液。
脱盐:采用纳滤法降低酶解液中的盐分含量[10],纳滤膜的截留分子量为100 u,即得产物酶解液。
冷冻干燥:产物酶解液经冷冻干燥后,即得低氟磷虾肽粉末。本论文中将三种蛋白酶制备所得低氟磷虾肽分别定义为胰蛋白酶水解磷虾肽(AKT)、碱性蛋白酶水解磷虾肽(AKA)和中性蛋白酶水解磷虾肽(AKN)。
1.2.2 低氟磷虾肽的得率计算

1.2.3 基本成分分析 蛋白质含量:采用凯氏定氮法测定,参照国标GB/T 5009.5-2010;水分含量:采用直接干燥法测定,参照GB/T 5009.3-2010;灰分含量:参照国标GB/T 5009.4-2010测定;脂肪含量:采用氯仿/甲醇(2/1,v/v)抽提法测定,参照Bligh&Dyer[11]的方法;总糖含量:采用硫酸苯酚法测定,参照Dubois等[12]的方法;总氟含量:样品经0.1 mol/L高氯酸消化后,采用氟离子选择电极法[13]测定;氨基酸组成分析:参照GB/T 5009.124-2003。
1.2.4 低氟磷虾肽的分子量分布 采用凝胶排阻色谱法测定。色谱条件如下:色谱柱:Superdex-peptide 10/300 GL;流动相:30%乙腈(0.1%TFA);进样量:50 μL;流速:0.5 mL/min;柱温:室温;紫外检测波长:220 nm;样品浓度:5 g/L。
1.2.5 低氟磷虾肽的红外光谱分析 将磷虾肽样品按照一定浓度溶于超纯水,采用红外光谱仪对样品在1800~1200 cm-1波数范围内进行扫描,扫描数为256,分辨率为4 cm-1[14]。红外光谱曲线采用OMNIC软件进行基线校正、曲线平滑和自动去卷曲处理。
1.2.6 低氟磷虾肽体外ACE抑制作用的测定 参照Cushman&Cheung[15]的方法,将样品按照不同浓度溶解在50 mmol/L的硼酸缓冲液(pH8.3,0.3 mol/L NaCl)中,取10 μL样品加入30 μL 2.5 mmol/L马尿基-L-组氨酰-L-亮氨酸(HHL),混匀,37℃预热5 min,加入8 μL 0.25 U ACE,37℃反应60 min,用70 μL 1 mol/L HCl终止反应。空白采用50 mmol/L硼酸缓冲液代替样品。
采用反相高效液相色谱法测定三种多肽混合物的ACE活性抑制作用,色谱条件如下:色谱柱:ZORBAX SB-C18(4.6 mm×250 mm,5 μm);流动相:10%~60% B,20 min;A:超纯水(0.05%TFA),B:乙腈(0.05% TFA);柱温:37℃;流速:0.8 mL/min;进样量:50 μL;检测波长:228 nm。
1.2.7 低氟磷虾肽体外抗氧化活性的测定
1.2.7.1 DPPH自由基清除能力 参照Yen&Hsieh[16]的方法,将样品配成不同浓度的水溶液,分别取200 μL不同浓度的样品溶液,加入600 μL甲醇和200 μL 0.15 mol/L的DPPH甲醇溶液,混匀2 min,室温避光放置30 min,测定517 nm吸光值。空白以水溶液代替样品。DPPH自由基的清除能力(RSA)计算参照方法[17-18]。

以多肽样品浓度和DPPH自由基的清除能力为源数据作图,计算出RSA为50%时的样品浓度(EC50),以BHT为阳性对照。
1.2.7.2 过渡金属离子螯合能力 参照Decker& Welch[19]的方法。将样品配成不同浓度的水溶液,分别取200 μL不同浓度的样品溶液,加入10 μL 2 mmol/L FeCl2和600 μL超纯水,混匀后,加入20 μL 5 mmol/L Ferrozine试剂,混匀2 min,室温静置10 min,测定562 nm吸光值。空白样品由超纯水代替。亚铁离子螯合能力(CA)的计算参照方法[17,20]。
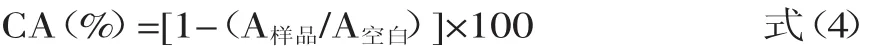
以多肽样品浓度和亚铁离子螯合能力为源数据作图,计算出CA为50%时的样品浓度(EC50),以EDTA作为阳性对照。
1.2.8 数据分析 所有实验均重复3次。运用PASW 18.0统计分析软件的单因素方差分析算法对数据进行方差分析。多重比较分析采用Tukey's test算法确定显著性差异(p<0.05)。
2 结果与分析
2.1 三种低氟磷虾肽的回收率
本实验中酶解上清液经过CaCl2脱氟、纳滤脱盐后直接冻干,得到低氟磷虾肽。三种磷虾肽的得率及蛋白质回收率如表1所示。

表1 三种低氟磷虾肽的得率及蛋白回收率Table1 Yield and recovery rate of krill peptides with low fluorine content by three types of proteases
由表1结果可知,采用三种蛋白酶分别水解脱脂磷虾粉,磷虾肽的回收率均在70%以上,且无显著性差异。欧成坤[21]研究结果表明,采用酸性蛋白酶水解牡蛎肉,蛋白溶出率为77%;任娇艳[22]采用碱性蛋白酶水解草鱼肌浆蛋白和基质蛋白,蛋白利用率分别为71%和40%。鉴于此,由于本实验的蛋白回收率较高,所采取的工艺路线可用于南极磷虾粉中蛋白质的回收利用。
新鲜生物原料水溶液的pH一般在7.0~8.0之间,因此,本实验选择最适pH在7.0以上的蛋白酶可以避免反应开始因为调pH向溶液中引入过多的无机盐。反应过程中,通过对磷虾酶解液pH的实时监控,发现其pH的下降对于反应最终蛋白得率的影响较小。综合考虑纳滤过程中脱盐所产生的成本消耗,水解过程中仅在反应1 h后进行一次pH调整。本实验方法蛋白回收率高、操作简便,成本较低,可应用于低氟磷虾肽的工业化制备。
2.2 三种低氟磷虾肽的基本成分分析
三种磷虾肽的基本组成如表2所示。由此可知,三种磷虾肽的灰分含量均低于7%,符合GB/T 22729-2008海洋鱼低聚肽粉标准的规定[23]。中性蛋白酶水解肽和碱性蛋白酶水解肽中糖类的含量分别为2.30% 和1.95%,而胰蛋白酶水解肽的总糖含量较低。
据Allowances[24]规定,成年人对氟的每日安全摄入量为3.1~3.8 mg,超过10 mg的每日摄入量会对人体产生危害。正常人摄入过量的氟会导致中毒,主要症状表现为骨骼结构的变化和酶抑制[25]。由表3可知,本实验得到的磷虾肽经过脱氟处理后,氟含量均在15 mg/kg以下。依据《中国居民膳食指南》对每日蛋白质建议摄入量的规定,每人每日的建议蛋白摄入量为55~90 g不等。据此推算,磷虾水解物的氟含量在安全允许范围内。
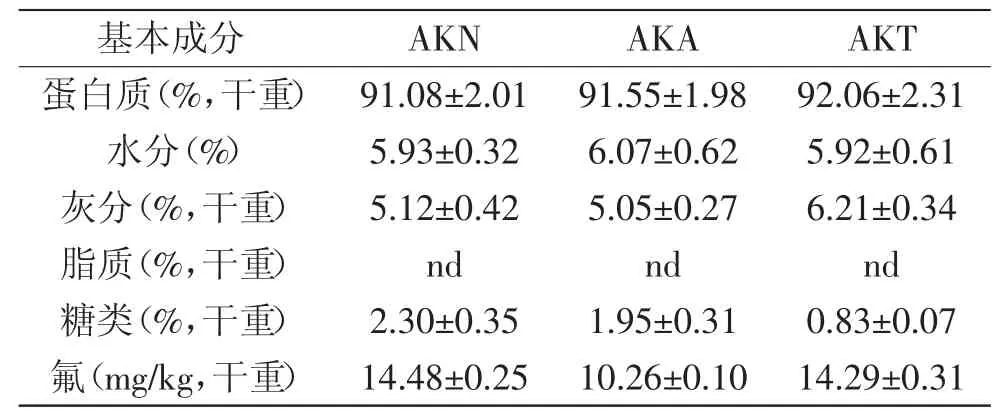
表2 三种低氟磷虾肽的基本成分分析Table2 Composition of krill peptides with low fluorine content by three types of proteases
三种低氟磷虾肽的氨基酸组成如表3所示。由表3可知,磷虾肽中谷氨酸和天冬氨酸含量较高,两种氨基酸的含量约占总氨基酸含量的27%。三种磷虾肽的必需氨基酸组成和总量均符合FAO对食品中必需氨基酸的要求。三种磷虾肽中,中性蛋白酶水解肽和碱性蛋白酶水解肽的氨基酸组成比较相近,但碱性蛋白酶水解肽的芳香族氨基酸、碱性氨基酸、酸性氨基酸和不带电极性氨基酸的含量均略高些。
2.3 三种低氟磷虾肽的分子量分布
本实验采取凝胶排阻色谱法(SEC)测定三种低氟磷虾肽的分子量分布。随着蛋白水解反应的进行,大分子蛋白被水解成不同分子量肽段的混合物。凝胶色谱法检测磷虾活性肽分子量结果如图1所示。
由图1可知,洗脱20~40 min后,三种低氟磷虾肽的色谱图中均依次出现三个相似的洗脱峰;洗脱40 min后,胰蛋白酶水解的磷虾肽出现多个洗脱峰,主要是由于酸性或芳香族氨基酸残基导致的保留时间延长引起的。
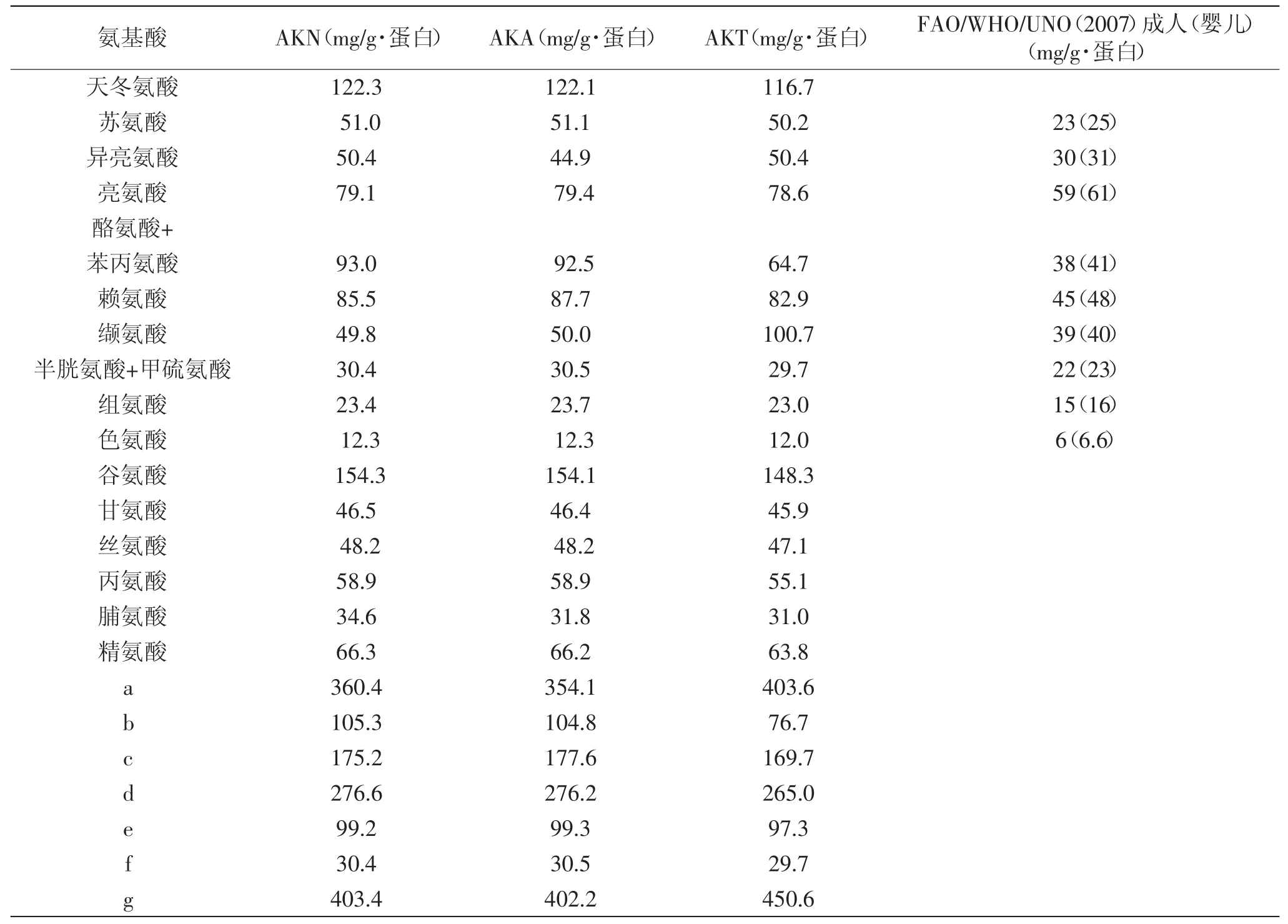
表3 三种低氟磷虾肽的氨基酸组成分析Table3 Amino acid composition of krill peptides with low fluorine content by three types of proteases
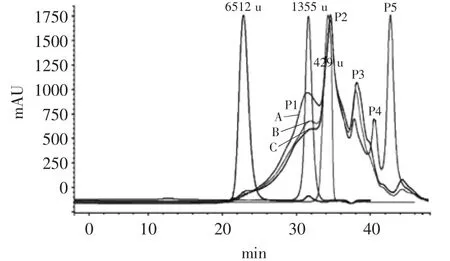
图1 三种低氟磷虾肽的凝胶排阻色谱图Fig.1 Size distribution of krill peptides with low fluorine content by three types of proteases
前人研究表明生物活性肽的活性往往与它的分子量有一定关系。Liu等[26]采用胃蛋白酶和木瓜蛋白酶的复合酶解海蜇(Rhopilema esculentum)蛋白,得到分子量小于2000 u的水解物片段,具有良好的体外ACE抑制活性和体内降血压活性;Rajapakse等[26]采用微生物发酵蓝贝蛋白并从中分离纯化得到了七肽片段HFGBPFH,分子量为962 u,具有优于α-生育酚的抗氧化活性。
三种低氟磷虾肽中分子量分布的差异主要是由酶切位点和酶作用方式的差异引起的。胰蛋白酶水解肽具有较强的特异性,而中性蛋白酶和碱性蛋白酶的作用位点多且丰富,因此其产物的分子量分布图谱中,中性蛋白酶和碱性蛋白酶水解肽表现出了较多的相似性,胰蛋白酶水解肽则表现出了较多的特异性。
2.4 三种低氟磷虾肽的红外光谱分析
磷虾肽红外光谱图的特征谱带可以反应其二级结构和侧链的振动情况。图2为三种低氟磷虾肽的原始红外光谱图和二阶导数图谱。
由图2可知,三种多肽的主要谱带分布相似,主要分为三个特征谱带:a.1600~1700 cm-1范围的酰胺Ⅰ谱带吸收峰;b.1500~1600 cm-1范围的酰胺Ⅱ谱带吸收峰,反应多肽主链的二级结构及部分侧链氨基酸残基信息;c.1400~1200 cm-1范围的酰胺Ⅲ谱带吸收峰。酰胺Ⅰ谱带吸收峰主要是由C=O伸缩振动引起的,反应多肽主链的二级结构。酰胺Ⅱ谱带受多肽主链的二级结构和部分氨基酸残基振动的共同影响,其中由谷氨酸和天冬氨酸侧链中的COOH引起的振动吸收峰主要位于1500~1600 cm-1范围内。酰胺Ⅲ谱带受主链中NH的弯曲振动和侧链残基的共同影响[28]。比较发现,碱性蛋白酶水解肽和中性蛋白酶水解肽的红外图谱较为相似,胰蛋白酶水解肽的酰胺Ⅱ谱带较其他两种强烈。
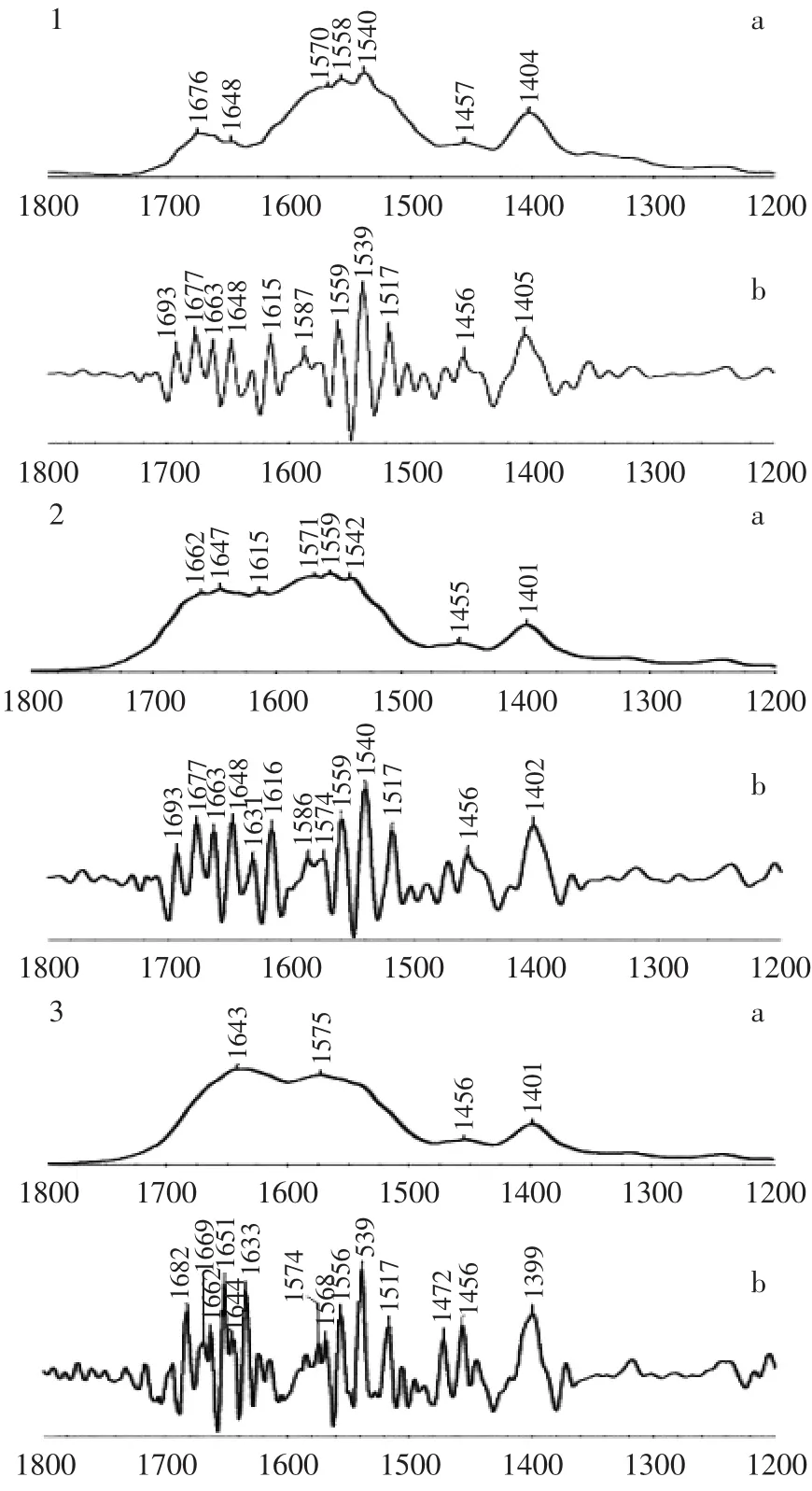
图2 三种低氟磷虾肽的红外光谱图Fig.2 Infrared spectra of krill peptides with low fluorine content by three types of proteases
2.5 三种低氟磷虾肽的ACE抑制作用
通过蛋白酶的水解作用,可以使很多食源性蛋白质转变成具有生物活性的多肽类物质或是潜在生理调节器[29]。
由表4可知,磷虾碱性蛋白酶和中性蛋白酶的水解产物多肽均具有较好的ACE抑制活性,分别为0.18 mg/mL和0.21 mg/mL。这与任艳[30]所制备的磷虾酶解液ACE抑制活性测定结果不一致,主要是因为原料以及提取方法的差异所致。He等[31]采用四种蛋白酶从12种海洋生物蛋白中提取到了IC50值为0.17~501.7 mg/mL不等的一系列多肽类,进一步说明原料以及蛋白酶种类对产物活性的重要性。
蛋白酶水解产物ACE活性抑制作用的差异与多肽片段的基本性质相关,包括分子量、极性、氨基酸组成以及末端氨基酸序列等。由凝胶排阻色谱图分析可知,中性蛋白酶和碱性蛋白酶水解肽的分子量分布表现出一致的趋势。由氨基酸组成分析结果可知,中性蛋白酶水解肽中疏水性氨基酸和芳香族氨基酸的含量分别为36.04%和10.53%;碱性蛋白酶水解肽中疏水性氨基酸和芳香族氨基酸的含量分别为35.41%和10.48%。

表4 三种低氟磷虾肽的ACE抑制作用测定结果Table4 ACE inhibition abilities of krill peptides with low fluorine content by three types of proteases
2.6 三种低氟磷虾肽的抗氧化活性
抗氧化剂的抗氧化能力与底物种类、抗氧化剂以及他们之间的亲和力有关[32]。研究表明,由于不同的检测方法中,活性物质发挥抗氧化活性的作用方式不同,因此不能通过单一的反应确定该物质抗氧化活性的强弱[33]。本实验同时采用DPPH自由基清除法和过渡金属离子螯合法对三种磷虾肽的抗氧化能力进行评估,结果如表5所示。三种低氟磷虾肽的DPPH自由基清除能力和亚铁离子螯合能力均显著弱于BHT(p<0.05)。其中,胰蛋白酶水解肽的DPPH自由基清除能力和亚铁离子螯合能力均显著高于碱性蛋白酶水解肽和中性蛋白酶水解肽(p<0.05)。
生物活性肽的抗氧化性与其来源、制备方法和活性测定方法均密切相关。Suetauna等[34]研究表明,多肽侧链中的酸性氨基酸或碱性氨基酸残基对多肽与金属离子螯合作用的发挥具有重要作用。红外光谱分析结果显示,胰蛋白酶水解肽在水溶液中会暴露出较多的酸性氨基酸残基,表现为光谱图中较高的侧链羧基振动峰。
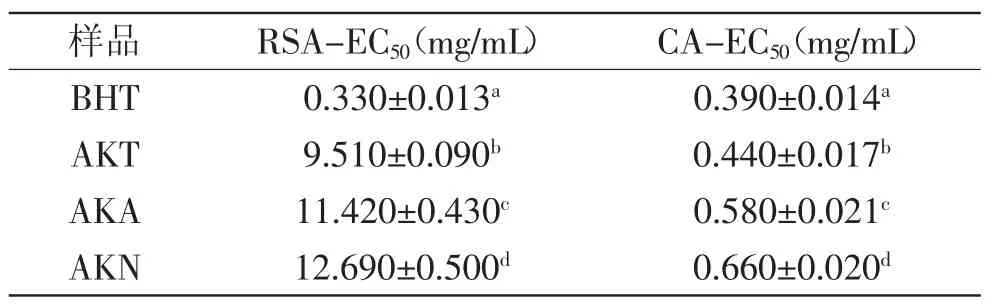
表5 三种低氟磷虾肽的抗氧化活性测定结果Table5 Antioxidant activies of krill peptides with low fluorine content by three types of proteases
3 结论
本研究建立了三种低氟磷虾肽的制备工艺,蛋白回收率均高于70%,三种磷虾肽的蛋白含量高于90%(干重),灰分含量均低于7.0%(干重),氟含量低于15 mg/kg(干重),必需氨基酸含量高,分子量主要分布在200~2000 u范围内。碱性蛋白酶水解肽和中性蛋白酶水解肽在氨基酸组成、分子量分布和二级结构方面具有较高的一致性。中性蛋白酶水解肽和碱性蛋白酶水解肽的ACE抑制作用显著优于胰蛋白酶水解肽;胰蛋白酶水解肽的抗氧化性显著高于中性蛋白酶水解肽和碱性蛋白酶水解肽。三种低氟磷虾肽的体外活性与其氨基酸组成、分子量分布和二级结构相关。
[1]Atkinson A,Siegel V,Pakhomov E A,et al.A re-appraisal of the total biomass and annual production of Antarctic krill[J].Deep-Sea Research part I,2009,56:727-740.
[2]Grantham G J.The Southern Ocean:The Utilization of krill [M].Rome:FAO,1977:1-61.
[3]Wang L Z,Xue C H,Wang Y M,et al.Extraction of proteins with low fluoride level from Antarctic krill(Euphausia superba)and their composition analysis[J].J Agric Food Chem.,2011,59:6108-6112.
[4]Tillander V,BjØrndal B,Burri L,et al.Fish oil and krill oil supplementations differentially regulate lipid catabolic and synthetic pathways in mice[J].Nutrition&Metabolism,2014,11:20-36.
[5]Shahidi F,Zhong Y.Bioactive peptides[J].Journal of AOAC International,2008,9:914-931.
[6]蔡木易.食源性肽研究进展[J].北京工商大学学报:自然科学版,2012,30(5):1-2.
[7]薛向阳,孔繁东,祖国仁,等.食品抗高血压肽的研究进展和前景分析[J].食品研究与开发,2004,25(6):28-30.
[8]张贵川,袁吕江.食源性生物活性肽的研究进展[J].中国粮油学报,2009,24(9):158-159.
[9]李红艳.南极磷虾酶解液脱氟研究[D].青岛:中国海洋大学,2011.
[10]孔凡丕,刘鹭,孙卓,李红娟,吕加平.纳滤技术对干酪乳清脱盐性能的影响[J].农业工程学报,2010,26(12):363-366.
[11]Bligh E G,Dyer W J.A rapid method of total lipid extraction and purification[J].Canadian Journal of Biochemistry and Physiology,1959,37:911-917.
[12]Dubois M,Gilles K A,Hamilton J K,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28:350-356.
[13]Adelung D,Buchholz F,Culik B,et al.Fluoride in tissues of krill Euphausia superba Dana and Meganyctiphanes norvegica M.Sars in relation to the moult cycle[J].Polar Biology,1987,7:43-50.
[14]Schmidt P,Dybal J,Trchov M.Investigations of the hydrophobic and hydrophilic interactions in polymer-water systems by ATR FTIR and Raman spectroscopy[J].Vibrational Spectroscopy,2006,42:278-283.
[15]Cushman D W,Cheung H.Spectrophotometric assay and properties of the angiotensin converting enzyme of rabbit lung[J].Biochem Pharmol,1971,20:911-917.
[16]Yen G C,Hsieh P P.Antioxidative activity and scavenging effects on active oxygen of xylose-lysine Maillard reaction-products[J].Journal of the Science of Food and Agriculture,1995,67:415-420.
[17]Xie Z,Jr Huang,Xu X,et al.Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate[J].Food Chemistry,2008,111:370-376.
[18]Byun H,Lee J K,Park H G,et al.Antioxidant peptides isolated from the marine rotifer,Brachionus rotundiformis[J].Process Biochemistry,2009,44:842-846.
[19]Decker E A,Welch B.Role of ferritin as a lipid oxidation catalyst in muscle food[J].Journal of Agricultural and Food Chemistry,1990,38:674-677.
[20]Gimenez B,Aleman A,Montero P,et al.Antioxidant and functional properties of gelatin hydrolysates obtained from skin of sole and squid[J].Food Chemistry,2009,114:976-983.
[21]欧成坤.酶法制备牡蛎生物活性肽工艺研究[D].无锡:江南大学,2005.
[22]任娇艳.草鱼蛋白源抗疲劳生物活性肽的制备分离及鉴定技术研究[D].广州:华南理工大学,2008.
[23]GB/T 22729-2008,海洋鱼低聚肽粉标准[S].
[24]National Academy of Sciences:National Research Council.Recommended Dietary Allowances[M].10th ed.Washington DC,1989.
[25]Eagers R Y.Toxic properties of inorganic fluoride compounds.Elsevier,1969:152.
[26]Liu X,Zhang M,Zhang C,et al.Angiotensin converting enzyme(ACE)inhibitory,antihypertensive and antihyperlipidaemic activities of protein hydrolysates from Rhopilema esculentum[J].Food Chemistry,2012,134:2134-2140.
[27]Rajapakse N,Mendis E,Jung W,et al.Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J].Food Research International,2005,38:175-182.
[28]Deacon G B,Phillips R J.Relationships between the carbon-oxygen stretching frequencies of carboxylate complexes and the type of carboxylate coordination[J].Chemical Reviews,1980,33:227-250.
[29]Pihlanto-Leppälä A.Bioactive peptides derived from bovine whey proteins:Opioid and ace-inhibitory peptides[J].Trends in Food Science&Technology,2001,2001:347-356.
[30]任艳.南极磷虾蛋白加工利用的初步研究[D].青岛:中国海洋大学,2009.
[31]He H L,Chen X L,Wu H,et al.High throughput and rapid screening of marine protein hydrolysates enriched inpeptides with angiotensin-I-converting enzyme inhibitory activity by capillary electrophoresis[J].Bioresource Technology,2007,98:3499-3505.
[32]Moure A,Dominguez H,Parajo J C.Antioxidant properties of ultrafiltration recovered soy protein fractions from industrial effluents and their hydrolysates[J].Process Biochemistry,2006,41:447-456.
[33]GÜLÇIN,ALICI H A,CESUR M.Determination of in Vitro Antioxidant and Radical Scavenging Activities of Propofol[J].Chemical&Pharmaceutical Bulletin,2005,53:281-285.
[34]Suetsuna K,Ukeda H,Ochi H.Isolation and characterization of free radical scavenging activities peptides derived from casein [J].Journal of Nutritional Biochemistry,2000(11):128-131.
ACE inhibition and antioxidant activities of three types of Antarctic krill (Euphausia superba)peptides with low fluorine content
GAO Ying,WANG Yan-chao,CHANG Yao-guang,XUE Yong,LI Zhao-jie,XUE Chang-hu*
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China)
The object of this study was to effectively recovery protein from defatted Antarctic krill powder.In this study,krill peptides with low fluorine content were prepared from defatted krill powder and their physicochemical properties and biological activities were characterized.Krill peptides were prepared through enzymatic hydrolysis with three types of protease.After enzymatic hydrolysis,defluorination,desalination and lyophilization,three types of krill peptides with low fluorine content were obtained.To evaluate the feasibility of these technologies and characterize the properties of krill peptides,the yield,proximate composition,molecular weight distribution and infrared spectroscopy of peptides were determined.The biological activities of these three types of peptides were explored through the measurement of their ACE inhibition and antioxidant activities in vitro.Three types of krill peptides all showed high recovery rate,high protein content and their molecular weight distribution mainly ranged from 200 to 2000 u.Krill peptides through neutral and alkaline protease exhibited significantly higher ACE inhibition activities in comparison with their counterparts through tryptic protease(p<0.05).Meanwhile,krill peptides through tryptic protease showed significantly better antioxidant activities than those through neutral and alkaline protease(p<0.05).The bioactivities of krill peptides in vitro were intimately related with their amino acid composition,molecular weight distribution and secondary structure.
Antarctic krill;peptide;ACE inhibition;antioxidant activity
TS254.9
A
1002-0306(2016)02-0082-07
10.13386/j.issn1002-0306.2016.02.008
2015-05-29
高颖(1993-),女,硕士研究生,研究方向:水产加工工业,E-mail:18762670985@163.com。
*通讯作者:薛长湖(1964-),男,博士,教授,研究方向:水产化学,E-mail:xuech@ouc.edu.cn。
国家自然科学基金(31330060);国家自然科学基金(U1406402)。
