氯虫苯甲酰胺在水稻及稻田环境中的残留动态
2016-09-14段劲生孙明娜肖青青朱玉杰孙海滨刘艳萍高同春
段劲生, 王 梅, 董 旭, 孙明娜, 肖青青,朱玉杰, 孙海滨, 刘艳萍, 高同春
(1.安徽省农业科学院植物保护与农产品质量安全研究所,农业部农产品质量安全风险评估实验室(合肥),安徽科立特农药环境评价科技有限公司, 合肥 230031; 2. 广东省农业科学院植物保护研究所, 广州 510640)
氯虫苯甲酰胺在水稻及稻田环境中的残留动态
段劲生1*,王梅1,董旭1,孙明娜1,肖青青1,朱玉杰1,孙海滨2,刘艳萍2,高同春1*
(1.安徽省农业科学院植物保护与农产品质量安全研究所,农业部农产品质量安全风险评估实验室(合肥),安徽科立特农药环境评价科技有限公司, 合肥230031; 2. 广东省农业科学院植物保护研究所, 广州510640)
采用田间试验方法,研究了氯虫苯甲酰胺在稻田水、土壤和水稻植株中的消解动态,测定了氯虫苯甲酰胺在水稻和土壤中的最终残留量。稻田水和土壤样品采用丙酮提取,水稻样品用乙腈溶液浸泡提取,经玻璃层析柱净化,HPLC紫外分析测定。结果表明,稻田水、土壤、水稻植株、谷壳、糙米中氯虫苯甲酰胺添加浓度为0.005~1.0mg/kg时,平均回收率为85.06%~95.83%,变异系数在2.08%~5.77%之间。方法的最低检测浓度为:稻田水0.005mg/kg,土壤0.01mg/kg,水稻植株0.02mg/kg,谷壳0.02mg/kg,糙米0.01mg/kg。氯虫苯甲酰胺在稻田水、土壤和水稻植株中的消解动态均符合一级动力学方程,半衰期分别为3.1~5.0d、6.6~9.0d、8.0~9.9d。以33.86g/hm2和50.80g/hm2间隔14d施用氯虫苯甲酰胺2次和3次,末次施药21d后氯虫苯甲酰胺的最高残留量为:土壤0.217mg/kg,水稻植株0.879mg/kg,谷壳0.389mg/kg,糙米0.018mg/kg。氯虫苯甲酰胺在糙米中的残留量低于我国和食品法典委员会(CAC)及欧盟的最大残留限量(MRL)标准。
氯虫苯甲酰胺;残留;水稻;稻田环境
氯虫苯甲酰胺(chlorantraniliprole)是由美国杜邦公司开发的第一个具有新型邻酰胺基苯甲酰胺类化学结构的广谱杀虫剂。该药具有良好的速效和持效性,有独特的化学结构和新颖的作用机理,能高效激活昆虫鱼尼丁(肌肉)受体,过度释放细胞内钙库中钙离子,导致昆虫瘫痪死亡,具有高效、低毒、广谱和环境亲和等特点。氯虫苯甲酰胺主要应用于防治水稻、甘蓝、棉花等多种作物上的鳞翅目害虫,对其他害虫也能进行有效防治[1-3]。
目前国内外有关氯虫苯甲酰胺的主要测定方法为HPLC[4-5]和HPLC-MS[6-7],但有关氯虫苯甲酰胺在水稻和稻田环境中的残留动态研究较少。步海燕等建立了不同水体中氯虫苯甲酰胺的残留检测方法,水样采用二氯甲烷作提取剂进行萃取,高效液相色谱检测,结果显示良好[8]。王廷廷等研究发现,氯虫苯甲酰胺在不同类型土壤中的吸附属于物理吸附过程,且氯虫苯甲酰胺在土壤中的解吸附存在迟滞现象,可能与土壤理化性质有关[9]。章虎等采用液相色谱-串联质谱电喷雾正离子扫描分析了稻米中氯虫苯甲酰胺的残留[10]。王思威等研究了氯虫苯甲酰胺颗粒剂在水稻上的残留行为,并为其合理使用建立参考标准[11]。本文研究了氯虫苯甲酰胺悬浮剂在水稻和稻田环境中残留消解规律和最终残留量,旨在为评价氯虫苯甲酰胺在水稻上使用的生态环境效应及农产品安全性提供科学依据。
1 材料与方法
1.1供试药剂与仪器
Agilent1200型高效液相色谱仪(美国安捷伦科技公司),配紫外检测器;AgilentHC-C18 色谱柱(250mm×4.6mm,5μm);KQ-50B超声波清洗器(昆山市超声仪器有限公司);RE-52CS旋转浓缩蒸发器(上海亚容生化仪器厂);SX2-2.5-10型高温电炉(上海博迅实业有限公司);FA2104S电子天平(上海天平仪器厂);N-EVAP24氮吹仪(美国Organomation仪器公司);Y-4水浴恒温振荡器(江苏金坛金城国胜试验仪器厂);IKA/MS-3涡动混合器(广州仪科实验室技术有限公司)。
氯虫苯甲酰胺标准品(纯度97.9%);乙腈(色谱纯);丙酮、乙腈、乙酸乙酯、二氯甲烷、石油醚(60~90℃)、浓盐酸、氯化钠、无水硫酸钠(均为分析纯)。
1.2田间试验设计
试验农药为4.3%氯虫苯甲酰胺悬浮剂,由先正达(中国)投资有限公司提供;供试作物为水稻(安徽为‘皖稻125’、广西为‘中浙优1号’、湖南为‘金优284’);试验于2010年和2011年在安徽、湖南和广西进行,三地试验田土壤类型分别为砂壤土、黏土和壤土。每试验小区20m2,重复3次,小区按照浓度由低到高排列,小区之间设保护行,并设空白对照。施药方式为兑水手动均匀喷雾。
1.2.1消解动态试验
于水稻分蘖期施药。稻田水和土壤中农药消解动态试验施用4.3%氯虫苯甲酰胺悬浮剂135.45g/hm21次,植株中的消解动态试验施用4.3%氯虫苯甲酰胺悬浮剂50.80g/hm21次,分别于施药后2h、6h、1d、3d、5d、7d、14d、21d、30d在小区内随机选取10点以上,每小区合计取水稻植株(水稻区)1kg左右、取稻田水样(无水稻的空水田区)1L左右、取土壤(无水稻的空水田区,0~10cm深)2kg左右,同时取空白对照样品。
1.2.2最终残留试验
于水稻生长期分别采用2个剂量喷施4.3%氯虫苯甲酰胺悬浮剂(高剂量50.80g/hm2,低剂量33.86g/hm2)2 次和3次,每次间隔14d。另设空白对照区,每处理区设3个20m2重复小区,各处理区间设保护行。于最后一次施药后14.21d分别采收水稻植株1kg、土壤和稻谷样品各2kg,同时采集空白对照样品。
1.3试验方法
1.3.1提取
稻田水样品:取经定性滤纸过滤水样50mL于分液漏斗中,加入50mL丙酮振摇2min,再加入15gNaCl振摇2min,然后用50mL×2乙酸乙酯萃取,合并丙酮相和乙酸乙酯相,经无水硫酸钠干燥后,于旋转蒸发器(≤ 45℃)浓缩至近干,用氮气吹干后,乙腈定容,待测。
土壤样品:称取20.0g土壤(以干重计)样品,加60mL丙酮浸泡过夜,振荡提取30min,过滤,再用60mL丙酮振荡提取30min,然后用10mL×2丙酮洗涤残渣,于旋转蒸发器(≤ 45℃)中浓缩至近2mL,待柱层析净化。
植株样品:称取10.0g剪碎植株样品,加20mL蒸馏水和80mL乙腈浸泡过夜,振荡提取30min,过滤,用80mL乙腈振荡提取30min,残渣用10mL×2乙腈洗涤,于旋转蒸发器(≤ 45℃)浓缩至约40mL,加60mL5%NaCl,用20mL石油醚去杂,然后加50mL乙腈,振摇1min,加15g固体NaCl,振摇2min,静置分层,收集乙腈相,水相再用50mL×2乙酸乙酯萃取,合并乙腈相和乙酸乙酯相,经无水硫酸钠干燥后,于旋转蒸发器(≤ 45℃)浓缩至约2mL,待柱层析净化。
糙米和稻壳样品:称取20.0g粉碎的糙米样品,加10mL2mol/LHCl和20mL蒸馏水浸泡20min,再加80mL乙腈浸泡过夜,振荡提取1h,过滤,残渣用20mL×2乙腈洗,合并滤液于分液漏斗中,加5.0gNaCl,振摇3min,静置分层,弃去下层水相,乙腈相经无水硫酸钠干燥后,于旋转蒸发器中(≤ 45℃)浓缩至约2mL,待柱层析净化。
1.3.2净化
在层析柱中装填5.0g中性氧化铝(用前130℃处理4h,加5%水减活),柱两端加2cm无水硫酸钠,先用20mL石油醚/丙酮(1/1, V/V)预淋洗,再将样品液转移到柱上,用100mL石油醚/丙酮(1/1, V/V)淋洗,收集淋洗液,于旋转蒸发器(≤ 45℃)中浓缩至近干,氮气吹干,乙腈定容2mL,待测。
1.3.3仪器条件
高效液相色谱仪:AgilentHPLC1200,配有紫外检测器;色谱柱:AgilentHC-C18 (4.6mm×250mm,5μm);柱箱温度:35℃;流动相:乙腈/水(V/V=50/50);流速:0.8mL/min;检测波长:220nm;进样体积:10μL;在上述色谱操作条件下,氯虫苯甲酰胺的保留时间为12.7min。
2 结果与分析
2.1方法的回收率、精密度和最低检测浓度
分别用乙腈配制0.25、0.5、1.0、2.0、4.0、8.0mg/L的氯虫苯甲酰胺标准溶液,按上述色谱条件进行测定。根据峰面积与相应的进样量绘制标准曲线,得到回归方程为y=47.474x-0.008 3,r=0.999 7。表明氯虫苯甲酰胺在0.25~8.0mg/L浓度范围内浓度与峰面积呈较为良好的线性关系,满足外标法定量检测的要求。在0.005~1.0mg/kg的添加浓度下,稻田水、土壤、水稻植株、谷壳和糙米中氯虫苯甲酰胺的平均添加回收率为85.06%~95.83%,变异系数为2.08%~5.77%(表1)。仪器的最小检出量为5×10-11g,最低检测浓度分别为稻田水0.005mg/kg、土壤0.01mg/kg、水稻植株0.02mg/kg、谷壳0.02mg/kg、糙米0.01mg/kg。
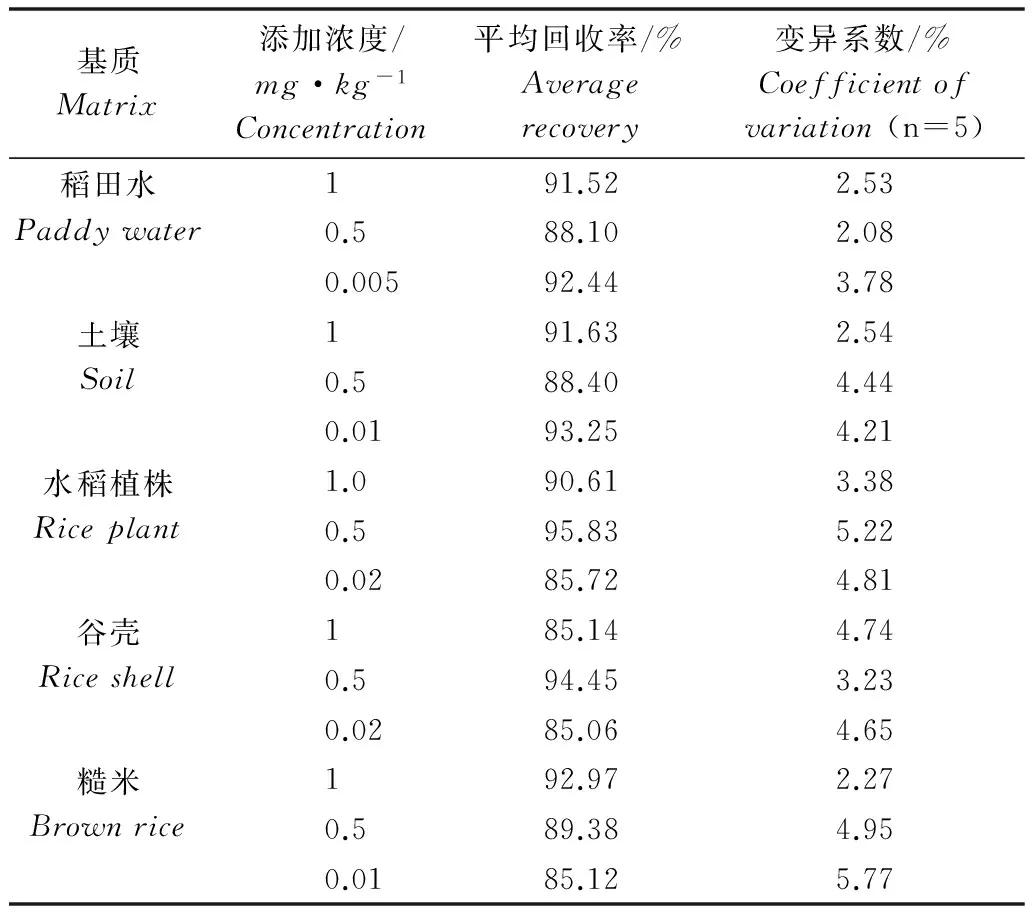
表1 氯虫苯甲酰胺在稻田水、土壤、水稻植株、 谷壳和糙米中添加回收率Table 1 Recoveries of chlorantraniliprole in paddy water,soil, rice plant, rice shell and brown rice
2.2氯虫苯甲酰胺在稻田系统和水稻植株中的消解动态
氯虫苯甲酰胺在安徽、湖南和广西三地的稻田水、土壤和水稻植株中的消解方程、相关系数和半衰期见表2。以氯虫苯甲酰胺残留量对施药后取样时间作图,从图1可以看出,氯虫苯甲酰胺的消解在稻田水和植株中随着时间的延长,其残留量逐渐下降;在土壤中的消解在施药后2h与不足3d期间为一个逐渐增加的过程,到第1~3天时达到最大值,之后则逐渐降低。氯虫苯甲酰胺在稻田水中的原始沉积量为0.201~0.400mg/kg,施药7d后,残留消解率均达75%以上;施药14d后,消解率达90%以上,半衰期为3.1~5.0d。氯虫苯甲酰胺在稻田土壤中的原始沉积量为0.101~0.249mg/kg。施药后21d,残留消解率为80%左右;施药后30d,消解率为90%左右,半衰期为6.6~9.0d。氯虫苯甲酰胺在水稻植株中的原始沉积量为0.976~2.836mg/kg。施药后21d,残留消解率达80%以上;施药后30d,消解率为90%左右,半衰期为8.0~9.9d。
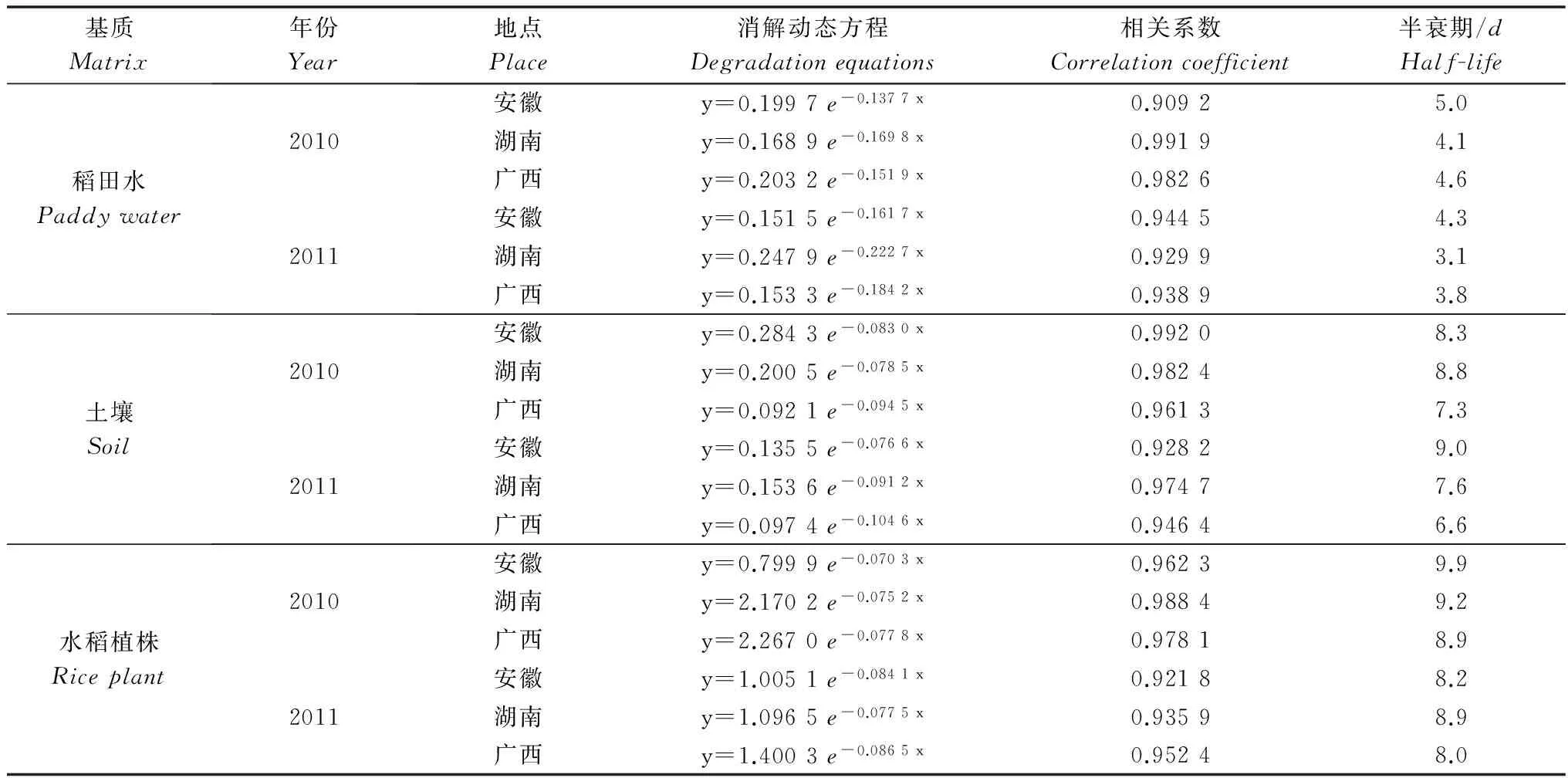
表2 氯虫苯甲酰胺在稻田水、土壤和水稻植株中的消解动态方程Table 2 Degradation equations of chlorantraniliprole in paddy water, soil and rice plant

图1 氯虫苯甲酰胺在稻田水、稻田土壤和 水稻植株中的消解动态Fig.1 Residual dynamics of chlorantraniliprole in paddy water, soil and rice plant
t检验结果(表3~5)表明,氯虫苯甲酰胺在稻田水中不同地区的残留消解行为差异性显著,广西地区可能由于降水等原因造成两年的消解行为差异性极显著;氯虫苯甲酰胺在土壤中的残留消解行为较为复杂。在土壤性质相同的条件下,环境气候条件影响了氯虫苯甲酰胺在土壤中的消解行为。相同施药季节不同年份的试验结果表明,氯虫苯甲酰胺在同一地区土壤中的消解行为亦存在显著差异的可能性。由此可见,外部气候条件、土壤性质、土壤中的农药原始沉积量等因素均对消解行为差异性存在影响;除2010年和2011年的安徽地区、2010年的湖南和广西地区两组外,氯虫苯甲酰胺在植株中的残留消解行为均呈现显著或极显著差异性。药剂的不同原始沉积量,不同生长状态下水稻植株对农药的吸附程度,稻田开放环境中残留农药的热分解等,均是影响其消解行为的主要原因。
2.3氯虫苯甲酰胺在稻田土壤稻秆和稻谷中的最终残留量
从表6可以看出,氯虫苯甲酰胺的残留量与施药浓度呈正相关,施药浓度越高,残留量越高;最终残留量与施药次数也呈正相关,施药次数越多,残留量越高。4.3%氯虫苯甲酰胺悬浮剂以有效成分50.80g/hm2和33.86g/hm2分别施药2次和3次,氯虫苯甲酰胺在土壤中的最终残留量在ND~0.255mg/kg之间,其中低剂量处理残留量最高0.157mg/kg,高剂量处理残留量最高0.255mg/kg。氯虫苯甲酰胺在水稻植株中的最终残留量在ND~1.281mg/kg,其中低剂量处理残留量最高0.997mg/kg,高剂量处理残留量最高1.281mg/kg。氯虫苯甲酰胺在谷壳中的最终残留量在ND~0.452mg/kg,其中低剂量处理残留量最高0.412mg/kg,高剂量处理残留量最高0.452mg/kg。氯虫苯甲酰胺在糙米中的最终残留量在ND~0.088mg/kg,其中低剂量处理残留量最高0.037mg/kg,高剂量处理残留量最高0.088mg/kg。
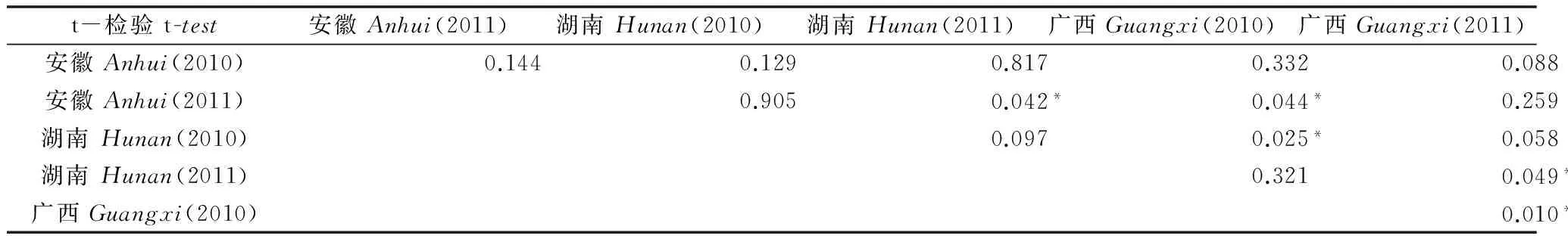
表3 氯虫苯甲酰胺在稻田水中消解动态差异性t检验1)Table 3 t-test for dissipation of chlorantraniliprole in paddy water
1)*代表在0.05水平差异显著;**代表在0.01水平差异极显著。下同。
*:Significantdifferenceat0.05level;**:Extremelysignificantdifferenceat0.01level.Thesamebelow.

表4 氯虫苯甲酰胺在土壤中消解动态差异性t检验Table 4 t-test for dissipation of chlorantraniliprole in soil

表5 氯虫苯甲酰胺在植株中消解动态差异性t检验Table 5 t-test for dissipation of chlorantraniliprole in rice plant
我国规定氯虫苯甲酰胺在糙米中的最大残留限量为0.5mg/kg,食品法典委员会(CAC)和欧盟规定在粮谷中的最大残留限量为0.02mg/kg,日本规定在糙米中为0.05mg/kg。以国际上的最低残留标准作参考,由最终残留结果显示,4.3%氯虫苯甲酰胺悬浮剂以有效成分33.86g/hm2和 50.80g/hm2施药2次、3次,采收间隔期为14d,糙米中氯虫苯甲酰胺的残留量最高为0.088mg/kg,高于0.02mg/kg;采收间隔期为21d,糙米中氯虫苯甲酰胺的残留量最高为0.018mg/kg,低于0.02mg/kg。因此,建议4.3%氯虫苯甲酰胺悬浮剂在水稻上使用,施药剂量不超过50.80g/hm2,施药2~3次,安全间隔期为21d。
3 讨论
本文对氯虫苯甲酰胺的残留分析方法,在水稻、土壤和稻田水中的残留动态以及在水稻、土壤中的最终残留进行了研究,作为评价氯虫苯甲酰胺使用安全性的基础。4.3%氯虫苯甲酰胺悬浮剂在安徽、湖南和广西三地的残留试验表明,氯虫苯甲酰胺在植株和稻田水中的残留量,随着时间的推移逐步降低,半衰期分别为8.0~9.9d和3.1~5.0d。在土壤中的残留浓度呈先上升后下降的趋势,施用后1~3d在稻田土中的含量达到最大,其半衰期为6.6~9.0d,属于易降解类农药。
最终残留量结果显示,4.3%氯虫苯甲酰胺悬浮剂以低剂量33.86g/hm2和高剂量50.80g/hm2施药2次和3次,采收间隔期为21d,糙米中氯虫苯甲酰胺的残留量均低于0.02mg/kg。参考各国限量标准,建议4.3%氯虫苯甲酰胺悬浮剂在水稻上使用,施药剂量不超过50.80g/hm2,施药2~3次,安全间隔期为21d。
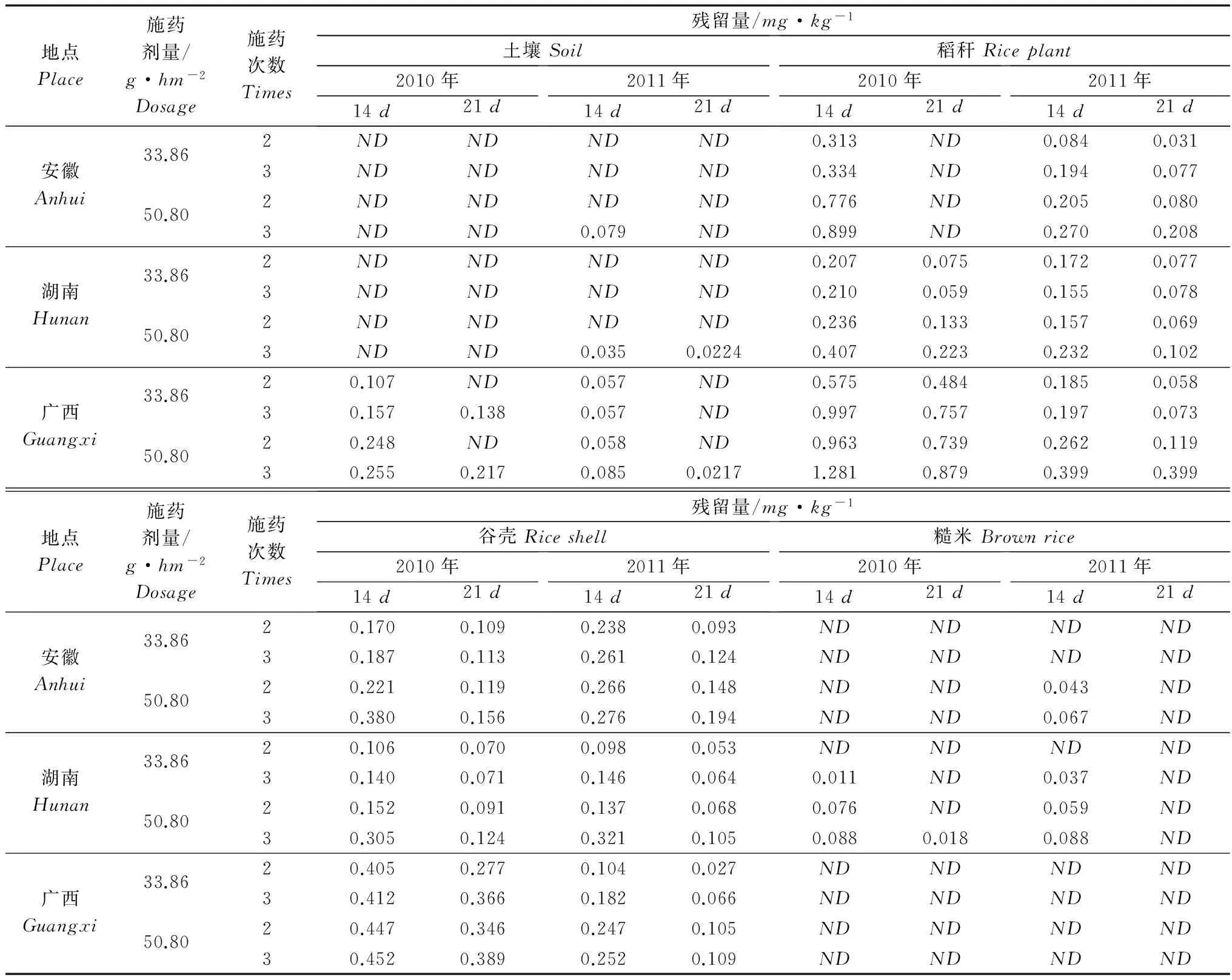
表6 氯虫苯甲酰胺在土壤、水稻植株、谷壳和糙米中的最终残留量Table 6 Final residues of chlorantraniliprole in soil,rice plant,rice shell and brown rice
[1]柴宝山,林丹,刘远雄,等. 新型邻甲酰氨基苯甲酰胺类杀虫剂的研究进展[J]. 农药,2007,46(3):148-153.
[2]徐尚成,余幼芬,王晓军,等. 新杀虫剂氯虫苯甲酰胺及其研究开发进展[J]. 现代农药,2008,7(5):8-11.
[3]USEnviromentalProtectionAgency.Chlorantraniliprole:Time-limitedpesticidetolerances[J].FederalRegister,2007,72(94):27452-27456.
[4]李瑞娟,于建垒,宋国春,等. 氯虫苯甲酰胺在甘蓝和土壤中的残留及消解动态[J]. 生态环境学报,2011,20(4):663-667.
[5]秦冬梅,秦旭,徐应明,等.土壤和番茄中氯虫苯甲酰胺的残留检测与消解动态研究[J].农业环境科学学报,2010,29(5):858-863.
[6]MandalK,KaurR,SahooSK,etal.Degradationpatternandriskassessmentofchlorantraniliproleonberseem(Trifolium alexandrinumL.)usinghighperformanceliquidchromatography[J].Chemosphere,2014, 112:100-104.
[7]SinghB,KarA,MandalK,etal.DevelopmentandvalidationofQuEChERSmethodforestimationofchlorantraniliproleresidueinvegetables[J].JournalofFoodScience,2012, 77(12):208-215.
[8]步海燕,欧晓明,马俊凯,等. 高效液相色谱法测定水体中的氯虫苯甲酰胺残留量[J]. 光谱实验室, 2008,25(6):1230-1234.
[9]王廷廷,余向阳,刘贤进,等. 氯虫苯甲酰胺在5种土壤中的吸附和解吸特性[J]. 江苏农业学报,2012,28(1):204-209.
[10]章虎,钱鸣蓉,李振,等. 高效液相色谱-串联质谱快速测定稻米中氯虫苯甲酰胺残留[J]. 农药,2010,49(12):906-908.
[11]王思威,孙海滨,刘艳萍. 氯虫苯甲酰胺颗粒剂在水稻环境中的残留行为与合理使用评价[J]. 农药,2013,52(12):899-902.
(责任编辑:杨明丽)
ResidueanddegradationofchlorantraniliproleinriceandtheenvironmentDuanJinsheng1,WangMei1,DongXu1,SunMingna1,XiaoQingqing1,
ZhuYujie1,SunHaibin2,LiuYanping2,GaoTongchun1
(1.InstituteofPlantProtectionandAgro-ProductsSafety,AnhuiAcademyofAgriculturalSciences,KeyLaboratoryofAgro-ProductSafetyRiskEvaluation(Hefei),MinistryofAgriculture,AnhuiCreatePesticideandEnvironmentEvaluationTechnologyCo.,Ltd.,Hefei230031,China; 2.InstituteofPlantProtection,GuangdongAcademyofAgriculturalSciences,Guangzhou510640,China)
Theresiduedynamicsofchlorantraniliproleinpaddywater,soilandriceplantwasstudied,anditsfinalresidueinpaddyandsoilwasdeterminedbyusingfieldtest.Theresiduesofpaddywaterandsoilsampleswereextractedwithacetone,andricesampleswerecleanedupbyglasschromatographiccolumnaftertheextractionwithacetonitrile,anddeterminedbyHPLC-UV.Theresultsshowedthat,whilethespikedconcentrationofchlorantraniliproleinpaddywater,soil,riceplant,riceshellandbrownricerangedfrom0.005mg/kgto1.0mg/kg,theaveragerecoverywas85.06%-95.83%withthevariationcoefficientof2.08%-5.77%.Theminimumdetectablemassfractioninpaddywater,soil,riceplant,riceshellandbrownricesampleswere0.005, 0.01, 0.02, 0.02, 0.01mg/kg,respectively.Degradationofchlorantraniliproleinpaddywater,soilandriceplantconformedtochemicalkineticequation.Thehalf-lifewas3.1-5.0daysinpaddywater, 6.6-9.0daysinsoiland8.0-9.9daysinplant.Chlorantraniliprolewassprayedtwiceorthreetimesata14daysintervalwiththeapplicationdoseof33.86g/hm2and50.80g/hm2,thefinalmaximumresidueofchlorantraniliproleafter21dayswere0.217mg/kginsoil, 0.879mg/kginriceplant, 0.389mg/kginriceshelland0.018mg/kginbrownrice,respectively.TheresidueinbrownricecouldbelowerthantheMRL(maximumresiduelimit)inChina,CACandEU.
chlorantraniliprole;residue;rice;ricefield
2014-12-02
2015-02-28
安徽省农科院科技创新团队项目(14C1105);国家科技基础性工作专项重点项目(2013FY113400);公益性行业(农业)科研专项(201403030)
E-mail:djszbs@sina.com;gtczbs@sina.com
S481.8
ADOI:10.3969/j.issn.0529-1542.2016.01.016
