西瓜重要种传病害研究进展
2016-09-14徐秀兰宋顺华张志勇吴学宏耿丽华
徐秀兰, 宋顺华, 张志勇, 吴学宏, 耿丽华*
(1. 北京市农林科学院蔬菜研究中心, 农业部华北地区园艺作物生物学与种质创制重点试验室,农业部都市农业(北方)重点试验室, 北京 100097; 2. 北京农学院植物科学技术学院,北京 102206; 3. 中国农业大学植物病理学系, 北京 100193)

西瓜重要种传病害研究进展
徐秀兰1,宋顺华1,张志勇2,吴学宏3,耿丽华1*
(1. 北京市农林科学院蔬菜研究中心, 农业部华北地区园艺作物生物学与种质创制重点试验室,农业部都市农业(北方)重点试验室, 北京100097; 2. 北京农学院植物科学技术学院,北京102206; 3. 中国农业大学植物病理学系, 北京100193)
本文围绕目前我国西瓜生产中西瓜蔓枯病、细菌性果斑病、黄瓜绿斑驳病毒病等重要的种传病害,阐述了其发生与危害;讨论了国内外在病原物种子传带机制方面的研究进展;分析比较种子健康传统检测技术与现代分子检测技术的优点与局限性;总结现有的种子处理方法,最后提出了尚未明确和亟须研究的问题,为西瓜种传病害的防控提供参考。
种传病害;种子健康检测;种子处理;西瓜
西瓜是深受人们喜爱的夏季消暑水果。我国是世界上最大的西瓜生产和消费国,2011年的西瓜产量已占到全球总量的66.9%,远超排在第二位的土耳其(占3.7%)。随着我国西瓜生产种植面积不断增加,西瓜种子产业也逐渐发展壮大。目前西瓜生产上有一定影响和实力的育种经营单位有20~30家,全国年生产西瓜种子约1 500 t[1]。西瓜种子生产的专业化和区域化初步形成,制种产区主要集中在我国西北地区。由于西瓜种子可携带多种病原微生物,近年来随着西瓜种子调运和贸易引起的病害传播和经济纠纷等问题越来越引起人们的关注。现今的西瓜种植中普遍采用工厂化嫁接育苗,由于种植密度高、温湿度大、嫁接造成伤口等因素都利于种传病害的传播流行,如何在西瓜制种和生产过程中防止西瓜种传病害的传播和危害,对于西瓜产业的良性发展显得尤为重要。本文围绕当前西瓜种传重要病原真菌、细菌和病毒类微生物总结讨论了病害的种传机制、检测技术以及种子处理技术的研究进展,提出了仍需加强研究的问题以及种传病害防治的建议。
1 西瓜生产中重要的种传病害及其危害
1.1西瓜种子携带真菌
已报道西瓜种子携带的真菌有10个属(表1),其中重要的致病菌有镰刀菌属(Fusarium)真菌和瓜类黑腐球壳菌(Didymellabryoniae)。虽然Fusarium和Didymella是典型的土传真菌,但种子传带仍是病菌远距离传播的主要途径。尖孢镰刀菌西瓜专化型(F.oxysporumf.sp.niveum)引起西瓜枯萎病[2],腐皮镰刀菌葫芦专化型(F.solanif.sp.cucurbitae)可导致西瓜幼苗根腐烂,带菌量高的种子可引起50%以上的发病率[3]。此外,研究表明镰刀菌还大幅度降低种子发芽活力[4]。瓜类黑腐球壳菌能侵染西瓜植株各个部位,它引起的蔓枯病在西瓜整个生育期均可发病,病株率一般为15%~25%,严重时达60%~80%,病害流行可使瓜田出现大量死藤,减产80%以上,严重影响西瓜的产量和品质[5-6]。
1.2西瓜种子携带细菌
由西瓜嗜酸菌(Acidovoraxcitrulli)引起的西瓜细菌性果斑病(又称果腐病)是目前最为重要的检疫性种传细菌病害。果斑病不仅危害果实,也在西瓜幼苗期引起腐烂枯死的症状。在适宜的环境条件下,果斑病造成西瓜田块毁灭性的损失。自20世纪60年代在美国佐治亚州发现,由于种子传带西瓜嗜酸菌和日益频繁的国际种子贸易,90年代细菌性果斑病在美国的西瓜种植田大暴发并迅速在全球多个国家传播[7]。果斑病的严重危害迫使种子公司转移繁种基地、采取种子处理措施,然而果斑病的发生和流行还是没有得到控制。由于西瓜的工厂化育苗嫁接的高温高湿环境很适宜西瓜嗜酸病菌的快速传播,一粒带菌量为10 cfu的种子足以引起苗期果斑病的发生[8]。另2种瓜类种传细菌性病害分别是假单胞菌属Pseudomonassyringaepv.lachrymans引起的角斑病,和黄单胞属Xanthomonascampestrispv.cucurbitae引起的叶斑病[9-10]。相对果斑病而言,这2种病害在西瓜上造成的危害较小,我国尚无这2种病害由种子传播造成大面积暴发的报道。
1.3西瓜种子携带病毒
西瓜种子可以传带多种病毒,包括南瓜花叶病毒(Squashmosaicvirus)、烟草环斑病毒(Tobaccoringspotvirus)、黄瓜绿斑驳花叶病毒(Cucumbergreenmottlemosaicvirus)、小西葫芦绿斑驳病毒(Zucchinigreenmottlemosaicvirus)等;其中黄瓜绿斑驳花叶病毒CGMMV是目前我国西瓜上最为重要的检疫性种传病毒,感病的西瓜果实空洞呈丝瓜瓤状,味苦不能食用,严重减产。2002年我国从入境的植物种子中检测到该病毒,2005年辽宁的大棚西瓜大面积暴发CGMMV,危害面积333 hm2,其中13 hm2绝收[11]。近年来,CGMMV的发生呈上升蔓延趋势,2011年浙江温岭地区危害面积100 hm2[12],至今全国至少已有12个省市有该病害发生。吴元华等[13]对黄瓜绿斑驳花叶病毒在中国定殖和扩散的风险性进行了分析,认为CGMMV在中国的风险值(R)已达2.39,属高度危险性有害生物,需要加强对该病的检疫管理。
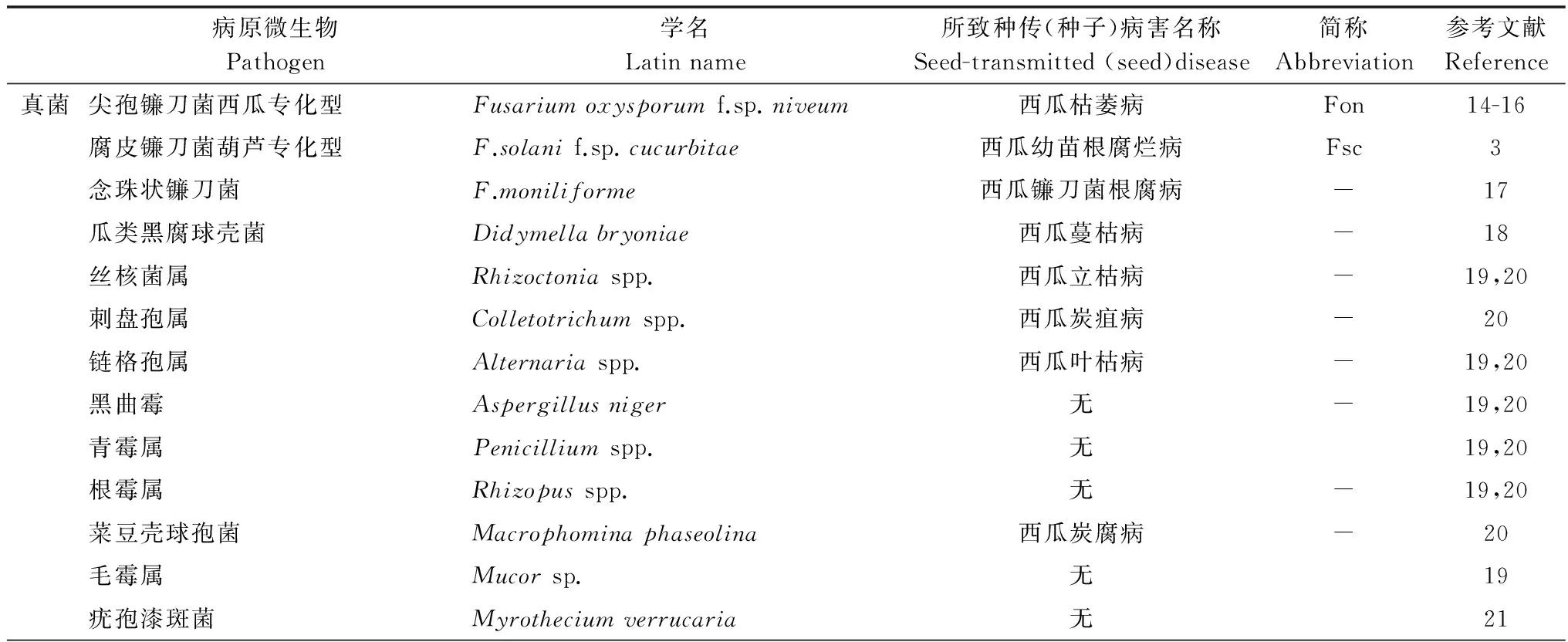
表1 西瓜种子携带微生物种类Table 1 Watermelon seed-associated microorganisms
续表1Table 1(Continued)

病原微生物Pathogen学名Latinname所致种传(种子)病害名称Seed-transmitted(seed)disease简称Abbreviation参考文献Reference细菌西瓜嗜酸菌Acidovoraxcitrulli西瓜细菌性果斑病Ac22丁香假单胞菌黄瓜致病变种Pseudomonassyringaepv.lachrymans西瓜细菌性角斑病Psl9甘蓝黑腐黄单胞瓜叶斑致病亚种Xanthomonascampestrispv.cucurbitae西瓜细菌性叶斑病-23病毒南瓜花叶病毒SquashmosaicvirusSqMV24烟草环斑病毒Tobaccoringspotvirus西瓜病毒病TRSV25黄瓜绿斑驳花叶病毒CucumbergreenmottlemosaicvirusCGMMV26小西葫芦绿斑驳病毒ZucchinigreenmottlemosaicvirusZGMMV27
2 病害的种传机制
种子传带病害机制的研究主要关注以下4个方面:1)种子如何受到病原微生物感染;2)种子受到感染的组织部位;3)病菌的传带率;4)病菌在种子内存活和保持侵染的能力。
通常病原真菌主要是在种子采收过程中附着在种子表面,但是有些病菌也能够通过种脐侵入造成种子内部带菌。西瓜种子携带的镰刀菌主要寄藏在种子外部,种子内部带菌率要低于外部[8,28]。引起西瓜蔓枯病的瓜类黑腐球壳菌以分生孢子和菌丝形态寄藏在西瓜种子的表皮、子叶和胚[18],在室温条件下种子表面的分生孢子可存活18个月,而寄藏在种子内部的菌丝体可存活24个月以上,仍保持侵染能力[29]。
西瓜细菌性果斑病的种子传带机制是目前国内外研究的热点。对于西瓜嗜酸菌如何感染西瓜种子有2种理论:1)病菌通过侵染果皮,在采种过程中附着感染种子。Rane和Latin[30]发现从田间自然发病表现症状的果实中采收的种子,种皮和内部胚可携带病菌,而无症状表现的果实中的种子则没有携带西瓜嗜酸菌。2)病菌通过感染花,导致发育中的种子感染,虽然果实不表现症状,但果瓤和种子均带菌[31];而且相比果皮接种的方法,雌蕊接种的西瓜嗜酸菌感染种胚的概率更高(高达90%),而子房接种后发病果实种子病菌寄藏在外胚乳的概率为80%[32]。Walcott研究组对西瓜种子传带西瓜嗜酸菌的分子机制研究发现,用西瓜嗜酸菌群体感应突变体(aacI-/aacR-)菌株接种的种子与野生型相比,其幼苗感染率降低了50%,由此推断群体感应(quorum sensing)直接调控了与病菌种子传播相关基因的表达[33]。Block和Shepherd[34]从5℃冷库保存了35年的西瓜种子上仍检测到西瓜嗜酸菌,且病菌依然保持致病能力,这是细菌在种子上存活时间最长的报道。笔者推测细菌能保持如此高度的存活能力与其侵染种子的部位和寄藏方式有关,西瓜嗜酸菌能够侵染种胚,可能在种子成熟过程中与种胚组织结合从而抗逆存活,然而病原细菌在种子的存活机制还有待进一步研究揭示。
黄瓜绿斑驳病毒CGMMV是正链RNA病毒,属于烟草花叶病毒属(Tobamovirus)。CGMMV侵染多种葫芦科作物,Shim等[26]检测到西瓜受到CGMMV感染后种子平均带毒率为24%,然而李立梅等[35]和吴会杰等[36]分别通过人工接种试验证明植株感病后西瓜种子的带毒率可高达64%~100%。采用不同的病毒株系、接种方法、培养环境等都可能造成种子带毒率差异较大。相比较高的带毒率,CGMMV的传毒率较低,为2.25%[36],这可能是由于病毒主要寄藏在种胚外,不能有效地进行种子到幼苗的侵染[37]。病毒通常是通过侵染母体植株而使种子带毒。这也是进行种子传带CGMMV研究的接种方式。此外病毒也可通过花粉传播,最新的研究证实CGMMV能够通过花粉感染黄瓜的果实和种子,感染果实的几率为17%~51%,收获种子的传毒率为12%~76%[38],但是保存7个月后的黄瓜种子传毒率下降很快[39]。至于西瓜花粉是否能传带病毒从而感染种子,以及病毒在西瓜种子的存活时间都有待进一步的研究。
综上所述,不同的病原真菌、细菌、病毒在西瓜种子寄藏部位、种子传带率和存活时间等方面有很大的差异。病菌的寄藏部位直接影响了病菌从种子到幼苗的传带能力和在种子表面或内部的存活时间,特别是病菌在种子内部的寄藏对检测和灭菌处理都造成一定难度。
3 西瓜种传病害的检测技术
种子健康检验是提高种子生产潜力的重要措施。在种子健康检验中,难以实现对所有的种子进行检测,只能检测种子样品,因此要求检验技术可行、准确和快速。在过去的几十年,种子健康检验技术发展迅速,取得了多方面进展。
3.1育秧检测(growing-out test)
对于西瓜种传病害最传统也是最直接的检测方法是出苗检测,即种子播种在灭菌的基质中,保持在适宜发病的环境条件下对幼苗进行发病评估、病原菌分离和鉴定。例如美国农业部推荐对细菌性果斑病进行出苗检测[40],播种至少10 000粒种子或检测该批样品10%的种子,出苗后每天观察西瓜幼苗子叶是否有水浸状斑点,而后对可疑症状的病株进行分离鉴定。出苗检测不仅能判定靶标病原菌是否存在,同时也能鉴定出病菌的致病力和种传能力,是目前被广泛接受的方法,但是该方法需要耗费很大的温室空间和人力,并且得到检测结果需要至少3周。
3.2培养检测(culture test)
培养检测也是一种能检测病原菌死活的方法,与出苗检测相比,培养检测大大节省了检测所需的空间和时间。此方法又分为吸水纸检测和培养基平板分离培养检测。吸水纸检测法可以分析活体内外的带菌情况。如按照国际种子健康系统(ISHS)的检测方法和规程,检测西瓜蔓枯病1 000粒,需将种子摆放在保湿的滤纸片上,25℃黑暗培养10 d,观察是否产生分生孢子器或假囊壳,并进行形态鉴定[41]。培养基平板分离培养检测是将种子浸提液涂在培养基平板上鉴定是否有目标菌生长,为了抑制其他腐生细菌的生长或是使目标菌形成独特的菌落形态,加入特定化合物的半选择性培养基能够提高检测灵敏度,如EBB、EBBA培养基是针对西瓜细菌性果斑病种子带菌检测的半选择培养基[42-43]。对于种子携带镰刀菌的检测是将种子洗涤液涂在PDA平板,同时解剖种子摆放在平板上直接培养,这种方法适用于种子外部和内部寄藏的多种真菌检测[8]。
3.3酶联免疫吸附检测(ELISA test)
分离培养检测只适用于可培养的真菌和细菌检测,不能用于不可体外培养微生物,例如病毒。病毒最常用的检测方法是酶联免疫吸附检测(enzyme linked immunosorbent assay,简称ELISA),利用抗原与抗体的特异性结合,以及酶标记反应显色不仅可以检测是否存在目标,还可以进行量化分析。改良的ELISA方法可检测到黄瓜种子800粒中1粒带毒种子[44]。国际种子检测协会(ISTA,2010)发布的最新检测规程中,对瓜类种子携带CGMMV的检测细则是:以不多于100粒的种子为小样研磨,对种子提取液采用ELISA检测,一共检测至少2 000粒种子。对于西瓜细菌性果斑病也有不同的单克隆及多克隆抗体双抗夹心(DAS-ELISA)检测方法,检测灵敏度一般可达到104cfu/mL[45-46]。
3.4分子生物学检测(molecular test)
以聚合酶链式反应(polymerase chain reaction,简称PCR)为基础的分子生物学检测技术为种传病害检测提供了一个更迅速、有效、灵敏的方法,被广泛运用于各类病害的检测。Zhang等[47]设计了用于检测枯萎病菌(Fusariumoxysporumf.sp.niveum)的引物Fn-l/Fn-2和检测蔓枯病菌的引物Mn-l/Mn-2,利用传统PCR和实时荧光定量real-time PCR,用这两种引物同时检测植物发病组织和土壤。李丽[48]采用以上引物从西瓜种子DNA中成功检测到种子传带的枯萎病菌。对于RNA病毒CGMMV的检测需要通过反转录PCR(reverse-transcript PCR),程兆榜等[49]根据病毒的外壳蛋白基因序列设计引物对江苏地区CGMMV株系进行了同源性比较。检测西瓜嗜酸菌的传统PCR引物已报道至少有5对,其中最初根据16S rDNA设计的引物WFB1/WFB2检测灵敏度最高,但是该对引物的专一性不强,同时扩增A.avenae及其他几个亚种[50-51]。以PCR为基础的检测西瓜嗜酸菌的方法还有实时荧光定量PCR[52-53],环介导等温扩增(loop-mediated isothermal amplification,LAMP)[54],和Padlock-Probe Assay[55]。
虽然以PCR为基础的检测方法有诸多的优点,但是也存在以下技术问题:由于种子本身带有的化学物质对PCR反应有抑制效应,有时可引起假阴性结果;此外PCR检测目标实为目标菌的核酸片段,不能排除检测到已失活目标菌,而引起假阳性结果[42]。研究者将不同的检测方法结合使用来减少和避免假阳性或假阴性的出现。如目前使用较多的是将培养检测和PCR技术结合的BIO-PCR,即先将种子浸提液在液体或固体培养基培养使检测目标增殖,同时稀释了抑制因子,从而提高检测的准确性。结合检测西瓜嗜酸菌的选择性培养基EBBA和real-time PCR甚至可以检测到1 mL种子提取液中的单个目标菌[43]。将免疫学和核酸检测相结合的免疫捕捉PCR(immno-capture PCR)也较多地应用在种子检测上,其原理是先通过抗原抗体特异结合的免疫学原理对检测目标进行富集,然后进行PCR检测,从而提升检测灵敏度[50]。国内外研究者已建立了针对西瓜嗜酸菌和CGMMV的免疫吸附PCR方法,可分别检测到102cfu/mL的西瓜嗜酸菌[56]和8 ng/mL的CGMMV[57]。利用染料EMA处理细菌,由于EMA能渗透到细胞膜不完整的死细胞内并与DNA共价结合,因而可避免检测到死菌的DNA片段,确保随后的PCR检测到的为活菌细胞[58]。
随着检测技术的不断发展,建立同时检测几种病原菌的方法成为新的研究方向。采用磁力捕捉杂交和不同荧光信号标记探针的real-time PCR,Ha等[52]建立了一种可同时检测西瓜种子携带的真菌瓜类黑腐球壳菌和细菌西瓜嗜酸菌的方法;在此基础上,Ling等[59]加入RT-PCR技术可同时检测西瓜种子携带的南瓜花叶病毒(Squashmosaicvirus, SqMV)。Charlermroj等[60]也创建了可同时检测西瓜嗜酸菌、辣椒脉斑驳病毒(Chillivein-bandingmottlevirus,CVbMV)、西瓜银色斑驳病毒(Watermelonsilvermottlevirus,WSMoV)和瓜黄色斑病毒(Melonyellowspotvirus,MYSV)的检测技术;张靓等[61]通过多重PCR和可视基因芯片技术可以同时筛查瓜类种子携带的6种细菌病害。总之,先进的检测技术可以提高结果的准确性和检测效率,同时也需要配备相应的仪器设备和高素质的检测人员,才能充分发挥其在种传病害检测中的优势。
4 西瓜种子处理技术
目前西瓜设施栽培面积和嫁接育苗规模不断扩大。种植者采用穴盘或小钵播种,在幼苗子叶展开后进行嫁接的工厂化育苗,由于苗床密度大,嫁接苗造成的伤口及伤口愈合所需的避光高湿环境均有助于种传病害的传播流行。因此在制种和采收后如何进行有效的种子处理是防治种传病害发生传播的关键环节。西瓜种子的采收一般要经过发酵、清洗和干燥的过程,发酵的过程使pH下降,能够杀死一部分种子表面的病原微生物[62-63]。但无籽瓜不能进行发酵处理,以免降低种子的发芽率。在清洗种子后,可用physan200、Tsunami100、盐酸等浸种处理,采用这些化学药剂浸种主要是针对细菌性果斑病菌[64],也可以同时去除蔓枯病和枯萎病的病原真菌[65]。此外,种子的干燥条件也是影响种子携带病菌的重要因素。宋顺华等[62]对比不同西瓜种子干燥处理的研究发现:随着干燥时间的延长,接种等量果斑病菌的种子,其幼苗发病率呈上升趋势;快速干燥处理可以避免病原菌在种子表面大量繁殖的可能性,从而降低种子的带菌量。
西瓜种子的采后处理可划分为化学处理、物理处理和生物处理。传统化学杀菌剂如福美双、代森锰锌、多菌灵的种子包衣或拌种处理可以消除种子携带的病原真菌,如镰刀菌和瓜类黑腐球壳菌[8,66]。次氯酸钠或磷酸三钠溶液浸种是用于防治西瓜种子携带的黄瓜绿斑驳花叶病毒的化学处理方法[67]。化学药剂处理面临的挑战是病菌抗药性的发展及农药所产生的环境污染及农药残留给人畜安全带来的隐患。研究发现,商业西瓜种子携带的瓜类黑腐球壳菌对甲基硫菌灵类杀菌剂具有抗药性[68]。物理处理主要是热处理,包括温汤浸种和干热处理。用55℃的温汤浸种2 h能够有效杀死种子携带的西瓜嗜酸菌[63],75℃干热处理3 d能够钝化种子传带的黄瓜绿斑驳病毒[69]。但是热处理需要精确的温度和时间掌控,否则引起种子活力的下降、出苗延迟、或导致植物受到不同程度的伤害,而且热处理后种子贮存期变短也制约了其在商业种子上的应用[63,70]。生物处理是用一些抑制病菌生长或刺激植物产生抗病性的微生物处理种子以减少种传病害发生,例如利用荧光假单胞菌(Pseudomonasfluorescens)和哈茨木霉(Trichodermaharzianum)处理甜瓜种子可以降低蔓枯病发病率,提高产量[66],与对照比较,用非致病性的西瓜嗜酸菌处理自然感染西瓜嗜酸菌的种子能降低细菌性果斑病的种传率[33]。生物处理对环境友好,对植物生长有益,但是生防微生物需要在种子发芽和幼苗生长过程中成功定殖,容易受到环境温湿度和土壤微生物群落结构的影响,因此目前在商业化种子的处理中应用并不广泛。
5 西瓜种传病害研究展望
西瓜产业在我国农业结构调整、增加农民收入和提高人民生活水平等方面占据重要位置,保障西瓜种子健康对西瓜产业的良性发展起着至关重要的作用。在西瓜生产中发生的种传病害数量繁多,危害严重。目前一些可以通过种子传带的重要病害,如列为检疫对象的细菌性果斑病,在我国的主要西瓜繁种地区已有发生[71],防止种传病害的继续扩散和危害迫在眉睫。面临这样严峻的局面,我国尚缺乏对细菌性果斑病等重要种传病害的统一检测手段,缺乏种子健康生产规程,西瓜种子处理方法不一,技术水平参差不齐,缺乏种子处理技术。因此,为了保障我国西瓜产业的发展,亟须加快西瓜种子健康生产、种子健康检测和种子处理技术的研究和相关法规的制定。
现有的研究在西瓜种传病原菌的种传机制、检测技术和种子保健处理等方面进行了大量的工作,但还缺乏十分有效的病害管理规程,仅仅提供了大量的试验方法和结果。今后针对西瓜重要种传病害研究的发展方向可能集中在以下几个方面:(1)深入了解种子如何受到病菌的感染、病菌的种子传带和存活机制,将有助于完善种子检测规程和提高种子处理技术;(2)目前的检测方法在应用中各有优势和劣势,发展快速、精确、能确认病菌活力的高通量检测方法、病原菌的多重复合检测技术或许是未来种传病害的检测方向;(3)在种子处理方面,亟须开发能够有效去除西瓜种子内部寄藏病菌,同时提高种子活力,且易于操作和推广的方法;(4)建立完善的种子采后保健处理规程。
[1]戴思慧,熊兴耀, 孙小武, 等. 我国西瓜种子生产加工处理现状及发展趋势[J]. 中国瓜菜, 2012, 25(2): 39-42.
[2]纪莉景, 王连生, 粟秋生, 等. 西瓜枯萎病菌分离及致病力测定[J]. 河北农业科学, 2010, 14(8): 137-138.
[3]Boughalleb N, El-Mahjoub M. Frequency ofFusariumoxysporumf.sp.niveumandF.solanif.sp.cucurbitaefrom watermelon seeds and their effect on disease incidence [J]. Research Journal of Parasitology, 2010, 5(4): 267-273.
[4]吴学宏, 刘西莉, 刘鹏飞, 等. 西瓜种子带菌检测及杀菌剂消毒处理效果[J]. 农药学学报, 2003, 5(3): 39-44.
[5]刘书林, 顾兴芳, 石延霞, 等. 瓜类蔬菜蔓枯病研究概况[J]. 中国蔬菜, 2013(18): 1-10.
[6]胡凤云, 莫贱友, 韦继光, 等. 西瓜甜瓜蔓枯病防治研究进展[J]. 中国瓜菜, 2011, 24(6):40-44.
[7]Burdman S, Walcott R.Acidovoraxcitrulli: generating basic and applied knowledge to tackle a global threat to the cucurbit industry[J].Molecular Plant Pathology,2012,13(8):805-815.
[8]Dutta B, Scherm H, Gitaitis R D, et al.Acidovoraxcitrulliseed inoculum load affects seedling transmission and spread of bacterial fruit blotch of watermelon under greenhouse conditions [J]. Plant Disease,2012, 96(5): 705-711.
[9]Kritzman G, Zutra D. Systemic movement ofPseudomonassyringaepv.lachrymansin the stem, leaves, fruit, and seed of cucumber [J]. Canadian Journal of Plant Pathology,1983,5(4):273-278.
[10]Ozdemir Z, Zitter T A.Bacterial leaf spot (Xanthomonascampestrispv.cucurbitae) as a factor in cucurbit production and evaluation of seed treatments for control in naturally infested seeds [C]∥Cucurbitaceae 2006, Asheville, North Carolina, 2006: 498-506.
[11]王荣洲. 黄瓜绿斑驳花叶病毒病的发生、危害症状与防控对策[J]. 新农村, 2013(2):23-24.
[12]李云明, 顾云琴, 施海萍, 等. 黄瓜绿斑驳花叶病毒病危害西瓜空间分布型研究[J]. 现代农业科技, 2012(22):121.
[13]吴元华, 李立梅, 赵秀香, 等. 黄瓜绿斑驳花叶病毒在我国定殖和扩散的风险性分析[J]. 植物保护, 2010, 36(1):33-36.
[14]张屹, 魏林, 许勇, 等. 西瓜枯萎病的研究进展[J]. 湖南农业科学, 2013(3):67-70.
[15]吴学宏,韩鲁明,陈倩,等.西瓜种传镰刀菌形态和分子鉴定及其对种子发芽的影响[J].植物病理学报,2009,39(2):118-124.
[16]Mclaughlin R J, Martyn R D. Identification and pathogenicity ofFusariumspecies isolated from surfaced disinfested watermelon seed [J]. Journal of Seed Technology, 1982, 7(1): 97-107.
[17]Gargouri S, Hajlaoui M R, Abdennadher M. Isolation and morphological and molecular identification ofFusariumspp. transmitted by watermelon seeds [J]. Bulletin OEPP, 2000, 30(2): 217-222.
[18]Lee D H, Mathur S B, Neergard P. Detection and location of seed-borne inoculum ofDidymellabryoniaeand its transmission in seedlings of cucumber and pumpkin [J]. Journal of Phytopathology, 1984, 109(4): 301-308.
[19]Cozmei E, Drobota I. The micromycetes presented on different vegetables seeds, stored in various atmospheric conditions [J]. Seria Horticultura, 2008, 51: 1027-1032.
[20]Pushpa K, Borkar G M, Patil D V. Studies on seed borne pathogens of pumpkin, cucumber, watermelon and muskmelon [J]. Journal of Soils and Crops, 1999, 9(2): 234-238.
[21]Bharath B G, Lokesh S, Prakash H S, et al. Evaluation of different plant protectants against seed mycoflora of watermelon[Citrulluslanatus(Thunb.) Matsum and Nakai] [J]. Research Journal of Botany, 2006, 1(1): 1-5.
[22]Hopkins D L, Thompson C M. Seed transmission ofAcidovoraxavenaesubsp.citrulliin cucurbits [J]. HortScience, 2002, 37(6): 924-926.
[23]Vincent S L, Brathwaite C W D. Bacterial leaf spot of cucumber in Trinidad [J]. Tropical Agriculture, 1982, 59(4): 287-288.
[24]Lockhart B E L, Jebbour F, Lennon A M. Seed transmission ofSquashmosaicvirusinChenopodiumspp.[J]. Plant Disease, 1985, 69: 946-947.
[25]Sammons B, Barnett O W.Tobaccoringspotvirusfrom squash grown in South Carolina and transmission of the virus through seed of smooth pigweed [J]. Plant Disease, 1987, 71:530-532.
[26]Shim C K, Lee J H, Hong S M, et al. Construction of antibodies for detection and diagnosis ofCucumbergreenmottlemosaicvirusfrom watermelon plants [J]. The Plant Pathology Journal, 2006, 22(1):21-27.
[27]Choi G S.Occurrence of two tobamovirus diseases in cucurbits and control measures in Korea [J]. The Plant Pathology Journal, 2001, 17(5): 243-248.
[28]Boughalleb N, El-Mahjoub M. Frequency ofFusariumoxysporumf.sp.niveumandF.solanif.sp.cucurbitaefrom watermelon seeds and their effect on disease incidence [J]. Journal of Parasitology, 2007, 2(1): 32-38.
[29]陈熙, 钟慧敏, 陈恩茂, 等. 西瓜蔓枯病的发生与防治[J]. 农业科技通讯, 1992(6): 26-27.
[30]Rane K K, Latin R X. Bacterial fruit blotch of watermelon: Association of the pathogen with seed [J]. The American Phytopathological Society, 1992: 509-512.
[31]Walcott R R, Gitaitis R D, Castro A C.Role of blossoms in watermelon seed infestation byAcidovoraxavenaesubsp.citrulli[J]. Phytopathology, 2003, 93: 528-534.
[32]Lessl J T, Fessehaie A, Walcott R R. Colonization of female watermelon blossoms byAcidovoraxavenaessp.citrulliand the relationship between blossom inoculum dosage and seed infestation [J]. Phytopathology, 2007, 155(2): 114-121.
[33]Johnson K L, Walcott R R. Quorum sensing contributes to seed-to-seedling transmission ofAcidovoraxcitrullion watermelon [J]. Journal of Phytopathology, 2013,161: 562-573.
[34]Block C, Shepherd L. Long-term survival and seed transmission ofAcidovoraxavenaesubsp.citrulliin melon and watermelon seed [J/OL]. Plant Health Progress, 2008, PHP-2008-1219-01-BR. http:∥www. plantmanagementnetwork.org/pub/php/brief/2008/melon/.
[35]李立梅, 吴元华, 赵秀香, 等. 黄瓜绿斑驳花叶病毒对西瓜产量、品质及种子带毒的影响[J]. 植物保护, 2010(6):82-86.
[36]吴会杰,秦碧霞,陈红运,等.黄瓜绿斑驳花叶病毒西瓜、甜瓜种子的带毒率和传毒率[J].中国农业科学,2011,44(7):1527-1532.
[37]Albrechtsen S E. Testing methods for seed-transmitted viruses: principles and protocols[M]. Wallingford, UK: CABI Publishing Press, 2005: 13-23.
[38]Liu H W, Luo L X, Li J Q, et al. Pollen and seed transmission ofCucumbergreenmottlemosaicvirusin cucumber [J]. Plant Pathology, 2014, 63: 72-77.
[39]Bos L. Seed-borne viruses [M]. Boca Raton Florida: CRC Press, 1977: 39-69.
[40]Gitaitis R, Walcott R. The epidemiology and management of seedborne bacterial diseases [J]. The Annual Review of Phytopathology, 2007, 45: 371-397.
[41]Anonymous. Seed health methods, vegetable crop methods. Published online by the NSHS-USDA-APHIS [J/OL]. National Seed Health System,2014.http:∥www. seedhealth. org.
[42]Schaad W, Sechler A. An improved semiselective agar medium forAcidovoraxavenaesubsp.citrulli[J]. Phytopathology, 1999, 89(6S):68-69.
[43]Zhao T, Feng J, Sechler A, et al. An improved assay for detection ofAcidovoraxcitrulliin watermelon and melon seed[J]. Seed Science and Technology, 2009, 37: 337-349.
[44]Kawai A, Kimura S, Nishio T. Detection forCucumbergreenmottlemosaicvirusin cucumber seeds using enzyme linked immunosorbent assay [J]. Research Bulletin of the Plant Protection Service, 1985(21): 47-53.
[45]Himananto O, Thummabenjapone P, Luxananil P. Novel and highly specific monoclonal antibody toAcidovoraxcitrulliand development of ELISA-based detection in cucurbit leaves and seed [J]. Plant Disease, 2011, 95: 1172-1178.
[46]Puttharugsa C, Wangkam T, Huangkamhang N. Development of surface plasmon resonance imaging for detection ofAcidovoraxavenaesubsp.citrulli(Aac) using specific monoclonal antibody[J]. Biosensors and Bioelectronics, 2011, 26: 2341-2346.
[47]Zhang Zhenggang, Zhang Jingyu, Wang Yuchao, et al. Molecular detection ofFusariumoxysporumf.sp.niveumandMycosphaerellamelon in infected plant tissues and soil[J]. FEMS Microbiology Letters, 2005(249): 39-47.
[48]李丽. 西瓜和甜瓜蔓枯病的分子检测研究[D]. 杭州: 浙江大学, 2013.
[49]程兆榜, 任春梅, 缪倩. 江苏黄瓜绿斑驳花叶病毒的鉴定[J]. 江苏农业学报, 2013(1): 65-70.
[50]Feng J J, Li J Q, Walcott R R, et al. Advances in detection ofAcidovoraxcitrulli, the causal agent of bacterial fruit blotch of cucurbits [J]. Seed Science and Technology,2013,41(1):1-15.
[51]Walcott R R, Gitaitis R D. Detection ofAcidovoraxavenaesubsp.citrulliin watermelon seed using immunomagnetic separation and the polymerase chain reaction [J]. Plant Disease, 2000, 84: 470-474.
[52]Ha Y, Fessehaie A, Ling K S, et al. Simultaneous detection ofAcidovoraxavenaesubsp.citrulliandDidymellabryoniaein cucurbit seedlots using magnetic capture hybridization and real-time polymerase chain reaction [J]. Phytopathology, 2009, 99(6): 666-678.
[53]Yang G, Erdman D D, Tondella M L, et al. Evaluation tetramethylrhodamine and black hole quencher 1 labeled probes and five commercial amplification mixes in TaqMan real-time RT-PCR assays for respiratory pathogens [J]. Journal of Virological Methods, 2009, 162:288-290.
[54]Oya H, Nakagawa H, Saito N, et al. Detection ofAcidovoraxavenaesubsp.citrullifrom seed using LAMP method [J]. Japanese Journal of Plant Pathology, 2008, 74: 304-310.
[55]Tian Yanli, Zhao Yuqiang, Bai Sa, et al. Reliable and sensitive detection ofAcidovoraxcitrulliin cucurbit seed using a Padlock-Probe-Based assay [J]. Plant Disease, 2013, 97(7): 961-966.
[56]宋蕤, 刘箐, 刘雅莉, 等. 西瓜细菌性果斑病菌快速免疫PCR检测[J]. 植物检疫, 2009(2): 4-6.
[57]阚春月,衣杰荣,王守法,等.免疫磁珠结合RT-PCR检测黄瓜绿斑驳花叶病毒[J].上海农业学报,2010,26(4):43-47.
[58]冯建军, 金志娟, 刘西莉, 等. 一种DNA染料结合聚合酶链反应检测鉴别植物病原细菌死活细胞[J]. 高等学校化学学报, 2008(29): 944-948.
[59]Ling Kaishu, Wechter W P, Walcott R R, et al. Development of a real-time RT-PCR assay forSquashmosaicvirususeful for broad spectrum detection of various serotypes and its incorporation into a multiplex seed health assay [J]. Journal of Phytopathology, 2011, 159(10): 649-656.
[60]Charlermroj R, Himananto O, Seepiban C, et al. Multiplex detection of plant pathogens using a microsphere immunoassay technology [J]. PloS ONE, 2013(84): e62344.
[61]张靓,田茜,刘风权,等.六种重要瓜类种传细菌可视基因芯片筛查方法研究[J].农业生物技术学报,2013,21(1):120-126.
[62]宋顺华, 吴萍, 孟淑春, 等. 种子处理对西瓜细菌性果斑病的防治效果[J]. 中国瓜菜, 2013, 26(3): 5-9.
[63]Hopkins D L, Thompson C M. Treatments to prevent seed transmission of bacterial fruit blotch of watermelon [C]. Cucurbitaceae.2006,Asheville, North Carolina, USA, 2006:17-21.
[64]许勇, 张兴平, 宫国义, 等. 细菌性果腐病与瓜类作物健康种子生产及检测技术(下)[J]. 中国西瓜甜瓜, 2004(1): 33-35.
[65]Hopkins D L, Thompson C M, Hilgren J, et al. Wet seed treatment with peroxyacetic acid for the control of bacterial fruit blotch and other seedborne diseases of watermelon[J]. Plant Disease, 2003, 87: 1495-1499.
[66]Sudisha J, Niranjana S R, Umesha S, et al. Transmission of seed-borne infection of muskmelon byDidymellabryoniaeand effect of seed treatments on disease incidence and fruit yield [J].Biological Control,2006,37:196-205.
[67]周红珍, 张志勇, 彭辉. 黄瓜绿斑驳花叶病毒病的发生症状及防控措施[J]. 现代农业科技, 2013,18:138-138.
[68]Thomas A, Langston J D, Walcott R R, et al. Evidence for fungicide-resistant seed-borne inoculum for gummy stem blight of watermelon [J]. Seed Science and Technology, 2014, 42: 92-96.
[69]Kim D H, Lee J M. Effects of seed sterilization treatment on germination and seedling growth of bottle gourd (Lagenariasiceraria) [J]. Journal of the Korean Society for Horticultural Science, 2001, 42(2): 131-136.
[70]张龑, 寇明明, 孙小武. 西瓜播种前种子处理概述[J]. 中国瓜菜, 2007(4): 29-31.
[71]贾丽慧, 刘建华, 周勇.新疆西瓜甜瓜杂交制种细菌性果斑病的发生与防治[J]. 中国瓜菜, 2012, 25(4):63-64.
(责任编辑:田喆)
Research advances in important seed-transmitted diseases of watermelon
Xu Xiulan1,Song Shunhua1,Zhang Zhiyong2,Wu Xuehong3,Geng Lihua1
(1. Vegetable Research Center, Beijing Academy of Agriculture and Forestry Sciences; Key Laboratory of Biological and Genetic Improvement of Horticultural Crops (North China), Ministry of Agriculture, Beijing100097, China;2. Plant Science and Technology College, Beijing University of Agriculture, Beijing102206, China;3. Department of Plant Pathology, China Agricultural University, Beijing100193, China)
This review focused on the research progress in the most important seed-transmitted diseases of watermelon in China, including gummy stem blight, bacterial fruit blotch andCucumbergreenmottlemosaicvirusdisease. The authors expounded the epidemics and damages caused by these seed-transmitted diseases, discussed the seed-transmission mechanisms, compared traditional and molecular techniques for seed health testing and summarized current seed treatments against the pathogens. At last, the authors pointed out the questions that are still unrevealed and the aspects requiring further research, provided helpful advice on disease management.
seed-transmitted diseases;seed health detection;seed treatment;watermelon
2014-12-18
2015-05-11
现代农业产业技术体系北京西甜瓜创新团队专项;北京市农林科学院蔬菜种质资源创新专项(KJCX20140111);国家自然科学基金(31401704)
E-mail: genglihua@nercv.org
S 436.5
A
10.3969/j.issn.0529-1542.2016.01.003
