橡胶树白粉病菌分子检测技术的建立
2016-09-14毛宇宁刘文波林春花缪卫国郑服丛
毛宇宁, 梁 鹏, 刘文波, 林春花, 缪卫国, 郑服丛
(海南省热带生物资源可持续利用重点实验室/海南大学环境与植物保护学院, 海口 570228)
实验方法与技术
橡胶树白粉病菌分子检测技术的建立
毛宇宁,梁鹏,刘文波,林春花,缪卫国*,郑服丛*
(海南省热带生物资源可持续利用重点实验室/海南大学环境与植物保护学院, 海口570228)
根据橡胶树白粉菌(OidiumheveaeSteinm.)基因组中的特有保守序列OHS,设计两对特异性引物OHF1/OHR1和OHF2/OHR2。以不同地区收集的6份O.heveae(OH1~OH6)和橡胶树胶孢炭疽病菌(ColletotrichumgloeosporioidesPenz.)等5种非靶标病原菌及健康橡胶树叶片基因组DNA为模板,建立了橡胶树白粉菌PCR及nested-PCR分子检测技术,并验证了检测体系的特异性和灵敏度。结果表明,引物OHF1/OHR1和OHF2/OHR2对橡胶树白粉菌均具有较高的特异性和灵敏度。其中引物OHF2/OHR2能检测到10 pg/μL的橡胶树白粉菌DNA,而以OHF1/OHR1和OHF2/OHR2组合进行nested-PCR,其最低DNA检测浓度达到0.01 fg/μL。人工接种试验中,当孢子接种量为2×103个/叶时,PCR和nested-PCR检测体系可分别在接种4 d和24 h后检测到目的条带。表明nested-PCR对在叶片组织中处于潜育期的橡胶树白粉菌的检测更有效,可为橡胶树白粉菌的检测提供一种简便而准确的检测方法。
橡胶树白粉病菌;潜育期;分子检测
橡胶树白粉病是由专性寄生的橡胶树粉孢属真菌OidiumheveaeSteinm.引起的气传性病害[1]。该病在适宜条件下具有发病快、危害重的特点。病菌主要危害橡胶树的嫩叶、嫩芽、嫩梢和花序。严重感病的叶片会出现畸形、皱缩、变黄甚至脱落[2-3]。早春时病菌还可能造成第二次落叶,使干胶产量明显减少,带来重大的经济损失[4]。橡胶树白粉菌的潜育期一般为5 d左右,期间病原菌已侵入橡胶树组织但大多数处于潜伏状态,因而植株不表现症状,这直接影响到对病害的准确估计和预测[5-9]。
目前,橡胶树白粉菌的鉴定主要是依据其引起症状、病菌形态和生理生化反应来完成[10-11]。在发病前或初期快速、准确地对病菌进行检测,对及时采取有效的防治措施,控制病害在胶林的扩散、减少经济损失具有十分重要的意义。关于橡胶树白粉病菌的分子检测技术报道甚少,根据真菌通用引物ITSl/ITS4可扩增出ITSI和ITS2及5.8S rDNA全序列[12],但不能通过扩增结果将橡胶树白粉菌与其他参比菌及健康橡胶树区分开,需经过进一步测序比对才能确定。
本研究团队前期完成了橡胶树白粉病菌全基因组测序,经比对分析找到一条橡胶树白粉菌特有的特异性保守序列OHS(专利申请号:201510577343.9)。本文根据该序列设计特异引物,建立橡胶树白粉菌PCR及nested-PCR分子检测技术,旨在开发出针对橡胶树叶片组织中处于潜育状态白粉病菌的分子检测技术,为该病害的早期诊断、防治方案的制订提供科学依据。
1 材料与方法
1.1供试菌株、植物材料和试剂
橡胶树白粉菌(OidiumheveaeSteinm.)OH1~OH6分别从海南大学环境与植物保护学院分子植物病理学实验室、海南西联农场、海南红光胶林、海南邦溪胶林、海南大丰农场、海南保显农场胶林的感病叶片上收集。橡胶树胶孢炭疽病菌(Colletotrichumgloeosporioides)、橡胶树棒孢霉落叶病菌(Corynesporacassiicola)、橡胶树茎杆溃疡病菌(Phytophthoracapsici)、香蕉枯萎病菌(Fusariumoxysporumf.sp.cubense)、芒果露水斑病菌(Cladosporiumcladosporioides)由海南大学环境与植物保护学院分子植物病理学实验室提供;健康的橡胶树苗及叶片(‘热研7-33-97’)由海南大学环境与植物保护学院分子植物病理学组培室提供。Omega真菌DNA提取试剂盒、Omega植物DNA提取试剂盒、Omega PCR扩增产物回收纯化试剂盒、TaqDNA聚合酶、dNTPs、2 000 bp DNA Ladder Marker购自天根生化科技(北京)有限公司;其余试剂均为国产分析纯。
1.2供试菌株及橡胶树叶片基因组DNA提取
由于橡胶树白粉菌不能离体培养,故OH1~OH6均需直接从感病橡胶树叶片上用软毛刷将白粉菌收集至无菌硫酸纸上,再进行DNA提取。其他供试菌株预先接种于PDA培养基中,于28℃的恒温恒湿培养箱中培养8~10 d后提取DNA。各菌株和橡胶树叶片基因组DNA的提取步骤参照试剂盒说明书。
1.3特异性引物设计与合成
根据橡胶树白粉菌保守序列OHS(GenBank登录号:KP171513.1;专利号:201510577343.9),利用Primer Premier 5.0 设计检测橡胶树白粉菌的特异性引物OHF1/OHR1和OHF2/OHR2(表1)。引物由北京华大基因公司合成。OHF1/OHR1的产物长度为666 bp;OHF2/OHR2的产物长度为538 bp。

表1 引物序列
1.4PCR反应体系的优化
参考引物理论退火温度,对OHF1/OHR1、OHF2/OHR2引物退火温度进行优化,温度梯度设置为52、53、54、55、56、57、58℃。
1.5引物的特异性检测和序列测定
采用超微量光吸收检测仪Nano Drop (ND-1000)测量供试菌株基因组及橡胶树叶片基因组DNA浓度,并稀释成1 ng/μL。用OHF1/OHR1、OHF2/OHR2分别进行PCR扩增,以灭菌的ddH2O为阴性对照。PCR 反应体系为:10×Taqbuffer 2.5 μL,2.5 mmol/L dNTPs 2 μL,正向和反向引物 (10 μmol/L) 各2.5 μL,模板DNA 1 μL,2.5 U/μLTaqDNA 聚合酶0.5 μL;ddH2O 补充至25 μL。反应程序:94℃预变性4 min;94℃变性30 s,57℃退火30 s,72℃延伸1 min, 35个循环;72 ℃延伸10 min。扩增产物经电泳检测后进行回收、克隆和测序。
1.6常规PCR灵敏度检测
以橡胶树白粉菌OH1为代表,将浓度为1 ng/μL的白粉菌DNA进行10倍梯度稀释,得到1 ng/μL、100 pg/μL 等9种不同浓度梯度。为减少稀释时加样误差,分别进行3个系列的梯度稀释,再将相同梯度的稀释液混合,取1 μL各浓度梯度的基因组DNA,分别用OHF1/OHR1、OHF2/OHR2进行PCR扩增,反应完成后电泳检测。
1.7Nested-PCR灵敏度检测
DNA浓度梯度设置同1.6。取1 μL各浓度 DNA,用OHF1/OHR1进行第一轮PCR扩增,取第一轮PCR产物1 μL作为模板用OHF2/OHR2进行第二轮PCR扩增。反应体系、程序及电泳检测方法同1.5。
1.8用PCR和nested-PCR检测橡胶树叶片中白粉病菌
将橡胶树白粉菌OH1接种于古铜期的橡胶树叶片, 12 d 后将橡胶树病叶表面的白粉菌采用软毛笔刷取法[13]收集至硫酸纸上,随后转入 2 mL无菌的离心管中配制成孢子悬浮液,利用血球计数板将孢子浓度调整为2×104个/mL。将健康橡胶树组培苗移栽于温室花盆中,当橡胶树叶片长至古铜期时,挑选长势一致的橡胶树苗(古铜期橡胶树苗叶片数大约15~18片),将孢子悬浮液均匀涂抹于叶片上,每片叶的接种量为100 μL,约含2×103个孢子,每盆苗所有古铜期叶片均接种,为1个重复,共3个重复。将接种后的橡胶树苗置于温度23℃、L∥D= 16 h∥8 h、湿度为80%的环境下培养。接种后每隔24 h从橡胶树苗上取样1次,当叶片上出现肉眼可见的白色粉层时停止取样。每次从每株苗上取1片叶,按1.2的方法提取叶片总DNA,取1 μL DNA为模板,分别用PCR和nested-PCR进行检测,以健康叶片DNA为对照。反应体系和程序同1.5。
2 结果与分析
2.1扩增体系的优化
根据OHF1/OHR1和OHF2/OHR2的理论退火温度,设置温度梯度进行PCR扩增。电泳结果(图1~2)表明:引物OHF1/OHR1在57℃时扩增出的条带很亮;引物OHF2/OHR2在55、56、57、58℃均扩增出明亮条带。因此,最佳退火温度确定为57℃,基于操作便利性,将 nested-PCR 的退火温度也设置为57℃。
2.2引物特异性检测与序列比对
用OHF1/OHR1和OHF2/OHR2分别对供试菌株及健康橡胶树叶片基因组DNA(全部稀释为1 ng/μL)进行PCR扩增。电泳结果(图3~4)表明,两对引物均能从6份橡胶树白粉菌(OH1~OH6) DNA中扩增出稳定均一的条带,而其他非靶标菌、健康橡胶树叶片及双蒸水对照均无任何条带。将扩增产物进行回收、测序和Blastn同源比对,结果表明,OHF1/OHR1扩增条带约666 bp,OHF2/OHR2扩增条带约538 bp,与预期大小一致,说明OHF1/OHR1和OHF2/OHR2对橡胶树白粉菌具有较强的特异性,能够用于区别橡胶树白粉菌与非靶标菌。

图1 不同温度对引物OHF1/OHR1的影响Fig.1 Effects of temperature on the primers OHF1/OHR1

图2 不同温度对引物OHF2/OHR2的影响Fig.2 Effects of temperature on the primers OHF2/OHR2
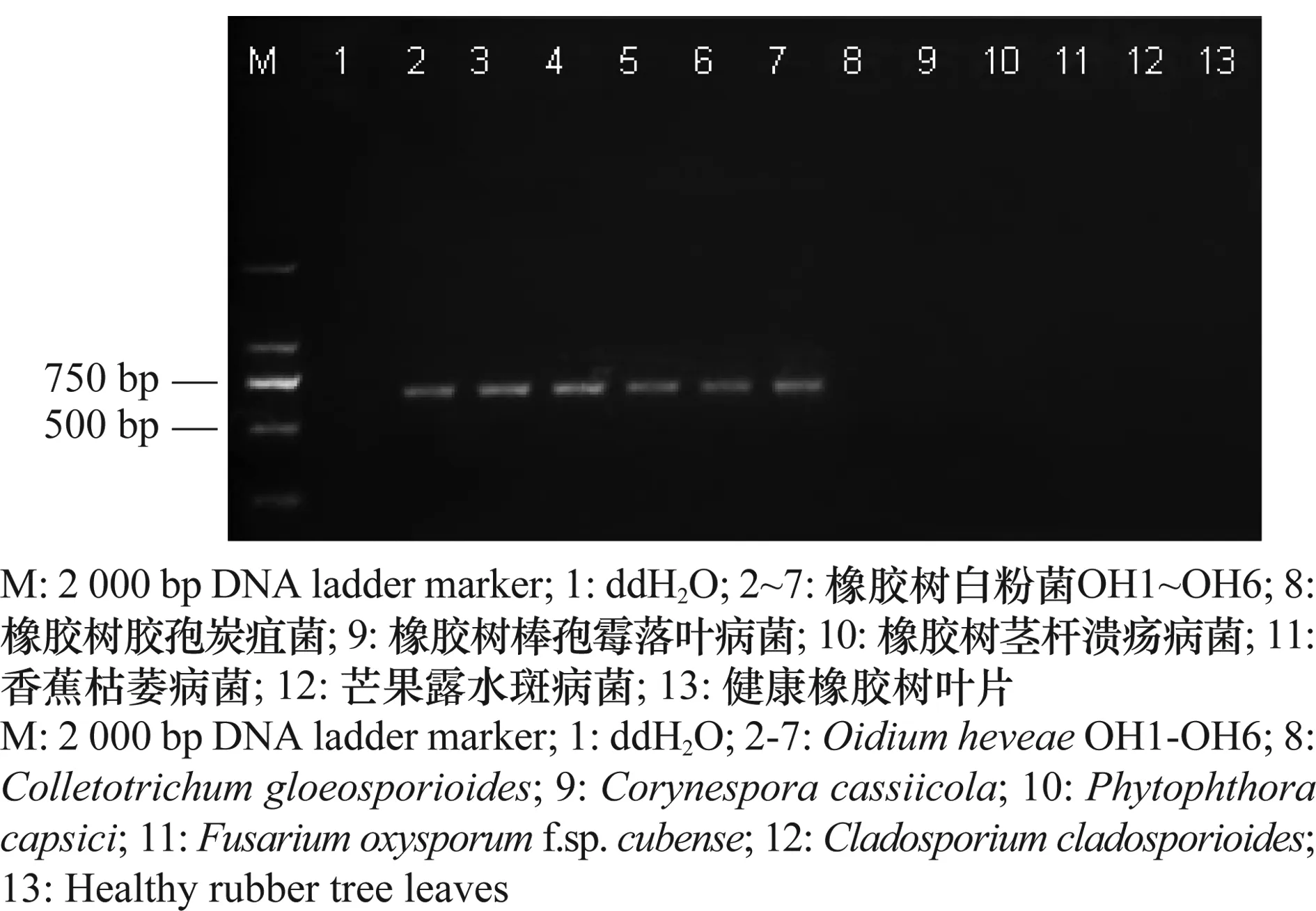
图3 引物OHF1/OHR1的特异性检测Fig.3 Specificity test of primers OHF1/OHR1

图4 引物OHF2/OHR2的特异性检测Fig.4 Specificity test of primers OHF2/OHR2
2.3引物的灵敏度检测
以不同浓度梯度的橡胶树白粉菌OH1的DNA为模板,分别用引物OHF1/OHR1和OHF2/OHR2进行PCR扩增,电泳结果(图5~6)表明: OHF1/OHR1的检测灵敏度为100 pg/μL,OHF2/OHR2的检测灵敏度为10 pg/μL。OHF2/OHR2的检测灵敏度比OHF1/OHR1高10倍。

图5 OHF1/OHR1的灵敏度检测Fig.5 Sensitivity test of primers OHF1/OHR1

图6 OHF2/OHR2的灵敏度检测Fig.6 Sensitivity test of primers OHF2/OHR2
2.4Nested-PCR的灵敏度检测
分别以10倍浓度梯度的橡胶树白粉菌OH1的DNA为模板,用OHF1/OHR1进行第一轮PCR扩增,以第一轮PCR 产物为模板,用OHF2/OHR2进行第二轮PCR扩增。电泳结果(图7)表明,nested-PCR可检测到的橡胶白粉菌DNA的最低浓度为0.01 fg/μL。

图7 Nested-PCR的灵敏度Fig.7 Sensitivity of nested-PCR
2.5橡胶树叶片中白粉病菌的分子检测
以接种后不同时间提取的橡胶树叶片基因组 DNA为模板,以引物OHF2/OHR2进行PCR检测,同时以OHF1/OHR1及OHF2/OHR2进行nested-PCR检测。 结果(图8~9)显示, 利用OHF2/OHR2进行PCR,在接种后第4天方可检测到目的条带,而利用nested-PCR可从接种后 24 h的橡胶树叶片中检测到目的条带。所有条带经测序比对证明结果正确。

图8 常规PCR检测橡胶树叶片中白粉病菌Fig.8 Conventional PCR amplification of Oidium heveae on rubber tree leaves

图9 Nested-PCR检测橡胶树叶片中白粉病菌Fig.9 Nested-PCR amplification of Oidium heveae on rubber tree leaves
3 讨论
PCR技术因其具有快速、准确、灵敏的特点,已被广泛应用于病原微生物的检测鉴定,但当病原菌在植物组织或土壤中的含量非常低时,采用常规PCR有时很难检测到目标病原菌。目前广泛使用的nested-PCR技术能大幅度地提高病原菌的检测灵敏度,已广泛应用于真菌、病毒、寄生虫等病原微生物的检测,显示了较好的应用价值[14-16,17-19]。
本研究设计的OHF1/OHR1、OHF2/OHR2与ITS通用引物相比,对橡胶树白粉菌具有更高的特异性及更强的灵敏度。以OHF2/OHR2为引物进行常规PCR,可以检测到的橡胶树白粉菌DNA的浓度为10 pg/μL,而用nested-PCR可检测到的橡胶树白粉菌DNA的浓度为0.01 fg/μL,是常规PCR的106倍。采用建立的方法对室内人工接种橡胶树白粉菌进行检测,常规PCR在接种后4 d才可检测到目的条带,而nested-PCR在接种24 h 后就可检测到目的条带。nested-PCR的检测灵敏度远远高于PCR,对在叶片组织中处于潜育期的橡胶树白粉菌具有很好的检测效果。
橡胶树白粉菌的潜育期为5 d左右,阴雨、冷凉气候有利于橡胶树白粉菌的暴发[20],若能提前3~4 d检测到橡胶树白粉菌,分析侵染程度,结合气象、环境条件,就能够对橡胶树白粉病进行早期诊断,采取相应的防治对策,减少由该病害带来的经济损失。本研究团队在建立橡胶树白粉菌预测预报体系过程中,针对不同接种量、不同潜育侵染阶段分别取样测定,分析感病后橡胶树叶片中的病原菌。用最低孢子接种量2×103个/叶接种时,5 d后在橡胶树叶片表面形成肉眼可见病斑,7~8 d后白粉病就大面积发生,采用常规PCR仅能从接种后4 d的橡胶树叶片中检测到白粉菌,而nested-PCR能从接种1 d后的橡胶树叶片中检测到潜伏侵染的白粉菌,说明nested-PCR结合OHF1/OHR1、OHF2/OHR2两套引物能提前监测到病原菌。通过建立的检测技术,我们已经建立了病原菌接种量与病害发生程度间的关系(另文发表)。虽然nested-PCR检测灵敏度高,但由于其需要做两轮PCR,并且涉及一些高端仪器设备,不利于田间直观快速诊断,因此,还需要探讨将该方法进一步改进并简化,以便寻找高效、快速、简便、特异性强且灵敏度高的分子检测技术对处于潜育期的橡胶树白粉菌进行分子检测,这对橡胶树白粉菌的早期诊断、科学防治会具有更大的意义。
[1]李增平, 郑服丛. 热区植物常见病害诊断图谱[M]. 北京: 中国农业出版社, 2009: 160.
[2]余卓桐, 王绍春. 橡胶树白粉病流行过程和流行结构分析[J]. 热带作物学报, 1988, 9(1): 83-89.
[3]范会雄, 谭象生. 橡胶树白粉病流行规律与防治技术[J]. 植物保护, 1997, 23(3): 28-30.
[4]张宇, 王萌, 杨叶, 等. 防治橡胶树白粉病15%乙嘧酚磺酸酯热雾剂的研制[J]. 中国热带农业, 2011(4): 45-47.
[5]Wastie R L, Chee K H, Lim T M. Screening-clones ofHeveaebrasiliensisfor disease resistance-a review [J]. Planter, Kuala Lumpur, 1973, 49(565): 164-169.
[6]Beeley F.Mildew disease ofHevea[J]. Malayan Agricultural Journal, 1930, 18(12): 596-599.
[7]陆大京, 周启昆, 郑冠标, 等. 橡胶树白粉病病原菌生物学研究[J]. 热带作物学报, 1982, 3(2): 63-70.
[8]余卓桐, 王绍春, 周春香, 等.橡胶树白粉病预测模式的研究[J]. 热带作物学报, 1985, 6(2): 57-66.
[9]曾士迈. 宏观植物病理学[M]. 北京: 中国农业出版社, 2005: 150.
[10]万三连, 梁鹏, 刘文波, 等.橡胶树与Oidiumheveae亲和互作组织细胞学研究[J]. 植物保护, 2014, 40(3): 26-36.
[11]张新春, 刘祥民, 王家保. 橡胶白粉病菌与寄主互作的超微结构观察[J]. 热带作物学报, 2010, 31(12): 2250-2254.
[12]刘先宝,高宏华,蔡吉苗,等.橡胶树白粉病菌rDNA-ITS序列及其系统发育分析[J].热带作物学报,2008,29(2):215-219.
[13]万三连,梁鹏, 宋风雅, 等. 橡胶树白粉菌收集及 DNA 和 RNA 提取方法比较[J]. 广东农业科学, 2013(11): 134-139.
[14]Ippolito A, Schena L, Nigro F. Detection ofPhytophthoranicotianaeandP.citrophthorain citrus roots and soils by nested-PCR [J]. European Journal of Plant Pathology, 2002, 108(9): 855-868.
[15]Mercado-Blanco J, Rodriguez-Jurado D, Pérez-Artés E, et al. Detection of the nondefoliating pathotype ofVerticilliumdahliaein infected olive plants by nested-PCR [J]. Plant Pathology, 2001, 50(5): 609-619.
[16]Foster S J, Ashby A M, Fitt B D L. Improved PCR-based assays for pre-symptomatic diagnosis of light leaf spot and determination of mating type ofPyrenopezizabrassicaeon winter oilseed rape [J]. European Journal of Plant Pathology, 2002, 108(4): 379-383.
[17]陈庆河, 李本金, 兰成忠, 等. 双重PCR检测马铃薯晚疫病菌和青枯病菌方法的建立及应用[J]. 植物病理学报, 2009, 39(6): 578-583.
[18]Zhou Yongli. Specific and sensitive detection of the fungal pathogenUstilaginoideavirensby nested-PCR [J]. Mycosystema, 2004, 23(l): 102-108.
[19]Porter-Jordan K, Rosenberg E I, Keiser J F, et al. Nested polymerase chain reaction assay for the detection of cytomegalovirus overcomes false positive caused by contamination with fragment DNA [J]. Journal of Medical Virology, 1990, 30(2): 85-89.
[20]余卓桐, 罗大全, 谢艺贤, 等. 橡胶树主要病害防治决策模型研究[J]. 中国热带农业, 2006(3): 26-29.
(责任编辑:杨明丽)
PCR and nested-PCR for the molecular detection of Oidium heveae Steinm.
Mao Yuning,Liang Peng,Liu Wenbo,Lin Chunhua,Miao Weiguo,Zheng Fucong
(Hainan Key Laboratory for Sustainable Utilization of Tropical Bio-Resources, College of Enviromental and Plant Protection, Hainan University, Haikou570228, China)
To establish methods for detection of powdery mildew of rubber tree by using conventional PCR and nested-PCR, two sets of specific primers OHF1/OHR1 and OHF2/OHR2 were designed respectively based on unique conserved sequence OHS ofOidiumheveae. SixO.heveaesamples (OH1-OH6) from different region, five strains of non-target pathogenic fungi and healthy rubber tree leaves were used to evaluate the specificity and sensitivity of conventional PCR and nested-PCR detection system. The results revealed that both OHF1/OHR1 and OHF2/OHR2 have high specificity and sensitivity. The detection limit is 10 pg/μL and 0.01 fg/μL DNA, respectively for conventional PCR (using primer OHF2/OHR2) and nested-PCR (using OHF1/OHR1 and OHF2/OHR2). Artificial inoculation test ofO.heveaeon rubber tree indicated that target band can be detected by PCR and nested-PCR at 4th day and 24 h after inoculation, respectively. These results suggested that the nested-PCR is more efficient than the conventional PCR forO.heveaein incubation period and provide an easy and accurate way forO.heveaedetection.
Oidiumheveae;incubation period;molecular detection
2015-10-30
2016-03-03
国家“973”计划项目(2011CB111612);国家现代农业产业技术体系(CARS-34-GW8);国家自然科学基金(31160359);教育部博士点基金(20104601110004);海南大学科研启动资金(kyqd1006)
E-mail: weiguomiao1105@126.com; zhengfucong@126.com
S 763.1
A
10.3969/j.issn.0529-1542.2016.04.019
Experimental Method & Technology
