海豚链球菌诱变发酵法制备透明质酸及其在动物皮肤修复中的应用
2016-09-13管峰金嘉长赵华国洪磊沈志森竺亚斌
管峰,金嘉长,赵华国,洪磊,沈志森,竺亚斌
1 宁波大学 医学院,浙江 宁波 3152112 宁波大学 医学院附属李惠利医院,浙江 宁波 315041
组织工程与细胞培养
海豚链球菌诱变发酵法制备透明质酸及其在动物皮肤修复中的应用
管峰1,金嘉长1,赵华国1,洪磊1,沈志森2,竺亚斌1
1 宁波大学 医学院,浙江 宁波 315211
2 宁波大学 医学院附属李惠利医院,浙江 宁波 315041
管峰, 金嘉长, 赵华国, 等. 海豚链球菌诱变发酵法制备透明质酸及其在动物皮肤修复中的应用. 生物工程学报,2016, 32(8): 1104-1114.
Guan F, Jin JC, Zhao HG, et al. Hyaluronic acid production by Streptococcus iniae and its application in rabbit skin's regeneration. Chin J Biotech, 2016, 32(8): 1104-1114.
透明质酸 (HA) 是一种非常重要的生物材料,是体内广泛存在的细胞外基质成分之一。为了获得产量、分子量及纯度较高的透明质酸,并研究透明质酸水凝胶在动物皮肤修复中的潜在作用。通过紫外诱变的方法对海豚链球菌进行诱变,并对此突变菌发酵后产物的蛋白含量及HA分子量进行了测定,通过CTAB法对发酵产物进行提纯,运用物理冻融法将透明质酸制成水凝胶后,用于兔背部全层皮肤修复的初探。结果表明通过诱变海豚链球菌产透明质酸的能力从 (82.3±3.3) mg/L增加到 (120±10.6) mg/L,增加了46.4%;产物经纯化后蛋白含量从 (0.178±0.011) mg/L减少到 (0.032±0.017) mg/L,减少了82.02%;所制得透明质酸的分子量约为3.0×105Da;透明质酸水凝胶对兔全层皮肤缺损的修复有较明显的促进作用,能减轻炎症和伤口瘢痕的形成。
海豚链球菌,发酵,透明质酸,皮肤修复
透明质酸 (Hyaluronic acid,HA) 是一种非常重要的直链聚阴离子粘多糖,由 (1→4)-β-D-葡萄糖醛酸及 (1→3)-β-D-N-乙酰氨基葡萄糖双糖重复单位组成[1],其结构式如图1所示[2]。1934年由美国哥伦比亚大学眼科教授Meyer和Palmer在牛眼晶状体中发现[3]。HA在体内分布广泛,在关节滑液、皮肤、脐带、脑、软骨等组织中均有分布,是大多数结缔组织中主要的细胞外基质成分。HA除了具有生物可吸收性、生物相容性、黏稠性、保水性和促进创伤愈合等重要特性,更重要的是其无抗原性、无过敏性、通常不发生免疫反应,因此,在医药、食品、化妆品等领域得到广泛开发和应用。而随着对 HA功能越来越深入的研究,其在组织工程和再生医学方面的应用也越来越受到关注,如在外科手术防黏剂、药物递送系统、癌症治疗、眼科、整容外科等领域已开始得到研究和开发[4-11]。
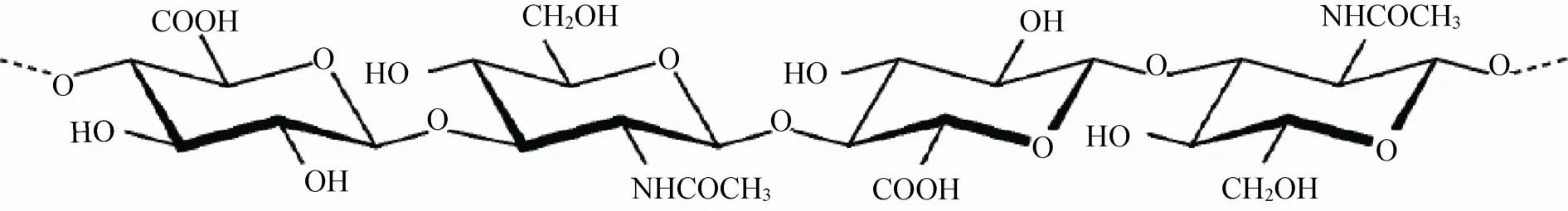
图1 透明质酸的结构式[2]Fig. 1 The structure scheme of hyaluronic acid[2].
透明质酸的生产方法有动物组织提取法和微生物发酵法,前者由于效率低、成本高、原料来源有限及来源组织的安全性等问题,已逐渐被微生物发酵法所取代。微生物发酵生产HA 于1983年被首次报道后[12],由于其克服了动物组织提取法所存在的缺点而得到广泛的关注和研究,目前发酵法已成为规模化生产HA的主要方法,文献所报道的发酵法中所采用的菌株主要为兽疫链球菌和马疫链球菌,缺乳链球菌、粪马链球菌及鸡霍乱杆菌等也有少量报道[13-15]。
海豚链球菌 (Streptococcus iniae, Strep.) 最初是从一例皮肤溃疡的亚马逊淡水河豚中分离得到的。它属兼性厌氧菌,大多呈β溶血活性,最佳生长温度为 37 ℃,10-45 ℃可生长[16]。据文献[12]报道,大多数链球菌在培养初期可见到微荚膜,内含有透明质酸,因为微荚膜对于细菌来说具有抗吞噬的作用,有利于细菌侵袭宿主。因此,本文对从海豚链球菌发酵产物中透明质酸的提取进行了研究,这在现有的文献上还未见过报道。另外,为了提高HA的产量,对海豚链球菌进行了紫外诱变及最佳培养基的筛选,在此基础上,对由 HA做成的凝胶进行了动物全层皮肤缺损的修复初探。
1 材料与方法
1.1材料与试剂
本实验所用海豚链球菌 (Streptococcus iniae,Strep.) 由宁波大学海洋学院提供,从美国罗非鱼中分离得到,并进行了 16S rRNA 的PCR鉴定。购自山东福瑞达公司的透明质酸 (分子量1 800 000 Da) 作为对照。十六烷基三甲基溴化铵 (CTAB,aladdin),脑-心浸出液肉汤(BHI,广州环凯),葡萄糖、七水硫酸镁、NaCl、乙醇、醋酸钠、乙酸、磷酸二氢钾、琼脂糖 (国药),酵母浸膏、牛肉浸膏、蛋白胨 (HANGWEI,杭州),十二烷基硫酸钠 (SDS,Solarbio)。
1.2培养基
BHI为粉末状,成分 (100 m L) 为胰蛋白胨1 g、氯化钠0.5 g、磷酸氢二钠0.25 g、葡萄糖0.2 g和牛心浸出液50 m L,pH 7.4。使用时称取3.7 g溶于100 m L超纯水,pH 7.4,121 ℃高压灭菌 30 m in。在上述 BHI液体培养基中加入1.5%的琼脂糖,即得 BHI固体培养基,然后121 ℃高压灭菌30 m in备用。
葡萄糖培养基由葡萄糖2 g、酵母浸膏2 g、牛肉浸膏2 g、蛋白胨1 g、七水硫酸镁0.2 g和磷酸二氢钾0.2 g组成,加100 m L超纯水溶解,调pH至7.4,121 ℃高压灭菌30 m in备用。
将上述液体BHI和葡萄糖培养基按一定比例混合即得混合培养基,本实验中BHI和葡萄糖培养基的比例设为0∶1,1∶0,1∶9,3∶7,5∶5,7∶3,9∶1等7种。
1.3海豚链球菌发酵产物的粗提和纯化
经Strep.菌发酵15 h后往发酵液中加入与发酵液等体积的0.1%十二烷基硫酸钠 (SDS,W/V),搅匀,室温静置10 m in,离心10 min (7 000 r/m in),取上清,加入两倍体积的乙醇,4 ℃过夜,然后4 ℃下离心18 m in (7 000 r/m in),得到的沉淀用乙醇盐溶液 (75%乙醇、25% 的0.15 mol/L NaCl)洗涤、离心3次,每次2 m in (10 000 r/min),最后将沉淀干燥,即得发酵粗产物[17]。
对发酵产物的纯化采用“CTAB法”[18-19]。在发酵初产物中加入0.1% SDS,静置10 m in后离心,取上清,加入一定量的CTAB (10%,W/W) 溶液,搅拌,静置15 m in,离心得沉淀;加入NaCl溶液 (0.2 mol/L) 搅拌,然后离心得上清液,在上清液中加入两倍体积乙醇,离心得到沉淀。最后,用乙醇盐溶液洗涤、离心3次,得到沉淀,室温下干燥。上述离心条件均为 2 m in,10 000 r/min。干燥后的HA,用于红外表征及分子量的测定[18]。
1.4发酵产物中HA浓度的测定
HA浓度的测定采用改良的CTAB比浊法[20],以标准HA配制浓度分别为0、20、40、60、80 及100 mg/L的标准溶液,测定400 nm处的吸光度,制作标准曲线。将上述纯化的发酵产物用超纯水溶解,取150 μL置于2 m L EP管,加入350 μL醋酸缓冲液 (0.2 mol/L醋酸钠,0.15 mol/L氯化钠,用乙酸调节 pH至6.0),最后加入1 m L CTAB溶液,混匀,室温静置10-15 m in,于400 nm波长下测定吸光度值。根据标准曲线推算出发酵产物中HA的浓度。
1.5发酵产物中蛋白质含量的测定及蛋白去除率的计算
BCA试剂盒由康为世纪公司 (Cat:CW 0014)提供,根据试剂盒说明书进行操作,先制作标准曲线,得到标准方程,根据样品的吸光度值计算出所测溶液的蛋白质浓度。
蛋白去除率为纯化前蛋白含量 (P0) 与纯化后蛋白含量 (P1) 的差值比上P0,即去除率= (P0-P1)/P0。
1.6HA分子量测定
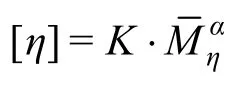
1.7海豚链球菌的紫外诱变
取少量处于对数生长期的海豚链球菌 Strep.均匀涂布于固体培养基上,紫外 (U ltraviolet,UV) 灯照射一定时间,根据不同照射时间的致死率,选择致死率在 90%以上的照射时间作为紫外诱变的最佳时间,然后挑取若干单菌落进行摇瓶培养,再扩大培养,然后对发酵液进行HA的提取、纯化、HA含量和蛋白含量以及分子量测定,与未诱变的菌株比较,筛选产量明显提高的菌株。紫外灯的功率为20 W,照射距离为30 cm,致死率的计算为不同照射时间下的菌落数 (N1) 与未照射下的菌落数 (N0) 之差,除以N0所得,即致死率=(N1-N0)/N0×100%。
1.8培养基的优化
将 BHI培养基 (B) 与葡萄糖培养基 (G)按不同的比例混合,观察菌体的生长状况,实验中按B∶G=0∶1,1∶0,1∶9,3∶7,5∶5,7∶3,9∶1共7种比例混合,然后将活化后的菌种按 1∶100的接种量接种到上述培养基中,28-30 ℃、150 r/min培养15 h以上,停止培养,取 500 μL混匀后的菌液,8 000 r/m in离心10 m in,吸去上清,再加入500 μL PBS重悬,取200 μL测吸光度 (波长600 nm),用于确定不同培养基下菌体的生物量。每种比例培养基重复培养3次,得到平均结果。
1.9透明质酸应用于兔子皮肤修复
运用物理冻法将透明质酸粉末制备成 HA水凝胶[22]。将上述制备的 HA水凝胶承载于无菌无纺布上。HA浓度为16 mg/m L,每张无纺布上的水凝胶用量为3 m L。以新西兰大白兔为实验动物,将兔子背部人为造成3.5 cm×3.5 cm的全层皮肤缺损,缺损皮厚度约为1.5 mm。实验兔分为二组共20只,一组常规消毒,纱布覆盖 (对照组);另一组酒精消毒后以上述HA水凝胶覆盖伤口 (HA组),2 d换一次凝胶,5 d后拆掉覆盖层。观察伤口外观、伤口尺寸随时间变化、伤口周围炎症情况及血液中的白细胞(White blood cell,WBC) 变化情况。
1.10统计分析
数据的分析采用 t检验,P<0.05时,差异具有显著性。应用Graphpad Prism 6.0及SPSS 22.0 软件进行分析。
2 结果与分析
2.1海豚链球菌的生长曲线
Strep. 在14 h的培养周期中其生长曲线如图2所示,从图中可以看出,0-6 h为该菌的生长适应期,6-10 h为该菌的对数生长期,10 h以后该菌即进入稳定期。对于发酵产物的提取,在链球菌进入稳定期后其自身的透明质酸酶会分解透明质酸,而且进入稳定期后其产透明质酸的能力也有所减弱,因此,我们在发酵培养11-13 h后,即进行透明质酸的提取;对于链球菌的紫外诱变,一般在对数生长的后期比较适宜,因此,我们选择在发酵培养9-10 h后进行紫外诱变。
2.2海豚链球菌的紫外诱变及培养基优化
2.2.1紫外诱变
海豚链球菌在相同紫外灯功率下,照射不同时间后的致死率如图3所示,在0、5、30、60 和120 s共5个时间点内,在照射时间为5 s时,已有近50%以上的链球菌死亡,30 s时,死亡率已达到90%以上,60 s以上,链球菌的死亡率已接近100%。因此,实验中我们采用紫外照射时间35 s作为紫外诱变时间。
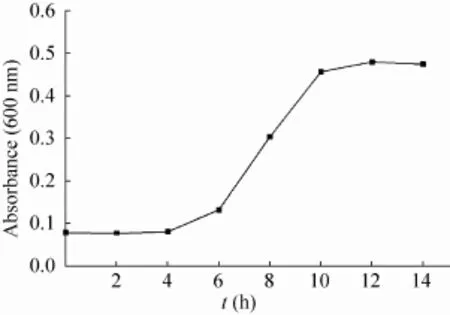
图2 海豚链球菌的生长曲线Fig. 2 The grow th curve of Streptococcus iniae as a function of time.
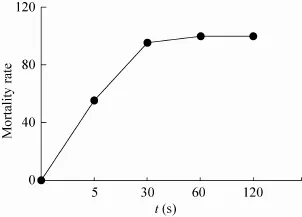
图3 海豚链球菌的紫外诱变致死率曲线Fig. 3 The mortality of Streptococcus iniae under UV treatment as a function of time.
对第一次紫外诱变后的菌株进行筛选,得到透明质酸产量略高的菌株,将该菌株再重复诱变一次,得到的菌株其产量比未诱变的Strep.提高达 46.4% (从 (82.3±3.3) mg/L增加到(120±10.6) mg/L),结果如图4所示。
2.2.2培养基的优化
在 7种不同的培养基中,BHI培养基中培养的链球菌其吸光度值比在葡萄糖培养基中培养的链球菌高很多,说明链球菌在普通葡萄糖培养基中很难生长,或生长缓慢,甚至不生长,而当在葡萄糖培养基中加入BHI后其生长明显加快,菌体量明显增多,且随着BHI比例的增加,其菌体量随之增高,在BG5.5 (即BHI∶葡萄糖培养基=5∶3) 之前,混合培养基中的菌体量少于BHI培养基中的菌体量,而在BG7.3之后 (包括 BG7.3) 混合培养基中菌体量则比纯BHI培养基中的菌体量多,且差异有统计学意义 (P<0.05),如图5所示。说明BHI中一定量的葡萄糖培养基有助于链球菌的生长。
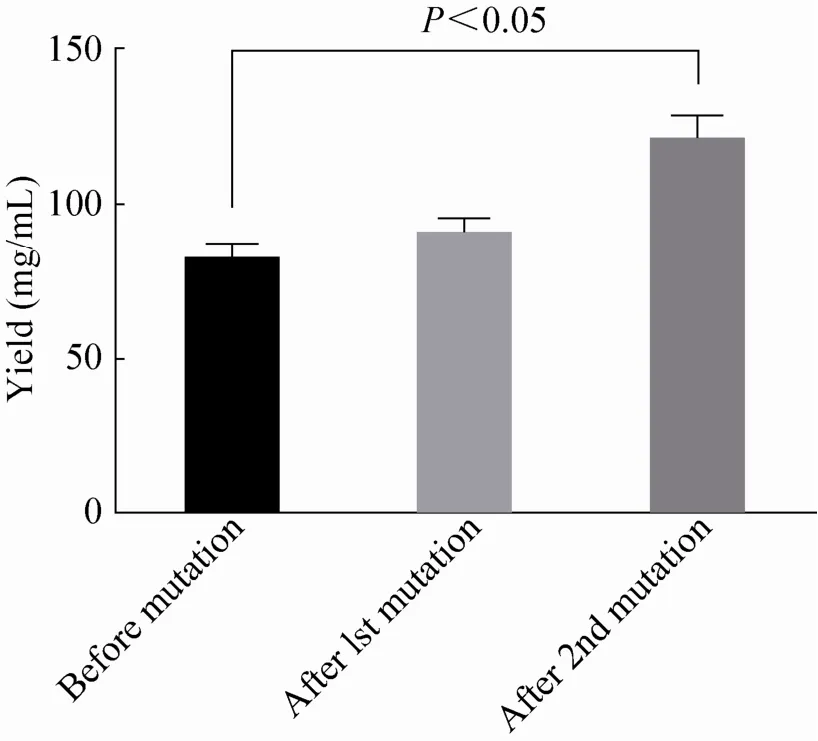
图4 海豚链球菌2次紫外诱变后的HA产量变化Fig. 4 The variation of HA's yield of Streptococcus iniae after two times of UV mutation.
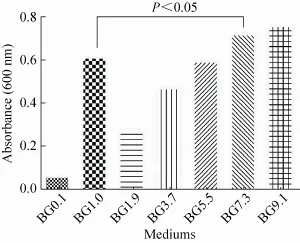
图5 海豚链球菌在不同培养基配比下的吸光度Fig. 5 Absorbance of Streptococcus iniae (at 600 nm)w ith a variety of culture media of different ratio of BHI to glucose medium. In picture, BG0.1 stands for the ratio of BHI medium to glucose medium (B:G)=0:1; so are others.
发酵产物纯化的目的主要是去除产物中的蛋白质成分,本文采用CTAB法[18-19]纯化HA,纯化后产物的蛋白含量从 (0.178±0.011) mg/L降低到 (0.032±0.017) mg/L,如图6所示(P<0.05),蛋白去除率达82.02%,纯化的效率为88.32%,比文献[19]报道的略低。对纯化后的HA采用乌氏粘度法进行分子量的测定,得到其分子量约为3×105Da。
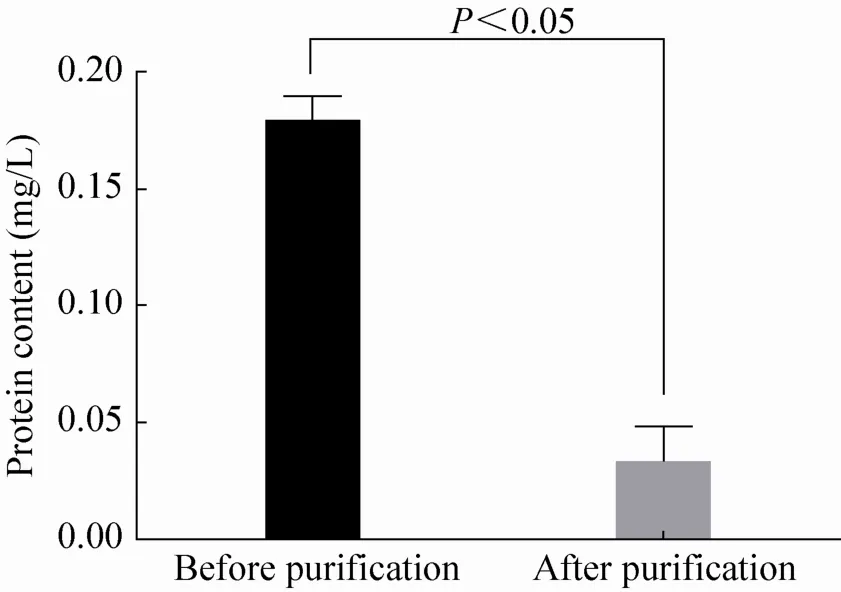
图6 HA纯化前后蛋白含量的变化Fig. 6 The variation of protein content before and after HA purification.
2.3FTIR表征
海豚链球菌发酵产物经纯化后,充分干燥,以溴化钾压片,利用红外光谱仪 (Thermo,美国) 进行FTIR吸收光谱测试 (扫描范围4 000-400 cm-1)。得到的红外吸收光谱与HA标准品进行比较,从图7可以看出,海豚链球菌发酵产物中HA的吸收峰 (A) 与HA标准品的吸收峰 (B) 基本一致,在3 400 cm-1附近有很强的O-H伸缩振动的特征吸收,说明存在多羟基结构;在2 920 cm-1附近有-CH2的伸缩振动;在1 560-1 620 cm-1附近有CO-、CN-的伸缩振动,说明存在酰胺基结构;1 420 cm-1处为羧基中O-H的伸缩振动,以上的特征吸收峰可以表明Streptococcus iniae发酵产物经纯化后得到的主要为HA,其含有的多糖羟基、乙酰氨基及羟羧基结构,与 HA重复单位中的乙酰氨基葡萄糖、葡萄糖醛酸一致。综上所述,采用Streptococcus iniae诱变发酵法可以作为HA的微生物发酵制备的菌株。
2.4HA 水凝胶在皮肤修复中的作用初探
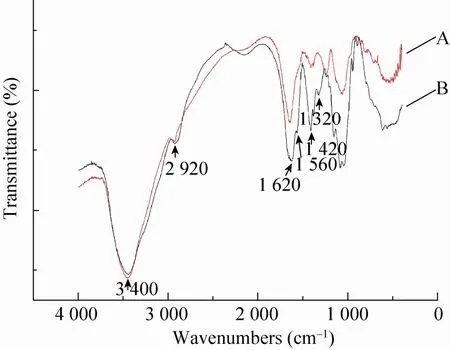
图7 透明质酸的FTIR曲线Fig. 7 FTIR curve of hyaluronic acid. A: HA fabricated from Strep. Fermentation; B: standard HA.
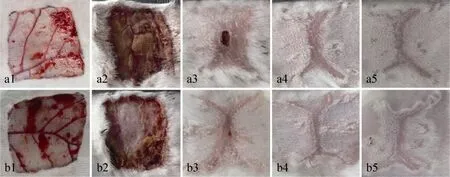
图8 兔子背部全层皮肤修复观察Fig. 8 Overview of wound skin repairing on rabbit's back. a: control group; b: HA group.1: day 0 post-operation; 2: day 5 post-operation; 3: day 18 post-operation; 4: day 27 post-operation; 5: day 40 post-operation.
兔子背部伤口分别经临床上常规纱布包覆和采用 HA水凝胶包覆后伤口修复的外观观察情况如图6所示,18 d和27 d时其伤口的修复情况均明显好于对照 (无凝胶) 组。HA组与对照组的伤口在手术后2 d均是湿润的,凝胶及无纺布上都有血迹,伤口有红肿,HA组比对照组略轻;在术后 5 d左右二组均有一定程度的化脓,伤口周围红肿但比 2 d时减轻,相对而言HA组化脓情况轻微,红肿不如对照组明显,伤口周围已部分结痂;5 d后伤口均慢慢缩小,整个伤口部分均结痂变硬;到18 d和27 d时,二组的伤口情况已发生明显差异 (图8和图9),结痂变硬的部分有所脱落,但瘢痕仍明显,至40 d时伤口几乎完全愈合,留下一个很小的无毛发区。
对实验兔进行血液白细胞检查,结果如图10所示。术后6 d前,白细胞值总体呈上升趋势,对照组 (Ctrl) 的白细胞上升趋势尤其明显,而 HA组变化不明显。通常手术一周内伤口易发生炎症,体现在血液中白细胞量增加,这也说明HA有助于降低伤口炎症的发生。6 d后,两组白细胞值总体呈下降趋势,说明此时兔子伤口炎症已较轻微;到20 d左右,基本与术前一致,也即在伤口处基本已无炎症。相比而言,HA组的总体炎症情况明显低于对照组,这对伤口的修复是非常有利的。
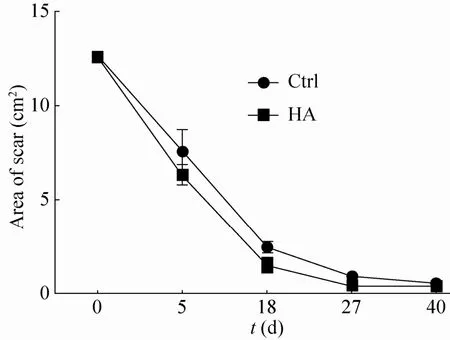
图9 伤口面积的大小变化 (cm2),第18及27天时,Ctrl及HA组的伤口面积差异有显著性 (P<0.05)Fig. 9 The variation of area of scars (cm2), the area of scars of Ctrl and HA groups are different significantly at the 18thand 27thdays (P<0.05).
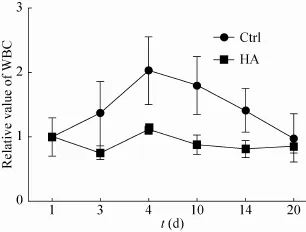
图10 术后20 d内对照组与HA组血液中白细胞相对含量的变化Fig. 10 Relative values of WBC in blood of Ctrl and HA groups in 20 days post-operation.
3 讨论
早在1937年Kendall等[23]就在溶血性链球菌中发现并提取了透明质酸,之后许多科学家及研究者对菌种及发酵提取方法做了众多改进,获得了无溶血性、透明质酸酶缺陷及透明质酸产量较高的菌株,形成了多种较好的发酵及分离纯化方法,使产物提取效率增大、杂质含量减少以及分子量提高。但这些研究所使用的菌株主要为兽疫链球菌或马疫链球菌等,本实验室所用的海豚链球菌是从美国罗非鱼中分离得到的,为革兰氏阳性球菌,兼性厌氧,呈β溶血。其微荚膜主要是由透明质酸组成,并且能一定程度地向培养基中分泌透明质酸,目前还未有从海豚链球菌中提取透明质酸的报道,我们的研究表明该海豚链球菌 Streptococcus iniae,尤其在紫外诱变后可以作为透明质酸的发酵菌株。
国内外报道的关于 HA菌株的诱变剂主要有紫外线、γ射线、亚硝基胍等[24],它们对菌株产生突变的作用方式有所不同,亚硝基胍等主要是引起碱基对置换,得到的突变株回复突变率较高,而紫外线、γ射线等则引起碱基对缺失、编码框移位等较大的遗传物质损伤,使回复突变率较低[25]。除了能产生相对稳定的突变株,紫外线和 γ射线还具有相对安全、无毒及无污染等优点。因此在海豚链球菌的筛选中,我们使用更方便、设备要求更低的紫外诱变方法,通过紫外诱变,我们得到了产量比未突变株有所提高的菌株。但是与兽疫链球等成熟的发酵菌株相比,海豚链球菌发酵的 HA在产量、分子量及纯度方面还是有很大不足[26-30]。不过,目前我们对于海豚链球菌发酵生产 HA的研究才刚刚开始,今后将在提高 HA产量、分子量及纯度上进行更深入的研究。
海豚链球菌对于培养基的要求非常高,基本上只在BHI培养基或含有脑心浸出液的培养基中能较好生长。在相同的培养条件下,海豚链球菌的生长速度比兽疫链球菌慢,尤其是在有氧条件下。但是从我们的实验结果看在 BHI培养基中加入一定量的葡萄糖培养基有助于海豚链球菌的生长,比在单独BHI培养基的生长情况要好。说明葡萄糖培养基或葡萄糖培养基中的某些成分在BHI培养基中的含量对海豚链球菌的生长有促进作用。这个问题还将在今后的研究中逐步深入。
透明质酸应用于皮肤修复的研究已有报道,如直接将 HA粉末应用于伤口[31-32],或者将 HA与其他成分如生长因子等混合应用于伤口[31,33]。我们采用将透明质酸制成水凝胶,在未加任何生长因子的情况下用于动物全层皮肤缺损的修复,初步研究已发现其明显的降低炎症、提高伤口收口速度、以及疤痕程度减轻等优点。这些优点可能跟 HA水凝胶在动物体内的降解有关。HA在体内的降解吸收速度决定于其分子量的大小,分子量大降解吸收慢,相反分子量小降解吸收快,当小分子量的 HA形成三维网络结构的凝胶后,其在体内的降解吸收速度也会变慢,因此等量的 HA在凝胶状态比在单体状态 (如 HA粉末) 在体内存在时间更长,发挥效用的时间也因此延长,这也是为什么我们要将 HA单体制成凝胶后应用于动物皮肤修复的原因。
4 结论
我们发现了一种新的有望作为透明质酸生产菌的链球菌——海豚链球菌 Streptococcus iniae,经过紫外诱变后获得了一株产量较高的突变株,相比原始菌株其产量提高达 46%,该海豚链球菌在有氧和无氧条件下均能产生透明质酸,但在无氧条件下略高。另一方面,Streptococcus iniae对培养基的要求比较高,需要牛心浸出液等成分才能很好的生长,在一般葡萄糖、蛋白胨培养基中生长非常缓慢,我们经过筛选发现在BHI培养基中混合少量葡萄糖培养基,有利于其生长。
将透明质酸采用物理方法 (即不加其他成分) 制成水凝胶后对兔子背部全层皮肤的修复具有明显的促进作用,表现在减轻伤口及全身的炎症反应、减少瘢痕的形成等。对于 HA用于皮肤修复更详细的研究仍在进行中,将会在后续工作中报道。由于在 HA转变成水凝胶的过程中没有添加其他成分,保证了其应用的安全性,也有助于今后在临床上进行推广。
REFERENCES
[1] Weissman B, Meyer K. The structure of hyalobiuronic acid and of hyaluronic acid from umbilical cord. J Am Chem Soc, 1954, 76(7): 1753-1757.
[2] Luan T. Study on the molecular characterization,rheological properties and physical cryogel of mucopolysaccharide hyaluronan [D]. Shanghai: Shanghai Jiao Tong University, 2011 (in Chinese).
栾途. 透明质酸粘多糖的分子表征、流变学性质及其物理凝胶的研究 [D]. 上海: 上海交通大学, 2011.
[3] Meyer K, Palmer JW. The polysaccharide of the vitreous humor. J Biolog Chem, 1934, 107(3): 629-634.
[4] A lmeida PV, Shahbazi MA, Mäkilä E, et al. Am ine-modified hyaluronic acid-functionalized porous silicon nanoparticles for targeting breast cancer tumors. Nanoscale, 2014, 6(17): 10377-10387.
[5] Back JH, Cho W J, Kim JH, et al. Application of hyaluronic acid/sodium alginate-based m icroparticles to prevent tissue adhesion in a rabbit model. Surg Today, 2016, 46(4): 501-508.
[6] Laffleur F, Dachs S. Development of novel mucoadhesive hyaluronic acid derivate as lubricant for the treatment of dry eye syndrome. Ther Deliv, 2015, 6(10): 1211-1219.
[7] Li L, Wang N, Jin X, et al. Biodegradable and injectable in situ cross-linking chitosan-hyaluronic acid based hydrogels for postoperative adhesion prevention. Biomaterials, 2014, 35(12): 3903-3917.
[8] Park JH, Cho HJ, Yoon HY, et al. Hyaluronic acid derivative-coated nanohybrid liposomes for cancer imaging and drug delivery. J Control Release,2014, 174: 98-108.
[9] Shen J, Xu ZW. Combined application of acellular bovine pericardium and hyaluronic acid in prevention of postoperative pericardial adhesion. A rtif Organs, 2014, 38(3): 224-230.
[10] Taub AF. Cheek augmentation improves feelings of facial attractiveness. J Drugs Dermatol, 2012,11(9): 1077-1080.
[11] Vasi AM, Popa M I, Butnaru M, et al. Chem ical functionalization of hyaluronic acid for drug delivery applications. Mater Sci Eng C Mater Biol Appl, 2014, 38: 177-185.
[12] Guo XP, Ling PX, W ang CX, et al. Production of hyaluronic acid. Pharm Biotechnol, 2000, 7(1): 61-64 (in Chinese).
郭学平, 凌沛学, 王春喜, 等. 透明质酸的生产.药物生物技术, 2000, 7(1): 61-64.
[13] Blank LM, M cLaughlin RL, Nielsen LK. Stable production of hyaluronic acid in Streptococcus zooepidemicus chemostats operated at high dilution rate. Biotechnol Bioeng, 2005, 90(6): 685-693.
[14] Don MM, Shoparwe NF. Kinetics of hyaluronic acid production by Streptococcus zooepidemicus considering the effect of glucose. Biochem Eng J,2010, 49(1): 95-103.
[15] Sae-Jin K, Sung-Yurb P, Chan-W ha K. A novel approach to the production of hyaluronic acid by Streptococcus zooepidemicus. J M icobiol Biotechnol, 2006,16(12): 1849-1855.
[16] Shen ZH. Isolation, identification, pathogenicity and detection of streptococcus iniae isolated from red drum sciaenops ocellatus [D]. Hangzhou: Zhejiang University, 2005 (in Chinese).
沈智华. 美国红鱼海豚链球菌分离、鉴定、致病性及检测技术研究 [D]. 杭州: 浙江大学, 2005.
[17] Jeong E, Shim WY, Kim JH. M etabolic engineering of Pichia pastoris for production of hyaluronic acid w ith high molecular weight. J Biotechnol, 2014, 185: 28-36.
[18] Chen YH. Study on preparation of hyaluronic acid by fermentation and its composite modification [D]. W uxi: Jiangnan University, 2010 (in Chinese).
陈永浩. 透明质酸发酵法制备及其复合改性研究 [D]. 无锡: 江南大学, 2010.
[19] Sheng RT, Tan TW. Separating hyaluronic acid from fermentation broth w ith CTAB. J Beijing Univ Chem Technol, 2006, 33(3): 33-36 (in Chinese).
盛瑞堂, 谭天伟. 用十六烷基三甲基溴化铵从发酵液中提取透明质酸. 北京化工大学学报,2006, 33(3): 33-36.
[20] Wen C, Yu HM, Sun YP, et al. Efficient quantification of hyaluronic acid in fermentation broth by modified CTAB method. China Biotechnol, 2010, 30(2): 89-93 (in Chinese).
文程, 于慧敏, 孙云鹏, 等. 高效测定发酵液中透明质酸含量的改良 CTAB浊度法. 中国生物工程杂志, 2010, 30(2): 89-93.
[21] Young RJ, Lovell PA. Introduction to Polymers. 3rd ed. Boca Raton: CRC Press Taylor & Francis Group, 2011.
[22] Okamoto A, M iyoshi T. A biocompatible gel of hyaluronan//Kennedy JF, Phillips GO, W illiams PA, Eds. Hyaluronan. Cambridge: Woodhead Publishing, 2002.
[23] Kendall FE, Heidelberger M, Dason MH. A serologically inactive polysaccharide streptococcus. J Biological Chem, 1937, 118(1): 61-69.
[24] Shi YL, Guo XP, Luan YH. Survey on mutation breeding of HA-producing strains. Food Drug,2006, 8(10A): 22-24 (in Chinese).
石艳丽, 郭学平, 栾贻宏. 产透明质酸菌的育种概况. 食品与药品, 2006, 8(10A): 22-24.
[25] Zhuge J, Li HZ. M icrobiology. 2nd ed. Beijing: Science Press, 2009: 297-409 (in Chinese).
诸葛健, 李华钟. 微生物学. 2版. 北京: 科学出版社, 2009: 297-409.
[26] A rmstrong DC, Johns MR. Culture conditions affect the molecular weight properties of hyaluronic acid produced by Streptococcus zooepidemicus. Appl Environ M icrobiol, 1997,63(7): 2759-2764.
[27] Duan XJ, Yang L, Zhang X, et al. Effect of oxygen and shear stress on molecular weight of hyaluronic acid. J M icrobiol Biotechnol, 2008,18(4): 718-724.
[28] Liu L, Sun J, Xu WB, et al. Modeling and optim ization of m icrobial hyaluronic acid production by Streptococcus zooepidemicus using radial basis function neural network coupling quantum-behaved particle swarm optim ization algorithm. Biotechnol Prog, 2009, 25(6): 1819-1825.
[29] Pires AMB, Eguchi SY, Santana MHA. The influence of m ineral ions on the m icrobial production and molecular weight of hyaluronic acid. Appl Biochem Biotechnol, 2010, 162(8): 2125-2135.
[30] Zhang JF, Ding X, Yang LY, et al. A serum-free medium for colony grow th and hyaluronic acid production by Streptococcus zooepidemicus NJUST01. Appl M icrobiol Biotechnol, 2006,72(1): 168-172.
[31] Wu ZZ, Tang Y, Fang HD, et al. Decellularized scaffolds containing hyaluronic acid and EGF for promoting the recovery of skin wounds. J Mater Sci M ater M ed, 2015, 26(1): 5322.
[32] Sabadotto M, Theunis J, Black D, et al. In vivo assessment of the effect of a cream containing Avena Rhealba®extract and hyaluronic acid on the restoration of the skin barrier in de-epiderm ised skin produced w ith an erbium-YAG laser. Eur J Dermatol, 2014, 24(5): 583-588.
[33] Shim izu N, Ishida D, Yamamoto A, et al. Development of a functional wound dressing composed of hyaluronic acid spongy sheet containing bioactive components: evaluation of wound healing potential in animal tests. J Biomater Sci Polym Ed, 2014, 25(12): 1278-1291.
(本文责编 陈宏宇)
December 9, 2015; Accepted: March 17, 2016
Yabin Zhu. Tel: +86-574-87609592; E-mail: zhuyabin@nbu.edu.cn
Hyaluronic acid production by Streptococcus iniae and its app lication in rabbit skin’s regeneration
Feng Guan1, Jiachang Jin1, Huaguo Zhao1, Lei Hong1, Zhisen Shen2, and Yabin Zhu1
1 The Medical School, Ningbo University, Ningbo 315211, Zhejiang, China
2 The Lihuili Hospital Affiliated to the Medical School, Ningbo University, Ningbo 315041, Zhejiang, China
Hyaluronic acid (HA) is an important biomaterial as the extracellular matrix in human body. We produced HA by fermentation of Streptococcus iniae (Strep.). Production of HA by Strep. was evaluated and further improved by strain mutation by ultraviolet. One strain w ith higher HA yield and lower content of protein was obtained. Its HA yield increased from (82.3±3.3) mg/L to (120±10.6) mg/L, and protein decreased from (0.178±0.011) mg/L to (0.032±0.017) mg/L. The molecular weight (MW) of HA yield from Strep. is about 3.0×105Da. Using the method of freezing and thaw ing, HA aqueous solution was transferred into hydrogel. This HA hydrogel, casted on sterilized non-woven fabric, was applied to repair rabbit skin w ith full-thickness defect. The prelim inary results of the animal tests displayed that HA hydrogel obviously reduced the inflammation around the wound and promoted the skin regeneration comparing w ith the control tests.
Streptococcus iniae, fermentation, hyaluronic acid, skin regeneration
Supported by: National Natural Science Foundation of China (Nos. 81171476, 81471797), Project of Scientific Innovation Team of Ningbo (Nos. 2015B11050, 2012C5015).
国家自然科学基金 (Nos. 81171476, 81471797),宁波科技创新团队项目 (Nos. 2015B11050, 2012C5015) 资助。
