构建一种检测水中As3+的敏感型大肠杆菌
2016-09-13王伍纪松军黄招竹卢彬彬吕建新温州医科大学检验医学院生命科学学院浙江省模式生物技术与应用重点实验室浙江温州325000
王伍,纪松军,黄招竹,卢彬彬,吕建新温州医科大学 检验医学院 生命科学学院 浙江省模式生物技术与应用重点实验室,浙江 温州 325000
环境生物技术
构建一种检测水中As3+的敏感型大肠杆菌
王伍*,纪松军*,黄招竹,卢彬彬,吕建新
温州医科大学 检验医学院 生命科学学院 浙江省模式生物技术与应用重点实验室,浙江 温州 325000
王伍, 纪松军, 黄招竹, 等. 构建一种检测水中As3+的敏感型大肠杆菌. 生物工程学报, 2016, 32(8): 1081-1092.
Wang W, Ji SJ, Huang ZZ, et al. Construction of an Escherichia coli strain for sensitive detection of arsenite ion in water. Chin J Biotech, 2016, 32(8): 1081-1092.
为构建一种敏感性强、特异性好的检测砷离子的大肠杆菌荧光报告菌株,本研究利用基因敲除技术,敲除了大肠杆菌中负责向胞外转运砷离子的arsB基因,构建对As3+敏感的菌株;利用egfp基因作为报告基因,构建融合检测载体pET28b-Pars-arsR-egfp。然后将检测载体pET28b-Pars-arsR-egfp转化至arsB基因敲除菌中完成敏感型 As3+检测菌株的构建。接着对此微生物传感器进行了检测条件的优化,以及线性检测范围、最低检出限、特异性等性能的确定。研究结果表明,与利用野生大肠杆菌作为检测宿主相比,此敏感型砷检测菌株对检测As3+的灵敏度有显著提高,最适检测As3+浓度范围为0.013-42.71 μmol/L,最低检出下限为5.13 nmol/L。因此,本研究利用基因敲除技术对大肠杆菌进行改造,成功地提高了砷检测微生物传感器的灵敏度,为重金属微生物传感器的优化研究工作提供了有用方案。
As3+检测,大肠杆菌,arsB基因,基因敲除,敏感性
砷 (As) 是环境中常见的污染物,能通过多种途径进入人体,对人体的多种组织和器官都能造成明显的损伤[1]。IARC (国际癌症研究机构)和WHO将砷列为人类致癌物。砷污染的主要来源是开采、焙烧、冶炼含砷矿石以及生产含砷产品过程中产生的含砷“三废”排放,另外农业上大量使用含砷农药也对环境造成威胁。砷的毒性主要取决于它的化学形态,形态不同毒性差异很大[2],所以选择适当、简便和快速的测定方法是现代分析技术取得发展的必要条件。最常用的砷检测分析技术,如原子荧光光谱法、气相色谱-质谱联用分析法 (GC-MS)[3]、高效液相相色谱分析-质谱法 (HPLC-MS)[4-5]和电感耦合等离子体质谱法 (ICP-MS)[6]等。这些传统的分析方法虽然具备高精确度、低检测限,但是均需要使用昂贵的仪器设备和专业操作人员,因此阻碍了大规模推广应用。
全细胞微生物传感器 (Whole-cell biosensor)是一种便捷、快速、低成本的环境重金属检测工具,它采用基因工程技术对活体微生物进行改造,使其能够对重金属污染物进行定量分析[7-8]。但是其特异性欠佳、灵敏度不高一直是限制其广泛应用的瓶颈问题。灵敏度不高是因为细菌体内存在一套对自我耐受保护机制,当重金属进入细菌体内以后,细菌会启动表达“外排泵”基因以泵出重金属,使菌体内重金属浓度维持在较低水平,导致检测灵敏度不高。例如大肠杆菌体内存在一套砷耐受操纵子 ars,表达ArsR、ArsB、ArsC三个相关蛋白,ArsR与As (III)结合后,从启动子P ars位置处解离出来,从而启动下游ArsB和A rsC的表达,其中ArsB属于ATPase家族,能够通过消耗 ATP,将胞内As (III) 泵到胞外,A rsC负责将As (Ⅴ) 还原成As (III),并被A rsB泵出胞外[9-10]。
目前已经报道的砷检测微生物传感器,大都是利用细菌体内本身的砷耐受操纵子,如转录调控因子ArsR来控制报告基因的表达来响应亚砷酸盐[11-12]。Stocker等构建了带有两个启动子的位点的检测元件,降低了报告基因的本底表达,改善砷反应生物传感器的灵敏度[12]。
本研究利用基因敲除技术[13],获得1株arsB基因敲除菌株,将 As3+检测元件导入到敲除菌株中,构建出特异性强、敏感性好的 As3+检测大肠杆菌报告菌株。与利用野生型大肠杆菌作为检测菌株相比,敲除菌株提高了对砷的敏感性,具有更低的检测下限,其在亚砷酸盐检测实验中表现出良好的性能,为目前重金属微生物传感器的优化研究工作提供了有用方案。
1 材料与方法
1.1材料
1.1.1菌株
E. coli DH5α [F-,λ-,endA1,hsdR17,hsdM+,supE44,thi1,recA1,gyrA96,relA1,Δ (argF,lacZYA),U169,φ80d,Δ (lacZ),M 15],由本实验室保存;E. coli MC4100 [F-,araD139,Δ (argF-lac),U169,rspL150,relA1,flbB5301,fruA25,deoC1,pstF25],由本实验室保存。
1.1.2质粒
pKD46[oriR101 repA101ts ParaB-gam-bet-exo Ampr]为同源重组的协助质粒,阿拉伯糖诱导后表达Bet、Exo和Gam三个λ噬菌体重组酶,完成抗性基因与待敲除基因的替换,高于37 ℃该质粒会丢失。
pKD3 [oriRγ cat bla Cmr],线性打靶载体模板,含氯霉素抗性基因 (cat) 和特异性同源重组位点 (FRT),为重组转化体提供筛选标志,由本实验室保存。
pCP20 [Ampr,Cmr] 为Flp重组酶的表达质粒,复制子为温度敏感型,42 ℃诱导Flp重组酶表达消除FRT位点间的氯霉素抗性基因,质粒也逐渐丢失,由本实验室保存。
pET28b [Kanar],含有His标签和T7终止子,由本实验室保存。
pEGFP,含有增强型绿色荧光蛋白基因,由本实验室保存。
1.1.3LB培养基
1.1.4主要试剂
2×phanta,购于 Vazyme公司;DL 5 000 DNA ladder marker,购于宝生物工程 (大连) 有限公司;质粒小量抽提试剂盒、胶回收试剂盒、PCR产物纯化试剂盒,购于宝生物工程 (大连)有限公司;NaAsO2、砷标准溶液,购于阿拉丁试剂网-上海阿拉丁生化科技股份有限公司;无缝克隆反应试剂盒购于和元生物技术 (上海)有限公司;其他所用试剂均为国产分析纯。
1.2方法
1.2.1PCR引物设计
用于同源重组的引物,5′端为50 bp的arsB基因两侧的同源臂,3′端为22 bp的用于扩增氯霉素抗性基因 (两侧有FRT位点) 的引物,以pKD3为模板,常规PCR方法扩增氯霉素抗性基因,产物片段长1 149 bp,胶回收后用于电转化上游同源臂引物H1-P1。敲除后鉴定上游引物arsB-jianding-F位于arsB基因上游108 bp,下游引物 arsB-jianding-R位于 arsB基因下游101 bp。
启动子和调节基因 arsR序列源于大肠杆菌E. coli MC4100,基因egfp[14]来源于Aequoreavictoria的水母 gfp的突变体根据文献公布序列合成获得,设计基因融合引物,具体引物信息见表1。
1.2.2arsB基因敲除菌株构建
以pKD3质粒为模板,利用P1和P2扩增含有arsB基因上下游50 bp同源臂的氯霉素基因片段,PCR反应体系为:2×phanta Taq 50 μL,正反引物各1.0 μL,模板1 μL,用dd H2O补齐到100 μL。PCR反应条件位:94 ℃4 min ;94 ℃40 s,50 ℃40 s,72 ℃1.5 m in ,35个循环;72 ℃ 10 m in,4 ℃保存。PCR产物以1.0%的琼脂糖凝胶电泳鉴定并胶回收试剂盒进行胶回收。
细菌培养,电转化方法参见文献[15],基因敲除方法参见文献[13]和[16]。

表1 基因敲除和融合引物信息Table 1 Prim ers of gene knockout and fusion
1.2.3砷检测元件及检测菌株的构建
以野生型E. coli MC4100和含egfp质粒为模板,利用 P5和 P6扩增启动子和调节基因Pars-arsR,P7和P8扩增增强型绿色荧光蛋白基因egfp,PCR反应体系为:2×phanta Taq 50 μL,正反引物各1.0 μL,模板1 μL,用dd H2O补齐到100 μL。PCR反应条件位:94 ℃4 m in ;94 ℃40 s,52 ℃40 s,72 ℃1 m in ,35个循环;72 ℃ 10 m in,4 ℃保存。PCR产物以1.0% 的琼脂糖凝胶电泳鉴定并胶回收试剂盒进行胶回收。
Pars-arsR、egfp胶回收片段分别测浓度,按照公式C1V1/bp1=C2V2/bp2,计算Pars-arsR和egfp加入的体积。因为设计引物时,Pars-arsR的反向引物P6含有egfp的5′端的同源臂单片段的同源臂序列,所以扩增的单片段Pars-arsR下游含有egfp上游同源臂序列,可通过不加引物PCR反应8个循环,将2个基因片段连接起来,交叉PCR反应体系为:2×phanta Taq 15 μL,模板Pars-arsR和egfp分别为1.5 μL和2.4 μL,用dd H2O补齐到30 μL。反应条件为:94 ℃ 3 m in;94 ℃40 s,55 ℃40 s,72 ℃1 m in ,8个循环;72 ℃、10 m in,4 ℃保存。
再以上述30 μL PCR产物为模板,再加入正反引物各0.5 μL和2×phanta Taq 10 μL,用dd H2O补齐到总体积为50 μL。PCR反应条件与扩增各元件单片段条件相同。产物以1.0%的琼脂糖凝胶电泳鉴定并胶回收试剂盒进行胶回收。
胶回收的融合基因片段 Pars-arsR-egfp与pET28b载体进行无缝克隆连接后,转化到超级感受菌株E. coli DH5α后挑取阳性克隆鉴定并测序 (上海桑尼生物科技有限公司),测序正确的克隆扩大培养后提质粒,再转化至野生型菌和arsB敲除菌,分别命名为pET28b-Pars-arsR-egfp/arsB-和pET28b-Pars-arsR-egfp/MC4100。
1.2.4arsB基因敲除菌株的生长曲线和最低抑菌浓度 (M IC) 的测定
生长曲线的测定:取5-10 μL,-80 ℃保存的转化有 pBAD空质粒的 arsB基因敲除菌和MC4100野生菌 (pBAD/arsB–和pBAD/MC4100)接种于5 m L新鲜LB液体培养基中,并分别加入终浓度为 100 μg/m L的氨苄青霉素,37 ℃、250 r/min恒温振荡培养过夜。吸取过夜菌液稀释10倍后取500 μL加入比色皿中,用空白LB液体培养基调零,使用Beckman DU 730测定OD600值。按照公式 V=1/10×OD600,吸取适量菌液加入到15 m L LB液体培养基中,并加入氨苄青霉素,使起始菌液OD600值约为0.02。每种菌株各做 3个平行管,同时分别吸取菌液400 μL,测定OD600值,作为0 h OD600值。其余菌液于37 ℃、250 r/m in恒温振荡培养。每隔1 h取400 μL菌液测定OD600值,监测12 h内浊度变化。对浓度大的菌悬液用LB液体培养基适当稀释后测定,使其OD600值在1.0以内,培养液实际的OD600值为稀释后测得的OD600值乘以相应的稀释倍数。实验结果为 3次独立实验的±s,n=3。
最低抑菌浓度的测定:吸取适量过夜菌液pBAD/MC4100和 pBAD/arsB–加入到 50 m L新鲜LB液体培养基中,使起始菌液OD600值为0.02,并分别加入氨苄青霉素,分装 (5 m L/管),加入As3+溶液,使其终浓度分别为0.5、2、8、32、128、512、1 024、2 048、4 096、5 000 (×10-6mol/L),另加等体积无菌M illiQ H2O作为阴性对照,37 ℃、250 r/m in振荡培养,监测其9 h内浊度改变,测量各管菌液OD600值。重复试验3次,每个浓度各做3个平行管。数据处理:汇总至少3次细菌对 As3+的敏感性结果,得出2种细菌各自的最小抑菌浓度 (M IC)。10 h后由于培养基营养成分耗尽,部分细菌吸光度有所下降,故以0-9 h作为细菌生长情况的监测时段。并且规定:9 h后,使试验管OD600值与对照管 OD600值之比不大于10%的最低As3+浓度为细菌的最低抑菌浓度 (M IC)。实验结果为3次独立实验的±s,n=3。
1.2.5传感器对As3+的孵育时间实验
取pET28b-Pars-arsR-egfp/MC4100和pET28b-Pars-arsR-egfp/arsB-过夜菌加入到50 m L新鲜LB液体培养基中,使起始菌液OD600值为0.02,并分别加入终浓度为50 μg/m L的卡那霉素,扩大培养至 OD600值为 0.5左右 (OD600值为 0.5左右大肠杆菌处于对数生长期),加入As3+溶液使终浓度为0.1、1.0、5.0、10 (×10-6mol/L),每个浓度各做3个平行管,另加等体积无菌M illiQ H2O 作为阴性对照。将以上菌液于 37 ℃、250 r/m in振荡培养,分别在0、1、2、3、4、5、6、7 h时间点收集菌液1 m L,8 000 r/m in离心2 m in,弃上清。收获的菌体用蛋白纯化脱盐缓冲液 (Desalting buffer,DB) 重悬,然后取重悬菌液稀释 20倍后 (根据菌液浓度稀释不同倍数,使得 OD600值相差不大),分别测量其稀释液荧光值与OD600值。激发光波长为481 nm,发射光波长为511 nm。重复试验3次,每个浓度各做3个平行管。
1.2.6传感器检测As3+的线性范围确定
分 别 取pET28b-Pars-arsR-egfp/arsB-和pET28b-Pars-arsR-egfp/MC4100过夜菌以1∶50接到新鲜LB培养基中,37 ℃、250 r/m in扩大培养至 OD600值为 0.5左右,分装至试管0.99 m L/管,加入10 μL不同浓度的As3+溶液至各管菌液终浓度分别为 0、0.013×10-6、0.13×10-6、0.27×10-6、0.53×10-6、0.67×10-6、1.07×10-6、2.14×10-6、2.67×10-6、4.27×10-6、8.54×10-6、10.68×10-6、17.09×10-6、34.18×10-6、42.71×10-6mol/L,各做3个平行管。将以上菌液于37 ℃、250 r/m in振荡培养4 h后,进行样品处理,处理步骤同上,完成传感器对 As3+的检测线性范围的确定。
1.2.7传感器对 As3+的最低检测限 (The lim it of detection, LOD) 的确定
将pET28b-Pars-arsR-egfp/MC4100和pET28b-Pars-arsR-egfp/arsB–过夜菌种子液加入到20 m L新鲜LB液体培养基中,使起始菌液OD600值为0.02,37 ℃、250 r/m in扩大培养至OD600为0.5左右,分装 (0.99 m L/管),每管加入10 μL无菌M illiQ H2O,做10个平行管,37 ℃、250 r/m in振荡培养3 h后,4 000 r/m in水平离心 10 m in,弃上清,收获的菌体重悬于1 m L DB中,然后取50 μL重悬菌液20倍稀释于0.95 m L DB中,混匀,分别测量其稀释液荧光值与OD600值。实验数据处理[17]:
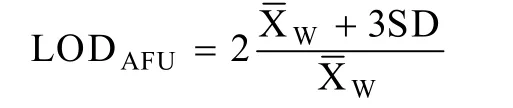
1.2.8传感器对As3+的特异性实验
吸取 pET28b-Pars-arsR-egfp/arsB–过夜菌加入到50 m L新鲜LB液体培养基中,使起始菌液OD600值为0.02,37 ℃、250 r/m in扩大培养至OD600值为0.5左右,分装至试管0.99 m L/管,分别加入 10 μL不同种类的金属离子 (As3+、Pb2+、Cd2+、Cu2+、Mn2+、Fe2+、Hg2+、Ni2+、Co2+)使其终浓度分别为0.5、5、10 μmol/L,另加等体积无菌M illiQ H2O作为阴性对照,各做3个平行管。将以上菌液于37 ℃、250 r/m in振荡培养4 h 后 (Pb2+离子为避光孵育),处理步骤同上。
1.2.9传感器对检测样品中As3+的回收实验
从实验室附近采集河水样品,经孔径为0.22 μm的过滤器对杂质和细菌进行过滤。用移液枪吸取计算好的pET28b-Pars-arsR-egfp/arsB–过夜菌种子液加入到上述90 m L新鲜LB液体培养基中,使起始菌液 OD600值约为 0.5,分装(0.9 m L/管),加入等体积不同浓度的砷单元素标准溶液至各管菌液,使其终浓度分别为0、0.13、1.07、4.27、10.68、17.09 μmol/L,然后再分别加入100 μL过滤后的湖水至每管菌液,每种浓度各做 3个平行管。将以上菌液于 37 ℃、250 r/m in振荡培养4 h后,8 000 r/m in水平离心2 m in,弃上清,收获的菌体重悬于1 m L DB中,然后取50 μL重悬菌液20倍稀释于0.95 m L DB中,混匀,分别测量其稀释液荧光值与 OD600值。然后根据上述标准曲线的回归方程计算样品中As3+的浓度,并利用电感耦合等离子体质谱仪 (ICP-MS) 对待测样品溶液的 As3+进行验证,最后计算加标回收率。实验结果为 3次独立实验的±s,n=3。
2 结果与分析
2.1arsB基因敲除菌株的构建
以E. coli MC4100基因组DNA为模板,用引物P3和P4扩增出arsB基因,以arsB::cat/MC4100基因组DNA为模板,用引物P3和P4扩增出arsB::cat基因和用引物P1和P2扩增出arsB::cat基因;以及以arsB-基因组DNA为模板,用引物P3和P4进行扩增,PCR产物经1.0%的琼脂糖凝胶电泳鉴定,如图 1所示,说明成功制备arsB基因敲除菌株arsB–。
2.2砷检测元件及检测菌株的构建
根据测序结果显示,砷检测元件已经成功构建,融合基因片段 Pars-arsR-egfp 大小为1 298 bp,碱基序列与理论完全匹配。挑取测序鉴定正确的质粒 pET28b-Pars-arsR-egfp,转化至E. coli MC4100和arsB-感受态细胞中,从而成功构建As3+检测菌株。
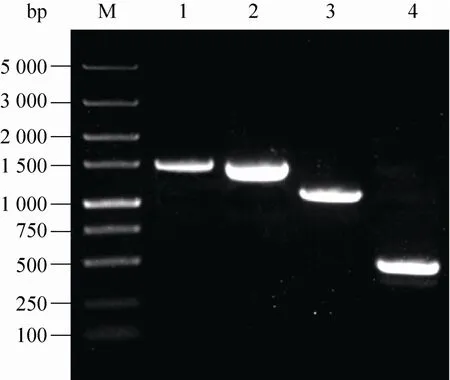
图1 arsB基因敲除菌株的构建过程及PCR鉴定Fig. 1 Construction and verification of arsB deletion mutant. Primers P1and P2were used to amplify the cat gene fragment w ith 50 bp extensions that are homologous to regions adjacent to the arsB gene (Lane 3: 1 115 bp). Primers P3and P4were used for PCR verification. Lane 1: w ild-type (arsB gene, 1 505 bp);Lane 2: arsB–mutant w ith cat gene (1 435 bp); Lane 4: arsB–mutant in which the cat gene was elim inated.
2.3arsB基因敲除菌株的生长曲线和最低抑菌浓度 (M IC) 的测定
由于将砷外泵基因arsB敲除,为了验证对其生长是否产生影响,我们首先进行了生长曲线测定。生长曲线结果如图2A所示,在LB培养基中,arsB基因敲除菌与野生型生长速率一致,说明对大肠杆菌的arsB基因进行敲除不会影响其生长状态和稳定性。
为验证arsB缺失以后,大肠杆菌对As3+的敏感性是否增强。我们对敲除菌进行了最低抑菌浓度的测定。如图2B所示,我们发现arsB敲除菌株在培养基As3+浓度为125 μmol/L时,其生长已基本被抑制。而野生型菌株需要达到 4 mmol/L时才受到抑制。这表明arsB基因敲除后,大肠杆菌对培养基中As3+的敏感性显著增强。
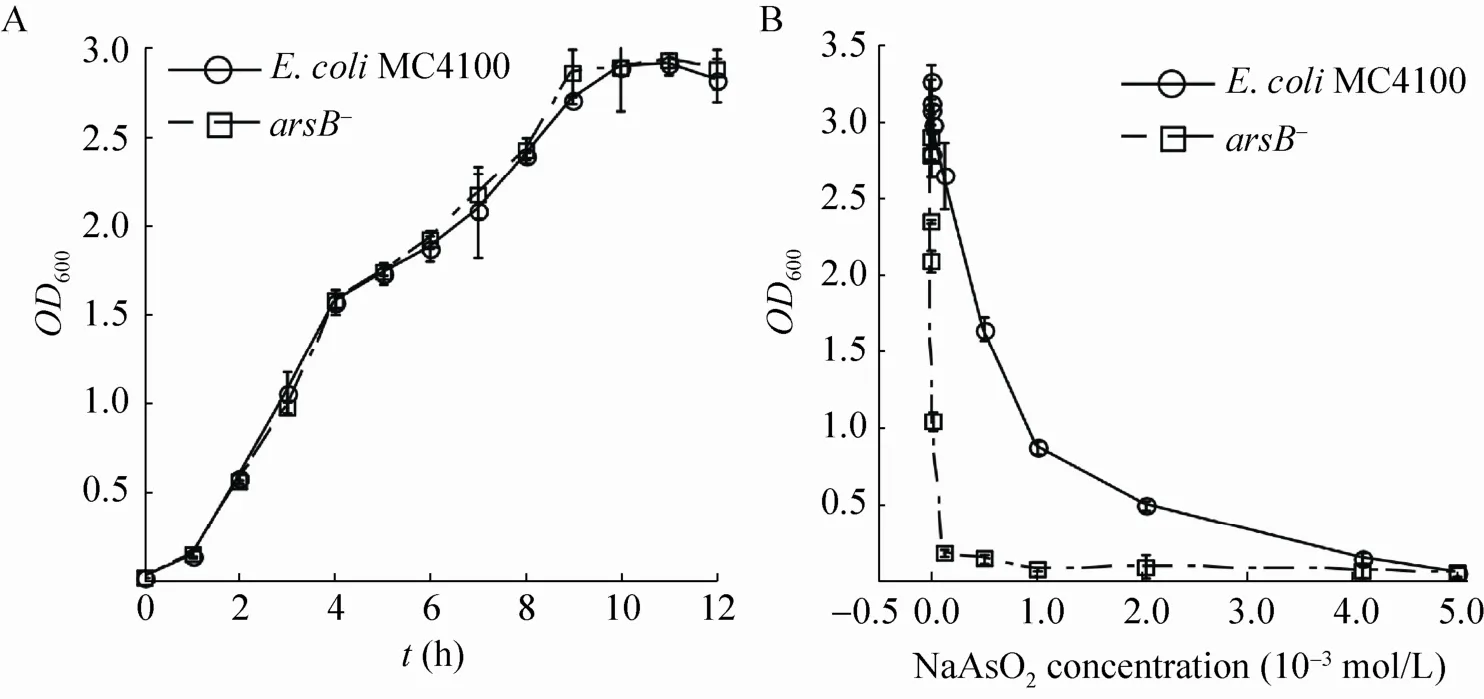
图2 arsB基因敲除菌株的生长曲线和最小抑菌浓度测定Fig. 2 Comparison of grow th and m inimal inhibitory concentration between arsB mutant strain and w ild strain E. coli MC4100. (A) Comparison of grow th between arsB mutant strain and w ild strain. The arsB mutant (square) and the w ild strain E. coli MC4100 (circle) were grown in LB medium. The cell density of each was measured every other hour. (B) Determ ination of m inimal inhibitory concentration. The arsB mutant (square) and the w ild strain E. coli MC4100 (circle) were grown in LB medium containing various concentrations of arsenite. The cell density of each was measured after 9 hours and the OD values at 600 nm were plotted. The values±s) shown are the average of at least three independent measurements.
2.4检测菌株对As3+的孵育时间实验
蛋白表达和成熟需要经过一系列的转录、翻译以及翻译后修饰过程,而且荧光蛋白发出荧光信号需要经过荧光信号的成熟过程,所以有必要对传感器的最佳孵育时间进行摸索。用不同终浓度的 As3+溶液诱导此传感器,在不同时间点测定EGFP荧光信号。图3结果表明,在0-6 h内,随着诱导时间的延长,无论是低浓度还是高浓度的 As3+,其诱导的 EGFP荧光信号都逐渐增强,在6 h时基本达到最高点后,荧光强度逐渐减弱。由于传感器在实际应用中检测时间的长短是一个重要考虑因素,本研究采用4 h作为诱导时间,因为诱导4 h的荧光信号强度也已达到最强荧光信号的70%-80%以上,基本满足检测需求。
2.5检测菌株检测As3+的线性范围确定
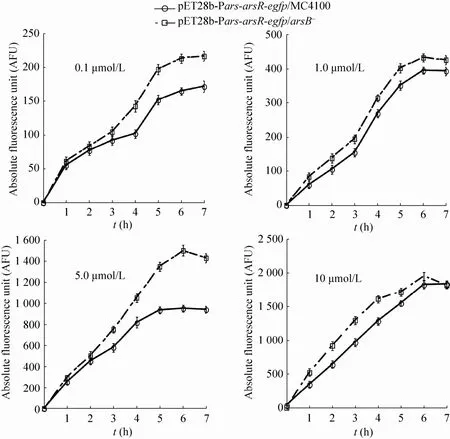
图3 As3+检测菌株的孵育时间实验Fig. 3 Optim ization of incubation time for the strains induced by arsenite in LB medium.
arsB砷外排泵基因敲除之后,能够减少细菌内砷离子的主动胞外转运,可以增加对砷的敏感性 (图2B)。因此,我们进行检测菌株检测As3+的线性范围的摸索和确定。如图 4所示,以As3+浓度为横坐标,AFU值为纵坐标作图,并进行曲线拟合。结果显示,经过4 h诱导后,野生型砷检测菌株的线性回归方程为 y=664.66 + 619.43 log(x),R2= 0.993 5,此时检测线性范围为 0.13×10-6-42.71×10-6mol/L。相比之下,arsB基因敲除型检测菌株的线性回归方程为y=1 002.8 + 824.79 log(x),R2= 0.994 6,对应的线性检测范围为0.013×10-6-42.71×10-6mol/L。这表明在保证良好的线性拟合条件下,arsB基因敲除型检测菌株具有更低的检测下限。图中也可以看出 arsB基因敲除型检测菌株对 As3+具有更高的荧光信号响应度。
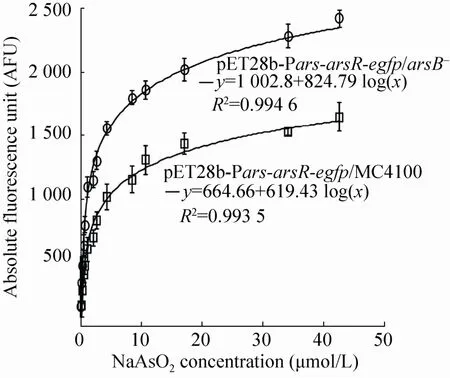
图4 检测菌株检测As3+的线性范围Fig. 4 The linear range of arsB mutant strain (circle)and w ild strain E. coli MC4100 (square) detecting arsenite ions. A fter 4 h incubation w ith various concentration of arsenite ions in LB medium, the linear equations and concentration range were obtained.
2.6检测菌株对 As3+的最低检测限 (LOD)的确定
为进一步验证 arsB基因敲除的检测菌株是否对 As3+具有更低的检测极限 (LOD),我们检测了两种菌株的最低检测限。根据实验结果计算得出,pET28b-Pars-arsR-egfp/arsB–菌株对 As3+的LOD值为5.13×10-9mol/L或3.843×10-4mg/L,pET28b-Pars-arsR-egfp/MC4100 菌株对As3+的LOD值为126.1×10-9mol/L或94.47×10-4mg/L。如图5所示,arsB基因敲除型检测菌株对As3+具有更低的检测下限,其最低检测限大约只有野生型检测菌株的 4%,证明 arsB基因敲除型检测菌株在实际应用中能够检测到更低的 As3+浓度。
2.7检测菌株对As3+的特异性实验
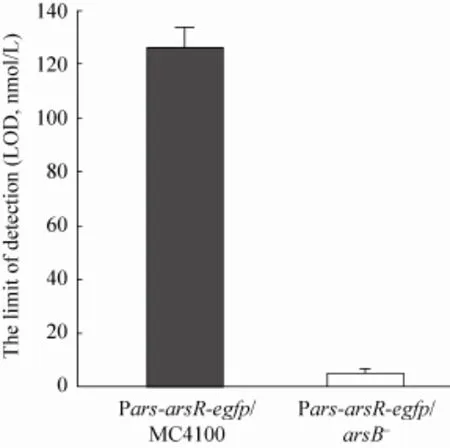
图5 检测菌株的最低检测限对比图Fig. 5 Comparison of the lim it of detection between arsB mutant strain (white column) and w ild strain E. coli MC4100 (grey column) containing the arsenite induced egfp expression plasm id.
从以上结果得知,arsB基因敲除型检测菌株对 As3+的检测具有更低的检测下限和响应度,具有更好的实际应用前景。考虑到传感器对待测物质的特异性检测是其实际应用的前提,为验证我们构建的 arsB基因敲除型检测菌株是否具有较高的特异性,我们加入等体积 (10 μL)不同种类的金属离子 (As3+、Pb2+、Cd2+、Cu2+、Mn2+、Fe2+、Hg2+、Ni2+、Co2+),终浓度分别为0.5、5、10 μmol/L,对构建成功的检测 As3+微生物传感器进行诱导,并用等体积无菌 M illiQ H2O作为阴性对照,检测其特异性。将 As3+的AFU值定义为 100%,并以其他各金属离子的AFU值与As3+AFU值的百分比表示对各金属离子选择的特异性。结果表明 (图 6),无论是高浓度还是低浓度的金属离子,只有 As3+能诱导此传感器产生荧光,其他金属对其荧光表达的干扰性非常弱 (均低于10%),证明此传感器特异性良好。
2.8传感器对检测样品中As3+的回收实验
微生物传感器的构建和优化的最终目的是将其运用到实际应用中,所以我们将构建的As3+检测菌株进行了河水样品的加标回收率评估实验。表 2可以看出,以电感耦合等离子体质谱仪 (ICP-MS) 检测的结果作为金标准,构建的 As3+检测菌株对河水样品中的 As3+检测回收率基本在 80%以上,表明此传感器具有较为良好的检测水体中砷离子的应用前景。
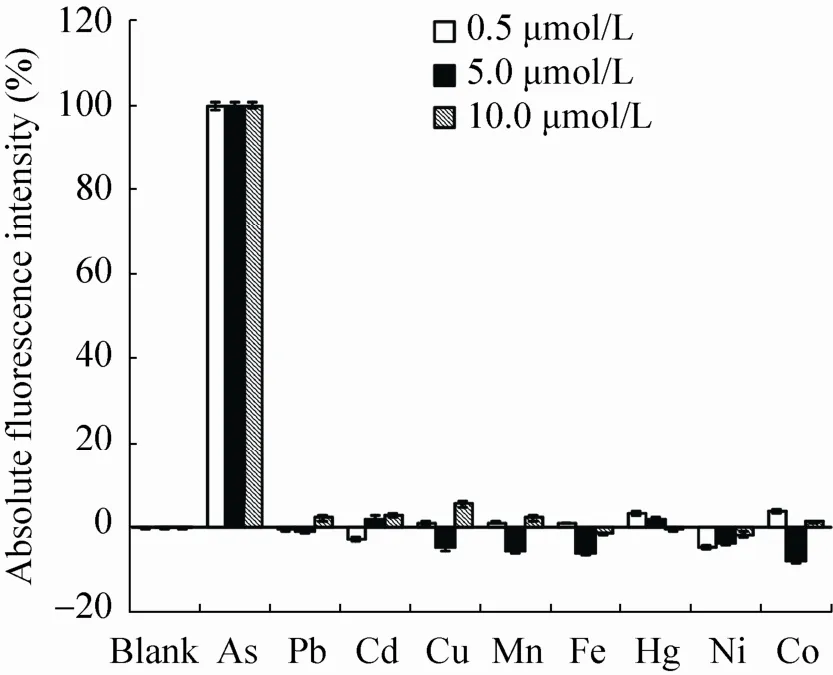
图6 检测菌株的特异性实验Fig. 6 Specificity test of arsenite detecting strain. Fluorescence intensity of arsB mutant strain containing the arsenite induced egfp expression plasm id were measured after incubation w ith various metals at the concentration of 0.5, 5, 10 μmol/L for each. A ll of the cell numbers were normalized to OD600=0.2 before the tests.
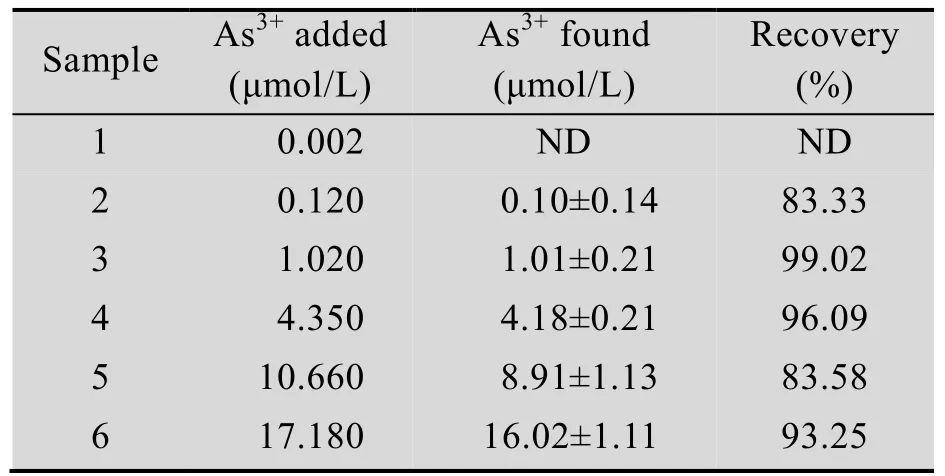
表2 传感器对检测样品中As3+的加标回收率Tab le 2 Spike-recovery tests of arsenite detecting strain
3 讨论
随着工农业的快速发展,水体中砷污染问题日趋严重,因此砷离子的检测尤为重要。传统的重金属检测方法如ICP-MS、冷原子吸收法等,需要专业设备,成本高,且操作比较繁琐,由于微生物传感器因其简便、快速、低廉、易推广等优点,近年来得到快速发展,例如检测铅[18]、砷[19]。本研究构建的生物传感器可通过荧光信号强度直观、特异地反映水体中的 As3+浓度,操作简便,是传统检测方法的一个有力补充。
近年来,研发理想的砷离子检测微生物传感器一直处于探索之中[19-20],然而均存在敏感性差、检测限高的瓶颈问题。Li等[20]通过将arsR操纵子突变和高通量筛选提高其活性,但其检测下限较高。胡春霞等[20]以绿色荧光蛋白为报告基因构建的环境砷离子生物检测体系的检测范围为0.2-1.0 μmol/L,还有Huang等构建的传感器[21],检测范围为 10-500 μg/L。Francisco等构建了带有两个启动子的位点的检测元件,降低了报告基因的背景值,改善了砷反应生物传感器的灵敏度[12]。
很多微生物具有一套消除重金属毒害的抗性机制,如通过酶参与的氧化还原反应将重金属转化为毒性较弱的形态 (如借助细胞质汞还原酶的催化将汞离子还原成毒性较弱的金属汞)[22]。但是微生物对砷的利用是通过氧化还原反应将其从砷酸盐转化为毒性更强的亚砷酸盐,然后借助特殊的砷转运蛋白将其从细胞中转运出去,导致野生型大肠杆菌对砷离子检测的敏感度不高[10]。本研究通过基因敲除技术将大肠杆菌基因组上合成砷外排泵的基因 arsB敲除,从而使进入菌体内的砷离子不能有效排出,其敏感性提高了30多倍 (图2B)。而且,利用arsB敲除菌株作为砷检测元件的宿主菌体,其对 As3+的最低检出下限是野生型菌株最低检出限的1/25,可低至5.13×10-9mol/L (3.843×10-4mg/L)。
自然界水体环境中,砷离子主要以三价砷(As3+) 和五价砷 (As5+) 的形式存在,其中三价砷的毒性更大[23],故本文主要采用 As3+为检测对象,对构建的砷离子传感器进行优化和评估。事实上,本文构建的砷离子传感器同样能够对As5+进行有效检测 (数据未呈现),只是达到最高荧光信号强度的孵育时间比 As3+略久。这主要是因为进入菌体中的As5+需要先通过ArsC还原成 As3+才能被砷离子检测元件检测到。我们将进一步对其检测 As5+或总砷的条件和参数进行优化和确定,使其能得到更广泛的应用。
本研究构建的 As3+检测传感器的线性检测范围为0.013-42.71 μmol/L。相比以往的砷检测微生物传感器,此传感器检测限更低,检测范围更宽,准确性良好,在检测重度砷污染环境具有较大优势,呈现出较好的应用前景。后续还需不断的深入探索,对该传感器进行进一步优化,比如在已经构建好的质粒上,进行多个完整检测元件的串联,以极大提高传感器检测灵敏度,从而进一步缩短相应的检测时间,以推进微生物传感器在环境监测领域的应用。
REFERENCES
[1] Debashis C, Dipti H, Santanu M. Assessment of arsenic exposure from groundwater and rice in Bengal Delta Region, West Bengal, India. Water Res, 2010, 44 (19): 5803-5812.
[2] Zhou B, Liu LY, Li XC, et al. Analysis of different forms of arsenic content in kelp. Stud Trace Elem Health, 2005, 22(4): 33-34 (in Chinese).
[3] Takeuchi A, Namera A, Kawasum i Y, et al. Development of ananalytical method for the determ ination of arsenic in urine by gas chromatography-mass spectrometry for biological monitoring of exposure to inorganic arsenic. J Occup Health, 2012, 54(6): 434-440.
[4] Guerin T, Astruc A, Astruc M. Speciation of arsenic and selenium compounds by HPLC hyphenated to specific detectors: a review of the main separation techniques. Talanta, 1999, 50(1): 1-24
[5] Gong ZL, Lu XF, Ma MS, et al. Arsenic speciation analysis. Talanta, 2002, 58(1): 77-96.
[6] K laue B, Blum JD. Trace analyses of arsenic in drinking water by inductively coupled plasma mass spectrometry: high resolution versus hydride generation. Anal Chem, 1999, 71(7): 1408-1414.
[7] Hynninen A, Virta M. Whole-cell bioreporters for the detection of bioavailable metals. Adv BiochemEng Biotechnol, 2009, 118: 31-63.
[8] Scott DL, Ramanathan S, Shi WP, et al. Genetically engineered bacteria: electrochem ical sensing systems for antimonite and arsenite. Anal Chem,1997, 69(1): 16-20.
[9] Xu C, Rosen BP. Dimerization is essential for DNA binding and repression by the ArsR metalloregulatory protein of Escherichia coli. J Bio Chem, 1997, 272(25): 15734-15738.
[10] M eng YL, Liu ZJ, Rosen BP. As(III) and Sb(III)uptake by GlpF and efflux by ArsB in Escherichia coli. J Bio Chem, 2004, 279(18): 18334-18341.
[11] Francisco M JS, Hope CL, Owolabi JB, et al. Identification of the metalloregulatory element of the plasm id-encoded arsenical resistance operon. Nucleic Acids Res, 1990, 18(3): 619-624.
[12] Judith S, Denisa B, Monika G, et al. Development of a set of simple bacterial biosensors for quantitative and rapid measurements of arsenite and arsenate in potable water. Environ Sci Technol,2003, 37(20): 4743-4750.
[13] Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci USA, 2000,97(12): 6640-6645.
[14] Cormack BP, Valdivia RH, Falkow S. FACS-optim ized mutants of the green fluorescent protein (GFP). Gene, 1996, 173(1): 33-38.
[15] Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989: 20-25.
[16] Bai GX, Sun ZW, Huang Y, et al. Deletion of clpP in chromosome of E. coli by red recombination. Chin J Biochem Mol Biol, 2005, 21(1): 35-38.
白光兴,孙志伟,黄莺, 等. 利用Red重组系统对大肠杆菌 ClpP基因的敲除. 中国生物化学与分子生物学报, 2005, 21(1): 35-38.
[17] Ivask A, Rõlova T, Kahru A. A suite of recombinant lum inescent bacterial strains for the quantification of bioavailable heavy metals and toxicity testing. BMC Biotechnology, 2009, 9(1): 1-15.
[18] Wei W, Liu X, Sun P, et al. Simple whole-cell biodetection and bioremediation of heavy metals based on an engineered lead-specific operon. Environ Sci Technol, 2014, 48(6): 3363-3371.
[19] Li LZ, Liang JT, Hong W, et al. Evolved bacterial biosensor for arsenite detection in environmental water. Environ Sci Technol, 2015, 49(10): 6149-6155.
[20] Hu CX, Ye MQ, Cen YC, et al. Constrution of method for detection of environmental arsenic based on green fluoresent protein as reporting gene. J Environ Health, 2013, 30(7): 634-636 (in Chinese).
胡春霞, 叶梦情, 岑益超, 等. 以绿色荧光蛋白为报告基因的环境砷离子生物检测体系的构建.环境与健康杂志, 2013, 30(7): 634-636. Huang CW, Wei CC, Liao HC. A low cost color-based bacterial biosensor for measuring arsenic in groundwater. Chemosphere, 2015, 141: 44-49.
[21] Silver SA, M isra TK. Plasm id-mediated heavy metal resistances. Annu Rev M icrobiol, 1988, 42: 717-743.
[22] Geng WH, Kom ine R, Ohta T, et al. Arsenic speciation in marine product samples: comparison of extraction-HPLC method and digestioncryogenic trap method. Talanta, 2009, 79(2): 369-375.
(本文责编 陈宏宇)
Construction of an Escherichia coli strain for sensitive detection of arsenite ion in water
Wu Wang*, Songjun Ji*, Zhaozhu Huang, Binbin Lu, and Jianxin Lü
Zhejiang Provincial Key Laboratory for Technology and Application of Model Organisms, School of Laboratory Medicine and Life Science, Wenzhou Medical University, Wenzhou 325000, Zhejiang, China
In order to construct an Escherichia coli strain with high sensitivity and specificity to detect arsenic ion using fluorescence as reporter, a sensitive strain to arsenic ion was obtained by knocking out the gene arsB that acts as an arsenicefflux pump. The pET28b vector containing arsenite detecting cassette Pars-arsR-egfp was constructed and then transformed into arsB deleted mutant. Measuring conditions of this constructed whole-cell biosensor were optimized and its linear concentration range, limit of detection and specificity were determined. This modified biosensor was much more sensitive than that using w ild-type strain as host. The optimal detection range of As3+concentration was 0.013 to 42.71 μmol/L, and the lim it concentration of detection was as low as 5.13 nmol/L. Thus we successfully improved the sensitivity of arsenite detecting biosensor by modification of E. coli genome, which may provide useful strategies for development and optimization of microbial sensors to detect heavy metals.
January 7, 2016; Accepted: March 24, 2016
Jianxin Lü. Tel/Fax: +86-577-8668-9805; E-mail: jxlu313@163.com
arsenite ion detection, Escherichia coli, arsB gene, gene knock-out, sensitivity
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2014AA06A514), Special Research Fund for Non-profit Sector of Zhejiang Province (No. 2016C33027).
*These authors contributed equally to this study.
国家高技术研究发展计划 (863计划) (No. 2014AA06A514),浙江省公益技术研究项目 (No. 2016C33027) 资助。
